Aktivierungsenergie
Werbung

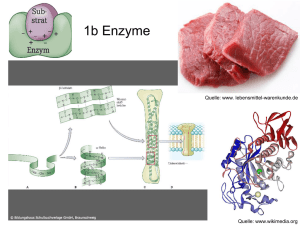
Aktivierungsenergie Damit eine chem. Reaktion ablaufen kann, ist Aktivierungsenergie erforderlich.. *Enzyme setzen die Aktivierungsenergie herab und beschleunigen damit die GG-Einstellung: E + S <-> [ES] <-> [EP] <-> E + P * Es erfolgt KEINE Verschiebung des Gleichgewichtes! * Jede enzymkatalysierte Reaktion läuft so lange ab, bis der GG-Zustand erreicht ist. Enzyme beschleunigen Reaktionen um einen Faktor von etwa 106 In Abwesenheit der Enzyme würden diese Reaktionen in kaum wahrnehmbarem Umfan ablaufen. Im Stoffwechsel sind meist viele enzymat. katalysierte Reaktionen hintereinandergeschaltet, d.h. die Reaktionsprodukte werden durch ihre Weiterreaktion laufend dem GG entzogen Dihydroxyaceton-P <-> Glycerinaldeyd-3-P <<< reagiert weiter Daraus ergibt sich ein FLIESGLEICHGEWICHT „steady state“ *Damit ein System Arbeit leisten kann, darf es nicht im GG sein, sondern muss auf ein solches hinstreben. * Lebende Organsimen sind offene Systeme ! Unter FließGG versteht man einen stationären Zustand, bei dem dauernde Substrate einströmen und Reaktionsprodukte ausgeschleust werden. *Es laufen also kontinuierlich Reaktionen ab, die auf ein GG hinstreben. Enzymaktivität Die Aktivität eines Enzyms ist definiert durch die Menge an Substrat, die pro Zeiteinheit umgesetzt wird. Sie wird in Katal oder Untis (Internationale EInheit IE) angegebn 1kat (Katal) = 1 mol/s imme rnoch üblich (prakticher) 1U (Unit) = 1ymol/min „Ein Unit ist jene Enzymmenge, die in der Lage ist, ein ymol Subsrtat pro Minute umzusetzen (zu verbrauchen).“ Umrechnung der Einheiten: 1kat = 6.107 U 1U ) 16,67 nkat * Zur Ermittlung der Enzymaktivität (Anzahl der Enzymeinheiten einer Lsg) bestimmt man die Geschwindigkeit des Substratumsatzes pro mL: v/mL = (dc*1/dt*mL9 (mol/s*mL od ymol/min*mL U/mL bzw kat/mL Wechselzahl (turnover number): Anzahl der Substratmoleküle, die pro Minute (bzw Sekunde) vom aktiven Zentrum eines Enzymmoleküls in Produkt umgesetzt werden: ymol Substrat / ymol Enzym = „molakre Aktivität“ [min-1 bzw s-1] Die Wechselzahl entspricht der kinetischen Konstanten k3 (Zerfallsreaktion des ESKomplexes) Faktoren, die die Enzymaktivität beeinflussen 1) pH-Wert Die meisten Enzyme zeigen bei einem bestimmten pH-Optimum ihre maximale Aktivität Der Bereich des Aktivitätsoptimums ist bei allen Enzymen verschieden (Werte von 0,5 bis mehrere pH-Einheiten). 2. Temperatur Die Geschwindigkeit der Enzymatischen Reaktion nimmt mit steigender Temperatur ( nach der RGT.-Regel) zu - allerdings nur in jenem Bereich, in dem das Enzym stabil ist. Oberhalb dieser Temperatur tritt meist Denaturierung ein. Die Denaturierungstemp sind bei allen Enzymen verschieden ( Werte von ca. 35 - 100°C) RGT Regel: Erhöhung der T um 10°C bewirkt Verdoppelung bis Verdreifachung der Reaktionsgeschwindigkeit.