2 - Webseite www.biotechLAB.net Administration
Werbung

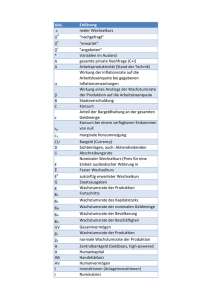
Exercise Learning Objects Find Data Files GO Übergang_Übung_ETHZ/UZH_2008 Applied and Environmental Microbiology - extent and dimen Applied and Environmental Microbiology - extent and dimen Applied and Environmental Mocrobiology_Instructions to A Batch growth - interpretation of experimental data_ETHZ/UZ Batch_Übung_Auswertung_ETHZ/UZH_2008 Batch_Übung_ETHZ/UZH_2008 Blank (1997) Chemostat_Übung_Auswertung_ETHZ/UZH_2008 Chemostat_Kayseretal_Übung_ETHZ/UZH_2008 Continuous culture - interpretation of experimental data_ETHZ/UZH_2007 Egli et al. (1986) Egli et al.(1980) Egli et al., 1986 (100%) Excelberechnung Übungen Störung Excelberechnung Übungen Sterilisation Flyer BiotechLAB_080318 Ghent - ‚White’ (industrial) biotechnology Ghent - (Bio)process simulation Ghent - Process monitoring and data evaluation Kovarová et al. (1996) Lendenmann et al. (2000) Leták_biotechLAB Maurer, M., M., Kühleitner, B. Gasser, and D. Mattanov Versatile modeling and optimization of fed batch processes production of secreted heterologous proteins with Pichia pas Microbial Cell Factories. 5: 37. Monod (1949) Postup řešení BCNNb_001_CZ Rechenbeispiel Diauxie Rechenbeispiel Diauxie - Lösung s, x = f(D) spezifische D- und z-Werte verschiedener Mikroorganismen Standing et al. (1972) Transienten_Übung_Auswertung_ETHZ/UZH_2008 Transient_Lösungen Transient_ohne Lösungen Transition from batch to continuous culture_ETHZ/UZH_20 V:\Data-Monat\Data-Februar\hyp\Experiments_Data van Dijken et al. (1976) Varma and Palsson (1994) Vsádková kultivace_úvod Wanner and Egli (1990) = f(time) in Glucose-limitierter kontinuierlicher Kultur (E 1986) x,s XXX xxx (Varma and Palsson, 1994) xxx (Wanner and Egli, 1990) </div Supported by HELP | |1|2|3|4|5|6|7|8 Equations GO A B C D E F G H I J K L M N O P Q R S T U V W X Y Z Für die Definition aquivalenter Sterilisationsverfahren under andere Kombination von Temperatur und Behandlungszeit. Anpassung an hitzeempfindliche Produkte. Die Abtötungskurve der Mikroorganismen in einem Sterilisationsprozess folgt der Kinetik 1. Ordnung. Abtötungskurve auf Basis "10", nicht "e". Integration zwischen den Werten N0 und N sowie den dazugehörigen Zeiten t0 Auswaschen eines innerten Stoffes (o. überflüssiger nicht-wachsender Biomasse) Beginn der Störung bei t=0 Der D-Wert entspricht dem reziproken Wert von KT Verdünnungsrate in Abhängigkeit vom Volumenstrom und Volumen spezifische Wachstumsrate in Chemostatkultur Verdünnungsrate in der Chemostatkultur in Abhängigkeit von der Substratkonzentration und der maximalen spezifischen Wachstumsrate Veränderung der Biomassekonzentration mit der Zeit (Differenzialgleichung) Veränderung der Substratkonzentration mit der Zeit (Differenzialgleichung) allgemeine Bilanzgleichung für einen Durchflussreaktor allgemeine Bilanzgleichung für eine Batchkultur Biomassebildungsrate in Batchkultur F-Wert F0-Wert Substrataffinitäts-/Sättigungskonstante (Monod) Substrataffinitäts-/Sättigungskonstante (Monod) Letalitätsfaktor, Berechnung der Letalität und der Effektivität eines Sterilisationsprozesses. ?????? spezifische Wachstumsarte in Abhängigkeit von der Substratkonzentration nach Monod-Kinetik spezifische Wachstumsrate bei zeitlicher Veränderung von V(t) spezifische Wachstumsrate für Batchkultur spezifische Wachstumsrate zu einem bestimmten Zeitpunkt maximale spezifische Wachstumsrate für Ks << s(t) in Batchkultur maximale spezifische Wachstumsrate für Ks << s(t) in Batchkultur spezifische Substratverbrauchsrate in Chemostatkultur spezifische Substratverbrauchsrate in Chemostatkultur spezifische Substratverbrauchsrate in Batchkultur Enzymbildungsrate (Enzymproduktivität) in Chemostatkultur Enzymbildungsrate (Enzymproduktivität) in Chemostatkultur Substratbildungsrate Biomassebildungsrate in Chemostatkultur (Biomasseproduktivität) Biomassebildungsrate in Batchkultur Substratkonzentration in Abhängigkeit von der Verdünnungsrate mit Berücksichtigung eines Absterbens von Zellen Substratkonzentration in der Chemostatkultur als Funktion der Verdünnungsrate Substratkonzentration in der Chemostatkultur als Funktion der Verdünnungsrate Einwaschen von Substrat (ohne Wachstum) Beginn der Störung bei t=0 Verlauf der Substratkonzentration im Auswasch-Versuch Beginn der Störung bei t=0 Substratkonzentrationsverlauf in Batchkultur für Ks << s(t) Dauer der Batchkultivierung Dauer der Batchkultivierung Zeitpunkt t, bei welchem x(t) während der Batchkultivierung erreicht wird Verdopplungszeit Anzahl Volumenwechsel in einem kontinuierlichen Rührkessel Biomassemenge in Batchkultur bei zeitlicher Veränderung von V(t) Anfangsbiomassekonzentration in Batchkultur Anfangsbiomassekonzentration in Batchkultur Anfangsbiomassekonzentration in Batchkultur Anfangsbiomassekonzentration in Batchkultur Anfangsbiomassekonzentration in Batchkultur Zeitverlauf der Biomassekonzentration für Ks << s(t) in Batchkultur Zeitverlauf der Biomassekonzentration für Ks << s(t) in Batchkultur Biomassekonzentration in Chemostatkulturen in Abhängigkeit von den Substratkonzentrationen Biomassekonzentration in der Chemostatkultur als Funktion der Verdünnungsrate Biomasseproduktivität in der Chemostatkultur als Funktion der Verdünnungsrate Biomassekonzentration in Abhängigkeit von der Verdünnungsrate mit Berücksichtigung eines Absterbens von Zellen Auswaschen von Biomasse (inkl. Wachstum mit µmax) Beginn der Störung bei t=0 Ausbeutekoeffizient (yield) Ausbeutekoeffizient für limitierenden Nährstoff in Chemostatkultur z-Wert </div RESULTS |