0,03175 min -1 - Carl von Ossietzky Universität Oldenburg
Werbung
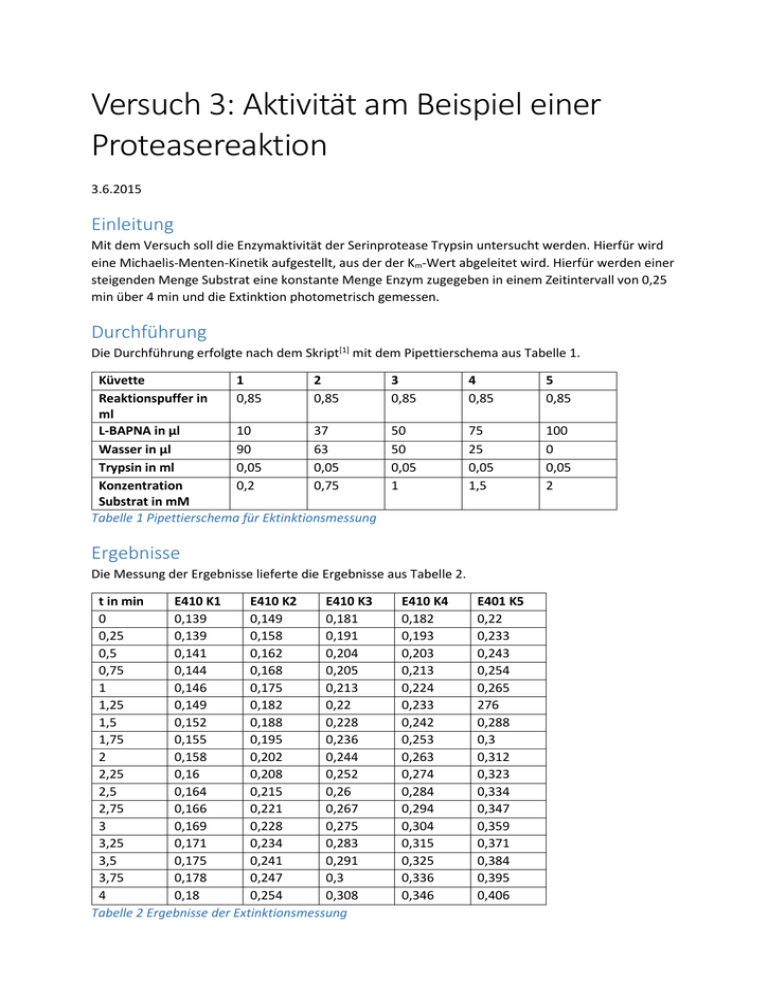
Versuch 3: Aktivität am Beispiel einer Proteasereaktion 3.6.2015 Einleitung Mit dem Versuch soll die Enzymaktivität der Serinprotease Trypsin untersucht werden. Hierfür wird eine Michaelis-Menten-Kinetik aufgestellt, aus der der Km-Wert abgeleitet wird. Hierfür werden einer steigenden Menge Substrat eine konstante Menge Enzym zugegeben in einem Zeitintervall von 0,25 min über 4 min und die Extinktion photometrisch gemessen. Durchführung Die Durchführung erfolgte nach dem Skript[1] mit dem Pipettierschema aus Tabelle 1. Küvette 1 2 Reaktionspuffer in 0,85 0,85 ml L-BAPNA in µl 10 37 Wasser in µl 90 63 Trypsin in ml 0,05 0,05 Konzentration 0,2 0,75 Substrat in mM Tabelle 1 Pipettierschema für Ektinktionsmessung 3 0,85 4 0,85 5 0,85 50 50 0,05 1 75 25 0,05 1,5 100 0 0,05 2 Ergebnisse Die Messung der Ergebnisse lieferte die Ergebnisse aus Tabelle 2. t in min E410 K1 E410 K2 E410 K3 0 0,139 0,149 0,181 0,25 0,139 0,158 0,191 0,5 0,141 0,162 0,204 0,75 0,144 0,168 0,205 1 0,146 0,175 0,213 1,25 0,149 0,182 0,22 1,5 0,152 0,188 0,228 1,75 0,155 0,195 0,236 2 0,158 0,202 0,244 2,25 0,16 0,208 0,252 2,5 0,164 0,215 0,26 2,75 0,166 0,221 0,267 3 0,169 0,228 0,275 3,25 0,171 0,234 0,283 3,5 0,175 0,241 0,291 3,75 0,178 0,247 0,3 4 0,18 0,254 0,308 Tabelle 2 Ergebnisse der Extinktionsmessung E410 K4 0,182 0,193 0,203 0,213 0,224 0,233 0,242 0,253 0,263 0,274 0,284 0,294 0,304 0,315 0,325 0,336 0,346 E401 K5 0,22 0,233 0,243 0,254 0,265 276 0,288 0,3 0,312 0,323 0,334 0,347 0,359 0,371 0,384 0,395 0,406 Auswertung Da es sich um einen linearen Zusammenhang handelt, gilt, dass die Anfangsgeschwindigkeit gleich der Steigung der Gerade des Zusammenhangs zwischen Extinktion zur Zeit ist. Es gilt: 𝑣0 = ∆𝐸 ∆𝑡 Daher ergibt sich für die Proben: 1. (0,2 mM): v0= 0,011 min-1 2. (0,75 mM): v0= 0,02625 min-1 3. (1 mM): v0= 0,03175 min-1 4. (1,5 mM): v0= 0,041 min-1 5. (2 mM): v0= 0,0465 min-1 Grafisch lässt sich die Anfangsgeschwindigkeit über ein Steigungsdreieck berechnen, wie exemplarisch an Probe in Abbildung 1. E410 K1 Extinktion bei 410 nm 0.19 0.18 0,011 0.17 ,011 1 0.16 0.15 0.14 0.13 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 t in min Abbildung 1 Steigungsdreieck/Anfangsgeschwindigkeitsbestimmung Probe 1 Aus den Anfangsgeschwindigkeiten lässt sich eine Michaelis-Menton-Kinetik aufstellen wie in Abbildung 2. Michealis-Menten-Kinetik v0 in min-1 0.05 0.04 0.03 0.02 0.01 0 0 0.5 1 1.5 2 2.5 c in mM Abbildung 2 Michaelis-Menten-Kinetik Zur Bestimmung von Km wird die Substratkonzentration und die Anfangsgeschwindigkeit reziprok aufgetragen in einem Line-Weaver-Burk-Diagramm, siehe Abbildung 3. 1/v0 in min Line-Weaver-Burk -2.00 100.00 90.00 80.00 70.00 60.00 50.00 40.00 30.00 20.00 10.00 0.00 -1.00 0.00 1.00 2.00 3.00 4.00 1/c in 1/mM Abbildung 3 Michaelis-Menton-Kinetik als Line-Weaver-Burk-Diagramm 5.00 6.00 Line-Weaver-Burk 1/v0 in min 100.00 90.00 80.00 70.00 60.00 50.00 40.00 17 30.00 20.00 10.00 0.00 -0.50 0.00 -2.00 -1.50 -1.00 0.50 1.00 1.50 2.00 1/c in 1/mM -1,2 Abbildung 4 Line-Weaver-Burk II An der Schnittstelle mit der x-Achse ergibt sich der negative reziproke Km-Wert. Für den Km Wert ergibt sich daher: Km=0,833 mM An der Schnittstelle mit der y-Achse ergibt sich der reziproke Wert für vmax. Daher ergibt sich für vmax: vmax= 0,0588 min-1 Die Enzymaktivität lässt sich folgendermaßen berechnen: 1U= 1µmol p-Nitroanilin/ min Nach dem Lambert-Behr‘schen Gesetz gilt: ∆𝐸 = 𝜀 ∗ 𝑐 ∗ 𝑑 Es gilt(exemplarisch Küvette 3): ∆𝐸 =0,03175 min-1 ε= 8800 M-1cm-1 d=1 cm 𝑐= ∆𝐸 0,03175 𝑚𝑖𝑛−1 𝑀 µ𝑀 = = 3,607 ∗ 10−6 = 3,607 −1 −1 ε∗d 8800 M cm ∗ 1𝑐𝑚 𝑚𝑖𝑛 𝑚𝑖𝑛 Bei einem Küvettenvolumen von 1 ml gilt: 0,003607 µ𝑀 𝑚𝑖𝑛 Daher ergeben sich 3,607 mU (da 1U= 1µmol p-Nitroanilin/ min) für die Enzymaktivität. Bezogen auf die Enzymmenge ergibt sich: 0,5 mg/ml Trypsin von 0,05 ml 10 mg/ml Das eingesetzte Volumen war ein ml, daher ergeben sich 10 mg 𝑆𝑝𝑒𝑧𝑖𝑓𝑖𝑠𝑐ℎ𝑒 𝐴𝑘𝑡𝑖𝑣𝑖𝑡ä𝑡 = 𝑈 𝑚𝑔 = 3,607 𝑚𝑈 10 𝑚𝑔 = 0,3607 𝑈 𝑔 Quellen 1. Praktikumsskript 2015 – AG Biochemie, Carl-von-Ossietzky-Universität Oldenburg (2015)