AUF-Jena-2011 - Medizinische Fakultät der Martin
Werbung
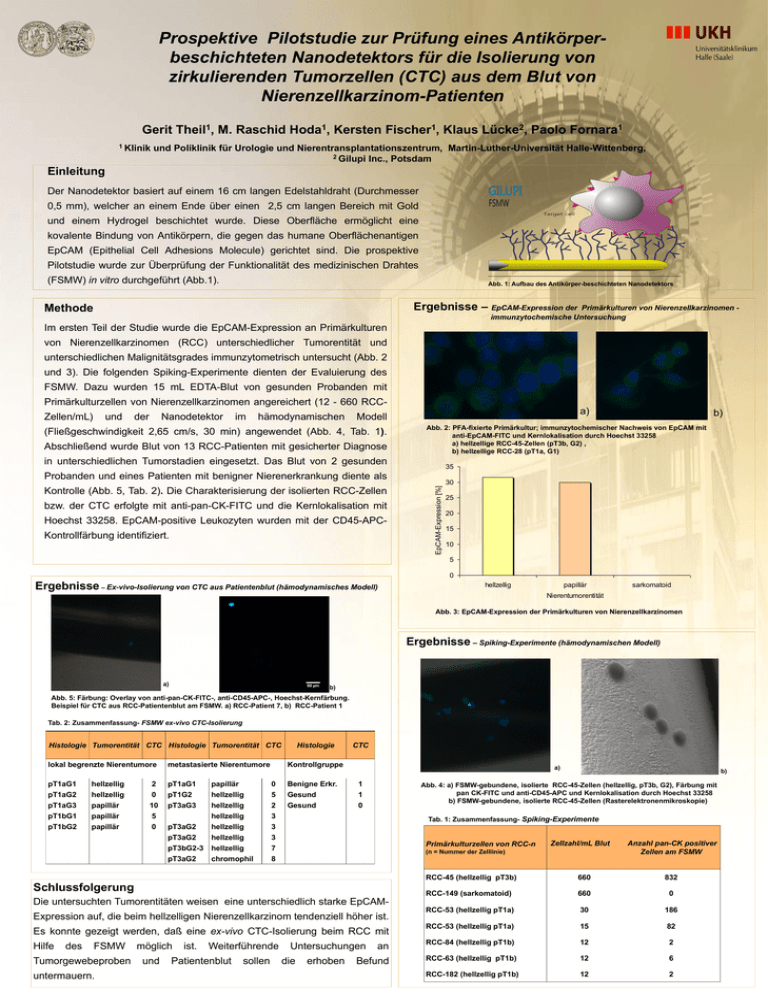
Prospektive Pilotstudie zur Prüfung eines Antikörperbeschichteten Nanodetektors für die Isolierung von zirkulierenden Tumorzellen (CTC) aus dem Blut von Nierenzellkarzinom-Patienten Gerit Theil1, M. Raschid Hoda1, Kersten Fischer1, Klaus Lücke2, Paolo Fornara1 1 Klinik und Poliklinik für Urologie und Nierentransplantationszentrum, Martin-Luther-Universität Halle-Wittenberg, 2 Gilupi Inc., Potsdam Einleitung Der Nanodetektor basiert auf einem 16 cm langen Edelstahldraht (Durchmesser 0,5 mm), welcher an einem Ende über einen 2,5 cm langen Bereich mit Gold und einem Hydrogel beschichtet wurde. Diese Oberfläche ermöglicht eine kovalente Bindung von Antikörpern, die gegen das humane Oberflächenantigen EpCAM (Epithelial Cell Adhesions Molecule) gerichtet sind. Die prospektive Pilotstudie wurde zur Überprüfung der Funktionalität des medizinischen Drahtes (FSMW) in vitro durchgeführt (Abb.1). Abb. 1: Aufbau des Antikörper-beschichteten Nanodetektors Ergebnisse – EpCAM-Expression der Methode Primärkulturen von Nierenzellkarzinomen immunzytochemische Untersuchung Im ersten Teil der Studie wurde die EpCAM-Expression an Primärkulturen von Nierenzellkarzinomen (RCC) unterschiedlicher Tumorentität und unterschiedlichen Malignitätsgrades immunzytometrisch untersucht (Abb. 2 und 3). Die folgenden Spiking-Experimente dienten der Evaluierung des FSMW. Dazu wurden 15 mL EDTA-Blut von gesunden Probanden mit Primärkulturzellen von Nierenzellkarzinomen angereichert (12 - 660 RCCZellen/mL) und der Nanodetektor im hämodynamischen a) Modell (Fließgeschwindigkeit 2,65 cm/s, 30 min) angewendet (Abb. 4, Tab. 1). Abschließend wurde Blut von 13 RCC-Patienten mit gesicherter Diagnose Abb. 2: PFA-fixierte Primärkultur; immunzytochemischer Nachweis von EpCAM mit anti-EpCAM-FITC und Kernlokalisation durch Hoechst 33258 a) hellzellige RCC-45-Zellen (pT3b, G2) , b) hellzellige RCC-28 (pT1a, G1) in unterschiedlichen Tumorstadien eingesetzt. Das Blut von 2 gesunden 35 bzw. der CTC erfolgte mit anti-pan-CK-FITC und die Kernlokalisation mit Hoechst 33258. EpCAM-positive Leukozyten wurden mit der CD45-APCKontrollfärbung identifiziert. EpCAM-Expression [%] Probanden und eines Patienten mit benigner Nierenerkrankung diente als Kontrolle (Abb. 5, Tab. 2). Die Charakterisierung der isolierten RCC-Zellen b) 30 25 20 15 10 5 0 Ergebnisse – Ex-vivo-Isolierung von CTC aus Patientenblut (hämodynamisches Modell) hellzellig papillär sarkomatoid Nierentumorentität Abb. 3: EpCAM-Expression der Primärkulturen von Nierenzellkarzinomen a) b) Ergebnisse – Spiking-Experimente (hämodynamischen Modell) a) b) Abb. 5: Färbung: Overlay von anti-pan-CK-FITC-, anti-CD45-APC-, Hoechst-Kernfärbung. Beispiel für CTC aus RCC-Patientenblut am FSMW. a) RCC-Patient 7, b) RCC-Patient 1 c) d) Tab. 2: Zusammenfassung- FSMW ex-vivo CTC-Isolierung Histologie Tumorentität CTC Histologie Tumorentität CTC lokal begrenzte Nierentumore metastasierte Nierentumore pT1aG1 pT1aG2 pT1aG3 pT1bG1 hellzellig hellzellig papillär papillär 2 0 10 5 pT1aG1 pT1G2 pT3aG3 pT1bG2 papillär 0 pT3aG2 pT3aG2 pT3bG2-3 pT3aG2 Histologie CTC Kontrollgruppe papillär hellzellig hellzellig hellzellig 0 5 2 3 hellzellig hellzellig hellzellig chromophil 3 3 7 8 Benigne Erkr. Gesund Gesund a) 1 1 0 b) Abb. 4: a) FSMW-gebundene, isolierte RCC-45-Zellen (hellzellig, pT3b, G2), Färbung mit pan CK-FITC und anti-CD45-APC und Kernlokalisation durch Hoechst 33258 b) FSMW-gebundene, isolierte RCC-45-Zellen (Rasterelektronenmikroskopie) e) Tab. 1: Zusammenfassung- Spiking-Experimente Primärkulturzellen von RCC-n Zellzahl/mL Blut (n = Nummer der Zelllinie) Anzahl pan-CK positiver Zellen am FSMW RCC-45 (hellzellig pT3b) 660 832 RCC-149 (sarkomatoid) 660 0 RCC-53 (hellzellig pT1a) 30 186 RCC-53 (hellzellig pT1a) 15 82 an RCC-84 (hellzellig pT1b) 12 2 Befund RCC-63 (hellzellig pT1b) 12 6 RCC-182 (hellzellig pT1b) 12 2 Schlussfolgerung Die untersuchten Tumorentitäten weisen eine unterschiedlich starke EpCAMExpression auf, die beim hellzelligen Nierenzellkarzinom tendenziell höher ist. Es konnte gezeigt werden, daß eine ex-vivo CTC-Isolierung beim RCC mit Hilfe des FSMW Tumorgewebeproben untermauern. möglich und ist. Weiterführende Patientenblut sollen Untersuchungen die erhoben