Präsentation ()
Werbung

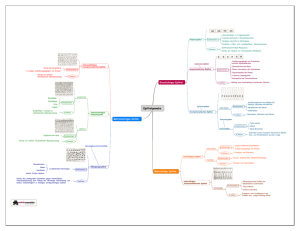
Philipps Universität Marburg Fachbereich Chemie (15) Experimentalvortrag Sommersemester 2007 Sauerstoff Referent: Stefan Dönges Periodensystem der Elemente 2 Gliederung Allgemeines Entstehung Vorkommen Darstellung Verwendung Eigenschaften Schulische Relevanz 3 Allgemeines Farb- und geruchloses Gas Typisches Nichtmetall Reagiert mit den meisten Elementen des PSE direkt Oxidationsmittel Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 4 Gasf. Sauerstoff: reaktionsträge Fl. Sauerstoff: wirkt stark oxidierend Oxidationsprozesse: exotherm (Bsp.: „Verbrennungsprozesse“) Diradikal Paramagnetisch Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 5 Entstehung Durch Kernfusionsprozesse in Sonnen Ende des Sternenlebens Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 6 Verteilung der Elemente im Weltraum: Durch Sonneneruptionen Durch Supernovae Explosionen Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 7 Vorkommen Am häufigsten vorkommendes Element (48,9%) Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 8 Bsp.: Erdkruste Massenanteil: 50,5 % Bsp.: Wasser Massenanteil: 88,8 % Bsp.: Atmosphäre Massenanteil: 23,16 % Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 9 Bsp.: Atmosphäre: Prozent Name 78,08 Stickstoff [N2] 20,95 Sauerstoff [O2] 0,93 Argon [Ar] 0,34 Kohlendioxid [CO2] 0,0018 Neon [Ne] 0,0005 Helium [He] Volumenprozent Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 10 Elementar Trisauerstoff (Ozon) Disauerstoff Umgebungsluft Gelöst im Wasser Ozonschicht Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 11 Disauerstoff Singulett Sauerstoff Triplett Sauerstoff 3O 2 ( 1O ) Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 2 ( ) 12 MO –Diagramm 1O 3O Bindungsordnung: 2 Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften - Schulische Relevanz Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 13 2 2 Sauerstoff Woher stammen die Namen? Namensgebung durch Formel zur Spinmultiplizität (2 * n + 1) Singulett: ( Triplett: ( ) ) 1O 2, 3O , 2 da Gesamtspin = 2 * [+½ + (-½)] +1 = 1 da Gesamtspin = 2 * [+½ + (+½)] +1 Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz =3 14 Versuch 1: Darstellung von Singulett - Sauerstoff Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 15 Reaktionsgleichung Chlorgasentwicklung: +4 –2 +1 –1 +2 MnO2 (s) + 4 HCl (aq) -1 0 +1 -2 MnCl2 (aq) + Cl2 (g) + 2 H2O (l) Chlor disporportioniert zu Hypochlorit und Chlorid 0 -2 +1 +1 -2 Cl2 (g) + 2 OH - (aq) ClO - -1 +1 -2 + Cl (aq) (aq) + H2O (l) Bildung von Singulett - Sauerstoff +1 -1 H2O2 (aq) OCl- + - OH- +1 -1 -1 +1 HOOCl (aq) rasch - HCl Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 0 1O 2 (aq) 16 Woher stammt das rote Schimmern, die „Chemolumineszenz“ ? 1 g 1-Photon-2Molekül-Prozess g 1 3 g 1. Übergang 1 g 1O ( 2 1 3 g ) + 1O2 ( ) Stoß g 3O ( 2 3 g 1.ÜG ) + 3O2 ( ) geht über zu: Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 17 2. Übergang 1 1 1 3 3 g g + 759 nm g g geht über zu: g 2.ÜG Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 18 Gebunden: Oxide (H2O, CO2, SiO2) Carbonate (CO32-) Silikate (SxOyz-) Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 19 Versuch 2: Luftanalyse Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 20 vorher nachher kupferfarben 0 grau-schwarz 0 +2 -2 2 Cu (s) + O2 (g) 2 CuO (s) Volumenabnahme 100 mL ca. 80 mL Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 21 ca. 20 % O2 in der Umgebungsluft Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 22 Woher dieser hohe Massenanteil Sauerstoff in der Umgebungsluft? Aus Photosyntheseprozessen Durch chlorophyllhaltige Pflanzen aus CO2 und H2O gewonnen Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 23 Photosynthese Bsp.: Bildung von Glucose (schematisch) 6 H2O + 6 CO2 Lichteinwirkung C6H12O6 + 6 O2 Chlorophyll Ein Baum (200.000 Blättern) produziert pro Sonnentag: 9,4 m3 O2 Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 24 Energieprofil des Photosyntheseprozesse Energie Energie C6H12O6 (s) + 6 O2 (g) 6 H2O(l) + 6 CO2 (g) Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 25 Demo 1: Photosyntheseprozess bei Wasserpest Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 26 Sauerstoffgewinnung Großtechnisch: Linde Verfahren zur Luftverflüssigung + fraktionierte Destillation Im Labor: Katalytische Zersetzung von H2O2 Thermische Zersetzung von Oxiden Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 27 Linde Verfahren zur Luftverflüssigung: Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 28 1. Schritt: Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 29 2. Schritt: Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 30 3. Schritt: Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 31 4. Schritt: Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 32 Auftrennung der verflüssigten Gase durch: Fraktionierte Destillation Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 33 Darstellung im Labor: Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 34 Versuch 3: Katalytische Zersetzung von Wasserstoffperoxid Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 35 Reaktionsgleichung: +1 -1 0 2 H2O2 (aq) <Kat> +1 -2 O2 (g) + 2 H2O (l) H2O (l) ∆H° = - 98 kJ/mol (exotherm) H2O (g) Wirkungsweise des Katalysators: +4 -2 +1 -1 MnO2 (s) + H2O2 (aq) +6 -2 +1 -1 “MnO3“(s) + H2O2 (aq) +6 -2 +1 -2 “MnO3“(s) + H2O (l) +4 -2 +1 -2 0 MnO2 (s) + H2O (l) + O2 (g) ↑ Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 36 Energieprofil der H2O2 Zersetzung - ohne MnO2 Energie 2 H2O2 EAkt / hin Hohe Aktivierungsenergie läuft bei Raumtemperatur nur gehemmt ab KINETISCH GEHEMMT 2 H2O + O2 Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 37 Energieprofil der H2O2 Zersetzung - mit MnO2 Energie 2 H2O2 EAkt Herabsetzung der Aktivierungsenergie Reaktion verläuft schon bei Zimmertemperatur 2 H2O + O2 Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 38 Sauerstoffnachweis Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 39 Demo 2: Verbrennung eines glimmenden Spanes Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 40 Verwendung Energiegewinnung in Organismen Stahlerzeugung Erzeugung hoher Temperaturen Schweißtechnik Medizinischen Zwecken Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 41 Verwendung: Atmung Verbrauch eines Menschen Pro Atemzug: 0,5 – 2,0 L (Luft) Atemvolumen / min: 4,7 L (Schlaf) – 60 L (Sport) (Luft) 12.000 L Luft pro Tag = 2.500 Liter O2 am Tag Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 42 Oxidationsvermögen: Schnelle, heftige Prozesse mit großer Energieabgabe Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 43 Versuch 4: Verbrennung von Stahlwolle Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 44 Reaktionsgleichung: 0 0 2 Fe (s) + O2 (g) +2 -2 2 FeO (s) nachher vorher Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 45 Oxidationsvermögen: Langsame Oxidationsprozesse Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 46 Versuch 5: Stille Verbrennung (Sauerstoffkorrosion) Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 47 Vorher: Nachher: Reaktionsgleichung 0 +2 2 Fe 2+ (aq) + 4 e- 2 Fe (s) +1 -2 0 -2 +1 2 H2O (l) + O2 (g) + 4 e+2 -2 +1 2 Fe 2+ (aq) + 4 OH- (aq) - 6 (aq) 4 OH- (aq) +2 -2 +1 2 Fe(OH)2 (s) Volumenabnahme im Reagenzglas Ansteigen der Wassersäule Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 48 Folgereaktion: +2 -2 +1 0 +1 -2 4 Fe(OH)2 (s) + O2 (g) + 2 H2O (l) +3 -2 +1 4 Fe(OH)3 (s) +3 -2 +1 +3 -2 -2 +1 +1 -2 Fe(OH)3 (aq) FeO(OH) (s) + H2O (l) Rostbildung: 2 FeO(OH) (s) „Fe2O3* H2O“ (s) rotbraun Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 49 Flugzeugpark, Mojave Wüste Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 50 Grund für die langsam ablaufende Oxidation: Hohe Dissoziationsenergie (498,34 kJ / mol) „Zündungsenergie“ fehlt Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 51 Demo 3: Flüssiger Sauerstoff Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 52 Magnetische Eigenschaften von Sauerstoff? Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 53 Versuch 6: Paramagnetismus von Sauerstoff Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 54 Paramagnetismus Stoffe mit ungepaarten Elektronen besitzen ein magnetisches Moment Grund: magnetisches Einzelmoment kann nicht ausgeglichen werden Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 55 Daraus folgt: Vergrößerung der Kraftflussdichte der Feldlinien im Inneren Stoff wird in ein Magnetfeld hineingezogen Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 56 MO – Schema des Disauerstoffs • Diradikal paramagnetisch Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 57 Reaktion mit flüssigem Sauerstoff Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 58 Demo 4: Verbrennung einer sauerstoffgetränkten Zigarre Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 59 Schulische Relevanz Jahrgangsstufe 7: Einführung in die Chemischen Reaktionen (V 2, V 3, V 4) Reaktionen von Metallen und Nichtmetallen mit Sauerstoff (V 2, V 4, V 5, Demo 4) Gesetz zur Erhaltung der Masse (V 4) Quantitative Zusammensetzung der Luft (V 2) Jahrgangsstufe 10: Redoxreaktionen (V 2, V 3, V 4, V 5) Ausgewählte Redoxreaktionen (V 4) (V 5) Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 60 Schulische Relevanz Jahrgangsstufe 12: Geschwindigkeit chemischer Reaktionen (Anwendung von Katalysatoren (V 3)) Jahrgangsstufe 12: GK / LK Wahlthema angewandte Chemie Korrosion (V 5) Allgemeines – Entstehung – Vorkommen – Darstellung – Verwendung – Eigenschaften – Schulische Relevanz 61 Vielen Dank für Ihre Aufmerksamkeit! -Ende- 62