1.9 Gase
Werbung

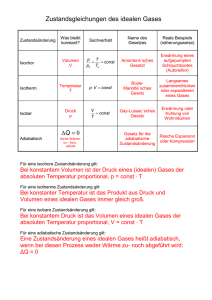
Ideale Gase Ideale Gase sind ein „Modellsystem“: - kugelförmige Teilchen, frei beweglich - Wechselwirkung nur durch vollkommen elastische Stöße - mittlere freie Weglänge zwischen den Stößen ist temperaturabhängig Gase nehmen jeden verfügbaren Raum ein; die Größe dieses Raums ist abhängig vom Druck im Gas vom Druck aus der Umgebung; die Größe dieses Raums bestimmt die Dichte: druckabhängige Dichte; Gase 1 Modellvorstellung zum Druck Druck entsteht durch den Stoß der Gasteilchen an die Gefäßwand: makroskopisch gemessener Druck ist Summe vieler Teilchenstöße jeder Teilchenstoß ist ein Impulsübertrag an die Wand, die Wand liefert den entsprechenden doppelten Gegenimpuls Häufigkeit der Impulsüberträge bestimmt Druckwirkung: je mehr Teilchen pro Zeiteinheit die Wand treffen, desto höher der Druck; wg. der temperaturabhängigen Teilchengeschwindigkeit ist der Druck wärmeabhängig Gase 2 Innere Energie U des idealen Gases Wärmeenergie ΔQ = ΔW + ΔU ΔU = Epot + Ekin Wärme ist in der Bewegungsenergie der Gasteilchen gespeichert (Epot = 0) : „kinetische Gastheorie“ ΔU = m · c · Die Konstante c ist die spezifische Wärme: - Materialeigenschaft, die von der Dichte und Masse der Teilchen abhängig ist (aber nicht von ihrem Zusammenhalt) - bei Gasen hängt die Dichte vom verfügbaren Volumen und vom Umgebungsdruck ab 3 Gasgesetze I Gesetz von Amontons (1663-1705) : Druckänderung bei konstantem Volumen Gasvolumen mit bestimmtem Druck erwärmen, Manometer ausgleichen und aus dem Schweredruck der überstehenden Flüssigkeit den Druck im Gasvolumen bestimmen: P = rFl·g·h + Luftdruck temperaturabhängiger Druck 3 h 2.5 p in Pa Gasvolumen Wasserbad 2 1.5 1 0.5 0 0 2 4 6 8 10 q in K Gase 4 Gasgesetze II Gesetz von Gay-Lussac (1778-1850) : Volumenänderung bei konstantem Druck Gasvolumen erwärmen, die aufsteigende Gasmenge in einem Auffangbehälter messen,der im Druckgleichgewicht mit der Umgebungsluft steht. temperaturabhängiges Volumen 3 Gasmessvolumen 2.5 V in ml 2 Gasvolumen 1.5 1 0.5 Wasserbad 0 0 2 4 6 8 10 θ in K Gase 5 Gasgesetze III Gesetz von Boyle (1627-1691) -Mariotte (1620-1684) : Änderung von Druck und Volumen bei konstanter Temperatur Beispiel: langsame Druckänderung in einer Fahrradpumpe Druckzunahme mit der Wassertiefe wg. des Schwerdrucks des Wassers. Boyle-Mariotte-Diagramm P · V = const. , p in bar bei konstanter Temperatur (Film zeigen) 160 140 120 100 80 60 40 20 0 0 0,5 1 1,5 V in cm³ Gase 6 Ideale Gasgleichung Kombination der drei Gasgesetze: - von Amontons: p/q = const bei konstantem Volumen - von Gay-Lussac: V/q = const bei konstantem Druck - von Boyle-Mariotte: p*V = const bei konstanter Temperatur ergibt eine Gleichung, die alle Variablen eines Gaszustandes enthält: P V q const. Für den Vergleich verschiedener Gaszustände gilt: P1 V1 q1 P2 V2 Gase q2 7 Allgemeine Gaskonstante P V q const. Der Wert der Konstanten ist abhängig vom Teilchengehalt des Gases. Für eine Teilchenzahl n gilt: P V q n R R ist die allgemeine Gaskonstante bei Normalbedingungen ( V = 22,4 l, p = 1013 hPa, q = 273 K, n = 1mol) ist R = 8,314 J / (mol·K) Gase 8 Allgemeine Gaskonstante R ist ein Maß für die Energie eines Mols eines Gases: R = 8,314 J / (mol · K) Teilt man diesen Wert durch die Anzahl der Teilchen eines Mols eines Stoffes ( n = 6,022 · 10 23 ), so erhält man die Energiemenge pro Teilchen: kB = R/n = 1,38 * 10 -23 J/K kB heißt Boltzmann(1844-1906)-Konstante und gibt die Energiemenge an, die ein Gasteilchen bei einer Temperaturänderung pro K zugeführt bekommt bzw. abgibt. Daraus ergibt sich die kinetische Energie der Gasteilchen: m·v²/2 = 3/2 · kB · q, wobei v die mittlere Geschwindigkeit der Gasteilchen ist. 9 Zustandsänderungen des idealen Gases Die Gasgleichung beschreibt die Änderung des Energiezustandes in einem idealen Gas: V/q = const: isobare Zustandsänderung: p/q = const: isochore Zustandsänderung p·V = const: isotherme Zustandsänderung P V n R q Beim letzten Beispiel ist am einfachsten anschaulich zu machen, dass all diese Prozesse mit einem Energieaustausch mit der Umgebung verbunden sind (Warmwerden der Fahrradpumpe). (Findet kein Energieaustausch mit der Umgebung statt, so heißt die Zustandsänderung „adiabatisch“ Q = 0 = W + ΔU W = - ΔU) Gase 10 Energieumsatz in Gasen Einheitenbetrachung: [p]=1N/m²; [V]=1m³; [p]*[V] = 1Nm = [E] isochor isobar isotherm schraffierte Fläche: mechanischer Energieumsatz ( Arbeit! ) Gase 11 Ideales und reales Gas P,V – Zustandsdiagramm in Kohlendioxid Experiment Theorie van der Waals (1837-1923): (p a V 2 )(V b) n R q Gleichung 3. Grades im Volumen V Gase 12 Eigenschaften realer Gase Wechselwirkung zwischen den Gasteilchen: van der Waals – Kräfte (gegenseitig induzierte elektrische Dipole in den Elektronenhüllen zweier Teilchen) praktische Folgen: Koexistenzphase zwischen verschiedenen Aggregatszuständen Verflüssigung durch Temperatur/Druckänderung bei genügend hohen Temperaturen verhält sich ein reales Gas wie das ideale Gas Gase 13