Document
Werbung

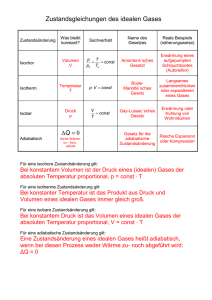
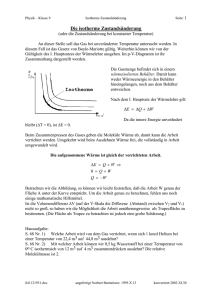
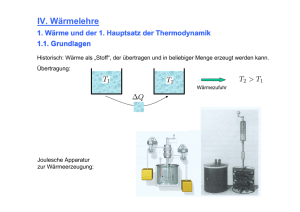
Vorlesung Physik für Pharmazeuten PPh - 07 Wärmelehre Aggregatzustände der Materie im atomistischen Bild Beispiel Wasser Eis Wasser Wasserdampf Dynamik an der Wasser-Luft Grenzfläche im atomistischen Bild Wärmelehre Thermodynamik p,V,T Die Thermodynamik beschreibt Phänomene, die mit Wärme zu tun haben, durch makroskopische Zustandsgrößen (Temperatur, Druck, Volumen, ...) bzw. Prozessgrößen (Wärme, Arbeit ...) thermodynamische Gesetze beschreiben Zustände, Zustandsänderungen, Phasenübergänge etc. pV = const. T Statistische Mechanik Wärme ist verknüpft mit ungeordneter Molekularbewegung von sehr vielen Teilchen. In einem atomistischen Bild können nur ! statistische Aussagen über Mittelwerte und Verteilungen der mechanischen Größen z.B. xi Orte, vi Geschwindigkeiten getroffen werden. Die Temperatur ist ein Maß für die mittlere kinetische Energie 3 1 r2 k B T = mv 2 2 Grundlagen für Messungen mit Wärme Abgeschlossenes System: -System, das mit keinem anderen System in Wechselwirkung steht - kein Teilchen- oder Wärmeaustausch Gleichgewichtszustand: "Befinden sich zwei Körper mit einem dritten im thermischen Gleichgewicht, so sind sie auch untereinander im Gleichgewicht" „Nullter Hauptsatz der Thermodynamik“ T1 T2 T0 T3 T0 T0 Celsiusskala und Fahrenheitskala 100°F=37°C Wasser/ Ammoniumchlorid Thermometer Messung der Temperatur über stark temperaturabhängige physikalische Größen Flüssigkeitsthermometer VolumenausDehnung ~ ΔT Thermoelement Thermospannung Bimetall-Thermometer Krümmung ~ ΔT Pyrometer Wärmestrahlung Thermische Ausdehnung fester und flüssiger Körper Erwärmung um "T = T2 ! T1 führt zu einer linearen Längenzunahme !L = # " L " !T α: Längenausdehnungskoeffizient !V = % V " L " !T # 3$ " L " !T γV: Volumenausdehnungskoeffizient Thermische Kräfte Schätzen Sie die Kraft des Bolzensprengers ab ! !L F = E " A" L = E " A " # " !T Lager einer Eisenbrücke zur Vermeidung von thermischen Spannungen E : E-Modul ~ 1011N/m2 A : Fläche ~ cm2 α: 10-5 K-1 ΔT : 100K F ~ 104 N Versuch Atomares Modell der thermischen Ausdehnung Tabelle : Wärmeausdehnung bei 20°C Die Atome schwingen um ihre Gleichgewichtslage. Für große Auslenkungen (größere kinetische Energie=höhere Temperatur) ist das Wechselwirkungspotential asymmetrisch und der Mittelwert des atomaren Abstands vergrößert sich. Wärmeausdehnung und Dichte Mit der thermischen Ausdehnung ändert sich auch die Dichte: im allgemeinen gilt: $0 $ (T ) = 1 + # V " (T ! T0 ) Berühmte Ausnahme: die Dichteanomalie des Wassers Höchste Dichte bei 3.9°C negativer Ausdehnungskoeffizient für 0<T<3.9°C Thermische Ausdehnung von Gasen V (T0 + TC ) = V (T0 )(1 + " V ! TC ) 1. Gay-Lussac-Gesetz Isobare Zustandsänderung : Zustandsänderung findet bei konstantem Druck statt. V 1 1 !V = = T0 273,15 Joseph Louis Gay-Lussac (1778-1850) -T0 ϑ[oC] Versuch : Gasthermometer Erfahrungstatsache : Die thermische Ausdehnung verdünnter Gase ist (nahezu) unabhängig von der Gassorte Isochore Zustandsänderung Zustandsänderung findet bei konstantem Volumen statt. p(T0 + TC ) = p(T0 )(1+ " P # TC ) 2. Gay-Lussac-Gesetz (Gesetz von Charles) ! p 1 1 !P = = T0 273,15 Gasthermometer mit Konstantem Volumen -T0 ϑ[oC] Ideale Gase und die absolute Temperaturskala p(T0 + TC ) = p(T0 )(1+ " P # TC ) Tripelpunkt des Wasser TK = 273,16 K ! Bei -273,15°C hat ein ideales Gas theoretisch keinen Druck und kein Volumen. Dieser natürlicher Fixpunkt wird als absoluter Nullpunkt einer absoluten Temperaturskala (der Kelvinskala) definiert. T [K ] = 273,15 + Tc [°C ] Umrechnung von Celsius in die Kelvinskala Temperaturdifferenzen in Kelvin und Celsius-Skala sind gleich. Es gibt keine negativen absoluten Temperaturen,TK=0 prinzipiell nie erreichbar. Der Begriff des idealen Gases • ein idealisiertes thermodynamisches System • „Punktteilchen“, keine Wechselwirkungen • stark verdünnte reale Gase verhalten sich näherungsweise wie ideale Gase • bei höheren Dichten treten Abweichungen vom idealen Verhalten auf. Isotherme Zustandsänderung Zustandsänderung findet bei konstanter Temperatur statt. p1 " V1 = p2 " V2 ! p Gesetz von Boyle-Mariotte n ! R !Tconst p(V ) = V T3 T2 T1 V Versuch Boyle-Mariotte Robert Boyle (1627-1691) Edme Mariotte (1620-1684) Zustandsgleichung idealer Gase p1V1 p2V2 = = const T1 T2 Allgemeine Zustandsgleichung idealer Gase (Lord Kelvin) ! p1 ! V1 = n ! R ! T n : Zahl der Mole R= 8,317 J/mol K Allgemeine Gaskonstante Für ein „ideales Gas“ ist bei einem Normaldruck von 1013,25 hPa und einer Normaltemperatur von 0°, das molare Volumen Vm,0=22,4 liter/mol Zustandsänderungen des idealen Gases im p-V-Diagramm p Isotherme : T=const Isobare : P=const Isochore : V=const V Die molekulare Deutung der Temperatur: Kinetische Gastheorie Ideales Gas: Moleküle verhalten sich wie harte Kugeln, d.h. sie führen nur elastische Stöße aus, keine WW, kein Eigenvolumen. - bei Normalbedingungen ca. 3 x 1019 Moleküle pro cm3 - mittlere freie Weglänge ca. 10-7 m. Demonstration : Rüttler Der Gasdruck - mikroskopisch betrachtet Moleküle treten mit mittlerer Geschwindigkeit <v> in das Volumen dV ein dV = A ! v x ! dt Anz. Moleküle, die pro Zeit auf die Wand treffen A! v x 1 dV 1 dN = N = N! ! dt 6 V 6 V Druck = Kraft Anz. Stöße Impulsübertrag = Zeit Fläche Fläche p= ! F dN 2mv 1 N 2mv = " = Av" A dt A 6V A 2N 1 2N 2 p= " mv = " E kin 3V 2 3V V N x dV Gleichverteilungssatz (Äquipartitionsgesetz) Im statistischen Gleichgewicht ist die kinetische Energie eines Moleküls pro „Freiheitsgrad“ im Mittel ½ kBT. Die mittlere Energie eines einatomigen Gases beträgt demnach Ekin = 3 N ! k BT 2 Für mehratomige Moleküle können auch Rotationen und Schwingungen beitragen, dann gilt f !N Ekin = k BT 2 Die Gesamtzahl der Freiheitsgrade, f, eines Gasmoleküls ist die Summe der Translations-, der Schwingungs- und der Rotationsfreiheitsgrade Die Boltzmannkonstante ist das Verhältnis aus Gaskonstante und Avogadrokonstante kB= R/NA= 1,38 ·10-23 J/K Ludwig Boltzmann (1844-1906) Maxwellsche Geschwindigkeitsverteilung Gefragt ist nach der Anzahl Moleküle dN mit Geschwindigkeiten zwischen v und (v+dv) : dN = N " f (v) dv f(v) : die Verteilungsfunktion der Geschwindigkeiten f(v) 90 K ! 800 3 2 m ( % f ( v) = 4 ! ) ! v ! & # e ' 2 !) ! k ! T $ 2 X10-6 600 300 K 400 900 K 200 0 0 2000 4000 v[m/s] 6000 8000 m! v 2 " 2!k !T Wärmemenge und Wärmekapazität - Wärme ist eine Form von Energie (wird also in Einheit Joule gemessen) - Die einem System zugeführte Wärme erhöht seinen Energieinhalt. - Q bezeichnet die einem System zugeführte oder entzogene Wärmemenge Die zugeführte Wärmemenge ist proportional zu Masse und Temperaturänderung !Q = c " m " !T = C " !T C (J/K) : Wärmekapazität c (J/kg K) : spezifische Wärmekapazität Neben der spezifischen Wärmekapazität wird auch häufig die molare Wärmekapazität cm (J/(mol*K)) verwendet (Wärmekapazität pro Mol) cm = C n n : Molenanzahl eines Stoffes Messung des elektrischen und mechanischen Wärmeäquivalents Joulesches Experiment 1 cal = 4,18 Joule = 4,18 W s Versuch Kalorimetrie Die spezifische Wärme cS eines Stoffes kann in einem Mischungskaloriemeter bestimmt werden. T0 S T0w Tm Tm : Mischungstemperatur cw " mw " (Tm ! T0 w ) = cS " mS " (T0 S ! Tm ) Die Volumenarbeit eines idealen Gases Die Arbeit, dW, die ein Gas gegen eine äußere Kraft leistet, wird Volumenarbeit genannt. (Die Arbeit hat ein negatives Vorzeichen, weil dem System Energie entzogen wird) Gas P=F/A dW = ! PdV Wisobar = ! P0 (V2 ! V1 ) Wisotherm V2 = ! " PdV = ! nRT ln V1