ln(u) - Institut für Thermodynamik und Wärmetechnik
Werbung

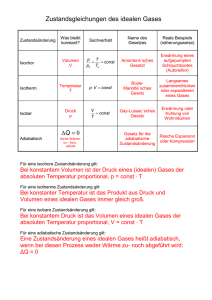
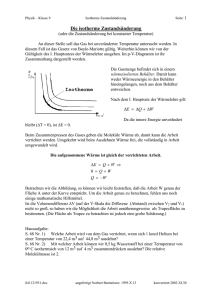
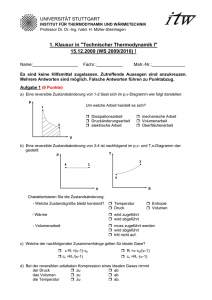
UNIVERSITÄT STUTTGART INSTITUT FÜR THERMODYNAMIK UND WÄRMETECHNIK Apl. Professor Dr.-Ing. K. Spindler 1. Klausur in "Technischer Thermodynamik I" 12.12.2012 (WS 2012 / 2013) ! Name:___________________ Fachr.:___________ Matr.-Nr.:______________ Es sind keine Hilfsmittel zugelassen. Zutreffende Aussagen sind anzukreuzen. Mehrere Antworten sind möglich. Falsche Antworten führen zu Punktabzug. Aufgabe 1 (11 Punkte) a) Ein geschlossenes System hat ein konstantes Volumen. Diese Aussage ist richtig falsch. b) Wie lautet das vollständige Differential für die Enthalpie h=h(p,T)? ……………………………………………………………………………. c) Bei einer reversiblen isochoren Druckerhöhung eines idealen Gases erwärmt sich das Gas kühlt sich das Gas ab bleibt die Temperatur konstant. d) Bei einer reversiblen isobaren Expansion eines idealen Gases nimmt die Entropie zu nimmt die Entropie ab bleibt die Entropie konstant. e) Kennzeichnen Sie nachfolgend alle kalorischen Zustandsgleichungen 2 u=u(T,v) h=h(T,p) ∫ w12 = − p dv 1 p=p(T,v) s = s(p,T) h2 − h1 = wt ,12 + q12 f) Bei einer reversiblen Zustandsänderung eines idealen Gases ist die zugeführte Wärme gleich der Erhöhung der inneren Energie. Dabei kann die Änderung der Geschwindigkeit und der Lage vernachlässigt werden und es gilt: U 2 - U 1 = Q 12 Es handelt sich um eine adiabate isotherme isochore isobare Zustandsänderung. g) Ein ideales Gas wird ausgehend vom Zustand 1 reversibel adiabat um ∆V=const. entspannt. (g1) Skizzieren Sie die Zustandsänderung im p,V- und T,S-Diagramm. (g2) Schraffieren Sie die bei dieser Zustandsänderung auftretende Volumenarbeit in dem dafür geeigneten Diagramm. T ∆V p ∆V 1 t. ons V=c 1 t. ons V=c t. ons V=c ∆V ∆V V S h) Bei rechtsgängigen Kreisprozessen wird mehr Wärme zu- als abgeführt weniger Wärme zu- als abgeführt sind zu- und abgeführte Wärmemengen gleich groß. i) Mit Hilfe des Jouleschen Überströmversuches wird gezeigt, dass U = U(V) U ≠ U(V) H = H(p) U = U(T) U ≠ U(T) H = H(T) H ≠ H(p) H ≠ H(T) Formelzusammenstellung - 1. Hauptsatz: geschlossenes System dU + dE kin + dE pot = dQ + dW mit offenes System dW = −pdV + dWdiss + dWmech, dh + de kin + de pot = dq + dw t mit dw t = vdp + dw diss + dw mech, potentielle Energie e pot = g ⋅ z , kinetische Energie e kin = c 2 /2 du = c V ⋅ dT , dh = c p ⋅ dT - ideale Gase: dT dv dT ds = c V ⋅ + Ri ⋅ = cp ⋅ − Ri T v T p ⋅ V = m ⋅ Ri ⋅ T , p ⋅ V = n ⋅Rm ⋅ T κ=c p /c v ; c p = c v + Ri ; dp ⋅ p cV,m= cV·M cp,m= cp·M theoretische Stoffwertbestimmung c V,m =(f/2)·R m ; c p ,m =(1+f/2)·R m mit f … Bewegungsfreiheitsgrade für Translation und Rotation reversibel adiabate Zustandsänderung: p ⋅ v κ = const. , T ⋅ v κ −1 = const. , κ -1 T/ p κ = const. - Umrechnung: 5 5 2 5 3 1 b a r = 10 P a = 10 N/m = 10 J /m - Schwerebeschleunigung: g = 9,81 m /s 2 - Universelle (molare) Gaskonstante: R m = 8,314 J/(mol K), R m = M ⋅ R i , M = m n - Mathematische Zusammenhänge: ∫ du = [ln(u)] u Es sind keine Hilfsmittel zugelassen. Bearbeitete Aufgaben werden als vollständig richtig bewertet, wenn neben dem korrekten Endergebnis auch der Rechengang ersichtlich ist. Aufgabe 2 (5 P u n kte ) = 1 mol/sec eines einatomigen, idealen Eine Turbine wird stationär von einem Stoffstrom n Gases durchströmt. Das ideale Gas (molare spezifische Wärmekapazität c v,m =(3/2)·R m ) erfährt in der Turbine eine reversible adiabate Zustandsänderung vom Zustand 1 (p 1 =5 bar, T 1 =600 K) auf p 2 =1,5 bar. Änderungen von kinetischen und potentiellen Energien sind zu vernachlässigen. a) Wie groß ist die Temperatur T2 nach der Zustandsänderung? Berechnung: T2 = ……....……….. K b) Welche Leistung wird von der Turbine abgegeben? Berechnung: P12 = ……....……….. W Aufgabe 3 (3 Punkte) Für die Aufheizung von 100 kg Wasser von 6°C auf 92°C wird ein verlustfrei arbeitender elektrischer Heizstab verwendet, der 4,5 h lang betrieben wird. Während des Erwärmungsvorganges werden 12% der zugeführten elektrischen Arbeit als Wärmeverlust an die Umgebung abgegeben. Gegeben: Konstante spezifische Wärmekapazität von Wasser c w =4186 J/(kg K). Wie groß ist elektrische Leistung des Heizstabes? Berechnung: P Heizstab = …………......… W Aufgabe 4 (5 P u n kte ) Zwei mit einer Wärmedämmung ummantelte, ruhende, starre Luftspeicherbehälter sind durch eine Leitung (vernachlässigbares Leitungsvolumen) miteinander verbunden. Durch Öffnen eines Ventiles kann die Verbindung von Behälter A und B hergestellt werden. Wärmedämmung Behälter A (luftgefüllt) Ventil Behälter B (luftgefüllt) Vor dem Öffnen des Ventiles befindet sich in beiden Behältern Luft (ideales Gas, konstante Stoffwerte: c p = 1005 J/(kgK), c v =718 J/(kg K)) und zwar im Behälter A bei p A =7 bar, V A =3 m3, ϑ A =35°C und im Behälter B bei p B =5 bar, V B =2 m3, ϑ B =18°C. Bestimmen Sie die Temperatur, die sich in beiden Behältern nach dem Öffnen des Ventils einstellt mit Hilfe des 1. Hauptsatzes der Thermodynamik. Berechnung: Temperatur nach dem Öffnen: ……....…