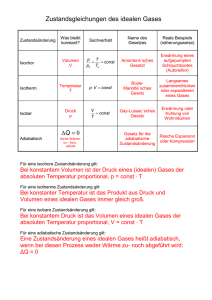
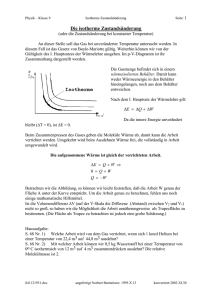
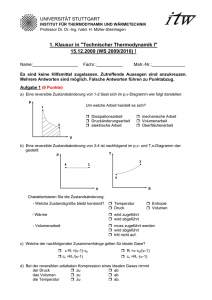
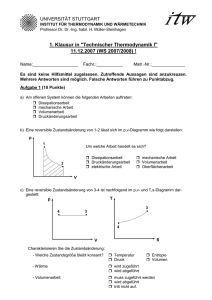
1. Klausur in "Technischer Thermodynamik I" (WiSe2013/14, 12.12
Werbung

UNIVERSITÄT STUTTGART INSTITUT FÜR THERMODYNAMIK UND WÄRMETECHNIK Apl. Professor Dr.-Ing. K. Spindler 1. Klausur in "Technischer Thermodynamik I" (WiSe2013/14, 12.12.2013) - VERSION 1 Name:______________________ Fachr.:_____________ Matr.-Nr.:________________ Es sind keine Hilfsmittel zugelassen. Zutreffende Aussagen sind anzukreuzen. Mehrere Antworten sind möglich. Falsche Antworten innerhalb einer Aufgabe führen zu Punktabzug. ------------------------------------------ KURZFRAGEN (8,5 Punkte) --------------------------------------------Aufgabe 1 In welcher Form wird bei der isothermen Kompression eines idealen Gases Energie über die Systemgrenze transportiert? a) Arbeit wird zu- und Wärme wird abgeführt. b) Arbeit wird zugeführt und es erfolgt kein Wärmeaustausch. c) Arbeit und Wärme werden zugeführt. d) Arbeit wird ab- und Wärme wird zugeführt. Aufgabe 2 Bei einer reversiblen Zustandsänderung eines idealen Gases ist die zugeführte technische Arbeit gleich der Enthalpieerhöhung. Dabei kann die Änderung der Geschwindigkeit und der Lage vernachlässigt werden. Es handelt sich um eine a) isotherme Zustandsänderung. b) isobare Zustandsänderung. c) adiabate Zustandsänderung. d) Das System ist offen. e) Das System ist geschlossen. Aufgabe 3 Durch die Avogadro-Zahl wird die a) Anzahl der Moleküle in einem Mol b) Anzahl der Moleküle in einem kg c) Energie der Teilchen pro Mol Aufgabe 4 Welche der Beziehungen/Bezeichnungen sind richtig? a) ϑ = T + 273,15 K b) Δϑ = 5 K c) Δϑ = ΔT festgelegt. Aufgabe 5 Der Sammelbegriff „technische Arbeit“ setzt sich zusammen aus a) Druckänderungsarbeit b) Volumenänderungsarbeit c) mechanischer Arbeit d) Dissipationsarbeit e) Verschiebearbeit Aufgabe 6 Bei einer adiabaten Expansion eines idealen Gases (ruhendes System) a) kühlt sich das Gas ab. b) bleibt die Gastemperatur konstant. c) erwärmt sich das Gas. Aufgabe 7 Es soll eine Maschine entwickelt werden, die Wärme vollständig in Arbeit umwandelt. Nach dem 1. Hauptsatz a) wird bzgl. der Umwandelbarkeit von Wärme in Arbeit keine Aussage getroffen. b) ist dies möglich. c) kann Wärme nur teilweise in Arbeit umgewandelt werden. Aufgabe 8 Die Grenzen eines geschlossenen Systems sind für Wärme a) durchlässig b) undurchlässig Arbeit c) durchlässig d) undurchlässig Masse e) undurchlässig. Aufgabe 9 Arbeit, die an einem ruhenden System reversibel verrichtet wurde und sich in einem p,vDiagramm als Fläche zwischen der Zustandslinie und der Druckachse skizzieren lässt, bezeichnet man als a) Volumenarbeit. b) technische Arbeit. c) mechanische Arbeit. d) Dissipationsarbeit. Aufgabe 10 Bei einer reversiblen isobaren Expansion eines idealen Gases a) nimmt die Entropie zu. b) nimmt die Entropie ab. c) bleibt die Entropie konstant. Aufgabe 11 Kennzeichnen Sie das T,s-Diagramm, in dem alle Zustandsänderungen eines idealen Gases richtig eingezeichnet sind. a) b) c) Aufgabe 12 Ein geschlossenes System hat ein konstantes Volumen. Diese Aussage ist a) richtig. b) falsch. ------------------------------------------ RECHENTEIL (10 Punkte) ----------------------------------------------Aufgabenstellung zu den Aufgaben 13 und 14 Zum Geschirrspülen wird 35 °C warmes Wasser benötigt. Hierzu wird ein Spülbecken, das ein Volumen von V = 30 Liter hat, vollständig gefüllt. Der Wassermassenstrom beim Befüllen beträgt ṁ = 10 kg/min. Das Wasser wird in einem Durchlauferhitzer von der Kaltwassertemperatur ϑ KW = 10 °C auf die Warmwassertemperatur ϑ WW = 35 °C erwärmt. Hinweise: - potentielle und kinetische Energien sind zu vernachlässigen - die spez. Wärmekapazität von Wasser ist konstant und beträgt c w = 4,18 kJ/(kg K) - die Dichte von Wasser bei 35 °C beträgt ρ W = 994 kg/m³ Aufgabe 13 Wie lange dauert es, bis das Spülbecken gefüllt ist? Berechnung: a) Δt = 178,9 s b) Δt = 20,1 s c) Δt = 17,9 s d) Δt = 201,2 s Aufgabe 14 Welcher Wärmestrom muss dem Wasser durch den Durchlauferhitzer zugeführt werden? Berechnung: a) Q̇ = 1045 W R b) Q̇ = 17417 W R c) Q̇ = 1,83 kW R d) Q̇ = 11,49 kW R Aufgabenstellung zu den Aufgaben 15, 16 und 17 2 kg eines idealen Gases (c v = 3117 J/(kgK), R i = 2077,2 J/(kgK)) wird in einem ruhenden Kolben/Zylinder-System reversibel isotherm entspannt. Bei der Zustandsänderung tritt eine Volumenänderungsarbeit W V,12 = -1252 kJ auf. Bei der Expansion verdoppelt sich das Volumen auf V 2 = 10,22 m3. Aufgabe 15 Wie groß ist die Wärmemenge, die bei der Zustandsänderung von 1 nach 2 auftritt? Berechnung: a) Q 12 = -1315 kJ b) Q 12 = -1252 kJ c) Q 12 = 1315 kJ d) Q 12 = 1252 kJ Aufgabe 16 Bei welcher Temperatur wird die Zustandsänderung durchgeführt? Berechnung: a) ϑ = 434,78 °C ϑ = 393,65 °C b) ϑ = 73,15 °C c) ϑ = 161,63 °C d) Aufgabe 17 Wie groß ist der Druck p 1 ? Berechnung: a) p 1 = 1,78 bar b) p 1 = 2,65 bar c) p 1 = 3,53 bar d) p 1 = 5,30 bar Formelzusammenstellung - 1. Hauptsatz: geschlossenes System dU + dE kin + dE pot = dQ + dW mit dW = −pdV + dWdiss + dWmech, offenes System dh + de kin + de pot = dq + dw t mit dw t = vdp + dw diss + dw mech, potentielle Energie e pot = g ⋅ z , kinetische Energie e kin = c 2 /2 du = c V ⋅ dT , - ideale Gase: dh = c p ⋅ dT dT dv dT ds = c V ⋅ + Ri ⋅ = cp ⋅ − Ri T v T p ⋅ V = m ⋅ Ri ⋅ T , p ⋅ V = n ⋅ Rm ⋅ T κ = c p /c v; c p = c v + Ri ; cV,m= cV·M cp,m= cp·M reversibel adiabate Zustandsänderung: p ⋅ v κ = const. , T ⋅ v κ −1 = const. , κ -1 T/ p κ = const. - Umrechnung: 1 b a r = 10 5 P a = 10 5 N/m 2 = 10 5 J /m 3 - Schwerebeschleunigung: g = 9,81 m /s 2 - Universelle (molare) Gaskonstante: R m = 8,314 J/(mol K), R m = M ⋅ R i , M = m n - Mathematische Zusammenhänge: ∫ du = [ln(u)] u dp ⋅ p