1. Klausur in "Technischer Thermodynamik I" 11.12
Werbung
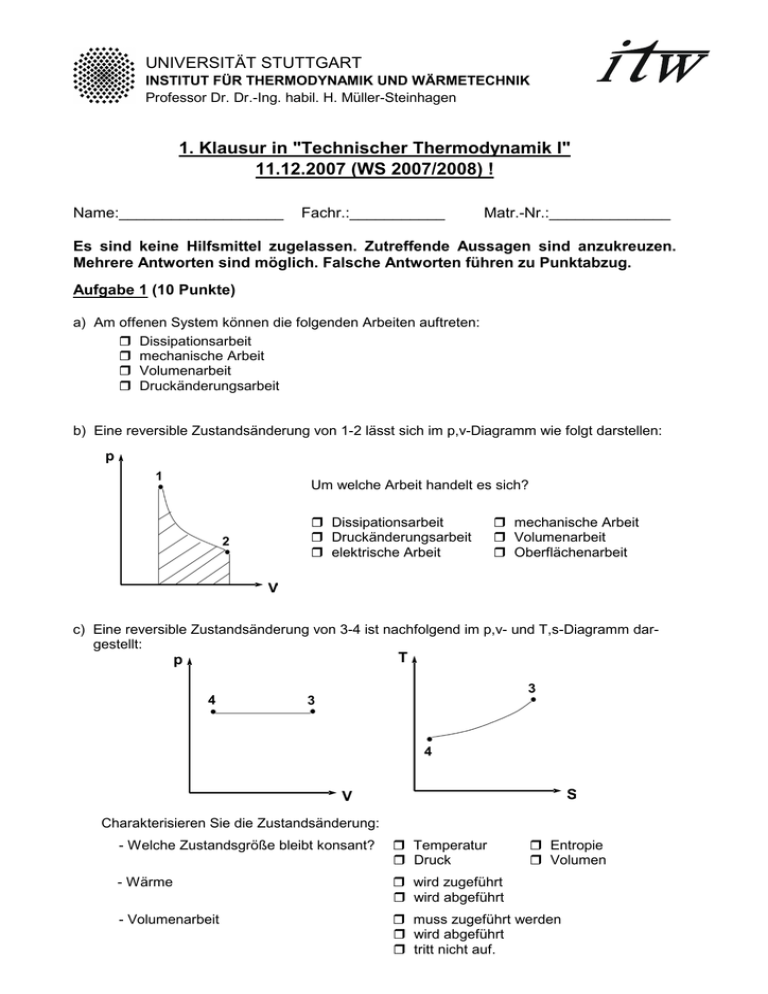
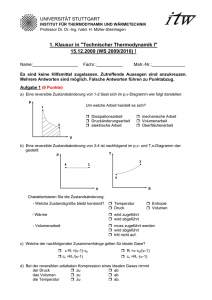
UNIVERSITÄT STUTTGART INSTITUT FÜR THERMODYNAMIK UND WÄRMETECHNIK Professor Dr. Dr.-Ing. habil. H. Müller-Steinhagen 1. Klausur in "Technischer Thermodynamik I" 11.12.2007 (WS 2007/2008) ! Name:___________________ Fachr.:___________ Matr.-Nr.:______________ Es sind keine Hilfsmittel zugelassen. Zutreffende Aussagen sind anzukreuzen. Mehrere Antworten sind möglich. Falsche Antworten führen zu Punktabzug. Aufgabe 1 (10 Punkte) a) Am offenen System können die folgenden Arbeiten auftreten: Dissipationsarbeit mechanische Arbeit Volumenarbeit Druckänderungsarbeit b) Eine reversible Zustandsänderung von 1-2 lässt sich im p,v-Diagramm wie folgt darstellen: Um welche Arbeit handelt es sich? Dissipationsarbeit Druckänderungsarbeit elektrische Arbeit mechanische Arbeit Volumenarbeit Oberflächenarbeit c) Eine reversible Zustandsänderung von 3-4 ist nachfolgend im p,v- und T,s-Diagramm dargestellt: Charakterisieren Sie die Zustandsänderung: - Welche Zustandsgröße bleibt konsant? Temperatur Druck Entropie Volumen - Wärme wird zugeführt wird abgeführt - Volumenarbeit muss zugeführt werden wird abgeführt tritt nicht auf. d) Es soll eine Maschine entwickelt werden, die Wärme vollständig in Arbeit umwandelt. Nach dem 1. Hauptsatz ist dies möglich kann Wärme nur teilweise in Arbeit umgewandelt werden wird hinsichtlich der Umwandelbarkeit von Wärme in Arbeit keine Aussage getroffen. e) Welche der nachfolgenden Zusammenhänge gelten für ideale Gase R i =c p + c v κ=(R i +c v ) / c v c v =R i /(κ-1) c p =R i + c v c v =R i +c p κ=c p / c v f) Ein ideales Gas wird isotherm (T=const.) in einem offenen System verdichtet. Die Zustandsänderung verläuft reversibel ohne Änderung des äußeren Systemzustandes. Markieren Sie die richtigen Aussagen: Es wird mehr Arbeit zugeführt als Wärme abgeführt Es wird weniger Arbeit zugeführt als Wärme abgeführt Die zugeführte Arbeit und die abgeführte Wärme sind gleich groß Die Änderung der Enthalpie ist ungleich Null Die Änderung der Enthalpie ist gleich Null Die Änderung der inneren Energie ist gleich Null Die zuzuführende Arbeit ist technische Arbeit Die zuzuführende Arbeit ist Druckänderungsarbeit Die zuzuführende Arbeit ist Volumenarbeit Die zuzuführende Arbeit ist Verschiebearbeit g) Kennzeichnen Sie nachfolgend Formulierungen der thermischen Zustandsgleichung idealer Gase: U2 − U1 = m ⋅ cv ⋅ (T2 - T1 ) H2 − H1 = m ⋅ cp ⋅ (T2 - T1 ) p ⋅ V = n ⋅ Ri ⋅ T p ⋅ V = m ⋅ Ri ⋅ T p ⋅ V = (m ⋅ Rm ⋅ T)/M p ⋅ V = (n ⋅ Rm ⋅ T)/M s2 - s1 = cp ⋅ ln(T2 / T1 ) - Ri ⋅ ln(p2 / p1 ) s2 - s1 = cV ⋅ ln(T2 / T1 ) + Ri ⋅ ln(V2 / V1 ) h) Kennzeichnen Sie das T,s-Diagramm, in dem alle Zustandsänderung richtig eingezeichnet sind. Formelzusammenstellung - 1. Hauptsatz: geschlossenes System U2 + Ekin,2 + Epot,2 − U1 − Ekin,1 − Epot,1 = Q12 + W12 mit W12 = WV,12 + Wdiss,12 + Wmech,12 dWv = −p ⋅ dV offenes System (h2 + ekin,2 + epot,2 − h1 − ekin,1 − epot,1 ) m = Q 12 + P12 mit P12 = m ⋅ w t,12 , w t,12 = w p,12 + w diss,12 + w mech,12 dwp = v ⋅ dp potentielle Energie epot = g ⋅ z , kinetische Energie ekin = c2/2 - ideale Gase: u2 −u1 = cV ⋅ (T2 − T1 ) , h2 −h1 = cp ⋅ (T2 − T1 ) p ⋅ v = Ri ⋅ T - Flüssigkeiten und Festkörper: u2 −u1 = cV ⋅ (T2 − T1 ) ; h2 −h1 = cp ⋅ (T2 − T1 ) ; - Umrechnung: 1 bar = 105 Pa = 105 N/m2= 105 J/m3 - Schwerebeschleunigung: g=9,81 m/s2 - Dichte: ρ = m/V - Universelle (molare) Gaskonstante: Rm = 8,314 J/(mol K) - Mathematische Zusammenhänge: ∫ du = [ln(u)] u cV ≈ cp Name:___________________ Fachr.:___________ Matr.-Nr.:______________ ____________________________________________________________________ Es sind keine Hilfsmittel zugelassen. Bearbeitete Aufgaben werden als vollständig richtig bewertet, wenn neben dem korrekten Endergebnis auch der Rechengang ersichtlich ist. Aufgabe 2 (6 Punkte) Eine reversible Zustandsänderung eines idealen Gases von 1-2, bei der sich die Temperatur nicht ändert (T 1 =T 2 ), lässt sich im p,v-Diagramm wie folgt darstellen: a) Schraffieren Sie die bei der Zustandsänderung 1-2 auftretende Druckänderungsarbeit als Fläche im p,vDiagramm. 2 b) Berechnen Sie die spezifische Druckänderungsarbeit w p,12 = v ⋅ dp zahlenmäßig, wenn ∫ 1 folgendes bekannt ist: Ideales Gas: individuelle Gaskonstante R i =276,4 J/(kgK) Zustand 1: p 1 =2 bar; v 1 =0,30 m3/kg Zustand 2: v 2 =0,15 m3/kg Berechnung: w p,12 =__________ kJ/kg c) Wie groß ist die spezifische Wärme q 12 , die bei dieser Zustandsänderung auftritt unter der Annahme, dass es sich um eine reversible Zustandsänderung in einem offenen System ohne Änderung von kinetischer und ptentieller Energien handelt? q 12 =__________ kJ/kg Aufgabe 3 (4 Punkte) Aus einem Wasserreservoir strömen pro Stunde 1500 t Wasser einer Turbinenanlage zu. Die Höhendifferenz zwischen Wasserzu- und Wasserablauf beträgt 850 m. Am Wasserzulauf liegt ruhendes Wasser vor, die Strömungsgeschwindigkeit am Wasserablauf beträgt 5 m/s. Bei der Durchströmung der Turbinenanlage stellt man fest, dass sich das Wasser um 3 K zwischen Zuund Ablauf abkühlt. Gegeben: - 2 Schwerebeschleunigung g= 9,81 m/s spezifische Wärmekapazität von Wasser c p = 4,186 kJ/(kgK)? a) Bestimmen Sie die Leistung der Turbinenanlage, wenn folgende Daten gegeben sind: Berechnung: P Turbine =_______________kW b) Wie groß ist die Änderung der spezifischen Enthalpie des Wassers? h 2 -h 1 =______________kJ/kg