Zustandsänderungen idealer Gase
Werbung

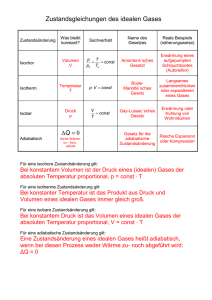
Zustandsänderungen idealer Gase Das Konzept des p-V Diagrammes Der Zustand eines Idealen Gases (konstanter Stoffmenge ν) wird eindeutig durch einen Punkt im p-V-Diagramm beschrieben; denn ν ist konstant und T ergibt sich aus p und V gemäß der Zustandsgleichung des idealen Gases: p ⋅V = ν ⋅ R ⋅ T = N ⋅ k B ⋅ T Jede mögliche Zustandsänderung eines idealen Gases entspricht einer Kurve im p-V-Diagramm. Geschlossenen Kurven entsprechen Zustandsänderungen, die zum gleichen Zustand des Gases zurückführen und die Kreisprozesse heißen. Dabei kann netto trotzdem Wärme (aus einem Wärmebad, nicht aus dem Gas selbst) in mechanische Arbeit umgesetzt werden (‚rechtslaufende Prozesse’) oder umgekehrt Wärme in ein Wärmebad bei höherer Temperatur transferiert werden (‚linkslaufende Prozesse’). Bei Kreisprozessen fungiert das ideale Gas lediglich als Arbeitsmedium, das netto nicht verändert wird! Merke: Bei einem Kreisprozess ist die von der Kurve im p-V-Diagramm eingeschlossene Fläche die pro Zyklus vom (am) Arbeitsmedium netto geleistete Arbeit. Gemäß dem 1. Hauptsatz der Wärmelehre und weil die inneren Energie eine Zustandsgröße ist, ist sie gleichzeitig die vom Arbeitsmedium netto aufgenommene (abgegebene) Wärme! Spezielle Zustandsänderungen