physikalische chemie iii
Werbung

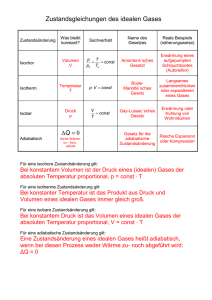
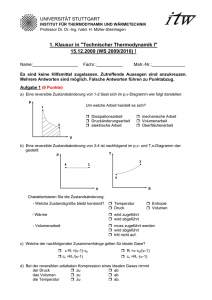
Physikalische Chemie I Übungen zur Vorlesung PHYSIKALISCHE CHEMIE I R. Strey / A. Müller / L.M. Feldmar / H. Klemmer 3. Übung WS 2013/14 1. Irreversible, isotherme Zustandsänderung eines idealen Gases Die Stoffmenge von drei Molen eines idealen Gases wird bei einer Temperatur von 27°C einer isothermen, irreversiblen Expansion gegen einen konstanten Druck von 1 bar unterworfen: Expansion von einem Volumen VI = 20 dm3 auf ein Endvolumen von VII = 60 dm3. Berechnen Sie: a) die Arbeit W, die das System leistet; b) die Wärmemenge Q, die das System aus dem Thermostaten aufnimmt; c) die Änderung U der Inneren Energie des Systems; d) die Änderung H der Enthalpie des Systems. 2. Reversible, isotherme Zustandsänderung eines idealen Gases Die Stoffmenge von drei Molen eines idealen Gases wird bei einer Temperatur von 27°C einer isothermen, irreversiblen Zustandsänderung unterworfen: Expansion von einem Volumen VI = 20 dm3 auf ein Endvolumen von VII = 60 dm3. Berechnen Sie: a) die Arbeit W, die das System leistet; b) die Wärmemenge Q, die das System aus dem Thermostaten aufnimmt; c) die Änderung U der Inneren Energie des Systems; d) die Änderung H der Enthalpie des Systems. 3. Reversible, isotherme Zustandsänderung eines realen Gases Die Stoffmenge von drei Molen Methan wird bei einer Temperatur von 27°C einer isothermen, reversiblen Expansion unterworfen: Expansion von einem Anfangsvolumen VI = 20 dm3 auf ein Endvolumen von VII = 60 dm3. Das Verhalten des Gases soll durch die VAN DER WAALS‘sche Zustandsgleichung mit den Parametern a = 2.28 dm6∙bar∙mol-2 b = 0.043 dm3∙mol-1 beschrieben werden. Berechnen Sie: a) die Arbeit W, die das System leistet; b) die Wärmemenge Q, die das System aus dem Thermostaten aufnimmt; c) die Änderung U der Inneren Energie des Systems; d) die Änderung H der Enthalpie des Systems. 4. Reversible, adiabatische Zustandsänderung eines idealen Gases Die Stoffmenge von drei Molen eines idealen zweiatomigen Gases wird bei der Ausgangstemperatur von 300 K einer adiabatischen, reversiblen Zustandsänderung unterworfen: Expansion von einem Anfangsvolumen VI = 20 dm3 auf ein Endvolumen von VII = 60 dm3. Das Verhältnis der Molwärme bei konstantem Druck und konstantem Volumen habe den Wert cp/cv = 1.4. Berechnen Sie: a) die Temperaturänderung T; b) die Arbeit W, die das System leistet; c) die Änderung U der Inneren Energie des Systems; d) die Änderung H der Enthalpie des Systems. Vergleichen sie die Ergebnisse für die adiabatische Zustandsänderung mit den Ergebnissen für die isotherme Zustandsänderung. 5. Enthalpieänderung In einem Gefäß mit adiabatischen Wänden befindet sich bei einem Druck von 1 bar und einer Temperatur von -10 °C die Masse m = 1 g unterkühltes Wasser. Es werden Eiskeime erzeugt. Dadurch bildet sich spontan ein heterogenes System, in dem Eis und Wasser bei einer Temperatur von 0 °C koexistieren. Berechnen Sie die Massen mW und mE des Wassers und des Eises, die im Gleichgewicht vorliegen, aus folgenden Daten: spezifische Wärme des Wassers cp(W) = 4.18 J/(g∙K) spezifische Wärme des Eises cp(E) = 2.09 J/(g∙K) Schmelzenthalpie des Eises bei 0 °C SH0 = 311 J/g Die spezifischen Wärmen können im betrachteten Temperaturbereich als konstant angenommen werden.




![229 ImpulsAufgaben [tra]](http://s1.studylibde.com/store/data/010316380_1-d3455d4f44fecb018dc28f8e7530479f-300x300.png)




