Aufgabe 21: Volumenarbeit 2 Ein ideales Gas wird reversibel (d.h.
Werbung

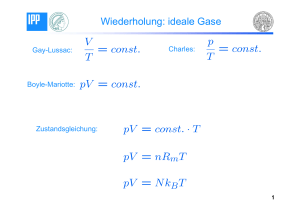
bu g ur Ei f hru g i die Physi a ische Che ie I f r Bi ge Phar a eute u d ehra t Wi terse ester 2012#2013 Department Chemie Prof. D. Lamb, PhD bu gsb att 6 Aufgabe 21: Volumenarbeit 2 Ein ideales Gas wird reversibel (d.h. pex = pgas) und isotherm komprimiert. Dabei nimmt das Volumen von 60 L bei 1 MPa und 300 K auf 250 L zu. Berechnen Sie: a) Den Gasdruck nach der Kompression. b) Die Arbeit, die das System leistet, sowie die Wärme, die beim Prozess fließt. (Beachten Sie hierbei die Vorzeichenkonvention des egozentrischen Systems!) c) Die Änderung der inneren Energie. d) Markieren Sie zudem die Arbeit in einem p-V-Diagramm Aufgabe 22 : Wärmekapazität 1 Bei der Bestimmung der Wärmekapazität von Gasen stellte man fest, dass sie in vielen Fällen ein Vielfaches von beträgt. a) Zeigen Sie, dass die molare Wärmekapazität eines idealen einatomigen Gases bei konstantem Volumen beträgt. Benutzen Sie dafür die Formeln: 3 ; 2 = + ; 3 = 2 b) Begründen Sie, warum die molare Wärmekapazität eines idealen einatomigen 1 = Gases bei konstantem Druck ( men ( , = , = ) höher als die bei konstantem Volu- ) ist. Wofür wird die zusätzliche Wärme benötigt? c) Recherchieren Sie, wie groß die beiden Kapazitäten für ideale, zweiatomige Gase sind. Woher kommt der Unterschied? Aufgabe 23 : Innere Energie Welche Wärme gibt ein ideales, einatomiges Gas ab, wenn es bei einem konstanten Druck (240 kPa) von 400 K auf 320 K abgekühlt wird? Das Anfangsvolumen beträgt hierbei 50 m³. Welcher Anteil davon wird durch die Änderung der inneren Energie erzeugt und welcher Anteil durch die am Gas geleistete Volumenarbeit. Aufgabe 24 : Wärmekapazität 3 Bei großen Temperaturänderungen kann die Wärmekapazität nicht mehr als konstant angenommen werden. Für Wasser gilt in guter Näherung eine lineare Temperaturabhängigkeit: c p = a + bT mit a = 3,9176 kJ / kgK und b = 8 ⋅ 10−4 kJ / kgK 2 . Berechnen Sie die Wärme, die 500 g Wasser zugeführt werden muss, um es von 30 °C auf 60 °C zu erwärmen: a) ohne Berücksichtigung der Temperaturabhängigkeit. Benützen Sie dafür den Wert bei 20 °C: cp = 4.182 kJ/kgK) b) mit Berücksichtigung der Temperaturabhängigkeit.