Kein Folientitel - Institut für Organische Chemie
Werbung
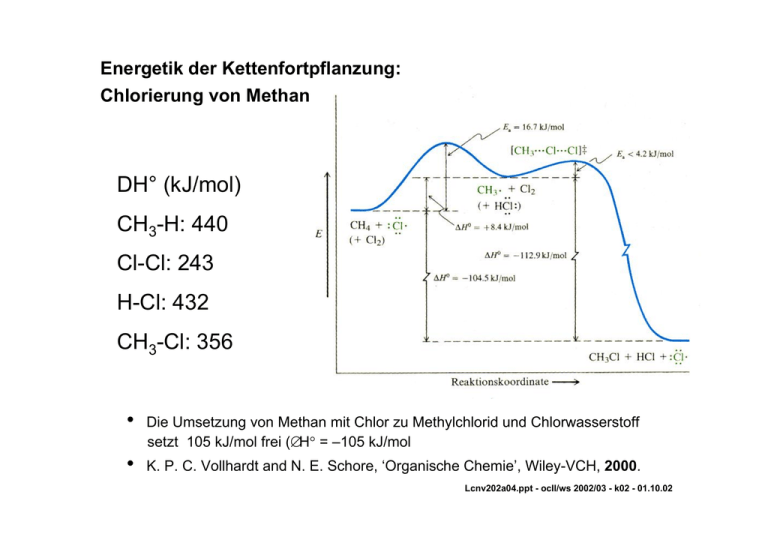
Energetik der Kettenfortpflanzung: Chlorierung von Methan DH° (kJ/mol) CH3-H: 440 Cl-Cl: 243 H-Cl: 432 CH3-Cl: 356 • Die Umsetzung von Methan mit Chlor zu Methylchlorid und Chlorwasserstoff setzt 105 kJ/mol frei (∆H° = –105 kJ/mol • K. P. C. Vollhardt and N. E. Schore, ‘Organische Chemie’, Wiley-VCH, 2000. Lcnv202a04.ppt - ocIl/ws 2002/03 - k02 - 01.10.02 Bindungsdissoziationsenergie R-H (DH°, kJ/mol) und Stabilisierungsenergie von Radikalen [Es(R•), kJ/mol] RH DH° Es CH3-H CH3CH2-H (CH3)2CH-H (CH3)3C-H CH2=CHCH2-H C6H5CH2-H CH2=CH-H C6H5-H 440 423 413 397 360 355 435 465 0 17 27 43 80 85 5 -25 Es(R•) = DH°(CH3-H) – DH°(R-H) Energiewerte sind auf das Methyl-Radikal als Referenz bezogen: Stabilisierungsenergie (Es) 0 • J. Fossey, D. Lefort, and J. Sorba, ‘Free Radicals in Organic Chemistry’, J. Wiley, 1995. Bindungsdissoziationsenergien (BDE) in kJ/mol RO-H R-H MeS-H (Me3Si)3Si-H Bu3Sn-H Et-Br Et-I Me3Pb-Me 395-440 290-460 368 330 309 288 221 205 Me3CO-OCMe3 155 Me2C(CN)-N=N-CMe2CN 134 R-Co(III)(dmgH)2py 83-146 T. Linker, M. Schmittel, Radikale und Radikalionen in der organischen Synthese, Wiley-VCH, Weinheim, 1998. lcnv202a07.ppt - ocIl/ws 2002/03 - k02 - 01.10.02 Chlorierung von Methan: Kettenreaktion (chain reaction) CH4 + X2 CH3X + HX X2 + AIBN (Halbwertszeit, 85°C, 1h) Initialisierung Edukt R-H H-X Produkt X. Kettenfortpflanzung R. R-X Produkt X-X Edukt Reaktionsenthalpien (∆Hr /kJ mol-1): X = F: - 430 X = Br: X = Cl: - 104 X = J: - 31 +53 lcnv202a09.ppt - ocIl/ws 2002/03 - k02 -01.10.02 Bell-Evans-Polanyi Principle • Proportionality of heat of activation ∆H# and heat of reaction ∆Hr : ∆H# ≈ ∆Hr • R. Brückner, 'Reaktionsmechanismen',Spektrum Akademischer Verlag, 1996. lcnv202a10.doc - ocIl/ws 2002/03 - vvg - k02 -01.10.02 2. Radikalreaktionen ¾ T. Linker, M. Schmittel, Radikale und Radikalionen in der organischen Synthese, Wiley-VCH, Weinheim, 1998. – 86 VK 5500 L756 Freie Radikale – Entdeckung, Beispiele, Struktur Homolytische Bildungsspaltung: Bindungsdissoziationsenergie Mechanismus der Radikalreaktionen: Chlorierung von Methan – Kettenreaktion, Zwischenstufen, Energetik Selektivität (Regioselektivität) - Struktur-Reaktivitätsbeziehungen - Hammond-Prinzip Präparativ wichtige Radikalreaktionen Radikale und Radikalreaktionen, Anwendungen: life science, Biochemie, Materialien Lcnv202k02i1.ppt - ocIl/ws 2002/03 - k02 - 01.10.02 2. Radikalreaktionen Radikalische Substitution Halogenierung, NBS Kolbe-Elektrolyse Hunsdiecker-Reaktion Autoxidation Sulfochlorierung Alkylhalogenid → Kohlenwasserstoff (RX→RH) Carbonsäure → Kohlenwasserstoff (RCO2H → RH) Radikalische Addition Markovnikov-Addition: HX-Addition (nur HBr!!) Weitere Beispiele: Cl3CBr, RSH, R2PH Radikalische Polymerisation Ethylen und substituierte Alkene, PVC, etc. Radikalische Cyclisierung ausgehend von acyclischen Alkylhalogeniden Radikalstarter: Tributylzinnhydrid, Hexabutyldistannan, AIBN Spezielle Reaktionen und Reagentien Samarium(II)diiod, Mangantriacetat Lcnv202k02i2.ppt - ocIl/ws 2002/03 - k02 - 01.10.02 Stabile freie Radikale - Radikalreaktionen in der Biochemie - Freie Radikale in der Materialwissenschaft » Stabile Radikale – Mesomeriestabilisierung Galvinoxyl-Radikal; Nitroxyl-Radikal [2,2,6,6-Tetramethylpiperidin-1-oxyl (Spinsonden)] » Ein Antibiotikum und Antitumormittel erzeugt ein Diradikal – Calicheamicin: 3-Hexen-1,5-diin Cyclisierung » Radikalreaktionen in der Biochemie – Inhibitoren von Radikalreaktionen: Vitamin E (α-Tocopherol) – Ribonukleotidreduktase: Aus Ribonukleotid entsteht Deoxyribonukleotid – Oxidation von Kohlenwasserstoffen zu Alkoholen durch Cytochrom P450 – Autoxidation von ungesättigten Fettsäuren und Phospholipiden – Freie Radikalumlagerung durch Coenzym B12 » Chemie der Radikale und Materialwissenschaften – Organische Leiter, Materialien mit magnetischen Eigenschaften Lcnv202k02i3.ppt - ocIl/ws 2002/03 - k02 -05.11.02











