O-18 und Deuterium - Institut für Geologie
Werbung

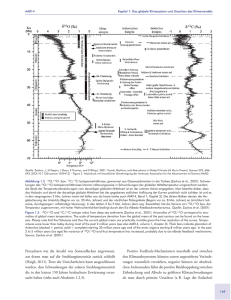
Geologisches Oberseminar Verwendung von stabilen Isotopen in den Geowissenschaften Deuterium und O-18 Betreuer: Prof. Merkel Bearbeiter: Katja R. Kunze Deuterium und O-18 4.1 Zusammenfassung Die Isotopenfraktionierung von Sauerstoff und Wasserstoff in der Hydrosphäre und Atmosphäre ist ein interessantes und wichtiges Phänomen. Verglichen mit dem durchschnittlichen Ozeanwasser sind Süßwasser und glaziales Eis und Schnee auf den Kontinenten an 16O und 1H angereichert und besitzten daher negative δ18O und δD Werte. Die Anreicherung an den leichteren Isotopen steigt mit fallender Lufttemperatur und variiert daher mit der Jahreszeit, sowie auch mit der Höhenlage und der geographischen Breite. Die isotopische Zusammensetzung von Ozeanwasser ist positiv korreliert mit dessen Salzgehalt und gibt Einblick in die Herkunft ozeanischen Tiefenwassers. Die Möglichkeit die Temperaturschwankungen des Ozeans in der geologischen Vergangenheit anhand von Karbonaten, Silikaten und Phosphaten zu bestimmen, hat eine große Bedeutung erlangt. Nützliche Informationen über die Paläoklimatologie sind durch die Auswertung der δ18O und δD Schwankungen an Eiskernen der polaren Gebiete zu erhalten. Weiterhin ist es möglich, die Herkunft von Grund- und Geothermalwässern zu bestimmen. 4.2 Einleitung Im Jahre 1931 erkannte Harold C. Urey, basierend auf theoretischen Grundlagen, daß ein Unterschied in den Dampfdrücken der Wasserstoffisotope bestehen muß. Urey plante daraufhin in Zusammenarbeit mit Murphy und Brickwedde ein Experiment, um mittels spektrometrischer Methoden 2H und 3H im durch sechs Liter verdampfenden Wasser entstandenen Gasvolumen nachzuweisen. Die Ergebnisse bestätigten unmittelbar das Vorhandensein von 2H, 3H konnte jedoch nicht gefunden werden. Urey nannte das neu entdeckte Isotop „Deuterium“, da es annähernd die doppelte Masse des Wasserstoffatoms besitzt (Urey et al., 1932). Der genaue Grund für dieses Phänomen war zu diesem Zeitpunkt noch unbekannt, da die Existenz von Neutronen nicht vor 1932 bewiesen war. 1934 erhielt Harold C. Urey den Nobelpreis für Chemie für die Entdeckung des Deuteriums. 4.3 Physikalische Grundlagen Nuklide, deren Atomkerne die gleiche Protonenzahl aber unterschiedlich viele Neutronen enthalten, werden isotope Nuklide bzw. Isotope eines Elementes genannt. • Wasserstoff besitzt zwei stabile Isotope: Protium und Deuterium. Tab. 4.1: Die stabilen Isotope des Wasserstoffs (HÖLTING, 1996) Isotop Vorkommen Atommasse 1 H 99,9844% 1,007825 2 H od. D 0,0156% 2,014100 • Sauerstoff besitzt drei stabile Isotope Tab. 4.2: Die stabilen Isotope des Sauerstoffs (MERKEL & SPERLING, 1996) Isotop Vorkommen Atommasse 16 O 99,76% 15,995 17 O 0,04% 16,999 18 O 0,20% 17,999 -1- Deuterium und O-18 Da Isotope die gleichen Elektonenhüllen besitzen, zeigen sie auch gleiche chemische Eigenschaften und können folglich Isotopenspezies einer chemischen Verbindung bilden. So wird Deuterium anstelle von Protium ins Wassermolekül eingebaut. Ebenso kann ein 16 O-Atom durch ein 18O-Atom ersetzt sein. Das Wassermoleküle kann folglich aus neun verschiedene isotopische Konfigurationen zusammengesetzt sein. Tab. 4.3: Die neun verschiedenen Konfigurationen des Wassermoleküls (HÖLTING 1996) Wassermolekül H2O16 HDO16 D2O16 H2O17 HDO17 D2O17 H2O18 HDO18 D2O18 rel. Molekülmasse 18,011 19,017 20,023 19,015 20,021 21,027 20,015 21,021 22,027 Der Dampfdruck der verschiedenen Wassermoleküle ist umgekehrt proportional zur Masse der Moleküle. H216O hat daher einen deutlich höheren Dampfdruck als D218O. Bei Phasenübergängen (Verdunstung, Kondensation, Sublimation) führt dies zur Anreicherung der isotopisch leichteren Moleküle in die stärker flüchtige Phase. Dieser Vorgang, die sogenannte Isotopenfraktionierung, ist stark temperaturabhängig. Im Zusammenhang mit diesen isotopischen Verschiedenheiten der Wassermoleküle ergeben sich Veränderungen in den physikalische Eigenschaften des Wassers. Dies soll an folgendem Beispiel deutlich werden: Tab. 4.4: Die physikalischen Unterschiede der isotopisch verschiedenen Wassermoleküle (HÖLTING 1996) Phys. Eigenschaft H2 16O D216O rel. Molekülmasse 18,011 20,023 Maximale Dichte [g/mL] 1,000 1,106 Dichtemaximum bei [°C] 3,980 11,230 Viskosität (bei 25 °C) [mPa s] 0,893 1,101 Schmelzpunkt [°C] 0,000 3,813 Siedepunkt [°C] 100,000 101,420 4.4 Analytik Das in den 40er Jahren entwickelte NIER-Massenspektrometer war die meßtechnische Voraussetzung zur Erfassung der Variabilität der Deuterium- und Sauerstoff-18-Gehalte. Zur Deuterium- und Sauerstoff-18-Analytik wird Ozeanwasser als Standardsubstanz benutzt. Das von der Internationalen Atomenergiebehörde (IAEA), Wien, autorisierte Standard Mean Ocean Water (Wien-SMOW) hat die Isotopenverhältnisse (HEBERT 1997) H / 1H = (155,76 ± 0,05) ⋅ 10 −6 und Gl. 4.1 O / 16O = (2005,2 ± 0,5) ⋅ 10 −6 Gl. 4.2 2 18 4.5 Sauerstoff und Wasserstoff in der Hydrosphäre und der Atmosphäre 4.5.1 Ozeanwasser Das Wasser des Ozeans hat eine auffallend gleiche Isotopenzusammensetzung. Fast alle Proben besitzen Werte von δ18O=0±1 und δD=0±5 relativ zum SMOW. (CRISS 1999) -2- Deuterium und O-18 Wenn Wasser von der Ozeanoberfläche verdunstet, ist der Wasserdampf an 16O und H angereichert. Deshalb ist der Betrag an δ18O und δD gegenüber dem Ozeanwasser negativ. Die Beträge der Isotopenfraktionierung für die Verdunstung von Wasser bei etwa 25°C sind: αD = (D / H )l (D / H )v = 1,074 Gl. 4.3 und α 18 = ( O/ O) ( O / O) 18 16 l 18 16 = 1,0092 Gl. 4.4 v Die Isotopenfraktionierung bei diesem Vorgang ist stark temperaturabhängig: Abb. 4.1: Die Fraktionierung der 18O und D Isotopen in Abhängigkeit von der Temperatur (FAURE 1986) Einen weiteren Einfluß auf die Isotopenfraktionierung bei der Verdunstung von Ozeanwasser hat die Feuchte h der unmittelbar darüber liegenden Luftschicht. Der daraus resultierende Deuteriumüberschuß berechnet sich nach folgender Formel: d = δD − m ⋅δ 18O Gl. 4.5 m: Anstieg der Geraden im CRAIG-Diagramm, Abb. 4.5 Typische Werte für m sind 7,5 im Nordpazifik, 6,5 im Nordatlantik und 6,0 im Roten Meer. Das bevorzugte Entweichen von H216O aus dem Oberflächenwasser von Ozeanen hat nicht nur einen Einfluß auf die Isotopenzusammensetzung sondern läßt auch den Salzgehalt ansteigen. Obwohl die Rate der δ18O Werte nur gering ist, wird durch Messungen eine positive Korrelation zwischen δ18O und δD Werten und dem Salzgehalt deutlich. Dieser Effekt ist gut am Beispiel des Roten Meeres in Abb. 2.4 illustriert. Der Salzgehalt des Oberflächen-, mittleren und Tiefenwasser im Roten Meer liegt zwischen 36 bis 40 ‰, während die δ18O Werte von +0,6 bis +1,9‰ und die δD Werte von +4 bis 10‰ schwanken. Das Tiefenwasser verschiedener Ozeane weist ebenfalls unterschiedliche δ18O Werte und damit Salinitätsunterschiede auf. So hat das Tiefenwasser des Nordatlantiks δ18O Werte -3- Deuterium und O-18 von +0,05‰, des Pazifiks –0,15‰ und der Antarktik –0,4‰. Diese Erkenntnis kann mittels sorgfältiger Messungen für die detaillierte Erforschung der Ozeanzirkulationen benutzt werden. δ18O [‰] Salzgehalt [‰] Abb. 4.2: Zusammenhang zwischen den δ18O und dem Salzgehalt am Beispiel des Roten Meeres (FAURE 1986) 4.5.2 Meteorisches Wasser Die physikalischen Prozesse, die für die Produktion, den Transport und die Kondensation von Wasserdampf in der Atmosphäre verantwortlich sind, verursacht auch eine große Variation in der Isotopenverteilung des meteorischen Wassers. Die Breite der δ18O Werte im natürlichen Niederschlag liegt zwischen +4 und -62‰, während die des Deuteriums zwischen +40 bis -500‰ variieren. Wenn Regentropen bei der Kondensation von Wasserdampf in Wolken geformt werden, ist die flüssige Phase an 18O und D angereichert. Die isotopische Zusammensetzung der ersten Regentropfen ist gleich der des Ozeanwassers. Das kontinuierlich bevorzugte Auswandern von 18O und D aus der feuchten Luftmasse hat eine Anreicherung von 16O und H in der verbleibenden Dampfphase zur Folge. Die δ18O und δD Werte im Wasserdampf in einer Luftmasse werden daher zunehmend negativer, während Regen, Schnee oder Hagel fallen. Auch die δ Werte im flüssigem und festem Niederschlag folgen dieser Tendenz, da eine Abnahme des 18O und D im Wasserdampf stattfindet. Die Kondensation von Wasser im Gleichgewicht zur Dampfphase und die anschließende Entfernung aus dem Gleichgewicht (Verlassen der Wolke) kann mittels der Destillationsgleichung nach Rayleight beschrieben werden: R R 0 = f (α −1 ) Gl. 4.6 R: 18O/16O Verhältnis des verbleibenden Dampfes R0: 18O/16O Verhältnis des Dampfes vor Beginn der Kondensation f: Fraktionierung des verbleibenden Dampfes α: Isotopenfraktionierungfaktor Rl/Rv Das Resultat der Isotopenfraktionierung während der Verdungstung von Wasser des Ozeans und der darauf folgenden Kondensation des Wasserdampfes in den Luftmassen ist, daß das Wasser gegenüber dem des Ozeans an D und 18O verarmt ist. • Kontinentaleffekt Niederschläge werden mit zunehmended kontinentaler Lage der Beprobungsstation isotopisch leicher, da sich die schweren Isotope bevorzugt aus der Luftmasse entfernen. -4- Deuterium und O-18 Die dabei entstehenden, oft komplizierten Isotopenmuster zeigen den Lauf der meteorischen Zyklenbahnen an (Abb. 4.3). Abb. 4.3: Kontinentaleffekt am Niederschlag über Deutschland (HEBERT, 1997) • Jahreszeitliche Schwankungen Jahreszeitlich hervorgerufene Variationen der δ18O und der δD Werte sind bedingt durch Temperaturschwankungen und der jeweils vorherrschenden Trajektion der Luftmassen. Abb. 4.4: Verwischung der jahreszeitlichen Variation des δ18O-Gehaltes mit zunehmender Tiefe (MERKEL et al., 1992) -5- Deuterium und O-18 Diese sind für die Klimarekonstruktionen (z.B. an Eiskernen, Kapitel 4.7.2) bedeutsame Effekte. Für die Hydrogeologie jedoch haben sie mit Ausnahme sehr kleiner Einzugsgebiete keine Bedeutung. Infolge des Mischungs- und Austauschverhaltens von Äquiferen tritt nämlich eine starke Dämpfung der Amplitude einer Inputzeitfunktion ein (Abb. 4.4). Es ist jedoch möglich die Verweilzeiten des Trockenwetterabflusses bis etwa vier Jahre nach Grundwasserneubildung abzuschätzen. • Breiteneffekt Innerhalb der Tropen werden im Niederschlag Ô18O Werte zwischen -1‰ und -4‰ beobachtet, die dem Ô18O Gehalt des Ozeanwassers nahe liegen, während nahe dem Polarkreis beprobte Niederschläge 18O Werte z.T. unter -20‰ aufweisen. Als Ursache dieses Effektes wird i.a. die Breitenabhängigkeit der Lufttemperatur angesehen. Man findet aber ebenso eine gute Korrelation zum Breitenkreismittelwert der jährlichen Verdunstung, die ihrerseits von der Temperatur abhängt. (HEBERT 1997) • Höheneffekt Die Abnahme der Lufttemperatur mit der Höhe bewirkt eine Abnahme der Ô18O und ÔD Werte im Niederschlag. Hinzu kommt die Ausregnung der Luftmassen, was ebenfalls eine Verminderung der schwereren Isotope zur Folge hat. Für Ô18O liegt diese Abnahme zwischen –0,15 und –0,40‰ pro 100m Höhenzuwachs (HÖLTING 1996). Für das Deuterium entspricht dies Werten von –11,2 bis –13,2‰ pro 100m Höhe. Dieser Effekt erlaubt die Bestimmung der Höhe des Einzugsgebietes für Grundwässer im Idealfall auf etwa 50m genau. Abb. 4.5: CRAIG-Diagramm (aus FAURE 1986) Da die Isotopenfraktionierung bei Wasserstoff- und Sauerstoffisotopen gleichernaßen wirksam wird, besteht für meteorische Wässer eine lineare Beziehung zwischen ihnen: (HÖLTING 1995) δD = mδ 18O + d Gl. 4.7 -6- Deuterium und O-18 Sie wird als Niederschlagsgerade (meteoric water line, MWL) bezeichnet (Abb. 4.5). Die Steigung m dieser Geraden hat für kontinentale Niederschläge einen Wert um 8, der Deuteriumexzeß d liegt bei +10. In offenen, stehenden Gewässern oder in Wadis arider Gebiete kommt es durch Verdunstung zu Isotopenfraktionierungen, die die Niederschlagsgerade verflachen. Aufgrund des sogenannten Eindunstungseffektes wurde an den Grundwässern der Nord-Sahara ein Anstieg der CRAIG-Geraden von lediglich m=2,9 gefunden. All diese am Niederschlag zu beobachtenden Isotopenphänomenen sind auf der Grundlage der Isotopieeffekte quantitativ beschreibbar. Man muß allerdings die Vorgeschichte des betreffenden Niederschlagsereignisses kennen: • Herkunft und Weg (Trajektorie) des Feuchtkörpers • Physiko-chemische Bedingungen bei der Genense und • Temperatur- und Anregungsregime längs des Transportweges. 4.5.3 Grundwasser Die meisten Grundwässer liegen an oder auf der MWL. Grundwassersysteme speichern somit die durchschnittlichen Gehalt an δ18O und δD des Niederschlags. Einige Ausnahmen müssen bei diese Annahme beachtet werden. In einigen Regionen, besonders in semiariden Gebieten, tragen nur die größteren, langanhaltenden Niederschlagsereignisse zur Grundwasserneubildung bei und die δD und δ18O Werte dieser Ereignisse können vom Gesamtdurchschnitt abweichen. Weiterhin kann die Verdunstung im Boden oder in Schneelagen Isotopenfraktionierungen des Wassers bewirken, was zu einem erhöhten Anteil an Deuterium und Sauerstoff-18 im Grundwasser führt. Außerdem kann das Grundwasser auch in früheren Zeiten gebildet wurden sein, als die Niederschläge andere Mengen und isotopische Zusammensetzungen besaßen als heute. 4.5.4 Geothermalwässer Die Herkunft von Wässern aus vulkanischen Prozessen und heißen Quellen ist von größtem Interesse, da die Möglichkeit besteht, daß es sich um juvenile Wässer handeln könnte. Die isotopische Zusammensetzung von Sauerstoff im juvenilen Wasser ist durch die der Silikatgesteine des oberen Mantels festgelegt. Mafische und ultramafische Gesteine besitzen δ18O Werte von +6 bis +7 relativ zum SMOW. Bei Temperaturen von 1000 °C sind Isotopieeffekte unerheblich, so daß das juvenile Wasser beim Verlassen der Kruste einen δ18O Wert von +7 besitzen. Die isotopische Zusammensetzung ändert sich nicht nur mit dem Austausch mit dem Tiefengestein sondern es wird auch mit meteorischen Wässern oder eindringenden Meerwasser vermischt. 4.6 Sauerstoff und Wasserstoff in der Lithosphäre Sauerstoff ist ein Hauptbestandteil in den meisten gesteinsbildenden Mineralen. Die Isotopenzusammensetzung der Minerale läßt auf dessen Herkunft und Bildungstemperaturen schließen. Wenn zwei Minerale A und B Isotopen mit einem gemeinsamen Reservoir austauschen, nimmt der Unterschied in ihren δ18O Werten mit zunehmenden Temperaturen ab. Diese Phänomen kann genutzt werden um die Temperatur des letztendlichen Isotopenaustauschs der entstandenen Minerale zu bestimmen. -7- Deuterium und O-18 Der Isotopenausgleich zwischen Mineralen und Wasser wird durch die Temperatur des Systems beeinflußt. Isotopenkonzentrationen können infolg dessen bestimmten Temperatutbereichen zugeordnet werden. Minerale vulkanischer Gesteine zeigen so reelle Mineralbildungstemperaturen, während die der Tiefengesteine aufgrund der langsamen Abkühlung und des dabei fortwährenden Isotopenaustausches niedrigere Temperaturen anzeigen. Wasser unterschiedlicher Herkunft spielt auch eine wichtige Rolle in der Bildung hydrothermaler Erzlagerstätten. Eine solchen Erzlagerstätte weist eine große isotopische Vielfalt auf, bedingt durch die unterschiedlichen Bildungszeiten und –temperaturen. Die isotopische Zusammensetzung von Granitplutonen kann für die Unterschiedung zwischen S und I-typ Graniten genutzt werden. So sind S-typ Granite im Vergleich zu Ityp Graniten an δ18O angereichert. Die Isotopenzusammensetzung von Tonmineralen hängt v.a. von der Zusammensetzung des Wassers während deren Bildung sowie von der Temperatur ab. So kann das δ18O und δD Verhältnis in Tonmineralen das der meteorischen Wässern widerspiegeln. Marine Karbonate haben δ18O Werte von +20‰ bis +30‰ relativ zum SMOW. Die δ18O Werte fallen mit zunehmenden Alter der Karbonate. Die Ursache dieses Effekts ist noch fraglich. Es gibt verschiedene Erklärungen: 1) Isotopische Wechselwirkungen mit meteorischen Wasser, 2) die Abnahme der Ozeantemperatur vom Archaikum bis heute und 3) ein Anstieg der δ18O Werte des Ozeanwassers seit dem Archaikum. Nichtmarine Karbonate zeigen geringere Anreicherungen an 18O, da sie im isotopischen Gleichgewicht mit dem meteorischen Wasser gebildet wurden sind. Die Abweichung der δ18O Werte von Mineralen in metamorphen Gesteinen nimmt mit zunehmender Metamorphose ab. 4.7 Klimarekonstruktionen Im Ergebnis der globalen Klimaänderungen (Eiszeit-Warmzeit-Wechsel) sind an der Luftfeuchte wie auch am atmosphärischen CO2 signifikante δ18O-Verschiebungen eingetreten, deren zeitlicher Verlauf im Gletschereis der polaren Kappen sowie in Tiefseesedimenten gespeichert ist. 4.7.1 Paläothermometer im Ozean Die Methode der Ermittlung der Paläptemperatur basiert auf der Tatsache, daß die Isotopenzusammensetzung des Sauerstoffs im Calciumcarbonat (Calcit oder Aragonit) von der des Wassers abweicht, wenn diese Verbindung im Wasser ausfällt. Die verschiedenen Ergebnisse des Isotopenaustausches zwischen Calciumkarbonat und Wasser können durch folgende Gleichung veranschaulicht werden: 1 3 CaCO 316 + H 2 O 18 ↔ 1 3 CaCO 318 + H 2 O 16 Gl. 4.8 Die Gleichgewichtskonstante für diese Reaktion ist: R K= c Gl. 4.9 Rw Rc und Rw sind dabei die 18O/16O Verhältnisse von Karbonat und Wasser. Der Faktor für die Isotopenfraktionierung für das Calcit-Wasser-System hat einen Wert von 1,0286 bei 25°C. Daher ist Calcit relativ zum Wasser unter isotopischen Gleichgewicht an δ18O angereichert. Da der Fraktionierungsfaktor temperaturabhängig ist, -8- Deuterium und O-18 ist auch die Isotopenzusammensetzung von Sauerstoff im Calcit im Gleichgewicht mit Wasser eine Funktion der Temperatur. Aus der isotopischen Zusammensetzung des Sauerstoffs im Karbonat lassen sich folglich Rückschlüsse auf die Paläotemperatur ziehen. Ähnliche Untersuchungen an Land wurden an terrestrischen Schneckengehäusen durchgeführt. Die δ18O Werte der Schneckengehäuse variieren stark, abhängig hauptsächlich von der Isotopenzusammensetzung des Sauerstoffs im Niederschlagswasser. Letztlich ist die isotopische Zusammensetzung der Schneckenhäuser abhängig von saisonalen Variationen der Temperatur und des Niederschlages welches wiederum abhängt von der geographischen Breite, der Höhenlage und lokalen Erscheinungen, wie der Abstand zur Küste, die Nähe von Seen und anderen Faktoren. Weiterhin sind die isotopischen Zusammensetzungen der Schneckengehäuse und damit die gespeicherten Temperaturen von Lebenszyklus der Schnecken und der Wachstumsrate ihrer Schalen im Laufe eines Jahres abhängig. Auch die Phosphatgehalte in den Knochen von Säugetieren wurden zur Untersuchung herangezogen. 4.7.2 Gletscher und Eiskappen Die Isotopenzusammensetzung von Sauerstoff und Wasserstoff in Eis und Schnee hat eine wichtige Bedeutung für die glaziologische Forschung, insbesondere für die Klimaforschung der letzten 100 000 Jahre, erlangt. Abb. 4.6: Jahreszeitliche Variationen von δ18O und δD im Schnee und Firn an Marke 5 am Südpol (FAURE 1986) -9- Deuterium und O-18 Die isotopische Zusammensetztung von Sauerstoff und Wasserstoff in Schneeablagerungen in polaren Regionen der Erde und in Hochgebirgsregionen ist hauptsächlich von der Temperatur bestimmt. Aus diesem Grund sind die δ18O und δD Werte des Schnees deutlich negativ und spiegeln sowohl Abweichungen in saisonalen Temperaturschwankungen, als auch Variationen in der Höhenlage und geographischen Breite wieder. Die saisonale Variation der δ18O Werte von Schnee kann für die Datierung von Schneeund Firnlagen genutzt werden. Schneeablagerungen des Sommers haben weniger negative δ18O Werte als die des Winters. Komplikationen entstehen in Gebieten mit geringen Niederschlägen, wie z.B. das Innere der Antarktik, da in diesen Regionen der Schnee durch Deflation remobilisiert und woanders abgelagert wird. Die Mächtigkeit der jährlichen Schichten kann daher stark schwanken oder es können sogar Lücken entstehen. Trotz alle dem wurden δ18O Profile von Schnee und Firn aus verschiedene Teilen der Antarktis für die Ermittlung der durchschnittlichen Wasseransammlung verwendet. Z.B. fanden Epstein et al. (1965), basierend auf dieser Methode, eine durchschnittliche Akkumulationsrate von 7 cm Wasser am Südpol in der Zeit zwischen 1958 bis 1963. Die erste derartige Bohrung wurde 1966 im Camp Century, nordwest Grönland, geteuft. Sie war 1390 m lang und 12 cm im Durchmesser. Die ermittelten δ18O Werte als Funktion der Tiefe schwankten zwischen –28 bis -40‰. Generell hat der obere Teil des Eiskernes einen relativ konstanten δ18O Wert von -29‰. Es folgt ein rascher Abfall auf -40‰, was auf eine deutlich niedrigere Lufttemperatur zu dieser Zeit schließen läßt. Nach diesem breiten Minimum (Weichselkaltzeit) kommt es zu einem erneuten Anstieg auf δ18O Werten um –26 ‰, was Hinweise auf eine Warmzeit gibt. Das δ18O Profil von Grönland gibt zweifellos signifikante klimatische Veränderungen wieder. Jedoch ist die Erstellung der zugehörigen Zeitskala schwierig, da keine Datierungen am Eiskern durchgeführt worden sind. Literatur CLARK J.D. & FRITZ P. (1997): Environmental Isotopes in Hydrogeology, Lewis Publishers CRISS R. E. (1999): Principles of stable isotope distribution, Oxford University Press FAURE G. (1986): Principles of Isotope Geology, John Wiley & Sons, second edition HEBERT D. (1997): Isotopenmethoden in der Hydrogeologie- Physikalische Grundlagen und Anwendungsmethodik, in Wissenschaftliche Mitteilungen, TU Bergakademie Freiberg, Institut für Geologie HÖLTING B. (1996): Hydrogeologie, Einführung in die Allgemeine und Angewandte Hydrogeologie, Enke-Verlag, 5. Auflage MERKEL B. & SPERLING S. (1996): Hydrogeochemische Stoffsysteme – Teil 1, in DVWK Schriften 110, Kommissionsvertrieb Wirtschafts- und Verlagsgesellschaft Gas und Wasser mbH, Bonn UREY, H.C., BRICKWEDDE, F.G., MURPHY G.M. (1932): An isotope of hydrogen of mass 2 and its concentration, (Abstract) Phys. Rev. - 10 - Deuterium und O-18 - 11 -