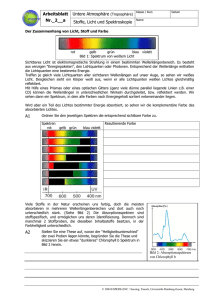
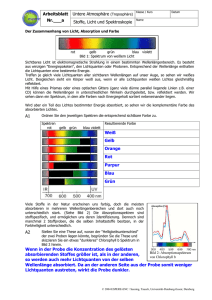
mikrobiologe
Werbung

DER MIKROBIOLOGE MITTEILUNGEN DES BERUFSVERBANDES DER ÄRZTE FÜR MIKROBIOLOGIE UND INFEKTIONSEPIDEMIOLOGIE E.V. 16. Jahrgang, Heft 4 August 2006 ÜBERSICHT P. Nenoff, W. Handrick, U. Paasch, C. Mügge und F. Berthold Das Erythema nodosum – eine Übersicht .......................................................................................... 122 Christine Klapp und Gisela Gille Chlamydien – eine heimliche Epidemie unter Jugendlichen? ........................................................... 129 Terminänderung Die 16. Frühjahrstagung des BÄMI in Kloster Banz, Staffelstein, muss aus organisatorischen Gründen um eine Woche verschoben werden. Der neue Termin ist Donnerstag, 26. April – Samstag, 28. April 2007 Wir wollen Sie schon jetzt darauf aufmerksam machen, dass im Anschluss an die Tagung durch den Feiertag am Dienstag den 1. Mai 2007 die Möglichkeit für ein „langes Wochenende“ gegeben ist. Sie haben die Möglichkeit Ihren Aufenthalt in Kloster Banz um diese Tage zu verlängern. Weitere Informationen dazu erhalten Sie im Dezemberheft des MIKROBIOLOGEN. Das komplette Inhaltsverzeichnis finden Sie auf der übernächsten Seite INHALTSVERZEICHNIS ÜBERSICHT P. Nenoff, W. Handrick, U. Paasch, C. Mügge und F. Berthold Das Erythema nodosum – eine Übersicht ................................................................................................... 122 Christine Klapp und Gisela Gille Chlamydien – eine heimliche Epidemie unter Jugendlichen? ................................................................... 129 QUALITÄTSSICHERUNG Iris Müller, Klaus-Peter Hunfeld und Volker Brade Bakteriologisch-infektionsserologischer Ringversuch Mai 2005: Zielwertübersicht und Kommentare Beitrag der Qualitätssicherungskommission der DGHM............................................................................ 137 Udo Reischl, Norbert Lehn, Hans Wolf, Matthias Maaß, und Eberhard Straube "Bakteriengenom-Nachweis PCR / NAT": Auswertung des aktuellen Ringversuchs von INSTAND e.V. zur externen Qualitätskontrolle molekularbiologischer Nachweisverfahren in der bakteriologischen Diagnostik - Beitrag der Qualitätssicherungskommission der DGHM -....................................................................... 145 Hans-Jürgen Tietz Abschlußbericht über den Ringversuch 491 (Dermatomykologie) des Jahres 2005 ................................. 159 TAGUNGSBERICHT R. Rüchel Tagungsbericht Klinische Mykologie ........................................................................................................ 162 ZEITSCHRIFTENREFERAT Nosokomiale Ausbrüche multiresistenter Klebsiella-pneumoniae-Stämme auf Intensivstationen ............ 163 BUCHBESPRECHUNGEN ...................................................................................................... 128, 135, 144, 158 MITTEILUNGEN ......................................................................................................................................... 163 STELLENANZEIGE ..................................................................................................................................... 163 FORTBILDUNGSVERANSTALTUNGEN ........................................................................................................ 164 BEZUGSQUELLEN ....................................................................................................................................... 164 TAGUNGSKALENDER ................................................................................................................................. 164 IMPRESSUM .................................................................................................................. dritte Umschlagseite MIKROBIOLOGE 16.Jg. 2006 121 ÜBERSICHT Das Erythema nodosum – eine Übersicht P. Nenoff 1), W. Handrick 2), U. Paasch 3), C. Mügge 4), F. Berthold 2) 1) Laboratorium für medizinische Mikrobiologie, Partnerschaft Dr. J. Herrmann und Prof. Dr. P. Nenoff, Mölbis 2) Institut für Medizinische Diagnostik Oderland, Frankfurt (Oder) 3) Klinik für Dermatologie, Allergologie und Venerologie, Universitätsklinikum Leipzig 4) Carl-von-Basedow-Klinikum, Medizinische Klinik II, Merseburg Zusammenfassung Ätiopathogenese Das Erythema nodosum ist ein entzündlicher Prozess im Bereich der Septen zwischen den subkutanen Fettläppchen, d.h. eine Pannikulitis, und wird als immunologische Reaktion auf unterschiedlichste antigenetische Stimuli aufgefasst. Allgemeine Aspekte In einer kurzen Übersicht werden die wichtigsten Aspekte der Epidemiologie, Ätiopathogenese, klinischen Symptomatik, Diagnostik, Differenzialdiagnostik und Therapie des Erythema nodosum dargestellt. Schlüsselwörter: Erythema nodosum, Pannikulitis, Pathogenese, Diagnostik, Therapie Erythema nodosum – a review Summary Erythema nodosum is an inflammatory process in the lower layers of the dermis and in the septal portions of the subcutaneous fat tissue (panniculitis), representing an immune reaction to many different antigenic stimuli. The aim of this paper is to give a short review of epidemiology, etiopathology, clinical symptoms and signs, diagnostics, differential diagnosis and therapy of erythema nodosum. Key words: Erythema nodosum, panniculitis, pathogenesis, diagnostics, therapy Das Erythema nodosum (EN) ist eine eher seltene Hauterkrankung mit einem charakteristischen klinischen Bild. Es handelt sich um eine „polyätiologische“ Entzündung des subkutanen Fettgewebes, also eine Pannikulitis. Infektionen kommt pathogenetisch eine entscheidende Rolle zu, daneben spielen Medikamente, chronisch entzündliche Krankheiten und Malignome eine wesentliche Rolle. Die ganze Breite der Palette der bisher mit einem EN assoziierten infektiösen und nicht-infektiösen Faktoren ist erstaunlich groß und kaum zu übersehen. Beim EN handelt es sich um einen entzündlichen Prozess im Bereich der Septen zwischen den subkutanen Fettläppchen (Pannikulitis) als immunologische Reaktion auf unterschiedlichste antigenetische Stimuli („Polyätiologie“). Die Pathogenese ist unklar. Man vermutet, dass es sich um eine Immunkomplex-Reaktion oder um eine Immunreaktion vom verzögerten Typ handelt. Das Überwiegen des weiblichen Geschlechts, das relativ häufige Vorkommen bei Schwangeren sowie bei Einnahme von Kontrazeptiva und das seltene Auftreten bei präpubertären Mädchen sprechen dafür, dass weibliche Sexualhormone pathogenetisch eine Rolle spielen. Histologischer Befund Beim EN kommt es zu einer leukozytären Infiltration der subkutanen Septen sowie zur Ablagerung von IgM und C3 in den Gefäßwänden. Das Infiltrat setzt sich aus Lymphozyten, Histiozyten, neutrophilen und eosinophilen Leukozyten sowie (vor allem in der Spätphase) aus Fremdkörper-Riesenzellen zusammen, dazu kommen epitheloidzellige Granulome, außerdem seltener Miescher´sche Radiärknötchen (Granulome) (Abb. 2 a und b) (5, 27). Auf ein akut neutrophiles Stadium folgt ein chronisches Stadium mit granulomatöser Entzündung. Dazu finden sich optional Fettzellnekrosen, manchmal sichelförmige Hämorrhagien. Krankheiten bzw. therapeutische Maßnahmen, die mit einem Erythema nodosum assoziiert sein können Das EN kann der auslösenden „Grundkrankheit“ (bzw. bei Malignomen dem Rezidiv) um mehrere Monate vorausgehen (1, 36, 45). Epidemiologie Am häufigsten ist das EN mit einer Infektion assoziiert. Eine Übersicht der dem EN zugrunde liegenden bakteriellen, viralen, mykotischen sowie parasitären Infektionen findet sich in Tab. 1. In Entwicklungsländern, aber z. B. auch in der Türkei, gilt die primäre Tuberkulose noch heute als häufigste Ursache eines EN (42), eine ähnliche Situation, wie man sie in Deutschland und Mitteleuropa in der Vergangenheit sah. Die 20-40-Jährigen bilden die typische Altersgruppe für das EN, Kinder erkranken selten (11, 16, 21, 26, 34, 48, 65). Das Verhältnis männlich zu weiblich beträgt 1:3 (10), bei Kindern etwa 1:1. Bohn et al. (5) analysierten 95 Patienten mit EN, wobei bei 50 eine Infektion auslösende Ursache war. Innerhalb der Gruppe der Infektionen waren solche der oberen Luftwege am häufigsten (37 Patienten). 122 MIKROBIOLOGE 16.Jg. 2006 Tab. 1: Infektionen, die mit einem Erythema nodosum einhergehen können Abb. 2 a • Bakterielle Infektionen - - Streptokokken: A-Streptokokken gelten heute als wichtige Ursache (z.B. als Tonsillopharyngitis, Erysipel, Impetigo, Cellulitis) (21); aber auch Infektionen durch andere Streptokokken-Spezies, z.B. dentogene Infektionen (32), können die Ursache sein Salmonellen: Enteritis-Salmonellen (16, 35, 65); Salmonella typhi (in Deutschland heute sehr selten, evtl. als Reise- bzw. Importinfektion) Shigellen Yersinien (18, 48) Francisella tularensis (in Deutschland unwahrscheinlich) (47) Campylobacter jejuni (53) Mykobakterien: Mycobacterium tuberculosis, in Deutschland evtl. bei Immigranten (49); atypische Mykobakterien (41, 48); Mycobacterium leprae (in Endemiegebieten) Chlamydien (Chl. pneumoniae, Chl. trachomatis, Chl. psittaci) (13, 15) Leptospiren (10) Mycoplasma pneumoniae (61) Bartonellen (Bartonella henselae als Auslöser der Katzenkratzkrankheit) (21, 24, 52, 54) Treponema pallidum Coxiella burnetii (64) Brucellen (nicht in Deutschland, u.U. aber als Reisekrankheit) Staphylococcus aureus (Brustabszesse) (62) • Virusinfektionen - Masernvirus HBV, HCV HPV-B19 (Humanes Parvovirus B 19) EBV (21, 38, 48) CMV (49) HIV (40) virale Erreger von Infektionen der oberen Luftwege • Pilzinfektionen - Trichophyton sp., u. a. Kerion celsi durch Trichophyton mentagrophytes (11, 19) tropische Mykosen (Blastomyces dermatitides, Coccidioides immitis, Histoplasma capsulatum, Paracoccidioides brasiliensis) (4) • Infektionen durch Protozoen - Entamoeba histolytica Giardia lamblia (57) Toxoplasma gondii (39) - - Abb. 2 b Abb. 2 a und b Histologie des Erythema nodosum mit vorwiegend septaler Pannikulitis unter Nachweis von Riesenzellen (HE-Färbung). Auch A-Streptokokken gelten als wichtige bakterielle Auslöser eines EN. Zu beachten ist, dass zum Zeitpunkt des Auftretens des EN die A-Streptokokken im Rachenabstrich oft nicht mehr nachweisbar sind. Kürzlich wurde über zwei Patientinnen berichtet, bei denen das EN mit (z. T. multiplen) Brustabszessen assoziiert war (bei einer Patientin handelte es sich um eine Staphylococcus aureus-Infektion (62). Einen weiteren Ursachenkomplex bilden entzündliche Erkrankungen nicht-infektiöser Genese. An erster Stelle ist hier die Sarkoidose zu nennen, darüber hinaus gibt es weitere chronisch-entzündliche Erkrankungen, in deren Verlauf sich ein EN entwickeln kann (Tab. 2). Aber auch Malignome können mit einem EN einhergehen, z. B. Mb. Hodgkin (6), Non-Hodgkin-Lymphome (45, 59) bzw. deren Rezidive und Leukämie (Tab. 3). Nicht selten geht das EN dem Malignom um bis zu mehrere Monate voraus, d. h., dem EN kommt hier eine Indikatorfunktion zu. So berichteten Anan et al. (1) über eine 65jährige Patientin mit akuter myelomonozytärer Leukämie, die ca. 5 Monate nach dem EN diagnostiziert wurde. Dennoch gilt das EN nicht als paraneoplastisches Syndrom. Auch Medikamente sind als potentielle EN-Auslöser zu beachten und anamnestisch immer zu erfragen (Tab. 4). Auch im Rahmen einer Strahlentherapie kann ein EN auftreten (17). - Selten sind Impfungen, u. a. die HBV-Impfung, mit einem EN assoziiert. Das gleiche gilt für Schilddrüsenerkrankungen. MIKROBIOLOGE 16.Jg. 2006 123 Tab. 2: Erythema nodosum bei entzündlichen Erkrankungen nicht-infektiöser Genese • • • • • • • • • Sarkoidose (2, 12, 22, 28, 31, 58) Mb. Crohn, Colitis ulcerosa (21, 46, 63) Sweet-Syndrom (22) Sjögren-Syndrom (66) primäre biliäre Zirrhose (meist Frauen im Alter zwischen 40 und 70 Jahren) Acne fulminans (60) Mb. Behçet (36, 48, 49, 50) IgA-Nephropathie Zoeliakie (3) Tab. 3: Malignome und Erythema nodosum • • • • Akute myelomonozytäre Leukämie (1) Morbus Hodgkin (6) Non-Hodgkin-Lymphome (45, 59) Karzinoid (37) einschmelzen (5). Häufig kommt es zu einem schubweisen Verlauf, außerdem können gleichzeitig Arthralgien, Myalgien und Fieber auftreten. Gelegentlich konfluieren die Läsionen, die betroffene Extremität kann deutlich ödematös sein. Diagnostik und Differenzialdiagnosen Das klinische Bild ist zwar typisch („Blickdiagnose“?), trotzdem gibt es eine Reihe von Differenzialdiagnosen, die nicht immer einfach auszuschließen sind. Diese sind vor allem mit kutan-subkutanen Knoten einhergehende Dermatosen des Unterschenkels. Zu denken ist u. a. an Pannikulitiden anderer Genese, z. B. Pfeifer-Weber-ChristianSyndrom, Kältepannikulitis und nodöse Vaskulitiden (Tab. 5). Im Einzelfall ist die histologische Untersuchung (44) zur diagnostischen Abklärung notwendig. Unbedingt zu erwähnen ist, dass der charakteristische histologische Befund keine Rückschlüsse auf die Ursache des EN zulässt. BSR und CRP sind meist auch ohne zugrunde liegende Infektion erhöht. Tab. 5: Differenzialdiagnosen des Erythema nodosum Tab. 4: Medikamente, die Auslöser eines Erythema nodosum sein können • • • • • • Sulfonamide Minocyclin (8) Phenytoin hormonelle Kontrazeptiva (44, 49, 67) Salicylate Omeprazol (51) Hormonelle Faktoren, vor allem hormonelle Kontrazeptiva, wurden bereits im Zusammenhang mit Medikamenten genannt. Darüber hinaus kommt es gelegentlich in der Schwangerschaft, vorzugsweise im 1. Trimenon (49), zum Auftreten eines EN. Gerade erschienen ist eine Kasuistik, die ein EN bei einer Japanerin infolge einer Akupunktur-Behandlung beschreibt (29). In den meisten publizierten Fallserien gibt es allerdings einen mehr oder weniger großen Anteil von EN-Fällen, deren Ätiologie nicht geklärt werden konnte (30-60 %), man spricht dann von einem „idiopathischen „EN“. Klinische Symptome und Befunde Typischerweise manifestiert sich das EN in symmetrisch (seltener unilateral) auftretenden rötlich-lividen berührungsempfindlichen, schmerzhaften Knoten unterschiedlicher Größe und Anzahl (Abb. 1 a und b). Die Knoten sind unscharf begrenzt, erhaben und von teigig-derber Konsistenz (Durchmesser: 1-5 cm). Meist treten diese Effloreszenzen an der Streckseite der Unterschenkel, insbesondere oberhalb des Sprunggelenkes, seltener in anderen Körperregionen (oberhalb des Kniegelenkes am Oberschenkel, Fußsohlen, Arme, Nacken) auf. Differenzialdiagnostisch bedeutsam ist der Umstand, dass die Knoten des EN nie 124 MIKROBIOLOGE 16.Jg. 2006 • • • • • • • • • • Pannikulitis anderer Genese (z. B. Pfeifer-WeberChristian-Syndrom, pankreatische Pannikulitis, Kältepannikulitis, Lupus-Pannikulitis, Lipogranulomatosis subcutanea Rothmann-Makai) atypische Reaktion auf einen Insektenstich traumatisch bedingte Hämatome (z.B. Misshandlung) Weichteilsarkom (55) Erythema induratum (Bazin) Periarteriitis nodosa Mb. Schoenlein-Henoch Perniones oberflächliche Thrombophlebitis noduläre Läsionen beim Sweet-Syndrom Phlegmone, Erysipel (58) Diagnostik der Grundkrankheit bzw. des auslösenden Mechanismus Nicht bei jedem Patienten sollen bzw. können alle irgendwie in Betracht kommenden Untersuchungen durchgeführt werden! Ein Vorschlag für ein Basis-Laboruntersuchungsprogramm ist in Tab. 6 ausgeführt. Weitere Untersuchungen in Bezug auf seltenere (infektiöse) Ursachen sollten bei klinischem Verdacht gezielt erfolgen. In nicht wenigen Fällen heilt ein EN spontan oder unter symptomatischer Therapie, auch wenn eine Ursache nicht gefunden wurde („idiopathisches“ EN). Der Anamnese kommt große Bedeutung zu, vor allem, weil es durch eine ausführliche Anamnese evtl. möglich wird, auf eine teure bzw. belastende invasive oder apparative Diagnostik zu verzichten. Abb. 1 a) Erythema nodosum in symmetrischer Ausprägung mit charakteristischen rötlich-lividen, berührungsempfindlichen, unscharf begrenzten, teigigderben Knoten an der Streckseite der Unterschenkel. b) Livid-rote, z. T. bläulich erscheinende, entzündliche, druckschmerzhafte Knoten prätibial. MIKROBIOLOGE 16.Jg. 2006 125 Tab. 6: Basis-Laboruntersuchungen zum Ausschluß häufiger Ursachen eines Erythema nodosum • • • • • • • • • • • • • • • Blutbild (Anämie?, Leukozytose?) Blutkultur Streptokokken-Antikörper (ASR, Anti-DNase B) Rachenabstrich auf A-Streptokokken Bartonella henselae-Antikörper Yersinia enterocolitica-Antikörper Mycoplasma pneumoniae-Antikörper Chlamydien-Antikörper Toxoplasma-Antikörper EBV-Antikörper Masern-Antikörper Parvovirus-B-19-Antikörper HIV-Test Stuhl auf TPER, Yersinien, Campylobacter ACE (Angiotensin-I-Converting-Enzym) zum Ausschluss einer Sarkoidose • Schilddrüsenhormone Zum klinischen Status gehören Untersuchung von Pharynx, Zähnen, Lymphknoten, Abdomen, der Haut (Exanthem, Ulzera?) sowie der Gelenke (Arthritis?). Die invasive Diagnostik umfasst den Tuberkulin-Test (Mendel-Mantoux), Knochenmark-Punktion, Gewebsbiopsie (z. B. bei Verdacht auf Tumor, Sarkoidose, Mykobakterien-Infektion, biliäre Zirrhose), außerdem im Einzelfall die Endoskopie (bei Verdacht auf Mb. Crohn bzw. Colitis ulcerosa). Ergänzend kommt die bildgebende Diagnostik zum Einsatz, an erster Stelle das Röntgenbild der Lunge (z. B. bei Verdacht auf Tbk, Lymphom, Pneumonie, Sarkoidose), bei entsprechendem Verdacht auch CT oder MRT. Bei pulmonalen Symptomen (z. B. Belastungsdyspnoe) ist die Lungenfunktionsdiagnostik durchzuführen. Des Weiteren sollten Ärzte anderer Fachgebiete in die Untersuchungen einbezogen werden, z. B. HNO-Arzt, Augenarzt (z. B. bei Verdacht auf Sarkoidose), Hautarzt und Zahnarzt. Therapie Die Therapie besteht vor allem in der Behandlung der auslösenden Krankheit (z. B. in der gezielten Antibiotikatherapie der auslösenden bakteriellen Infektion) bzw. in der Beendigung einer Arzneimittelgabe, wenn das Mittel offensichtlich das EN ausgelöst hat. Oft kommt es auch zur spontanen Rückbildung. Bei Schmerzen und Fieber wird symptomatisch behandelt, evtl. kurzzeitig mit Ibuprofen oder Indometacin, oft wird auch Acetylsalicylsäure als antiinflammatorisches Mittel eingesetzt. Systemische Kortikosteroide kommen nur in Ausnahmefällen zum Einsatz, auch Mycophenolatmofetil wurde verwendet (7). Auch Thalidomid, nicht zuletzt wegen seiner hemmenden Wirkung auf die Angiogenese, wurde in der Vergangenheit bereits beim EN eingesetzt (33). Ob dieser Wirkstoff tatsächlich einen günstigen 126 MIKROBIOLOGE 16.Jg. 2006 Effekt hat, z. B. bei chronischen Verläufen des EN, ist in Anbetracht der spärlichen Daten noch fraglich. Früher wurde Kaliumjodid zur Therapie des EN verwendet. Man erklärte sich die Wirksamkeit zumindest theoretisch aus der Fähigkeit von Kaliumjodid, die Freigabe von Heparin aus Mastzellen stimulieren zu können (50). Heparin wiederum ist in der Lage, die Immunreaktion vom verzögerten Typ zu unterdrücken. Deshalb werden auch Heparinoide unter okklusiven Bedingungen beim EN eingesetzt. Lokaltherapeutische Mittel wie Ichthyol-Watteverbande, Wickel mit Eis, Alkohol, essigsaurer Tonerde, Heublumen sowie Diclofenac-Gel lindern im Einzelfall die Beschwerden, es gibt dafür in der Literatur aber allenfalls anektdotische Berichte. Die Autoren selbst haben gute Erfahrung mit topischen Glukokortikoiden, außerdem mit der Kompressionstherapie. Einfache symptomatische Maßnahmen sind Hochlagerung der Beine sowie Bettruhe. Verlauf Die Knoten können im Verlauf bläulich-livid, aber auch gelblich-braun werden, die einzelne Läsion heilt meist in 2-3 Wochen ab. Durch den schubweisen Verlauf beträgt die Gesamtdauer der Erkrankung etwa 6-8 Wochen. Chronisch-rezidivierende Verläufe kommen vor, u. a. bei Malignomen (6), Sarkoidose (31), aber auch unter Einnahme eines oralen Antikonzeptivums (44). Fazit für die Praxis Das EN ist eine „polyätiologische“ Dermatose, die durch eine kaum zu überschauende Anzahl von Faktoren verursacht werden kann. Zu denken ist an erster Stelle an Infektionen des oberen Respirationstraktes (vorzugsweise durch A-Streptokokken), aber auch Darminfektionen, z. B. durch Yersinien, sind nicht selten Ursache des EN. Darüber hinaus ist an orale Kontrazeptiva zu denken, und nicht zuletzt zählt die Sarkoidose zu den wesentlichen assoziierten Erkrankungen. Selten kommt das EN im Verlauf einer malignen Erkrankung vor, manchmal auch (im Sinne einer Indikatorerkrankung bei hämatologischen Malignomen) bereits Monate zuvor. Falls die Ursache nicht offensichtlich ist bzw. auch zur Abgrenzung von differenzialdiagnostisch zu erwägenden Dermatosen, muss im Einzelfall labordiagnostisch gefahndet werden. Die Palette der wesentlichen Laborparameter wurde im Text erläutert. Die Therapie ist – nachdem die zugrunde liegenden Faktoren beseitigt oder behandelt wurden – symptomatisch. Literatur 1. 2. 3. 4. 5. Anan, T.; Imamura, T.; Yokoyama, S.; Fujiwara, S.: Erythema nodosum and granulomatous lesions preceding acute myelomonocytic leukemia. J. Dermatol. 31 (2004) 741-747 Barnard, S.; Marshall, R.; Parry, R.G.; Johnston, P.: Sarcoid presenting with hypercalcaemia and erythema nodosum in a haemodialysis patient. Nephrol. Dial. Transplant. 17 (2002) 175 Bartyik, K.; Várkonyi, A.; Kirschner, A.; Endreffy, E.; Túri, S.; Karg, E.: Erythema nodosum in association with celiac disease. Pediatr. Dermatol. 21 (2004) 227-230 Body BA. Cutaneous manifestations of systemic mycoses. Dermatol. Clin. 14 (1996) 125-135 Bohn, S.; Büchner, S.; Itin, P.: Erythema nodosum: 112 Fälle. Epidemiologie, Klinik und Histopathologie. Schweiz. Med. Wschr. 127 (1997) 1168-1176 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. Bonci, A.; Di Lernia, V.; Merli, F.; Lo Scocco, G.: Erythema nodosum and Hodgkin´s disease. Clin. Exper. Dermatol. 26 (2001) 408-411 Boyd, A.S.: Use of mycophenolate mofetil in erythema nodosum. J. Am. Acad. Dermatol. 47 (2002) 968-969 Bridges, A. J.; Graziano, F. M.; Calhoun, W.; Reizner, G. T.: Hyperpigmentation, neutrophilic alveolitis and erythema nodosum resulting from minocycline. J. Am. Acad. Dermatol. 22 (1990) 959-962 Brodell, R. T.; Mehrabi, D.: Underlying causes of erythema nodosum. Postgrad. Med. 108 (2000) 147-149 Buckler, J. M. H.: Leptospirosis presenting with erythema nodosum. Arch. Dis. Childh. 52 (1977) 418-419 Calista, D.; Schianchi, S.; Morri, M.: Erythema nodosum induced by kerion celsi of the scalp. Pediatr. Dermatol. 18 (2001) 114-116 Cancrini, C.; Angelici, F.; Colavita, M.; Cortis, E.; Chini, L.; Mammone, F.; Rossi, P.; De Sanctis, R.: Erythema nodosum: a presenting sign of early onset sarcoidosis. Clin. Exper. Rheumatol. 16 (1998) 337-339 Cascina, A. ; Bianco, A.M.; Mangiarotti, P.; Montecucco, C.M.; Meloni, F.: Cutaneous vasculitis and reactive arthritis following respiratory infection due to Chlamydia pneumoniae: report of a case. Clin. Exper. Rheumatol. 20 (2002) 845-847 Cribier, B.; Caille, A.; Heid, E.; Grosshans E. : Erythema nodosum and associated diseases. A study of 129 cases. Int. J. Dermatol. 37 (1998) 667-672 Erntell, M.; Ljunggren, K.; Gadd, T.; Persson, K.: Erythema nodosum – a manifestation of Chlamydia pneumoniae (strain TWAR) infection. Scand. J. Infect. Dis. 21 (1989) 693-696 Farges, C.; de Lumley, L.; Piguet, C. ; Gilbert, B.: Gastroentérite à Salmonella enteritidis et érythème noueux. Arch. Pédiatr. 6 (1999) 337-338 Fearfield, L.A.; Bunker, C.B.: Radiotherapy and erythema nodosum. Br. J. Dermatol. 142 (2000) 189 Folliot, J. P.; Ducloux, G.: Érythème noueux à yersinia enterocolitica. Lille Méd. 24 (1979) 39-40 Foti, C.; Diaferio, A.; Daddabbo, M.; Angelini, G.: Tinea barbae associated with erythema nodosum in an immunocompetent man. J. Eur. Acad. Dermatol. Venereol. 15 (2001) 250-251 Garcia-Porrua, C.; Gonzalez-Gay, M. A.; Vazquez-Caruncho, M.; Lopez-Lazaro, L.; Lueiro, M.; Fernandez, M. L.; Alvarez-Ferreira, J.; Pujol, R. M.: Erythema nodosum. Etiologic and predictive factors in a defined population. Arthr. & Rheum. 43 (2000) 584-592 Garty, B. Z.; Poznanski, O.: Erythema nodosum in Israeli children. Isr. Med. Assoc. J. 2 (2000) 145-146 Gillot, T.J.; Whallett, A.J.; Struthers, G. R.; Ilchyshyn, A.: Concurrent Sweet´s syndrome (acute neutrophilic dermatosis), erythema nodosum and sarcoidosis. Clin. Exper. Dermatol. 22 (1996) 54-56 Gonzalez-Gay, M.A; Garcia, Pourra, C.; Pujol, R. M.; Salvarani, C.: Erythema nodosum: a clinical approach. Clin. Exp. Rheumatol. 19 (2001) 365-368 Graffin, B.; Genty, I.; Crétel, E.; Jean, R.; Drancourt, M. ; Durand, J. M. : Erythème noueux au cours d´une maladie des griffes du chat. Presse Méd. 29 (2000) 1125 Grunewald, R. W.; Fiedler, G. M.; Stöckmann, F.; Schauer, A.; Müller, G. A.: Ungewöhnliche Diagnose bei rezidivierender Arthritis, Erythema nodosum und Herzrhythmusstörungen. Dtsch. Med. Wschr. 122 (1997) 1516-1520 Hassink, R. I.; Pasquinelli, C. E.; Jacomella, V.; Laux-End, R.; Bianchetti, M. G.: Conditions currently associated with erythema nodosum in Swiss children. Eur. J. Pediatr. 156 (1997) 851-853 Haustein, U. F.; Klug, H.: Ultrastrukturelle Untersuchung der Blutgefäße beim Erythema nodosum. Dermatol. Monatsschr. 163 (1977) 13-23 Hyland-McGuire, P.; Guly, H.: Erythema nodosum – diagnostic difficulties in the accident and emergency department. J. Accid. Emerg. Med. 13 (1996) 211-212 Inoue, T.; Katoh, N.; Kishimoto, S.: Erythema nodosum induced by the synergism of acupuncture therapy and flu-like infection. J. Dermatol. 32 (2005) 493-496 Kakourou, T.; Drosatou, P.; Psychou, F.; Aroni, K.; Nicolaidou, P.: Erythema nodosum in children: a prospective study. J. Am. Acad. Dermatol. 44 (2001) 17-21 Karunakara, B. P.; Maiya, P. P.; Mallikarjuna, H. B.: Childhood sarcoidosis presenting as recurrent erythema nodosum. Ind. J. Pediatr. 69 (2002) 829 Kirch, W.; Dührsen, U.: Erythema nodosum of dental origin. Clin. Investig. 70 (1992) 1073-1078 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. 46. 47. 48. 49. 50. 51. 52. 53. 54. 55. 56. 57. 58. 59. 60. 61. Kumar, S.; Witzig, T. E.; Rajkumar, S. V.: Thalidomid: current role in the treatment of non-plasma cell malignancies. J. Clin. Oncol. 22 (2004) 2477-2488 Labbé, L.; Perel, Y.; Maleville, J.; Taieb, A.: Erythema nodosum in children: a study of 27 patients. Pediatr. Dermatol. 13 (1996) 447-450 Lauhio, A.; Repo, H.; Nyberg, M.; Lähdevirta, J.: Erythema nodosum and conjunctivitis triggered by enteritis due to Salmonella typhimurium. Scand. J. Infect. Dis. 20 (1988) 221-223 Lentner, A.; Wrobel, K.; Frank, J.: Erythema nodosum als Primärmanifestation eines M. Behcet. Haut- u. Geschlechtskr. 70 (1995) 448 Lin, J.-T.; Chen, P.-M.; Huang, D.-F.; Kwang, W.-K.; Lo, K.; Wang, W.-S.: Erythema nodosum associated with carcinoid tumour. Clin. Exper. Dermatol. 29 (2004) 426-437 Llorens-Terol, J.; Martinez-Roig, A.: Erythema nodosum associated with infectious mononucleosis. Helv. Paediatr. Acta 38 (1983) 91-94 Longmore, H. J. A.: Toxoplasmosis and erythema nodosum. Br. Med. J. 1 (1977) 490 Louthrenoo, W.; Lertprasertsuke, N.; Kasitanon, N.; Sukitawut, W.: Erythema nodosum as a manifestation of HIV infection. Asian Pac. J. Allergy Immunol. 20 (2002) 175-178 Manckoundia, P.; Leveque, L.; Bonnotte, B.; Collet, E.; Lorcerie, B.: Infection à Mycobacterium avium intracellulare révélée par un érythème noueux. Presse Méd. 30 (2001) 1552 Mert, A.; Ozaras, R.; Tabak, F.; Ozturk, R.: Primary tuberculosis cases presenting with erythema nodosum. J. Dermatol. 31 (2004) 66-68 Mert, A.; Ozaras, R.; Tabak, F.; Pekmezci, S.; Demirkesen, C.; Ozturk, R.: Erythema nodosum: an experience of 10 years. Scand. J. Infect. Dis. 36 (2004) 424-427 Müller-Ladner, U.; Kaufmann, R.; Adler, G.; Scherbaum, W. A.: Rezidivierendes Erythema nodosum nach Einnahme eines niedrig dosierten oralen Kontrazeptivums. Med. Klin. 89 (1994) 100-102 Navarro, J. T.; Ribera, J. M.; Vaquero, M.; Tuset, E.; Junca, J.; Milla, F.; Feliu, E.: Erythema nodosum as a presenting feature of Tcell-rich B-cell lymphoma. Ann. Hematol. 780 (1995) 107-108 Orchard, T. R.; Chua, C. N.; Ahmad, T.; Cheng, H.; Welsh, K. I.; Jewell, D. P.: Uveitis and erythema nodosum in inflammatory bowel disease: clinical features and the role of HLA genes. Gastroenterology 123 (2002) 714-718 Peter, R.; Banyai, T.: Erythema nodosum revealing oculoglandular tularemia. Dermatology 202 (2001) 79-80 Picco, P.; Gattorno, M.; Vignola, S.; Barabino, A.; Marazzi, M. G.; Bondi, E.; Pistoia, V.; Buoncompagni, A.: Clinical and biological characteristics of immunopathological disease-related erythema nodosum in children. Scand. J. Rheumatol. 28 (1999) 27-32 Psychos, D. N.; Voulgari, P. V.; Skopouli, F. N.; Drosos, A. A.; Moutsopoulos, H. M.: Erythema nodosum: the underlying conditions. Clin. Rheumatol. 19 (2000) 212-216 Requena, L.; Requena, C.: Erythema nodosum. Dermatol. Online J. 8 (2002) 4 Ricci, R. M.; Deering, K. C.: Erythema nodosum caused by omeprazole. Cutis 57 (1996) 434 Ridder, G. J.; Boedeker, C. C.; Technau-Ihling, K.; Sander, A.: Catscratch disease: Otolaryngologic manifestations and management. Otolaryngol. Head & Neck. Surg. 132 (2005) 353-358 Sanders, C. J. G.; Hulsmann, R.-F. H. J.: Persistent erythema nodosum and asymptomatic Campylobacter infection. J. Am. Acad. Dermatol. 24 (1991) 285-286 Sarret, C.; Barbier, C.; Faucher, R.; Lacombe, P.; Meyer, M.; Labbé, A.: Erythema nodosum and adenopathy in a 15-year-old boy: uncommon signs of cat scratch disease. Arch. Pédiad. 12 (2005) 295-297 Siriwardena, A. K.: Erythema nodosum mimicking soft tissue sarcoma. Br. J. Clin. Pract. 44 (1990) 515-517 Späthling, S.; Herzer, P.; Zöllner, N.: Erythema nodosum. Internist 33 (1992) W11-W16 Steiger, U.; Weber, M.: Ungewöhnliche Ursache von Erythema nodosum, Pleuraerguss und reaktiver Arthritis: Giardia lamblia. Schweiz. Rundschr. Med. Prax. 91 (2002) 1091-1092 Stockmeger, M.: Erythema nodosum bei Sarkoidose Grad. 1. Praxis 89 (2000) 102-103 Szeimies, R. M.; Kaudewitz, P.; Braun-Falco, O.: Erythema nodosum und Non-Hodgkin-Lymphom. Hautarzt 43 (1992) 583-586 Tan, B. B.; Lear, J. T.; Smith, A. G.: Acne fulminans and erythema nodosum during isotretinoin therapy responding to dapsone. Clin. Exper. Dermatol. 22 (1997) 26-27 Teyssandier, R.; Guidet, B.; Pinta, P.; Offenstadt, G.: Pneumopathie MIKROBIOLOGE 16.Jg. 2006 127 à Mycoplasma pneumoniae avec anémie grave et érythème noueux. Presse Méd. 14 (1985) 1613 62. Ujiie, H.; Sawamura, D.; Yokota, K.; Tateishi, Y.; Inokuma, D.; Shimizu, H.: Intractable erythema nodosum associated with severe breast abscesses: reports of two cases. Clin. Exper. Dermatol. 30 (2005) 584-585 63. Vanbiervliet, G.; Anty, R.; Schneider, S.; Arab, K.; Rampal, P.; Hebuterne, X.: Traitement d´un syndrome de Sweet et d´un érythème noueux compliquant une maladie de Crohn par anti-TNFα (infliximab). Gastroenterol. Clin. Biol. 26 (2002) 295-297 64. Vazquez-Lopez, F.; Rippe, M. L.; Soler, T.; Rodriguez, A.; Arribas, J. M.; Perez-Oliva, N.: Erythema nodosum and acute Q fever : re- port of a case with granulomatous hepatitis and immunological abnormalities. Acta Derm. Venereol. 77 (1996) 73-74 65. Villirillo, A.; Balsano, L.; Quinti, S.; Ughi, C.; Ventura, A.; Maggiore, G.: Erythema nodosum associated with Salmonella enteritidis infection. Pediatr. Infect. Dis. J. 14 (1995) 919-920 66. Yamamoto, T.; Yokoyama, A.; Yamamoto, Y.; Mamada, A.: Erythema nodosum associated with Sjögren´s syndrome. Br. J. Rheumatol. 36 (1997) 707-708 67. Yang, S. G.; Han, K. H. ; Cho, K. H.; Lee, A.-Y.: Development of erythema nodosum in the course of oestrogen replacement therapy. Br. J. Dermatol. 137 (1997) 319-320 Korrespondenzadressen Priv.-Doz. Dr. med. Uwe Paasch Klinik für Dermatologie, Venerologie und Allergologie Universitätsklinikum Leipzig Philipp-Rosenthal-Str. 22-25, 04103 Leipzig Tel. 0341 – 9718600 e-mail [email protected] Prof. Dr. med. Pietro Nenoff Haut- und Laborarzt Laboratorium für medizinische Mikrobiologie Partnerschaft Dr. rer. nat. Jürgen Herrmann und Prof. Dr. med. Pietro Nenoff Straße des Friedens 8, 04579 Mölbis Tel.: 034347 – 50 323; Fax 034347 – 50 123 e-mail [email protected] www.mykologie-experten.de Prof. Dr. W. Handrick Institut für Medizinische Diagnostik Oderland Am Klaistpark 1 15230 Frankfurt (Oder) Tel. 0335 – 5581 148, Fax: 0335 – 5581 178 E-Mail : [email protected] BUCHBESPRECHUNG Infektionsschutz und Seuchenrecht Kommentar zum Infektionsschutzgesetz und Sammlung deutscher und internationaler Vorschriften (früherer Titel „Deutsche Seuchengesetze“ - Sammlung des gesamten Bundesseuchenrechts sowie Kommentar zum BundesSeuchengesetz und Sammlung des all gemeinen Gesundheitsrechts in Bund und Ländern) Begründet von F. Etmer und P.V. Lundt (†), fortgeführt von P.V. Lundt(†) und P. Schiwy. Loseblattsammlung in 4 Ordnern. 224. Ergänzungslieferung; ca. 300 Seiten; Stand: 01. Mai 2005. Starnberg: R.S. Schulz, 2005. ISBN 3-7962-0312-4. Euro 105,00. 225. Ergänzungslieferung; ca. 270 Seiten; Stand: 01. Juni 2005. Starnberg: R.S. Schulz, 2005. ISBN 3-7962-0312-4. Euro 95,00. Die Lieferungen 224 und 225 enthalten wenig Spannendes, u.a.: Rückstandshöchstmengen-Verordnung (Änderung zuletzt vom 27.04.05) [224] Binnenmarkt-Tierseuchenschutzverordnung (vom 06.04.05) [224] Lebensmittel-Einfuhr-Verordnung (vom 08.12.05) [224] In der Geflügelfleischhygiene-Verordnung (Änderung vom 09.11.04) [224] wurde die Verpflichtung ergänzt, Rückstellproben anzufertigen und diese sowie „Isolate von Krankheitserregern“ „während eines von der zuständigen Behörde festzusetzenden Zeitraums, jedoch nicht länger als zwölf Monate, aufzubewahren.“ (§14 Abs. 4). In Anlage 1, Kapitel II wurde u.a. der Begriff der auf Mensch oder Tier übertragbaren Krankheit durch „insbesondere Campy- 128 MIKROBIOLOGE 16.Jg. 2006 Dr. med. Claudia Mügge Carl-von-Basedow-Klinikum Merseburg Medizinische Klinik II Weiße Mauer 52, 06274 Merseburg Tel. 03461 – 272202 e-mail [email protected] Dr. med. Frank Berthold Institut für Medizinische Diagnostik Oderland Am Kleistpark 1, 15230 Frankfurt (Oder) Tel.: 0335 – 55 81 121, Fax: 0335 – 55 81 178 E-mail [email protected] lobacteriose, Listeriose und Salmonellose“ präzisiert. In Anlage 1, Kapitel IV wurde der Umfang der Laboruntersuchungen auf Krankheitserreger (Stichproben, Poolproben) präzisiert. Ergänzt wurden in den Approbationsordnungen für Apotheker, für Ärzte und Zahnärzte, den Prüfungsordnungen für Hebammen, Psychotherapeuten und Kinderpsychotherapeuten sowie für Berufe in der Krankenpflege, außerdem für pharmazeutischtechnische Assistenten (Änderungen vom 23.03.05) [225] jeweils unter „Meldung zur Prüfung“ der Satz: „Die besonderen Belange behinderter Prüflinge sind zur Wahrung ihrer Chancengleichheit bei Durchführung der Prüfungen zu berücksichtigen.“ Im Arzneimittelgesetz (Änderung vom 15.04.05) [225] wurde u.a. hinsichtlich der ab 1.9.06 erforderlichen Kennzeichnung in Blindenschrift ein wenig zurückgerudert (gilt z.B. nicht mehr für Arzneimittel, die dazu bestimmt sind, ausschließlich durch Angehörige der Heilberufe angewendet zu werden). In der Lebensmittelkenzeichnungsverordnung (Änderung vom 18.05.05) [225] wurde mit § 9a eine Kennzeichungspflicht für Süßwaren und Getränke, die Glycyrrhizinsäure oder deren Ammoniumsalz enthalten, eingeführt. Die Diätverordnung wurde mit Stand 28.04.05 [225] neu gefasst. Im Landesrecht sind u.a. enthalten: Bremen: Heilberufsgesetz (vom 15.04.05) [225] Hamburg: Abfallwirtschaftsgesetz und AbfallausschlussVerordnung (vom 21.03.05) [224] Thüringen: Tierseuchengesetz (Änderung vom 22.03.05) [224]. E. Kniehl, Karlsruhe ÜBERSICHT Chlamydien – eine heimliche Epidemie unter Jugendlichen? Christine Klapp +*, Gisela Gille * + Klinik für Geburtsmedizin, Charité Virchow Klinikum, Berlin * Ärztliche Gesellschaft zur Gesundheitsförderung der Frau , ÄGGF e.V. Einleitung Die seit vielen Jahren früh beginnende Pubertät hat vielfältige körperliche, psychosexuelle und psychosoziale Aus- und Nebenwirkungen. Hatten junge Mädchen zum Ende des 19.Jahrhunderts im Durchschnitt mit 16 Jahren ihre erste Regel, so liegt dieser Zeitpunkt heute bei 12,3 Jahren im Mittel, aber auch eine Menarche bei einer 9 jährigen gilt als „frühnormal“ und gäbe primär keinen Anlass zur Sorge. Allerdings erlebt ein Drittel aller Mädchen die Menarche schon vor dem 11. Lebensjahr, und diese stellt ja nicht den Beginn, sondern den Abschluss einer etwa vier Jahre dauernden körperlichen Veränderung dar. Somit sind die beeindruckendsten körperlichen Veränderungen für die Hälfte der Mädchen zwischen 9 und 12 Jahren abgeschlossen (Neises 2000), und geschlechtspezifische Trieb- impulse und sexuelle Bedürfnisse werden damit auch immer früher wach. Die somit früh einsetzende Wirkung der Sexualhormone bleibt nicht ohne Folgen: Immer früher gehen Jugendliche sexuelle Beziehungen ein. Die Wiederholungsbefragung von 14 – 17-jährigen durch die Bundeszentrale für gesundheitliche Aufklärung 2001 (BzGA) spiegelt den Trend der letzten Jahre (siehe Abbildung 1) Jede(r) dritte Jugendliche im Alter zwischen 14 und 16 Jahren hat Geschlechtsverkehr gehabt. Der Anteil koituserfahrener Jugendlicher ist seit Anfang der 80-er Jahre bei den Jungen generell und bei den Mädchen vor allem in den jüngeren Jahrgängen kontinuierlich gestiegen (BzgA 2001). Koituserfahrung Anteile in den einzelnen Altersgruppen Angaben in % 70 66 61 60 50 40 40 37 30 25 20 18 11 10 8 0 14 Jahre 15 Jahre 16 Jahre Jungen 17 Jahre Mädchen Abb. 1: Koituserfahrung von Jugendlichen nach Altersgruppen Quelle: BzGA 2001 MIKROBIOLOGE 16.Jg. 2006 129 Die Zahl der Schwangerschaften, vor allem der Schwangerschaftsabbrüche bei den unter 15 Jährigen steigt seit Jahren an, und die Gefahr der Ansteckung mit sexuell übertragbaren Krankheiten verschiedenster Art nimmt zu. Dieses Phänomen wirkt auf den ersten Blick unerklärlich, scheint doch noch keine andere Generation so aufgeklärt, hat schier unbegrenzten Zugang zu Informationen und Verhütungsmitteln, und die Pille gibt es für junge Mädchen seit einigen Jahren kostenlos. Verständlich wird dies, wenn man weiß, dass ein großer Teil der Jugendlichen nur sehr unklare Vorstellungen über Körperfunktionen, speziell im Genitalbereich hat. Informationen und Vorstellungen, magisches Denken und Befürchtungen sind eng miteinander verknüpft, so dass auch Informationen zur Verhütung nicht in den richtigen Kontext gebracht werden können und das subjektiv Wichtige und Richtige bei all der Informationsflut auch nicht herausgefiltert werden kann. Wir fanden in einer Studie mit knapp 2000 Jugendlichen u.a., dass die Selbsteinschätzung von eigenem Wissens fälschlich ausgesprochen hoch ist und daher meist auch nicht die entsprechenden Fragen gestellt werden können. • häufiger früh schwanger (Statistisches Bundesamt 2004) und • erwerben zunehmend mehr sexuell übertragbare Infektionen und Krankheiten (Keck, Clad 2004, Gille et al. 2005, Klapp et al. 2005). Diese Tatsachen, kombiniert mit der Erfahrung, dass Kinderwunsch und die Möglichkeit dessen Unerfüllbarkeit Themen sind, die die Jugendlichen emotional mehr bewegen als AIDS und ungewollte Gravidität, und das Faktum, dass es keinerlei belastbare Zahlen bislang dazu gibt, hat uns dazu bewogen, im Frühjahr/Sommer 2004 eine erste Prävalenzbeobachtung zu Chlamydieninfektionen bei minderjährigen Mädchen in Berlin zu starten. Urogenitale Chlamydien-Infektion – warum sind gerade die Jungen betroffen? Viele wissen nicht, dass sie bereits ab der ersten Regel schwanger werden können, weniger als ein Fünftel weiß, wann im Zyklus das Konzeptionsoptimum besteht, und knapp 90% haben noch nie von der häufigsten sexuell übertragbaren Infektion – Chlamydien - und ihren Folgen (BzGA 2001, Klapp 2002, Gille et al.2004) gehört, schätzen aber ihr Wissen zu sexuell übertragbaren Krankheiten fälschlich hoch ein (s.Abb.2). Chlamydia trachomatis (CT) ist in Europa und USA das häufigste sexuell übertragene Bakterium mit einer wachsenden Zahl Infizierter, gilt als Hauptverursacher infektionsbedingter Sterilität und ist in Deutschland nicht (mehr) meldepflichtig. Der weitaus größte Teil der Infizierten rekrutiert sich aus Mädchen und sehr jungen Frauen, da Chlamydien bevorzugt an Oberflächen mit zylindrischem Schleimhautepithel adhärieren, das im Genitaltrakt insbesondere junger Mädchen reichlich vorzufinden ist. Nach Weström 1993 hat Jugendlichkeit per se als Risikofaktor für eine CT – Infektion zu gelten, weil aufgrund der Östrogendominanz in den ersten fertilen Jahren einer jungen Frau neben einer ausgeprägten Portioektopie der Zervikalkanal für Mikroorganismen leicht passierbar ist, die Reifung der lokalen Immunabwehr im Genitaltrakt zunächst noch unvollständig ist und bei rauchenden Mädchen ohnehin vermindert ist. Zudem kann die Suszeptibilität für CT unter hormoneller Kontrazeption erhöht sein, die Prävalenz kann auf das 8 – fache steigen Selbsteinschätzung der Kenntnisse über STD‘s ( Frage an Mädchen 9./10. Klassen Gymnasium ) Die meisten Mädchen haben beim „1. Mal “ einen älteren Partner, auch dadurch erhöht sich die Wahrscheinlichkeit einer CT – Infektion. Hinzu kommt die Einschätzung, dass sehr viel mehr Jugendliche sexuelle Erfahrung hätten, als es der Realität entspricht (vermutet: Bei 16 Jährigen bis zu 80%; real: 40%), und dann entsteht schnell die Befürchtung, den Anschluss zu verlieren („alle, außer mir haben schon Erfahrung...“). 22,3 % 77,7 % "fühle mich sehr gut/gut/befriedigend informiert" "fühle mich nicht ausreichend informiert" Abb.2: Selbsteinschätzung der Kenntnisse zu STD´s bei 14-16jährigen Mädchen (Gymnasium) Die Situation der Jugendlichen, stellt sich folgendermaßen dar, sie: • experimentieren früh mit sexuellen Beziehungen (BzGA 2001), wissen aber trotz mannigfaltiger Informationsmöglichkeiten wenig (Gille2002, Klapp 2005), • verhüten nicht sicher, obwohl sie fast unbegrenztem Zugang zu Verhütungsmitteln haben, werden in der Konsequenz 130 MIKROBIOLOGE 16.Jg. 2006 Die Einschätzung, dass es normal sei, früh Geschlechtsverkehr zu haben, gepaart mit Überschätzung des eigenen Wissens bei realen Informationsdefiziten, ergibt eine besonders brisante Mischung hinsichtlich des Risikos von ungewollter Schwangerschaft und Infektion (STD) für Minderjährige. Eine signifikante Abhängigkeit der Prävalenz von Chlamydia trachomatis vom Alter der Frau wurde schon 1997 von Koch et al. nachgewiesen, die für ledige Frauen im Alter von 20 – 24 Jahren eine Prävalenz von 8% und für die von 35 – 39 Jahren eine Prävalenz von 2, 5% gefunden haben. Problem: Für Deutschland liegen keine harten epidemiologischen Daten vor, die Meldepflicht wurde abgeschafft, die Prävalenzen in der Literatur beziehen sich auf einzelne Studien oder auf Erhebungen im Ausland. Bis die symptomarme Chlamydieninfektion klinisch relevant wird, vergehen allerdings in der Regel viele Jahre, und sie wird meistens erst dann bemerkt, wenn der Kinderwunsch in den Vordergrund tritt: Jede 4. – 5- Frau mit einer genitalen Chlamydieninfektion ist von einer nachfolgenden Sterilität betroffen. 7% aller jungen Paare sind in Deutschland unfreiwillig steril, was zu 30 – 50% seine Ursache in einer viele Jahre zurückliegenden Chlamydieninfektion hat. Bereits heute können geschätzte 100. 000 Frauen in Deutschland aufgrund einer abgelaufenen Chlamydieninfektion auf natürlichem Wege keine Kinder mehr bekommen (Keck und Clad 2004) Chlamydien sind obligat intrazellulär lebende Bakterien mit jahrelanger häufig asymptomatischer Persistenz, ca.70- 90% der Infizierten ahnen nichts von der Infektion und haben auch noch nie etwas von Chlamydien gehört. So ist diese Infektion eine unbekannte Krankheit in dreierlei Sinn: ▪ ▪ ▪ Unbekannt als Krankheit Unbekannt für den Infizierten aufgrund der Symptomarmut Unbekannt hinsichtlich epidemiologischer Daten. Infektion mit Chlamydia trachomatis Serotypen D-K, kurze Zusammenfassung Übertragung Sexuell , seltener durch Schmierinfektion (Konjunktivitis) Inkubationszeit:1-3 Wochen Symptomatik Frau – wenn vorhanden (10-25%) Urethritis- Zervizitis (gelblich-klebriger Fluor)- Endometritis (Zwischen- und Kontaktblutungen)- Salpingitis (starker Schmerz) – Infertilität/Extrauteringravidität, post partum:Endometritis, Salpingitis Mann Urethritis - Epidiymitis – Prostatitis (Schmerzen im Damm, Hoden, nach Orgasmus, Beeinträchtigung der Fertilität) Mann und Frau Konjunktivitis, Perihepatitis, Proktitis (Pruritus, Brennen, Tenesmen), M. Reiter, postgonorrhoische Urethritis/Zervizitis, Arthritis Fetus/Neugeborenes Vorzeitiger Blasensprung, Vorzeitige Wehen, Frühgeburt, postpartal: Konjunktivitis 40%, Pneumonie 20% (Petersen 2003) Cave: Chlamydien und Lues fördern HIV-Infektion! Diagnostik Als klassischer „Goldstandard“ der Chlamydiendiagnostik galt lange Zeit die Anzucht in der Zellkultur, welche aber wegen ihrer mäßigen Sensitivität und ihres erheblichen technischen und logistischen Aufwands für die tägliche Praxis wenig geeignet ist. Der direkte Erregernachweis durch Immunfluoreszenz oder ELISA wird seit einigen Jahren zunehmend durch die Nukleinsäure – Amplifikationstechniken (z. B. PCR, LCR) abgelöst, welche aufgrund ihrer hohen Sensitivität (ca. 90%) und Spezifität ( ca. 98%) als neuer „Goldstandard“ gelten. Bei chronischen Infektionen allerdings spielt die Serologie (z.B. laparaskopisch gewonnenes Sekret) und Anzucht noch eine bedeutende Rolle. Sehr wichtig ist, auch immer an Kombination mit anderen STD/STI zu denken, so ist z.B. bei 30% eine Gonorrhoe als Begleitinfektion zu erwarten und deshalb sollten „die üblichen Verdächtigen“ mit kontrolliert werden. Bei positivem Chlamydienbefund: GO, Herpes simplex, Lues, Hepatitis B, HIV und dies auch beim Partner abklären Prophylaxe: Sexuelle Treue, Kondome Therapie der frischen CT – Infektion Doxycyclin 100 mg 2 x täglich über 10 Tage Azithromycin 1000 mg als Einmalgabe (teurer, aber bessere Compliance) In der Schwangerschaft: Erythromycin Bei Endometritis/Salpingitis Kombination: Gentamicin-Clindamycin (1x240 mg bzw.4x600mg) oder Ofloxacin-Metronidazol (2x 200 bzw. 2x500mg) Bei der chronischen CT-Infektion: Behandlung mit Doxycyclin, aber über mind.3 Wochen bis Monate (reakt. Arthritis) Immer ist der Partner in die Therapie einzubeziehen. (Petersen 2003) Fragestellung Uns interessierte dabei vor allem • die Prävalenz von CT bei (normalen)14-17jährigen Mädchen (keine „Risiko-Klientel“) • der Kenntnisstand zu CT-Infektion (Bedeutung, Ursachen, Folgen, Prävention) • das Sexual- und Verhütungsverhalten (beim 1.Mal, vor ½ Jahr, beim letzten Mal) und die jeweiligen Korrelationen Setting/Methodik Die Berliner Ärztinnen der Ärztlichen Gesellschaft zur Gesundheitsförderung der Frau e. V. (ÄGGF) haben im Jahr 2004 über einen Zeitraum von 5 Monaten Aufklärungsveranstaltungen in 92 Berliner Schulen durchgeführt Sowohl dort, wie parallel dazu in 30 gynäkologischen Praxen in Berlin wurde jungen Mädchen zwischen 14 und 21 Jahren mit ungeschütztem Geschlechtsverkehr in der Anamnese (n = 521) ein kostenloser PCR – Test auf Chlamydien angeboten. Außerdem wurden die Teilnehmerinnen gebeten, einen anonymisierten Fragebogen über Sexualverhalten, Gründe für den Arztbesuch, mögliche Symptomatik und ihr früheres sowie aktuelles Verhütungsverhalten auszufüllen (Gille, Klapp, Diedrich et al 2005). Ausschlusskriterien waren Alter unter 14 Jahren, Virginität und mangelnde deutsche Sprachkenntnisse. Die schulische Intervention wurde mit der Senatsschulverwaltung Berlin abgesprochen, die Prävalenzbeobachtung wurde mit dem zuständigen Datenschutzbeauftragten abgestimmt. Insgesamt liegen n = 521 Abstriche und Fragebögen vor, für die Altersgruppe der hier vorgestellten minderjährigen Mädchen n = 266. MIKROBIOLOGE 16.Jg. 2006 131 Ergebnisse Die Prävalenz von Chlamydia trachomatis Infektionen bei minderjährigen Mädchen in Berlin ist überraschend hoch, vor allem wenn man bedenkt, dass hier eine ganz normale Klientel untersucht wurde, die größtenteils nur zur Routine-Untersuchung, Pillenverordnung oder wegen des PCRTest-Angebots etc. zum Frauenarzt ging und auch der Untersuchungszeitraum selbst (1.Halbjahr) außerhalb des jahreszeitlichen Gipfels sog. „Urlaubs-Chlamydien“ lag . Es lagen n=266 und ausgefüllte Fragebögen von Mädchen unter 18 Jahren vor. Abb 4 : CT-Prävalenz nach Schulart (n=266), (Test: Cobas –Amplicor) Die Mädchen unserer Stichprobe hatten zu etwa 75% keine entsprechende Symptomatik. Ähnliches wird bei Screening-Untersuchungen in der Literatur berichtet. Über 83% haben vor unserer Information noch nie etwas von Chlamydien gehört und 87% sind die möglichen gesundheitlichen und reproduktionsbehindernden Folgen unbekannt. Abb. 3.: CT-Prävalenz insgesamt (altersgewichtet) (n=266) 14-17j.Mädchen (Test: Cobas-Amplicor) Verhütung - ungenügend Die Gesamtprävalenz bei minderjährigen Mädchen betrug 5,4%, bei den 17 jährigen schon 10%. Lag sie bei einem Partner um 3%, so stieg sie bei 2-4 Partnern auf 6% und bei 10 und mehr Partnern auf 19%. In allen Alters-Gruppen wird von ca. 65% das Kondom als das Mittel der Wahl beim ersten Geschlechtsverkehr angegeben, doch diese verwenden es offensichtlich primär zur Kontrazeption. Im Lauf der Zeit wird es zunehmend durch die Pille abgelöst, so dass beim letzten Verkehr nur noch etwa 22% ein Kondom verwendet haben, insgesamt nur 18,4% bei jedem Geschlechtsverkehr. Mädchen mit Hauptschulabschluss oder ohne Schulabschluss wiesen zu 9%, Realschülerinnen zu 4,1% und Gymnasiastinnen zu 6,2% Infektionen auf. Das bedeutet nun aber, dass über 80% der Mädchen ohne Schutz vor STD/STI in mehr oder weniger wechselnden sexuellen Beziehungen stehen. Diese Durchschnittswerte wurden bei einer mittleren Expositionszeit (seit 1.GV) von gerade mal 19 Monaten erreicht. Ein Viertel verwendete bislang noch nie ein Kondom und über die Hälfte nur unregelmäßig. Diese stieg je nach Anzahl der Sexualpartner und (geringerer) Schulbildung weiter an. Da der Anteil von Hauptschülerinnen mit 5 und mehr Partnern fast doppelt so hoch war, wie bei Gymnasiastinnen, lässt sich die Prävalenz bei Kombination von hoher Partnerzahl, schlechter Schulbildung und frühem „Einstieg“ ins Sexualleben (somit langer Expositionszeit) noch entsprechend steigern. Wenn man nun in Rechnung stellt, dass bei den jüngeren Untersuchten schon 17,2% ihren ersten Geschlechtsverkehr bis zum Alter von 13 Jahren hatten, dies bei den 17/18 jährigen knapp 16% und bei den Ältesten (bis 21 J.) nur 3,4% waren, kann hier in den nächsten Jahren durchaus noch ein Anstieg erwartet werden. 132 MIKROBIOLOGE 16.Jg. 2006 Zur Infektion und weiteren Verbreitung trägt dann auch noch das unzureichende Verhütungsverhalten bei. Mädchen mit geringer Schulbildung haben auch hier eine fatale Spitzenposition bei unzureichender Verhütung inne. Interessanterweise ist das Image von Kondomen nicht mehrheitlich negativ – dies hat wohl auch die entsprechende Öffentlichkeitsarbeit der BzGA mit bewirkt, doch offensichtlich führt dies nicht zum gewünschten Erfolg von regelmäßiger Anwendung. Womöglich spielt die Assoziation von Kondomen mit HIV-Infektion und AIDS, die auch zahlenmäßig mit der Lebenswirklichkeit von Jugendlichen relativ wenig zu tun hat, eine wichtige negative Rolle, berührt dies doch die Lebensplanung nur am Rande. Abb.5: Häufigkeit von Kondomverwendung nach Alter (n=266) Diese Ergebnisse sind hinsichtlich der generativen Gesundheit der nachwachsenden Generation von hoher präventiver Bedeutung und werden für die minderjährigen Mädchen (n = 266) vorgestellt und vor dem Hintergrund soziokultureller Daten reflektiert. Dabei erscheint uns als besondere Herausforderung, dass es sich hier um eine STI handelt, die gut und sicher zu diagnostizieren ist, es existieren einfache und bekannte Möglichkeiten der Prävention, evaluierte Aufklärungskonzepte und es gibt auch therapeutisch bewährte, preiswerte Medikamente – man müsste nur wissen, wer infiziert ist ! In Deutschland verfügen wir allerdings über keinerlei offizielle Zahlen, laut Infektionsschutzgesetz besteht seit 1. Januar 2001 nur noch für HIV und Syphilis eine Laborberichtspflicht an das Robert Koch-Institut (RKI) in Berlin. Das RKI hat dennoch die Ärzteschaft bei der epidemiologischen Erfassung nicht meldepflichtiger STD’s um Mithilfe aufgerufen, im Januar 2004 wurde die erste Auswertung veröffentlicht: Von 1400 erfassten STD’s stand die Chlamydieninfektion an 1. Stelle (Epidemiologisches Bulletin 2004) und die Dunkelziffer wird aufgrund der gravierenden Untererfassung auf das Zehnfache geschätzt. sollten ihren eigenen individuellen Körper und seine faszinierenden Funktionen verstehen lernen und dieses Wissen in ihrem Alltag praktisch umsetzen können. Hierbei brauchen sie zunächst die Unterstützung der Eltern, aber zunehmend in der Entwicklung die von beratungskompetenten, verschwiegenen Ärzten. Als eine Art Verstärker wirkt das immer mit Begeisterung angenommene Thema „Fruchtbarkeit“ als positiver Wert, sie als Potenz erkennen und für schützenswert erachten (Klapp 2005, Klapp et al 2005). Im Rahmen aufsuchender, entwicklungsbegleitender gynäkologischer Gesundheitsförderung und Prävention gehen wir mit unserer Arbeitsgruppe von derzeit 8 Ärztinnen seit vielen Jahren in Berliner Schulen. Schon seit mehr als 15 Jahren arbeiten wir eng mit der Ärztekammer Berlin und der Senats-Schulverwaltung zusammen. Wir sind hier als Teil der gemeinnützigen ÄGGF e.V. tätig, die bundesweit pro Jahr ca. 70.000 Jugendliche, hauptsächlich Mädchen und junge Frauen erreicht (siehe auch www.aeggf.de). Ärztliche Aufklärung – aber wie? In Berlin sehen wir - mit steigender Tendenz - derzeit etwa 6.000 – 8.000 Heranwachsende im 2. Lebensjahrzehnt zu Anfang der Pubertät (5./6.Klassenstufe) und zu Beginn mehrheitlich erster eigener Erfahrungen mit Sexualität (8.-10.Klassenstufe), die von sich aus mit ihren vielen Fragen und Unsicherheiten nicht in einer ärztlichen Praxis landen würden. Verhütungsaufklärung im Sinn von Angstmache erreicht gerade bei Jugendlichen wenig. Es gilt, Wissensdefizite und Fehlinformationen behutsam aufzuspüren, durch kompetente, praxisnahe, einfühlsame und emotional positiv besetzte Information zu ersetzen. Junge Menschen Schüler, Eltern und Pädagogen schätzen unsere 2002 vom Robert Koch Institut Berlin evaluierte Kompetenz, wenn wir begleitend und ergänzend zum schulischen Sexualkundeunterricht unsere 90 minütige Einheit „ArztStunde“ anbieten (Gille 2002, Layer et al.2004). Noch besser als Screening und Behandlung sind Aufklärung und Screening. MIKROBIOLOGE 16.Jg. 2006 133 Fazit aus jedem Unterrichtsbesuch: Jugendliche haben eine brisante Mischung aus Neugier, Halbwissen und Lust am Risiko, andererseits aber eine große Bereitschaft etwas über sich und ihren Körper erfahren zu wollen, wenn es neutral aber empathisch, kompetent und verschwiegen angeboten wird. Das Thema Sexualität brennt den Jugendlichen unter den Nägeln - doch Eltern und Lehrer sind ab einem bestimmten Alter der Heranwachsenden manchmal zu nah und vertraut, manchmal zu sehr in der Rolle des Erziehenden und Bewertenden und damit nicht mehr primäre Ansprechpartner, so ziehen sie sich und ihren Intimbereich vor jenen zunehmend zurück. Eltern glauben oft, ihre Kinder wüssten über Sexualität und Verhütung mehr und besser Bescheid als sie selbst, überlassen es der Schule, dem Medienangebot oder dem Zufall, ob ihr Kind damit zurecht kommt und kümmern sich selbst wenig um Aufklärung und Grenzsetzung. Bei unseren Veranstaltungen mit Jugendlichen sehen wir diese oft überflutet von Information unterschiedlicher Qualität, die sich aber nicht von allein ordnet und in anwendbares Wissen umsetzen lässt. So benötigen Mädchen (und Jungen mit Sicherheit in ähnlicher Weise) umfassende Kenntnisse über • • • Den eigenen Körper und seine Äußerungen Die Variabilität der Norm Die zyklischen Abläufe im Mädchenkörper und die Menstruation • Tipps und Tricks im Umgang mit der Menstruationshygiene • Den Zusammenhang zwischen dem, was sie selber an sich beobachten können und der Fruchtbarkeit • Das Wachsen und Werden eines Kindes im Mutterleib als positive Dimension weiblicher Identität • Schwangerschaft • Kontrazeption • Sexuell übertragbare Krankheiten, Infektionen und Impfungen (Gille 2004) Schlussfolgerungen/Forderungen Auch wenn unsere Studie nicht repräsentativ ist, so weist sie doch auf einen Anstieg von Infektionen und in der Konsequenz damit auch Krankheiten und deren Spätfolgen, wie sie aus anderen westlichen Ländern berichtet werden. Wenn in den Niederlanden und in Schweden die Prävalenz innerhalb von wenigen Jahren um über 60% gestiegen ist, sollten wir uns in Deutschland Gedanken machen (Epidemiologisches Bulletin 2003). Können wir verantworten, dass Jugendliche einen so hohen Preis für die von uns erkämpfte Liberalisierung der Sexualität bezahlen? In anderen Ländern gibt es längst (wieder) eine Meldepflicht für Chlamydien (Schweden), Screeningangebote Wissenszuwachs von T1 nach T3 bei ausgewählten Fragen zu „Infektionskrankheiten/ Impfen“ Vor der Ärztinnen- 2 Wochen nach der Informationsstunde -Ärztinnen Informationsstunde Verbesserung 6. Klasse Ansteckung mit Hepatitis B durch Speichel möglich? 9./10. Klasse Werden Chlamydien durch sexuellen Kontakt übertragen? 9./10. Klasse 0% 20% 40% 60% 80% 100% 0% richtig 20% 40% 60% 80% 100% falsch 0% weiß nicht Abb.6: Teil der Evaluation der ÄGGF-Arbeit in Schulen durch das Robert-Koch-Institut Berlin 2002 134 MIKROBIOLOGE 16.Jg. 2006 20% 40% 60% 80% 100% %-Punkt-Differenz (USA), breit angelegte Aufklärung (Niederlande) – hier in Deutschland beginnt sich langsam ein vorsichtiges Bewusstwerden der Situation abzuzeichnen, von konkreten unerlässlichen Fragen und Maßnahmen sind wir noch weit entfernt 4. 5. Diese sollten sein: • • Gewinnung bundesweiter verlässlicher Daten Aufklärung der Bevölkerung (evaluierte ärztliche Aufklärung für Schulen durch ÄGGF e.V. und individuell in der Praxis –Allgemeinmedizin, Pädiatrie, Urologie, Gynäkologie) • Aufklärungsartikel, Beiträge, Filme in den Massenmedien • Screening-Angebote für noch zu definierende Risikogruppen • Screening-Angebote für sexuell aktive Jugendliche (z.B. anlässlich Verhütungsberatung in der Praxis) • Aufnahme von STD/STI in den Themenkatalog des Präventionsgesetzes Unsere Arbeit in Schulen hat nachgewiesen: Empathische ärztliche Aufklärung ist einfach und wirkungsvoll: Sie erreicht die Jugendlichen, kommt in den Köpfen an, wird verstanden, emotional positiv besetzt, akzeptiert, und über einen längeren Zeitraum gemerkt – und dies ist die Basis für jegliche mögliche Verhaltensänderung. Wo immer Ärzte mit Jugendlichen in Berührung kommen, sollte diese Chance genutzt werden – nicht nur zur Prävention von Chlamydieninfektionen. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. me sexuell übertragbarer Infektionen in den Niederlanden. 2003; Nr. 40; 325 Gille G: „Weil ich ein Mädchen bin ...“ Mädchensprechstunde: Wird die Frauenheilkunde ihrem präventiven Auftrag gerecht? Gynäkologe 2004; 621-629 Gille G ÄGGF – RKI-Studie bestätigt Erfolg der „ÄrztinnenInformationsstunde“. Jahresbericht 2000, Frauenarzt 43 (8), p 966967, 2002 Gille G, Klapp C, Diedrichs K, Schäfer A, Moter A, Griesinger G, Kirschner R: Chlamydien - eine heimliche Epidemie unter Jugendlichen? Prävalenzbeobachtung bei jungen Mädchen in Berlin. DÄB 2005 Keck C, Clad A: Infektionen in der Reproduktionsmedizin. Gynäkologe 2004; 37; 607 – 617 Klapp C: Der ärztliche Blick auf die Prävention in der Sexualität junger Mädchen. Psychomed 6, 2005 Klapp C. Gille G, Diedrich K, Schäfer A, Moter A: Mit 14 schwanger - mit 20 steril Chlamydieninfektion bei Teenagern in Berlin erste Ergebnisse einer Prävalenzstudie. Berliner Ärzte 9, 2005 Koch J, Kirschner W, Schäfer A: Bestimmung der Prävalenz genitaler HPV – und Chlamydia-trachomatis-Infektionen in einem repräsentativen Querschnitt der weiblichen Normalbevölkerung in Berlin. Infektionsepidemiologische Forschung II / 1997; 1-7 Layer C, Gille G, Klapp C, Ravens-Sieberer U Prävention der Hepatitis B bei Jugendlichen. Effekt einer Arztstunde in der Schule. Medizinische Klinik, p 703-707 (12) 2004 Neises M Die sehr junge Patientin. In: Psychosomatische Grundversorgung in der Frauenheilkunde. Hrg: Neises M, Ditz S, Thieme 2000 Paavoonen J, W Eggert -Kruse: Chlamydia trachomatis : An impact on human reproduction. Human Reproduction Update 1999; Vol.5; No.5; 433 – 447 Petersen E E: Infektionen in Gynäkologie und Geburtshilfe. Thieme 2003 Weström L: Ist die Pubertät an sich ein Risiko für sexuell übertragbare Erkrankungen? Korasion April 1993; 14 –15 Korrespondenzadresse: Literatur: 1. 2. 3. Bundeszentrale für gesundheitliche Aufklärung (BzgA) 2001 : Jugendsexualität Wiederholungsbefragung von 14-17-Jährigen und ihren Eltern; 48 Epidemiologisches Bulletin des Robert Koch–Instituts: Das STD – Sentinel des RKI – erste Ergebnisse. 2004; Nr. 1; 3 Epidemiologisches Bulletin des Robert Koch–Instituts: Zur Zunah- OÄ Dr. med. Christine Klapp Klinik für Geburtsmedizin Charité Virchow Klinikum 13353 Berlin Tel.030 450 664 067 E-Mail: [email protected] BUCHBESPRECHUNG Public Health Microbiology Methods and Protocols Herausgegeben von John F. Spencer und Alicia L. Ragout de Spencer. 568 Seiten, zahlreiche Abbildungen und Tabellen, gebunden. Erschienen in John M. Walker (Serienherausgeber): „Methods in Molecular Biology“, Vol. 268. Humana Press, Totowa, USA, 2004. ISBN 1-588-29-117-0, E-ISBN 1-59259766-1, ISSN 1064-3745. USD 125. „The world abounds with microorganisms that are hazardous to human health in the normal course of life“. Mit diesem Zitat beginnt der Kommentartext auf dem hinteren Einbanddeckel des hier besprochenen Buches. Man kann es so formulieren; aber kann man es wirklich so formulieren? Der Rezensent als Mediziner und Philosoph bekennt sich hier gerne zu einem klaren „Nein“. Das Leben per se, ante se und inter se ist a priori gefährlich. Was soll eine so reißerische Aussage über die „bugs“ und damit Verpönung der Mikroorganismen, betrachten wir doch die Allgemeinheit der uns a priori ersichtlichen Gefahren für unser Leben als Bezugskoordinaten! Nun zum Buch an sich. Die Thematik „Public Health Microbiology“ gewinnt insbesondere in der heutigen Zeit vor den Situationen bezüglich zum Beispiel Lebensmitteln / Fleisch- und Milchprodukte, Umwelt- und Verbraucherschutz zunehmendst an Bedeutung und selbstverständlich auch an politischem und medienwirksamen Interesse und inadäquater Polemik. Es ist ein echter publikumswirksamer öffentlicher Selbstläufer, auch für Onkel Otto und Lieschen Müller beim Bierchen und Chips hinterm Fernseher. Im Vorwort zu diesem Buch finden wir lediglich eine Reflektion des Gesamtinhaltes. Eine erforderliche Reflektion von „Public Health Microbiology“ und des Gesamtkontextes der Thematik sowie bezüglich Beweggründen zu diesem Buch wird jedoch nicht gegeben. Damit wird nicht die Gesamtthematik erörtert und eine Synopse der Grundlage dieser Thematik gegeben, was der Ansicht des Rezensenten nach unbedingt von Nöten gewesen wäre, und wozu ein Editor im allgemeinen auch befähigt ist. Das Buch ist in 8 Hauptteile aufgeteilt - mit 52 „überfrachtenden“ Einzelbeiträgen - die sich im Folgenden zur Information des potentiellen Leserkreises aufgelistet finden: MIKROBIOLOGE 16.Jg. 2006 135 Part I / Bacteria: (1) Detection of Tetracycline Resistance Genes by PCR Methods; (2) Integron Analysis and Genetic Mapping of Antimicrobial Resistance Genes in Salmonella enterica serotype typhimurium; (3) Molecular-Based Identification and Typing of Campylobacter jejuni and C. coli; (4) Molecular Genotyping Methods and Computerized Analysis for the Study of Salmonella enterica. Part II / Viruses: (5) Detection of Infectious Rotaviruses by Flow Cytometry; (6) Integrated Cell Culture/PCR for Detection of Enteric Viruses in Environmental Samples; (7) Abundance in Sewage of Bacteriophages Infecting Escherichia coli O157:H7; (8) Molecular Genotyping of Irish Rotavirus Strains; (9) Hepatitis A Virus: Molecular Detection and Typing. Part III / Fungi: (10) Typing Fungal Isolates: Molecular Methods and Computerized Analysis; (11) Fungal Isolation and Enumeration in Foods; (12) Determination of Aflatoxins and Zearalenone in Different Culture Media. Part IV / Other Pathogens: (13) Intracellular Multiplication of Legionella Species and the Influence of Amoebae on Their Intracellular Growth in Human Monocytes: Mono Mac 6 Cells and Acanthamoeba castellanii as Suitable In Vitro Models; (14) Viability of Amoebae, Fungal Conidia, and Yeasts: Rapid Assessment by Flow Cytometry; (15) Detection and Differentiation of Cryptosporidium Oocysts in Water by PCR-RFLP; (16) Genotyping of Cryptosporidium parvum With Microsattelite Markers; (17) Immunomagnetic Separation of Pathogenic Organisms From Environmental Matrices; (18) Detection of Erysipelothrix rhusiopathiae in Clinical and Environmental Samples; (19) Interaction between Lactic Acid Bacteria and Gastrointestinal Nematodes of Caprine Origin; (20) Molecular Detection of Genes Responsible for Cyanobacterial Toxin Production in the Genera Microcystis, Nodularia, and Cylindrospermopsis. Part V / Bacteriocins and Other Inhibitors: (21) Purification of Antilisterial Bacteriocins, (22) The Hazard Analysis and Critical Control Point System in Food Safety; (23) Testing Disinfectants in the Food Factory: Phenol Coefficient Method; (24) Nontraditional Method of Evaluating Disinfectants: With Isolated Microorganisms From the Food Factory; (25) Microbiological Analysis of Cosmetics; (26) Helicobacter pylori and Food Products: A Public Health Problem; (27) Microbiological Test for Sanitation of Equipment in the Food Factory; (28) Spectrophotometric Determination of Histamine in Fisheries Using an Enzyme Immunoassay Method; (29) Flavonoids From Argentine Tagetes (Asteraceae) With Antimicrobial Activity; (30) Purification of Bacteriocins Produced by Lactic Acid Bacteria; (31) Production of Antimicrobial Substances by Lactic Acid Bacteria I: Determination of Hydrogen Peroxide; (32) Production of Antimicrobial Substances by Lactic Bacteria II: Screening Bacteriocin-Producing Strains With Probiotic Purposes and Characterization of Lactobacillus Bacteriocin; (33) Statistic Models to Optimize Production of Probiotic Characteristics; (34) MeatModel System Development for Antibacterial Activity Determination. Part VI / In Vitro Studies in Mice: (35) Colonization Capability of Lactobacilli Pathogens in the Respiratory Tract of Mice: Microbiological, Cytological, Structural, and Ultrastructural Studies; (36) Effects of Estrogen Administration on the Colonization Capability of Lactobacilli and Escherichia coli in the Urinary Tracts of Mice; (37) Effect of Lactobacilli Administration in the Vaginal Tract of Mice: Evaluation of Side Effects and Local Immune Response by Local Administration of Selected Strains; (38) Determination of Bacterial Adhesion to Intestinal Mucus; (39) Animal Model for In Vivo Evaluation of Cholesterol Reduction by Lactic Acid Bacteria; (40) Assessing Survival of Dairy Propionibacteria in Gastrointestinal Conditions and Adherence to Intestinal Epithelia. 136 MIKROBIOLOGE 16.Jg. 2006 Part VII / Special Methods: (41) Bacterial Surface Characteristics Applied to Selection of Probiotic Microorganisms; (42) Adhesion Ability of Lactobacillus to Vaginal Epithelial Cells: Study by Microbiological Methods; (43) Hydroxylapatite Beads As an Experimental Model to Study the Adhesion of Lactic Acid Bacteria From the Oral Cavity to Hard Tissues; (44) Microtechnique for Identification of Lactic Acid Bacteria; (45) Differentiation of Lactic Acid Bacteria Strains by Postelectrophoretic Detecton of Esterases; (46) Determination of Esterolytic and Lipolytic Activities of Lactic Acid Bacteria; (47) Meat-Model System Development for Proteolytic Activity Determination; (48) ß-Glucuronidase Method to Determine Mastitis Levels in Goat Milk; (49) Differences Between Biogenic Amine Detection by HPLC Methods Using OPA and Dansyl Derivatives. Part VIII / Reviews: (50) Microflora of the Gastrointestinal Tract: A Review; (51) Public Health Implications Related to Spread of Pathogens in Manure From Livestock and Poultry Operations; (52) Molecular Aspects of Disease Pathogenesis in the Transmissible Spongiform Encephalopathies. Von international herausragenden und ausgewiesenen Wissenschaftlern der jeweiligen Fachgebiete verfasste Beiträge finden sich in diesem Buch wieder. Wer ist der primär adressierte Leserkreis? Diese Frage kann der Rezensent sich nicht beantworten, und dieses wird sich der angesprochene Kreis als selbsterklärend aus der Auflistung des Inhaltes dieses Buches entnehmen können. Leider stehen der Ansicht des Rezensenten nach eine Unzahl von Kapiteln zur „Großthematik“ parallel und relativ zusammenhanglos sich nebeneinander. Einen „Roten Faden“ und Spannungsbogen innerhalb dieses Buches ist somit nicht direkt erkennbar, obwohl die Einzelbeiträge auf sich genommen hervorragend sind. Die systematische Gliederung des Buches in acht Hauptkapitel lässt die Intention eines Spannungsbogens zwar erkennen, dieses war jedoch bei der Vielzahl an Einzelkapiteln unmöglich umzusetzen. Zusammenfassend ein detailverliebtes, methodenorientiertes Buch mit einer Menge hoch relevanter Informationssubstanz in den einzelnen Kapiteln. Da die „Halbwertszeit des Wissens“ auf diesem Fachgebiet relativ kurz ist, sieht der Rezensent es als angeraten und auch sehr erfolgsversprechend an, in absehbarer Zukunft eine revidierte Neuauflage anzustreben, in der versucht wird, bei gleichem Informationsgehalt dem Buch einen „Spannungsbogen“, „Roten Faden“ und erkennbaren kohärenten Gesamtkontext zu geben. Der Rezensent ist sich aber durchaus bewusst, wie ambitioniert es ist, diesem Anspruch gerecht zu werden, so dass dieses Buch mehr als eine Aneinanderreihung einzelner, exzellenter wissenschaftlicher Beiträge wird. Manchmal ist auch weniger mehr. Aus diesem Grunde definiert sich dieses Buch in den Augen des Rezensenten in der vorliegenden Form als eine klassische „Bibliothekspublikation“, die als Nachschlagewerk beispielsweise in keiner Universitätsbibliothek oder Bibliothek von Untersuchungsämtern u.s.w., die mit „Publik Health Microbiology“ befasst sind, fehlen sollte. Zu guter Letzt: Etwas unglücklich ist die Wahl und häufige Benutzung des Terminus „hazardous microorganisms“. Letztendlich wird der „Mikrokosmos“ hier fast ausschließlich als negativ belastete Bedrohung dargestellt, so dass das Buch damit unter einer ominösen „grauen Wolke“ von Krankheitserregern steht, die wohl die meisten Medizinischen Mikrobiologen so nicht sehen und erkennen werden können. Last not least: Die Verschlagwortung im Index ist exzellent und erlaubt dem Leser einen schnellen Zugriff zu der jeweils gesuchten Fragestellung. A. Schmidt, Witten/Herdecke QUALITÄTSSICHERUNG Bakteriologisch-infektionsserologischer Ringversuch Mai 2005: Zielwertübersicht und Kommentare Beitrag der Qualitätssicherungskommission der DGHM Iris Müller, Klaus-Peter Hunfeld und Volker Brade Institut für Medizinische Mikrobiologie der Universitätsklinik Frankfurt am Main Nachfolgend werden die Zielwerte des bakteriologischinfektionsserologischen Ringversuchs vom Mai 2005 abschließend publiziert und spezielle, für die Qualitätssicherung besonders bedeutsame Befunde in knapper Form zusammenfassend dargestellt und kommentiert. Weitergehende statistische Detailinformationen sind jedem Versuchsteilnehmer zugegangen und herstellerspezifische Analysen sind zudem unter www.instand-ev.de verfügbar. 1. 1.1 Klinische Information Probe 31 und 32 stammen beide von klinisch gesunden Blutspendern. 1.2 Ermittlung der Zielwerte Als Zielwert wurde der Modal bzw. der Median der qualitativen und quantitativen Ergebnisse aller Teilnehmer festgesetzt. Der Zielwert der Probe 31 liegt bei 2,0 I.E. / ml (Median der Zielwertlaboratorien: 2,24 I.E. / ml). Teilnehmerkollektiv, Versuchsbedingungen und Bewertungsrichtlinien Es nahmen insgesamt 1094 verschiedene Laboratorien teil, davon 992 aus Deutschland und 102 aus dem europäischen Ausland (Tabelle 1). Pro Untersuchungsgruppe wurden jeweils zwei Kontrollproben mit den Nummern 31 und 32 an die Teilnehmer verschickt. Die Auswertung des Versuchs erfogte wie gewohnt in Zusammenarbeit mit INSTAND e.V. Düsseldorf. Die dabei zu Grunde gelegten Bewertungsrichtlinien, Standardverdünnungen und cutoff-Werte finden sich in den vorangegangenen Publikationen zum Thema [1, 2, 3]. Der Zielwert der Probe 32 liegt bei 1,0 I.E. / ml (Median der Zielwertlaboratorien: 1,12 I.E. / ml). Der Bewertungsbereich für beide Proben umfasst großzügig den Bereich +/- 40 % um den Zielwert. 1.3 Diagnostische Gesamtbewertung und Kommentar Probe 31: Für den Patienten besteht ausreichender Impfschutz, eine Auffrischimpfung sollte in etwa 5 bis 10 Jahren erfolgen. Probe 32: Für den Patienten besteht ausreichender Impfschutz, eine Auffrischimpfung sollte je nach individuellem Teilnehmerergebnis in etwa 2 bis 5 Jahren, bzw. in 5 bis 10 Jahren erfolgen. Tabelle 1: INSTAND-Ringversuche in der bakteriologischen Infektionsserologie Stand 5/2005 (Teilnehmerzahl: N =1094) Instand Index Nr. 310 311 312 313 314 315 316 321 323 331 332 334 Teilnehmer N Tetanus 130 Lues 429 C. trachomatis-Ak 230 C. trachomatis-Direktnachweis 98 C. pneumoniae-Ak 206 Yersinien-Serologie 219 C. trachomatis-Direktnachweis-IFT 32 Streptokokken 296 Rheumafaktor 397 Salmonellen 116 B. burgdorferi 401 H. pylori 199 Tetanus (310) Untersuchungsgruppe Die quant. Gesamtbestehensquoten (Tabelle 2) liegen je nach Hersteller bei 60-92,9% und waren ebenso wie die der diagnostischen Gesamtbewertung (95%) bei hochpositiven Proben insgesamt deutlich besser als zuletzt. 1. Lues (311) 2.1 Klinische Information Probe 31 wurde einem gesunden Spender ohne Hinweis auf eine Infektion entnommen. Probe 32 wurde einem Patienten 1 Monat nach suffizienter Therapie einer Reinfektion entnommen. MIKROBIOLOGE 16.Jg. 2006 137 Tabelle 2: Tetanus ELISA: Herstellerabhängige quantitative Ergebnisse des Ringversuches Mai 2005 Hersteller Probe Sollwert (I.E. / ml) Bewertungsbereich 31 2,0 1,2 – 2,8 32 1,0 0,6 – 1,4 31 2,0 1,2 – 2,8 VR 32 1,0 0,6 – 1,4 31 2,0 1,2 – 2,8 VT 32 1,0 0,6 – 1,4 31 2,0 1,2 – 2,8 Restliche Hersteller 32 1,0 0,6 – 1,4 BS: The Binding Site, VR: Virion, VT: Virotech BS Teilnehmerkollektiv SchwankungsMittelwert breite 0,8 – 2,2 1,86 0,95 0,86 – 2,41 0,48 – 4,6 2,05 1,05 0,23 – 2,3 1,46 0,85 – 2,4 0,87 0,6 – 1,5 2,27 0,8 – 3,2 0,96 0,35 – 1,9 Zur Festlegung der qualitativen bzw. der quantitativen Zielwerte wurde der Modal bzw. der Median der Testergebnisse der Zielwertlaboratorien herangezogen. Probe 31: TPHA: negativ mit Werten von 0 bis 79,9 TPPA: negativ mit Werten von 0 bis 79,9, ELISA (polyvalent): negativ, ELISA-IgG: negativ, ELISAIgM: negativ, FTA-abs-IgG: negativ mit Werten von 0 bis 4,9, VDRL: negativ mit Werten von 0 bis 0,9, Kardiolipin-KBR: negativ mit Werten von 0 bis 4,9, FTA-abs-IgM: negativ mit Werten von 0 bis 4,9, IgG-Immunoblot: negativ, IgM-Immunoblot: negativ 2.3 Diagnostische Gesamtbewertung Probe 31: Der Befund bietet keinen Hinweis auf eine Infektion. Der Patient ist als Blutspender geeignet. Probe 32: Der Befund ist in Zusammenschau aller Testergebnisse mit einer behandlungsbedürftigen (Re-) Infektion vereinbar, der Patient ist daher als Blutspender nicht geeignet. Eine Befundkontrolle sollte in 3-6 Monaten erfolgen. 2.4 Kommentar MIKROBIOLOGE 16.Jg. 2006 17,4 13,5 17,9 14,3 17,8 17,0 16,5 15,7 5 55 28 32 Probe 80,0 60,0 89,1 90,9 96,4 96,4 87,5 84,4 Total gesamt 60,0 85,5 92,9 84,4 85,8 Die hier vorliegende Befundkonstellation wird häufig bei frischen oder nicht lange zurückliegenden ReInfektionen beobachtet, die gerade im Rahmen der aktuellen Syphilis-Epidemie in den Risikokollektiven der Ballungszentren häufig vorkommen. Charakteristisch ist in diesen Fällen der rasche Anstieg des VDRL und des TPPA/TPHA, wobei ein Anstieg des spezifischen IgM, wenn überhaupt, zumeist verzögert erfolgt. Die vorliegende Befundkonstellation kann ohne entsprechende Vorbefunde oder zusätzliche klinische Informationen nicht als zurückliegend und nicht behandlungsbedürftig interpretiert und kommentiert werden. Wir erkennen zwar großzügig einen breiten Titerbereich als akzeptabel an, als richtiger Befund gilt aber der jeweilige Modal/Median der Zielwertlaboratorien. Zu beachten ist, dass bei der Interpretation der Lues-Serologie hinsichtlich der Behandlungsbedürftigkeit dem spezifischen IgMNachweis ein zwar wichtiger, aber keinesfalls ein absoluter Stellenwert zukommt. Zum einen können spezifische IgM-Antikörper gerade auch bei HIVPatienten nach Therapie niedrigtitrig noch für 6-12 Monate nachweisbar bleiben. Zum anderen kann eine IgM-Antikörperantwort bei frischen Re-Infektionen ganz fehlen! Für die Beurteilung des Infektionsstatus ist daher, wie im vorliegenden Fall, neben ev. verfügbaren zusätzlichen klinischen Informationen (liegen wie im Ringversuch in praxi aber häufig nicht vor!) die Zusammenschau der Konstellation aller serologischen Befunde der Syphilis-Serologie und, wenn immer möglich, der Vergleich mit eventuellen Vorbefunden oder Verlaufskontrollen entscheidend. Probe 32: TPHA: positiv mit einem Titer von 10240 (Median), TPPA: positiv mit einem Titer von 10240 (Median), ELISA (polyvalent): positiv, ELISA-IgG: positiv, ELISA-IgM: neg./grenzw./pos., FTA-absIgG: positiv mit einem Titer von 1280 (Median) VDRL: positiv mit einem Titer von 8 (Median), Kardiolipin-KBR: positiv mit einem Titer von 20 (Median), FTA-abs-IgM: neg./grenzw./pos. mit Werten von 0 bis10, IgG-Immunoblot: positiv, IgMImmunoblot: neg./grenzw./pos. 138 VK tung als behandlungsbedürftige Infektion bereitete aber Probleme (Bestehensquote 67%). An dieser Bewertung des Befundes wurde aber bei passender klinischer Information gerade wegen der eindeutigen Interpretation der Probe durch die Zielwertlaboratorien festgehalten. 2.2 Ermittlung der Zielwerte Die Bewertung der positiven Probe 32 bereitete insofern Schwierigkeiten, als eine Reihe von Teilnehmern bei nur schwach positivem oder sogar negativem spezifischen IgM-Nachweis trotz deutlich erhöhter TPPA/TPHA- und VDRL-Titer eine zurückliegende, ausreichend therapierte Infektion diagnostizierte. Da einige Hersteller momentan ihre IgM-Tests überarbeiten [4], wurden die Ergebnisse der spezifischen IgM-Nachweisverfahren im vorliegenden Ringversuch großzügig bewertet. Die qualitativen und quantitativen Bestehensquoten waren insgesamt erfreulich (74-98%). Die klinische Bewer- Bestehensquote [%] N 3 Chlamydia trachomatis (312) 3.1 Klinische Information Probe 31 und 32 stammen beide von gesunden Blutspendern. 3.2 Zielwertermittlung Zur Festlegung der qualitativen bzw. der quantitativen Zielwerte der Titertests wurde der Modal bzw. der Median der Testergebnisse der Zielwertlaboratorien herangezogen. Probe 31: KBR: negativ mit Werten von 0 bis 9,9, negativ, C.C.-trachomatis-IgG-ELISA: trachomatis-IgM-ELISA: negativ, C.-trachomatisIgA-ELISA: negativ, MIFT-IgG: negativ mit einem Wert zwischen 0 und 19,9, MIFT-IgM: negativ mit Werten von 0 bis 19,9, MIFT-IgA: negativ mit Werten von 0 bis 19,9 5 5.1 Klinische Information Probe 31 stammt von einem Patienten mit respiratorischer Infektsymptomatik, Probe 32 von einem gesunden Blutspender ohne klinischen Befund. 5.2 Zielwertermittlung Die Auswertung des speziesspezifischen IgGELISAs erfolgte ausschließlich qualitativ. Zur Festlegung der übrigen qualitativen bzw. der quantitativen Zielwerte der klassischen Titertests wurde der Modal bzw. der Median der Testergebnisse der Zielwertlaboratorien herangezogen. Probe 32: KBR: negativ mit Werten von 0 bis 9,9, C.-trachomatis-IgG-ELISA: negativ/grenzw., C.trachomatis-IgM-ELISA: negativ, C.-trachomatisIgA-ELISA: negativ, MIFT-IgG: negativ mit einem Wert zwischen 0 und 19,9, MIFT-IgM: negativ mit Werten von 0 bis 19,9, MIFT-IgA: negativ mit Werten von 0 bis 19,9 Probe 31: KBR: negativ mit Werten von 0 bis 9,9, C. pneumoniae-IgG-ELISA: positiv; C.-pneumoniaeIgM-ELISA: negativ, C.-pneumoniae-IgA-ELISA: grenz./pos., MIFT-IgG: positiv mit einem Titer von 80, C.-pneumoniae-MIFT-IgM: negativ mit Werten von 0 bis 19,9, C.-pneumoniae-MIFT-IgA: grenzw./positiv mit Titer von 40. 3.3 Testergebnisse und diagn. Gesamtbewertung Die Resultate sowohl für Probe 31 wie auch für Probe 32 sprechen gegen eine ChlamydienInfektion. Die Gesamtbestehensquoten waren bei zwei negativen Proben verfahrensabhängig mit 7096,6% erfreulich. 4 Probe 32: KBR: negativ mit Werten von 0 bis 19,9, C. pneumoniae-IgG-ELISA: grenzw./pos; C. pneumoniae -IgM-ELISA: neg., C. pneumoniae-IgAELISA: negativ, C.-pneumoniae-MIFT-IgG: positiv mit einem Titer von 40, C.-pneumoniae-MIFT-IgM: negativ mit Werten von 0 bis 19,9, MIFT-IgA: negativ mit einem Wert von 0 bis 19,9. Chlamydien-Direktnachweis (313) 4.1 Proben-Information Chlamydia pneumoniae (314) 5.3 Diagnostische Gesamtbewertung und Kommentar Probe 31 bestand aus für Chlamydia trachomatis negativ getestetem sterilen Urin. Probe 32 bestand aus einem sterilen Urin gespickt mit 1,8 x 104 IFUs einer inaktivierten Chlamydia trachomatis Kultur. Probe 31: Die Befundkonstellation erlaubt primär die Interpretation „serologischer Hinweis auf eine abgelaufene Chlamydia pneumoniae Infektion“ aber auch die Auslegung „Hinweis auf eine derzeit bestehende Chlamydia pneumoniae Infektion“. 4.2 Zielwertermittlung und diagnostische Gesamtbewertung Probe 32: Die Befundkonstellation läßt sich mit der einer abgelaufenen Chlamydia pneumoniae Infektion vereinbaren. Zur qualitativen Zielwertermittlung wurden die Ergebnisse der Zielwertwertlaboratorien mit den verschiedenen Verfahren einschließlich der PCR herangezogen. Der spezifische IgA-Nachweis bleibt nach wie vor problematisch (verfahrensabhängige Bestehensquoten: 46-72%). Auch die klinische Bewertung solcher Proben durch die Teilnehmer ist sehr heterogen. Aus der Arbeit des CAP-Netzes sind mit molekularbiologischen Verfahren Nachweisraten von 1-2% bei Patienten mit ambulant erworbener Pneumonie bekannt. Angesichts dieser Zahlen und bei fortbestehenden Schwierigkeiten in der Durchführung und Interpretation der C. pneumoniae-Serologie bleibt die Bedeutung des spezifischen Antikörpernachweises für die Patientenversorgung zweifelhaft. Da die Konzentration an IFUs in Probe 32 für die weniger sensitiven Testsysteme offensichtlich um den cut-off lag, wurden für den C. trachomatisAntigen ELISA sowie für andere AgNachweisverfahren die Angabe „negativ bzw. grenzwertig“ akzeptiert, für das sensitivere PCRVerfahren wurden nur die Angabe „positv“ akzeptiert. Im diagnostischen Kommentar wurde für Probe 31 „Kein Hinweis für Infektion“ anerkannt. Für Probe 32 wurde für Teilnehmer mit PCR-Verfahren nur der Kommentar „Hinweis auf bestehende C. trachomatis Infektion“ akzeptiert. Für alle anderen Teilnehmer wurde auch die Bewertung „Kein Hinweis auf eine Infektion“ akzeptiert. Die Gesamtbestehensquoten lagen verfahrensabhängig zwischen 84,6 und 97%; bei diagnostische Gesamtbewertung kommentierten 92% der Teilnehmer richtig. 6 Yersinien-Serologie (315) 6.1 Klinische Information Probe 31 wurde einem gesunden Blutspender entnommen. Probe 32 stammt von einem Patienten mit arthritischen Beschwerden. MIKROBIOLOGE 16.Jg. 2006 139 6.2 Zielwertermittlung Zur Festlegung der qualitativen bzw. der quantitativen Zielwerte der Titertests wurde der Modal bzw. der Median der Testergebnisse der Zielwertlaboratorien herangezogen. 7.3 Diagnostische Gesamtbewertung und Kommentar Probe 31 ist im Widal-Test, im ELISA und auch im Immunoblot negativ für spezifische Antikörper. Für Probe 31 besteht kein Hinweis auf eine Infektion. Der Befund in Probe 32 deutet auf eine Infektion mit C. trachomatis hin. Für Probe 32 waren sowohl im ELISA wie auch im Immunoblot spezifische IgG- und IgA-Antikörper nachweisbar. Spezifische IgM-Antikörper waren nicht nachweisbar. Der Widal-Test erbrachte ein negatives Ergebnis Der C. trachomatis-Direktnachweis mittels IFT wurde heuer erstmals durchgeführt. Die Bestehensquoten waren bei deutlich positiver Probe 32 mit 82% für den IFT und mit 81% für die klinische Bewertung erfreulich gut. 6.3 Diagnostische Gesamtbewertung und Kommentar Probe 31: Es besteht kein Hinweis für Infektion. Probe 32 Zugelassen wurden die Bewertungen a.) Hinweis für eine Yersinien-assoziierte Folgeerkrankung, b.) Hinweis auf zurückliegende Infektion sowie c.) die Kombination aus beiden Bewertungen. Die methodenabhängigen Gesamtbestehensquoten waren mit 70-100 % erfreulich gut. Lediglich die klinische Bewertung von Probe 32 bereitete offensichtliche Schwierigkeiten. Im ELISA und im Immunoblot wurde die Probe von 81 bzw. 89 % der Teilnehmer positiv für spezifische IgA-Antikörper getestet. Ein positiver IgA-Nachweis sollte immer auch an eine Yersinien-assoziierte Folgeerkrankung denken lassen, und ein entsprechender Hinweis sollte sich auch im klinischen Kommentar wiederfinden. Trotz großzügiger Annerkennung verschiedenster Kommentare bewerteten lediglich 59% der Teilnehmer beide Proben korrekt. 7 Bewertung des Chlamydia trachomatis-Ag-IFT: Probe 31: negativ; Probe 32: positiv. Chlamydia trachomatis Direktnachweis-IFT (316) 7.1 Klinische Information Probe 31: Objektträger mit nicht infizierten, fixierten Zellen aus einer Zellkultur. Probe 32 Objektträger mit fixierten C. trachomatis-infizierten Zellen aus einer Zellkultur. 7.2 Zielwertermittlung Zur Festlegung der qualitativen bzw. der quantitativen Zielwerte der Titertests wurde der Modal der Teilnehmerergebnisse herangezogen. 8 Streptokokken (321) 8.1 Klinische Information Probe 31 wurde aus den Seren eines Patienten mit Z. n. Streptokokkenangina sowie eines gesunden Blutspenders gepoolt. Probe 32 stammt von einem klinisch unauffälligen Blutspender. 8.2 Zielwertermittlung Die quantitative Auswertung erfolgte methodenabhängig (Tabellen 3 und 4). Der qualitative und quantitative methodenabhängige Zielwert wurde dabei als methodenabhängiger Modal bzw. Median aller Teilnehmerergebnisse festgelegt. Der qualitative Bewertungsbereich liegt für positive Proben ± 24 % um ihren methodenabhängigen Zielwert. Probe 31: Streptokokken-O-Lysin: positiv, methodenunabhängiger Median der Zielwertlaboratorien: 549 IU / ml, methodenunabhängiger Median aller Teilnehmer: 624 IU / ml, Streptodornase: neg./ grenzw./pos., methodenunabhängiger Median der Zielwertlaboratorien: 117 IU / ml, methodenunabhängiger Median aller Teilnehmer: 167 IU / ml. Probe 32: Streptokokken-O-Lysin: negativ, Median der Zielwertlaboratorien methodenunabhängig: 0 IU / ml, methodenunabhängiger Median aller Teilnehmer: 84 IU / ml, Streptodornase: negativ, Median der Zielwertlaboratorien methodenunabhängig: 0 IU / ml, methodenunabhängiger Median aller Teilnehmer: 57 IU / ml. Tabelle 3: Methodenabhängige Auswertung der quantitativen Streptokokken-O-Lysin-Bestimmung Methode/ Hersteller Latex-Agglutination EndpunktNephelometrie KinetischeNephelometrie Turbidimetrische Immunpräzipitation ohne ausreichende Angaben 140 N Probe 31 Sollwert Wertungs[IU/ml] bereich 400 400 – 800 Gesamtquote [%] 87,5 8 53 676 673 511 – 834 96,2 59 0 – 199 96,2 94,3 43 594 594 451 – 736 100,0 25 0 – 199 100,0 100,0 153 645 616 468 – 764 81,1 42 0 – 199 99,2 80,7 10 404 400 300 - 600 90,0 0 0 - 199 100,0 90,0 Total 81,3 MIKROBIOLOGE 16.Jg. 2006 Quote [%] 87,5 Probe 32 Mittelwert Wertungs- Quote [IU/ml] bereich [%] 0 0 – 199 100,0 Mittelwert [IU/ml] 496 Tabelle 4: Methodenabhängige Auswertung der quantitativen Streptodornase-Bestimmung Methode/ Hersteller Latex-Agglutination Agglutination EndpunktNephelometrie KinetischeNephelometrie ohne ausreichende Angaben Probe 31 Sollwert Wertungs[IU/ml] bereich Quote [%] Gesamtquote [%] 0 – 199 100 80,8 98 0 – 199 100 82,1 100 3 0 – 199 100 100 87,5 94 0 – 199 100 87,5 Total 85,4 Quote [%] Gesamtquote [%] Quote [%] Probe 32 Mittelwert Wertungs[IU/ml] bereich N Mittelwert [IU/ml] 26 129 100 100 – 200 80,8 0 39 182 181 137 – 224 82,1 15 155 151 115 – 187 16 184 177 134 - 219 Tabelle 5: Methodenabhängige Auswertung der quantitativen Rheumafaktor-Bestimmung Methode/ Hersteller Latex-Agglutination Agglutination EndpunktNephelometrie KinetischeNephelometrie Turbidimetrische Immunpräzipitation Probe 31 Sollwert Wertungs[IU/ml] bereich Quote [%] Mittelwert [IU/ml] 5 320,0 320 80 – 640 100,0 20 0 – 19,9 20,0 20,0 69 199,0 195 146 – 244 94,2 9 0 – 19,9 98,6 94,2 49 120,0 119 88 – 148 89,8 20,4 0 – 19,9 85,7 81,6 195 116,8 104 78 - 130 74,9 8,8 0 – 19,9 90,7 71,8 Total 78,7 8.3 Testergebnisse und Kommentar Probe 32: Qualitativ ist die Probe negativ zu bewerten. Der Bewertungsbereich liegt methodenunabhängig zwischen 0 – 19,9 IU / ml. Der methodenunabhängige Median der Zielwertwertlaboratorien liegt bei 11,4 IU / ml. Der Median aller Teilnehmerergebnisse liegt bei 8,9 IU / ml. Die methodenabhängigen Bestehensquoten sind in Tabelle 5 dargestellt und liegen im Bereich der Ergebnisse der letzten Ringversuche. Die methodenabhängigen Bestehensquoten für die ASL- und Streptodornasebestimmung sind in Tabelle 3 und 4 zusammengefasst. Der Ergebnisbereich der Streptodornasebestimmung in Probe 31 reichten von negativ bis positiv, da der quantitative Zielwert nahe am Cut-off liegt (methodenabhängige Zielwerte: 100-181 IU/ml.) 9 Probe 32 Mittelwert Wertungs[IU/ml] bereich N Rheumafaktor (323) 9.1 Klinische Information 10 Salmonellen (331) 10.1 Klinische Information Probe 31 wurde aus den Seren eines Patienten mit rheumatoider Arthritis sowie eines gesunden Blutspenders gepoolt. Probe 31 wurde einem Patienten ca. drei Wochen nach gastrointestinalem Infekt mit kulturell gesicherter Salmonella Paratyphi A Infektion (2; a; -) entnommen Probe 32 wurde einem gesunden Blutspender ohne rheumatische Erkrankung entnommen. Probe 32 stammt von einem klinisch gesunden Blutspender und war negativ vorgetestet worden. 9.2 Zielwertbestimmung Die quantitative Bewertung wurde methodenabhängig vorgenommen. Als qualitativer und quantitativer Zielwert der positiven Probe wurde jeweils methodenabhängig der Modal bzw. der Median der Teilnehmerergebnisse festgelegt. Der Bewertungsbereich umfasst einen Schwankungsbereich von ± 25 % um den ermittelten Zielwert. Für die negative Probe 32 wurde methodenunabhängig ein fester Bewertungsbereich unterhalb des cut-off festgelegt. Probe 31: Qualitativ ist die Probe positiv zu bewerten. Die quantitative Analyse ergibt methodenunabhängig für den Median der Zielwertlaboratorien 209 IU / ml. Der Median aller Teilnehmerergebnisse beträgt 117 IU / ml. 10.2 Zielwertermittlung Die qualitativen und quantitative Zielwerte wurden aus den Ergebnissen der Zielwertlaboratorien ermittelt. Probe 31: S. Typhi-O-Ag: negativ mit Werten von 0 bis 50, S. Typhi-(O)H-Ag negativ mit Werten von 0 bis 50, S. Enteritit.-(O)H-Ag negativ mit Werten von 0 bis 50, Salmonellen-O-Ag Gr. A neg./grenzw./pos. mit Werten von 0 bis 200, Salmonellen-O-Ag Gr. B neg./grenzw./pos. mit Werten von 0 bis 200, S. Parat. (O)H-Ag Gr. B negativ mit Werten von 0 bis 50, S. Typhim. (O)H-Ag Gr. B negativ mit Werten von 0 bis 50, Salmonellen-O-Ag. Gr. C negativ mit Werten von 0 bis 50. MIKROBIOLOGE 16.Jg. 2006 141 Probe 32 ist qualitativ und quantitativ negativ für Antikörper gegen Salmonellen mit Werten von 0 bis 50 für die Bestimmung der Antikörper gegen die Ound (O)H-Antigene. Die serologischen Ergebnisse der Probe 32 sind mit einer Infektion im Stadium II-III (symptomatisch oder asymptomatisch) der Lyme-Borreliose vereinbar und passen gut zur verfügbaren klinischen Information. Der Ringversuch gestaltete sich insgesamt unproblematisch. PHA und IFT schnitten erneut deutlich schwächer ab (Bestehensquoten: 65-80%) als ELISA und Blot (Bestehensquoten: 87-97%). Neu eingeführte Testsysteme wie der Line-Blot (Bestehensquote:79%) und der LIA (Bestehensquote: 94%) können noch nicht umfassend beurteilt werden. Der klinische Kommentar bereitete bei großzügiger Bewertung keine Schwierigkeiten (Bestehensquoten: 98%). 10.3 Diagnostische Gesamtbewertung und Kommentar Bei klinisch eindeutig definierter Probe, kulturell gesicherter Infektion und dazu passenden klar positiven Ergebnissen in einer Reihe von Zielwertlaboratorien waren die Ergebnisse im Teilnehmerkollektiv für Probe 31 so inhomogen, dass auf eine einheitliche klinische Bewertung dieses Serums verzichtet werden musste. Die diesen Befunden zugrunde liegenden unterschiedlichen Sensitivitäten der WidalTestungen lassen auf eine sehr unterschiedliche Qualität der verwendeten Antigene und Testverfahren (Röhrchen-Widal bzw. Mikrotiterverfahren) schließen und stimmen was die Verlässlichkeit des Verfahrens in der praktischen Labordiagnostik angeht bedenklich. Zwar wurde großzügig bewertet; Teilnehmer, die nicht zu einem auffälligen Ergebnis und zur Bewertung „V. a. Infektion“ gekommen sind sollten ihre Methoden dringen überprüfen! Probe 32 war negativ und es liegt serologisch kein Hinweis auf eine Infektion vor. 11 12 12.1 Klinische Information Probe 31 wurde einem Blutspender ohne bekannte klinische Symptomatik entnommen. Probe 32 stammt von einem Patienten nach Therapie eines Ulcus vor ca. 3-4 Monaten 12.2 Zielwertermittlung Probe 31: zeigt in allen IgG- und IgANachweisverfahren negative Ergebnisse. Probe 32: wegen der inhomogenen Ergebnisse sowohl der Zielwertlaboratorien wie auch des Teilnehmerkollektivs wurde diese Probe aus der Bewertung genommen und der Ringversuch lediglich anhand von Probe 31 bewertet. Borrelien (332) 11.1 Klinische Information Probe 31 stammt von einem gesunden Blutspender ohne Hinweis auf eine Lyme-Borreliose oder einen Zeckenstich in der Anamnese. Probe 32 wurde einer Patientin mit Neuroborreliose (M. Bannwarth, Liquorpleozytose, positiver spezifischer Antikörperindex) ca. 6 Wochen nach suffizienter Therapie entnommen. 11.2 Zielwertermittlung Zur Festlegung der qualitativen bzw. der quantitativen Zielwerte der Titertests wurde der Modal bzw. der Median der Testergebnisse der Zielwertlaboratorien herangezogen. Probe 31 ist qualitativ und quantitativ in allen Testverfahren zum Nachweis spezifischer Borrelien-IgG und IgM-Antikörper negativ. Probe 32: PHA: positiv mit einem Titer von 320, ELISA poly.: positiv, ELISA-IgG: positiv, ELISA-IgM: positiv, IFT-IgG: positiv mit einem Titer von 320, IFTIgM: grenzw./positiv mit einem Titer von 40, Immunoblot-IgG: positiv unter Berücksichtigung der ausgewerteten Banden [p83/100, p58, p41, p39, OspC, VlsE], Immunoblot-IgM: positiv unter Berücksichtigung der ausgewerteten Banden [OspC]. Borrelien-Line-Blot: positiv, Borrelien-Luminiszenz-Assay-IgG: positiv, Borrelien-Luminiszenz-Assay-IgM: positiv. 11.3 Diagnostische Gesamtbewertung und Kommentar Der serologische Befund der Probe 31 gibt keinen Hinweis auf eine Infektion. Eine Erkrankung im Frühstadium ist jedoch nicht ausgeschlossen, so dass bei weiter bestehendem klinischem Verdacht eine Kontrolluntersuchung in 2-3 Wochen erfolgen sollte. 142 MIKROBIOLOGE 16.Jg. 2006 Helicobacter (334) 12.3 Diagnostische Gesamtbewertung Der serologische Befund der Probe 31 bietet keinen Anhaltspunkt für eine Infektion mit Helicobacter pylori (Gesamtbestehensquote: 85 %). Literatur: 1. Hunfeld K.-P., Brade V., Ringversuche in der bakteriologischen Infektionsserologie – Standortbestimmung und Auswertung des Ringversuchs X/1999, Der Mikrobiologe (2000), 10:135-144. 2. Hunfeld K.-P., Müller I., Brade V., Externe Qualitätskontrolle in der bakteriologischen Infektionsserologie: Ringversuchsauswertung September 2001, Der Mikrobiologe (2002), 12: 96-108. 3. Entwurf der zuständigen wissenschaftlichen Fachgesellschaften (BÄMI, DGHM, DVV, GfV, DPG und DMG) für die Richtlinie der Bundesärztekammer zur Qualitätssicherung auf dem Gebiet der Medizinischen Mikrobiologie. Ringversuche in der Mikrobiologie. B. SPEZIELLER TEIL. II. Ringversuche in der Infektionsserologie. (2004) INSTAND Informationen, I/2004: 2-6 4. Müller I., Hunfeld K.-P., Brade V. Bakteriologisch-infektionsserologischer Ringversuch November 2004: Zielwertübersicht und Kommentare, Der Mikrobiologe (2006), 16: 93-98. Korrespondenzadresse: Dipl.-Chem. Iris Müller Ringversuchslabor für bakteriologische Infektionsserologie Institut für Medizinische Mikrobiologie der Universitätsklinik Frankfurt/Main Paul-Ehrlich Str. 40, 60596 Frankfurt/M. Tel.: 069/6301-6441, Fax: 069/6301-83066 Email: Iris.Mü[email protected] BUCHBESPRECHUNGEN Impfen - ganz praktisch herausgegeben von Burkhard Schneeweiß. 2. Auflage. 112 Seiten, 26 farbige Abbildungen, Format 240 mm x 170 mm, Hardcover. UNI-MED Science, Bremen, 2005. ISBN 3-89599-871-0. Euro 44,80. Dieses Buch erschien in der ersten Auflage 2002. Offenbar war die Resonanz so gut, dass nun die 2. Auflage vorliegt, die auf Grund vieler neuer Aspekte und zahlreicher Vorschläge zur Verbesserung komplett überarbeitet und aktualisiert wurde. Neu hinzugekommen ist ein Kapitel über Abrechnungsfragen. In den Vorworten zur 1. und 2. Auflage werden allgemeine Bemerkungen zur überaus segensreichen Auswirkungen der Entwicklung und Einführung von Impfungen gemacht. Das Ziel des Buches ist es, die notwendigen Informationen für den Arzt zur Durchführung von Impfungen zu geben und wichtige Fragen anderer interessierter Kreise, vor allem Eltern, zu beantworten. Damit sollen nach wie vor bestehende Unsicherheiten und Vorbehalte gegen Impfungen ausgeräumt werden. Alle Ärzte werden dringlich gebeten, sich für die Aufrechterhaltung eines umfassenden und soliden Impfschutzes einzusetzen. Hierbei sollten auch alle Erwachsenen für ihren lebenslangen Impfschutz selbst Sorge tragen. Der Autor möchte durch das Aufnehmen und Analysieren häufiger Argumente von notorischen Impfgegnern Hilfen zur Aufklärung innerhalb und außerhalb der Ärzteschaft geben, um die Impfbereitschaft nachhaltig zu fördern. Im Einzelnen gliedert sich das Buch wie folgt: 1. Grundlagen (Was sind Impfstoffe? Wie wirken Impfstoffe? Wie sicher sind Impfstoffe? Wer empfiehlt und überwacht? S. 8 - 31), 2. Empfehlungen (Impfungen für alle Kinder, Impfungen für alle Jugendlichen, Impfungen für alle Erwachsenen, Impfungen von Risikopersonen und aus besonderen Anlässen, S. 34 – 57), 3. Durchführung (Wer impft? Wie wird geimpft? Welche Fehler gilt es zu vermeiden? Welche Argumente haben Impfskeptiker? S. 60 – 73), Häufige Fragen (S. 76 – 86), Anhang (Abkürzungen, Glossar, Kontaktadressen für impfpräventable Erkrankungen), Weiterführende Literatur, Index. Alle Texte sind sehr anschaulich und einprägsam geschrieben, so dass sie auch für Nichtärzte verständlich sein dürften. Es ist dem Autor gelungen, auch komplexe Zusammenhänge einleuchtend zu präsentieren. Die jeweiligen Kapitel sind klar und logisch strukturiert. Im Kapitel Empfehlungen wird auch kurz auf die Bedrohung durch biologische Waffen eingegangen. Das Kapitel Durchführung besticht durch die lückenlose Beschreibung aller praktischen und juristischen Aspekte und verdeutlicht diese durch sehr instruktive Abbildungen, z. B. zur Impftechnik. Hier findet sich auch der eingefügte Abschnitt zu allen Fragen der korrekten Abrechnung von Impfleistungen. Die Auswahl häufig geäußerter Fragen und ihre kompetente Beantwortung sind recht interessant und dürften dem Arzt die Führung aufklärender Gespräche erleichtern. Auch das Kapitel, das sich mit den Argumenten von Impfskeptikern beschäftigt, ist gut geeignet, um unberechtigten Verdächtigungen und Verschwörungstheorien wirksam entgegen zu treten. Der abschließende Anhang ergänzt vor allem durch die recht umfassenden Adressenangaben und die sehr hilfreichen Angaben zu weiterführender Literatur vorteilhaft die vorherigen Kapitel. Die zahlreichen Tabellen sind klar im Aufbau, die Abbildungen sind zielführend, vor allem überzeugen die schematischen Darstellungen zur Verdeutlichung komplexer Sachverhalte. Ausstattung, Druck und Papier sind einwandfrei, der Preis ist gerechtfertigt. Es wäre zu begrüßen, wenn dieses Werk in weiteren Auflagen fortgeführt werden könnte. Es kann allen direkt und indirekt mit Impfungen befassten Ärzten, aber auch anderen interessierten Kreisen sehr empfohlen werden. F.- B. Spencker, Leipzig 144 MIKROBIOLOGE 16.Jg. 2006 Impfratgeber – Impfempfehlungen für Kinder, Jugendliche und Erwachsene herausgegeben von Ulrich Heininger. 3. neu bearbeitete Auflage. 136 Seiten, 18 Abbildungen, Hardcover. UNI-MED Science, Bremen, 2005. ISBN 3-89599-815-X. Euro 44,80. In den Vorworten zur ersten und dritten Auflage weist der Autor auf die andauernde unzureichende Akzeptanz der Schutzimpfungen in der Bevölkerung hin, die er u. a. auf ungerechtfertigte Sicherheitsbedenken bei Laien, aber eben auch bei Ärzten zurückführt. Als Zielstellungen des Buches werden genannt: ÄrztInnen und MedizinstudentInnen Wissen und Argumente zu vermitteln, um das Anliegen von Schutzimpfungen zu unterstützen. Die Entwicklung neuer und die Verbesserung bekannter Impfstoffe werden als sehr dynamische Prozesse beschrieben, die eine kontinuierliche und sorgfältige Fortbildung aller Ärzte erfordern. Die diesbezüglichen Aspekte aller in Deutschland, der Schweiz und in Österreich eingesetzten Schutzimpfungen werden diskutiert. Jeder Impfung geht eine kurze Darstellung des Krankheitsbildes (Pathogenese, Diagnostik, Therapie) voraus und die Beschreibung ggf. alternativer Präventivmaßnahmen. Schließlich geht der Autor auch auf noch nicht verfügbare Impfstoffe ein, an denen jedoch gearbeitet wird und deren Einführung absehbar ist. Die Aktualisierung des Buches in der jetzt vorliegenden Auflage war wegen der zahlreichen Änderungen in den Impfempfehlungen erforderlich. Der Inhalt des Buches gliedert sich wie folgt: 1. Geschichte des Impfwesens (S. 12 – 16), 2. Allgemeine Grundlagen (S. 18 – 28; Immunologische Grundlagen, Passive Immunisierung, Aktive Immunisierung, Simultanimpfungen, Zeitabstände zwischen Impfungen, Wirksamkeit und Verträglichkeit von Impfungen, Impftechniken), 3. Formale Grundlagen (S. 30 – 39; Impfstoffherstellung, Prüfung und Zulassung von Impfstoffen, Untersuchung, Aufklärung und Beratung des Impflings, Abklärung von Impfnebenwirkungen, Impfdokumentation, Aufbewahrung von Impfstoffen, Gegenwärtige Impfempfehlungen in Deutschland, Österreich und der Schweiz, Kombinierte Impfungen – Kombinationsimpfstoffe), 4. Allgemein empfohlene Impfungen für Kinder und Jugendliche (S. 42 – 84; Diphtherie, Tetanus, Pertussis, Poliomyelitis, Haemophilus influenzae Typ B Infektionen, Hepatitis B, Masern, Mumps, Röteln, Varizellen), 5. Indikations- und Reiseimpfungen für Kinder und Jugendliche (S. 86 – 115; Tuberkulose, Influenza, Hepatitis A, Frühsommer-Meningoenzephalitis, Pneumokokken-Erkrankungen, Meningokokken-Erkrankungen, Typhus, Cholera, Tollwut, Gelbfieber, Japanische Enzephalitis), 6. Impfungen in besonderen Situationen (S. 118 – 122; Frühgeborene, Immundefizienz und Asplenie, Allergien, Impfempfehlungen für Aussiedler, Flüchtlinge oder Asylsuchende), 7. Zukünftige Impfstoffe (S. 124 – 128; Rotavirus-Vakzine, HIV, Neue Impftechnologien). Am Schluss findet sich ein relativ kurz gefasster aber ausreichender Index. Wie nicht anders zu erwarten, sind alle Kapitel sehr sorgfältig erarbeitet, ist doch der Autor seit längerem als erfahrener Kinderarzt, Infektiologe und Impfarzt bekannt. Wo sinnvoll finden sich Internetadressen, um dem Leser die ständig notwendigen Aktualisierungen zu erleichtern. Besonders hinweisen möchte der Rezensent auf das Kapitel 6. Impfungen in besonderen Situationen, da hier der Autor klar und deutlich viele Details erläutert und die immer wieder zu registrierenden Missverständnisse ausräumt. Die Abbildungen und Tabellen sind sehr gut gelungen und für den Leser hilfreich. Ausstattung, Druck und Papier sind einwandfrei. Das Buch sollte bei keinem Arzt fehlen, der direkt oder indirekt mit Schutzimpfungen befasst ist. Der Preis ist als angemessen anzusehen. F.- B. Spencker, Leipzig QUALITÄTSSICHERUNG "Bakteriengenom-Nachweis PCR / NAT": Auswertung des aktuellen Ringversuchs von INSTAND e.V. zur externen Qualitätskontrolle molekularbiologischer Nachweisverfahren in der bakteriologischen Diagnostik - Beitrag der Qualitätssicherungskommission der DGHM Udo Reischl, Norbert Lehn, Hans Wolf Institut für Medizinische Mikrobiologie und Hygiene, Klinikum der Universität Regensburg Matthias Maaß Institut für Medizinische Mikrobiologie, Universitätsklinikum Salzburg Eberhard Straube Institut für Medizinische Mikrobiologie, Klinikum der Friedrich-Schiller Universität Jena Nach erfolgreicher Etablierung dieser neuen Ringversuchs-Serie wollen wir hier auch für Kolleginnen und Kollegen, die bisher noch nicht an diesen Ringversuchen teilgenommen haben, die Ergebnisse der aktuellen Ringversuche für den NAT-gestützten Nachweis von Neisseria gonorrhoeae, Chlamydia trachomatis, Bordetella pertussis, Helicobacter pylori, EHEC / STEC, Borrelia burgdorferi sensu lato, Legionella pneumophila, Salmonella enterica und Listeria spp., MRSA bzw. cMRSA und Chlamydia pneumoniae darstellen und kurz diskutieren. Für nähere Informationen über die Zusammensetzung der Ringversuchsproben, dem Sinn und Zweck dieser neuen Möglichkeit zur externen Qualitätskontrolle im Umfeld der Nukleinsäurediagnostik sowie zu den Eckdaten unseres flexiblen Ringversuchskonzepts sei hier auf unsere initiale Veröffentlichung in dieser Zeitschrift verwiesen (13. Jahrgang, August 2003, Heft 4, Seiten 149-156). Gerne werden wir hier auch weiterhin in regelmäßigen Abständen und in ähnlicher Form über die Auswertung und Analyse der zukünftigen Ringversuche berichten. Wie bei allen anderen Ringversuchen erfolgt die Anmeldung zu ausgewählten Teilen der Reihe "BakteriengenomNachweis (PCR / NAT)" über das Institut für Standardisierung und Dokumentation im Medizinischen Laboratorium (INSTAND e.V.), Düsseldorf (www.instand-ev.de). Nach Abschluß des jeweiligen Ringversuchs werden die Ergebnisse der einzelnen Teilnehmer dort zentral erfasst und anhand von individuellen Bewertungskriterien werden die schriftlichen Zertifikate erstellt. Eine Analyse der Ringversuchsergebnisse in ähnlicher Form ist bereits jedem der angemeldeten Teilnehmer als Anlage zu diesem Zertifikat zugegangen. Zusätzlich stehen für diesen und für alle folgenden Ringversuche eine Reihe weiterer Informationen (wie die anonymisierten Ergebnisse der einzelnen Sollwertlaboratorien oder die entsprechenden Ergebnisse unserer quantitativen real-time PCR Testsysteme) auch im Internet unter "www.udo-reischl.de", Unterpunkt "INSTAND-Ringversuche (PCR / NAT)", als pdf-Files zum freien Download bereit. Bei der Gestaltung zukünftiger erregerspezifischer Ringversuche sind wir natürlich stets bemüht den Anregungen und Wünschen von Seiten der Teilnehmer möglichst zeit- nah und professionell Rechnung zu tragen. Nach dem erfolgreichen Verlauf der aktuellen Probe-Ringversuche werden RV 539 "MRSA bzw. cMRSA" (sog. communityassociated Methicillin-resistente S. aureus) und RV 540 "Chlamydia pneumoniae" nun als fester Bestandteil in das PCR/NAT-Ringversuchsprogramm von INSTAND e.V. aufgenommen. Die Konzeption und Auswertung der Chlamydia pneumoniae-spezifischen Ringversuche erfolgt dabei in enger Zusammenarbeit mit Herrn Professor Maaß, Universitätsklinikum Salzburg, der hier auch als Ringversuchsleiter fungieren wird. Mit der Einbeziehung der beiden letztgenannten Erreger bzw. Erregergruppen wollen wir vor allem den zahlreichen Anfragen seitens humandiagnostisch orientierter mikrobiologischer Laboratorien und aktuellen infektiologischen Notwendigkeiten nachkommen. Anmerkung: ab 2006 werden die Ringversuche zum "Bakteriengenom-Nachweis mittels PCR oder anderer Nukleinsäureamplifikationstechniken" (jetzt RV 430 bis RV 438) aus organisatorischen Gründen bei INSTAND e.V. der 500er-Nummerngruppe zugeordnet (dann RV 530 bis RV540). Nachdem in einigen der vorhergegangenen Runden dieser Ringversuchs-Serie vorwiegend Proben mit relativ hoher Keimzahl versandt wurden, wurde bei der Konzeption des aktuellen Ringversuchs zum Bakteriengenomnachweis mittels PCR oder anderer Nukleinsäure-amplifikationstechniken (NAT) bei einigen Zielorganismen wieder der Versand von Proben mit relativ niedrigen bzw. als grenzwertig zu betrachtenden Erregerzahlen angestrebt. Es sei an dieser Stelle auch darauf hingewiesen, dass zahlreiche Rückstell-Probensätze der letzten Ringversuche verfügbar sind und bei Bedarf über den Ringversuchsleiter nachbestellt werden können. Die jeweiligen Sets an Rückstellproben enthalten u.a. als "grenzwertig positiv" zu bezeichnende Proben für B. pertussis (Probe # 32202), H. pylori (Probe # 32302), B. burgdorferi (Probe # 32503), L. pneumophila (Probe # 32601) und für Salmonella enteritidis (Probe # 32702). Auch in den aktuellen Ringversuchssets befinden sich wieder einige Proben mit relativ geringer Menge folgender Zielorganismen: Chlamydia trachomatis (Probe # 52101), B. pertussis (Probe # MIKROBIOLOGE 16.Jg. 2006 145 52204), EHEC (Probe # 52401), L. pneumophila (Probe # 52603), L. monocytogenes (Probe # 52801), MRSA (Probe # 52903), sowie Chlamydia pneumoniae (Probe # 52411). Im Rahmen der Testentwicklung bzw. Testoptimierung können diese Probensätze beispielsweise als Qualitätskontrollen oder als standardisierte Sensitivitätsmarker für die Austestung der unteren Nachweisgrenze von eigen entwickelten Nukleinsäure-gestützten Testsystemen dienen. Mit Ausnahme der zuvor erwähnten "grenzwertig positiven" Einzelproben wurden die Mengen der entsprechenden Zielorganismen in den Probensätzen der aktuellen Ringversuchsrunde wieder relativ deutlich über der Nachweisgrenze von "durchschnittlich sensitiven PCR/NATTestkonzepten" eingestellt. Diese definieren wir wie folgt: als Richtwert für die Bewertung von Ringversuchsergebnissen gilt das 50- bis 100-fache der unteren Nachweisgrenze durchschnittlich sensitiver PCR-Protokolle unter Standardbedingungen (50 µl Reaktionsansätze, 35 PCRZyklen, gut evaluierte Primersequenzen). Bei den meisten Probenmaterialien der aktuellen Ringversuchsrunde stellen falsch-negative Ergebnisse damit einen deutlichen Hinweis auf ernstzunehmende Mängel innerhalb der eingesetzten Verfahren zur NukleinsäureExtraktion, Amplifikation und Detektion dar. Falsch-positive Ergebnisse sind dagegen in der Regel als Hinweis auf eine Kreuzkontamination während der Probenextraktion und -abarbeitung und/oder auf mangelnde Spezifität der eingesetzten Testsysteme zu betrachten. In bewährter Form werden im Folgenden die Ergebnisse der jeweiligen erregerspezifischen Ringversuche dargestellt. Tabelle 1 zeigt dabei die Probenzusammensetzung und das erwartete Ergebnis (Sollwert). Die von den einzelnen Teilnehmern mitgeteilten Ergebnisse werden in Tabelle 2 nach der Häufigkeit der Mitteilung von positiven oder negativen Ergebnissen und in Tabelle 3 nach der absoluten Anzahl der richtig positiven und richtig negativen Ergebnisse sowie deren prozentualem Anteil (Befundhäufigkeit) je Amplifikationssystem bzw. Testkonzept aufgeschlüsselt. Für die objektive Bewertung von kommerziellen Testsystemen sollten neben der rein statistischen Betrachtung der mitgeteilten Ringversuchsergebnisse auch die Anzahl und vor allem die methodische bzw. technische Qualifikation der individuellen Teilnehmer berücksichtigt werden. Da wir im Zuge unserer Ringversuche aber das gesamte Spektrum von spezialisierten Expertenlabors bis hin zum "Gelegenheitsanwender" abdecken, müssen die arithmetisch ermittelten Richtigkeitsquoten bei der Bewertung einzelner Testsysteme auch immer mit einem gewissen Toleranzbereich betrachtet werden. RV 430: Chlamydia trachomatis & Neisseria gonorrhoeae Die relativ hohe Erregermenge in zwei der drei positiven Proben und die Verfügbarkeit gut evaluierter und z.T. automatisierter NAT-gestützter Analysesysteme für beide Zielorganismen führte hier zu hohen Richtigkeitsquoten sowohl für positive als auch für negative Befunde. Das aktuelle Set an Ringversuchsproben enthielt diesmal eine Probe mit einer etwas geringeren Menge an C. trachomatis (# 52001), eine Probe mit relativ hoher Menge an N. gonorrhoeae (# 52004), eine Probe mit etwas geringeren Mengen an C. trachomatis und N. gonorrhoeae (# 52002) sowie eine Probe ohne diese beiden Zielorganismen (# 52003). Unter den von 74 Teilnehmern mitgeteilten 296 NATErgebnissen fanden sich für Chlamydia trachomatis insgesamt nur 1 falsch-positives Ergebnis (das vermutlich durch laborinterne Kontaminationsereignisse hervorgerufen wurde) und 15 falsch-negative Ergebnisse. Dabei wurden 7 der insgesamt 15 falsch-negativen Ergebnisse bei der schwach positiven Probe # 52001 beobachtet. Im Rahmen des NAT-gestützten Gonokokken-Nachweises wurde lediglich von einem Teilnehmer für die Probe # 52003 ein falsch-positives Ergebnis mitgeteilt. Bei den ermittelten Richtigkeitsquoten für Teilnehmer mit dem Roche Amplicor, COBAS Amplicor, dem Becton Dickinson ProbeTec oder anderen Testsystemen muss berücksichtigt werden, dass im Rahmen dieser Ringversuchsauswertung in Tabelle 3 nicht zwischen dem spezifischen Nachweis von Chlamydien und Gonokokken differenziert wurde. Mit Ausnahme der Probe # 52002, die etwas geringere Mengen an beiden Zielorganismen enthielt, wurden mit diesen kombinierten Testsystemen insgesamt relativ hohe Richtigkeitsquoten sowohl für die positiven als auch für die negativen Ergebnisse beobachtet. Interessanterweise schnitt auch diesmal die Gruppe der eigenentwickelten "in house" Assays im Durchschnitt etwas schlechter ab als die Gruppe der kommerziellen Testsystmeme. Inhibitionsereignisse wurden von keinem der Teilnehmer beobachtet. Unabhängig von der Art des verwendeten Testsystems soll in diesem Zusammenhang auch noch einmal darauf hingewiesen werden, dass in Gegenwart von relativ hohen Mengen an Zielorganismen (bzw. deren Nukleinsäure) die Interne Kontrollreaktion aufgrund der "Konkurrenzsituation" mit der Amplifikaton der eigentlichen Zielsequenz durchaus negativ ausfallen kann, obwohl keine Inhibiton der PCR-Reaktion im eigentlichen Sinne vorliegt. PCR-/NAT Chlamydia trachomatis & GO (RV 430) September 2005 Tabelle 1: Probenzusammensetzung und erwartetes Ergebnis. Tabelle 2: Häufigkeit der Mitteilung verschiedener Befunde Probennummer n = 74 52004 146 Ø / ++ 64 63 Escherichia coli K12 Neisseria gonorrhoeae 4 (~ 1x10 CFU/mL) MIKROBIOLOGE 16.Jg. 2006 52004 Ø/Ø 52003 62 52002 +/+ Positiv CT Positive CT & GO Positive GO 67 6 0 1 0 60 0 0 0 1 Negativ 7 8 73 0 Fraglich 0 0 0 0 Befund 52001 52002 Chlamydia trachomatis (~ 1x103 IFU/mL) Chlamydia trachomatis 3 (~ 1x10 IFU/mL) & Neisseria gonorrhoeae (~ 5x103 CFU/mL) 52004 61 52003 +/Ø 52002 52001 52003 Inhibition Probenzusammensetzung / Erwartet 52001 Gruppe A n.d. 0 0 0 0 0 nein 74 74 74 74 73 Ja 0 0 0 0 Tabelle 3: Häufigkeit richtig positiver und richtig negativer NAT-Befunde bei Anwendern verschiedener Methoden. NAT richtig positiv NAT-Methode [Code] (total number *) NAT richtig negativ Absolut Relativ % Absolut Relativ % COBAS Amplicor [23] (n = 38) 109 109 / 114 96 34 34 / 34 100 In house PCR assay [28] (n = 17) 48 48 / 51 94 15 15 / 17 88 BD ProbeTec [24] (n = 11) 29 29 / 33 88 11 11 / 11 100 Roche Amplicor [22] (n = 4) 11 11 / 12 92 4 4/4 100 GenProbe Amplified CT [21] (n = 1) 0 0/3 0 1 1/1 100 Other commercial tests [27] (n = 6) 13 13 / 18 72 6 6/6 100 Andere / k.A. [29] (n = 1) 2 2/3 66 1 1/1 100 * Durch Mehrfachnennung oder fehlende Angabe kann die absolute Zahl der Ergebnisse (Tab. 2) von der Anzahl der Teilnehmer abweichen. RV 431: Chlamydia trachomatis Das aktuelle Set an Ringversuchsproben enthielt diesmal zwei Proben mit höherer Menge an Zielorganismen (# 52102 und # 52103), eine Probe mit etwas geringerer Menge (# 52101), sowie eine Probe ohne Zielorganismen (# 52104), die ausschließlich E. coli enthielt. Wurden bei den vorhergegangenen Ringversuchen noch durchwegs sehr hohe Richtigkeitsquoten sowohl für die positiven als auch für die negativen Befunde ermittelt, so lagen diesmal vor allem bei der niedriger konzentrierten Probe # 52101 die Richtigkeitsquoten für die positiven Ergebnisse deutlich niedriger. Aufgrund der relativ geringen Menge an Zielorganismen in der Probe # 52101 und dem Umstand, dass derzeit noch keine verbindlichen Untergrenzen für die analytische Sensitivität von diagnostischen Nachweissystemen für C. trachomatis definiert sind, wurde bei der Erstellung der Zertifikate ein negatives Ergebnis hier nicht als "falsch-negativ" bewertet. Unabhängig davon sollten aber bei Ringversuchsteilnehmern mit hohem Anspruch an die individuelle Testsensitivität solche falsch-negativen Ergebnisse gegebenenfalls Anlass zur Überprüfung und Optimierung des jeweiligen NAT-gestützten Testsystems sein. Im Gegensatz zur vorhergegangenen Runde dieses Ringversuchs gab es diesmal leider wieder 3 falsch-positive Ergebnisse für die negative Probe # 52104, was bei den betroffenen Teilnehmern auch indirekt für ein Versagen von Test- bzw. laborspezifischen Maßnahmen zur Vermeidung von Kontaminationsereignissen sprechen könnte. Diese Problematik muss umso mehr hervorgehoben werden, da sich unter den 4 Proben des aktuellen Ringversuchs keine hochpositiven und damit kontaminationsträchtigen Einzelproben befanden. Inhibitionsereignisse wurden von keinem der insgesamt 83 Teilnehmer mitgeteilt Die schwach positive Probe # 52101 ausgenommen, fanden sich unter den 332 mitgeteilten NAT-Ergebnissen 3 als "fraglich" eingestufte, 20 falsch-negative und 3 falsch-positive Ergebnisse. Ansonsten waren im Rahmen dieses Ringversuchs keine auffälligen Unterschiede hinsichtlich Sensitivität und Spezifität zwischen den kommerziellen (n = 67) und den selbst entwickelten in house-Testsystemen (n = 16) zu beobachten. Bei den Ringversuchen RV 430 und RV 431 gaben insgesamt drei der Teilnehmer die Verwendung von AMPLIFIED Testkits der Firma Gen-Probe an. Dieses Testsystem weist die erregerspezifischen RNA-Zielsequenzen bekanntermaßen über einen RNA-basierten Amplifikationsprozess (TMA; Transcription-Mediated Amplification) nach. Auch wenn das Herstellungsverfahren unserer Ringversuchsproben primär nicht auf die Stabilisierung von RNA-Molekülen hin optimiert und getestet wurde, so weist die erfolgreiche Detektion von C. trachomatis RNA in 2 der insgesamt 5 positiven Proben doch auf die Anwesenheit von ausreichend hohen Mengen an erregerspezifischen RNA-Molekülen in dem konfektionierten und lyophilisierten Probenmaterial hin. Interessanterweise konnten mit den AMPLIFIED Testkits im Rahmen der aktuellen Ringversuchsrunde aber nur diejenigen Proben mit mindestens 104 IFU / ml positiv getestet werden. Offensichtlich wurde mit dieser Erregermenge die untere Nachweisgrenze dieses Testsystems erreicht. Die niedriger konzentrierten Proben (# 52001, # 52002 und # 52101; C. trachomatis ~ 103 IFU/ml) konnten von keinem der 3 Teilnehmer mit dem AMPLIFIED Testkit der Firma GenProbe positiv getestet werden. PCR-/NAT Chlamydia trachomatis (RV 431) September 2005 Tabelle 1: Probenzusammensetzung und erwartetes Ergebnis. Tabelle 2: Häufigkeit der Mitteilung verschiedener Befunde Probennummer n = 83 Inhibition 52103 ++ 61 52104 Ø 62 52104 61 52103 ++ 52102 52102 Chlamydia trachomatis (~ 1x103 IFU/mL) Chlamydia trachomatis 4 (~ 1x10 IFU/mL) Chlamydia trachomatis 4 (~ 1x10 IFU/mL) 52101 61 52104 + Befund 52103 52101 52102 Probenzusammensetzung Erwartet 52101 Gruppe A Positiv 60 81 75 3 n.d. 2 2 2 2 Negativ 12 1 7 80 nein 81 81 81 81 Fraglich 1 1 1 0 ja 0 0 0 0 Escherichia coli K12 MIKROBIOLOGE 16.Jg. 2006 147 Tabelle 3: Häufigkeit richtig positiver und richtig negativer NAT-Befunde bei Anwendern verschiedener Methoden. NAT richtig positiv NAT-Methode [Code] (total number *) NAT richtig negativ Absolut Relativ % Absolut Relativ % COBAS Amplicor [23] (n = 36) 100 103 / 108 95 35 35 / 35 100 In house PCR assay [28] (n = 15) 40 40 / 45 88 14 14 / 15 93 BD ProbeTec [24] (n = 9) 25 25 / 27 93 9 9/9 100 Roche Amplicor [22] (n = 7) 21 24 / 21 100 7 7/7 100 Other commercial tests [27] (n = 8) 22 22 / 24 92 7 7/8 87 GenProbe AMPLIFIED [21] (n = 2) 4 4/6 66 2 2/2 100 RealArt CT [25] (n = 10) 25 25 / 30 83 9 9 / 10 90 Andere / k.A. [29] (n = 1) 2 2/3 66 1 1/1 100 * Durch Mehrfachnennung oder fehlende Angabe kann die absolute Zahl der Ergebnisse (Tab. 2) von der Anzahl der Teilnehmer abweichen. RV 432: Bordetella pertussis Das aktuelle Set an Ringversuchsproben enthielt je eine Probe mit hoher Menge an Zielorganismen (# 52202), mit relativ geringerer Menge (# 52204), ohne Zielorganismen (# 52203), sowie eine Probe mit relativ hoher Menge an einer mit dem Zielorganismus eng verwandten Spezies (# 52201). Die Verfügbarkeit von offensichtlich inzwischen sehr gut evaluierten NAT-gestützten Analysesystemen für den Nachweis von B. pertussis DNA führte auch diesmal zu hohen Richtigkeitsquoten bei der relativ stark positiven und bei der negativen Probe. Die etwas geringere Menge an B. pertussis in der Probe # 52204 konnte zudem von 42 der insgesamt 57 Teilnehmer mit den individuell etablierten PCR-Testsystemen eindeutig nachgewiesen werden. Nur 14 Teilnehmer berichteten hier ein falsch-negatives Ergebnis und ein Teilnehmer klassifizierte sein Ergebnis für Probe # 52204 als "fraglich". Auffällig war beim aktuellen Ringversuch eine hohe Rate an "falsch-positiven" Ergebnissen für die Probe #52201, die diesmal nennenswerte Mengen an Bordetella holmesii enthielt. Wie bereits bei zwei der vorhergegangenen Ringversuche erwähnt, ist diese Kreuzreaktion bei der Verwendung von IS481 als "B. pertussis-spezifische" Zielsequenz jedoch ganz einfach zu erklären: auf dem Genom aller bisher untersuchten B. holmesii-Isolate befinden sich einige Kopien der bakteriellen Insertionssequenz IS481. Kopien der Insertionssequenz IS481wurden auch gelegentlich bei B. bronchiseptica gefunden. Dieser Umstand führte bei 46 der 57 Teilnehmer zwangsläufig zu "falschpositiven" PCR-Ergebnissen für die Probe #52201. Die Inzidenz von B. holmesii und B. bronchiseptica in klinischen Materialien von Menschen dürfte jedoch (zumindest hierzulande) eher gering sein. Daher erscheint es auch vertretbar, die Sequenz IS481, für die eine Vielzahl von Validierungsdaten vorliegt, auch weiterhin zur NATgestützten Diagnostik einer Infektion mit B. pertussis einzusetzen. Bemühungen zu einer internationalen Standardisierung der Bordetella-PCR im real-time Format sind nach wie vor auf dem Wege. Im Rahmen dieses Ringversuchs wollten wir aber lediglich auf diese potentielle Kreuzreaktion aufmerksam machen, und bei Verwendung der IS481-Zielsequenz wurde ein positives Ergebnis für Probe #52204 daher nicht als Fehler bewertet. Zudem wurde diese unausweichliche Kreuzreaktion nicht bei der Berechnung der Richtigkeitsquoten für die negativen Ergebnisse berücksichtigt (Tabelle 3). Unter den insgesamt 228 NAT-Ergebnissen befanden sich somit 15 falsch-negative (für die B. pertussis-positiven Proben #52202 und #52204) aber kein falsch-positives Ergebnis. Inhibitionskontrollen wurden von 54 der insgesamt 57 Teilnehmer durchgeführt und Inhibitionsereignisse wurden nicht beobachtet. Wie auch beim vorhergehenden Ringversuch verwendete die überwiegende Anzahl der Teilnehmer selbst entwickelte (in house) Testsysteme mit Inhibitions- und/oder Positivkontrollen zum NATgestützten Nachweis von B. pertussis. PCR-/NAT Bordetella pertussis (RV 432) September 2005 61 52203 Ø 62 Escherichia coli K12 52204 + 61 Bordetella pertussis ATTC 12742 4 (~ 1x10 CFU/mL) MIKROBIOLOGE 16.Jg. 2006 52204 ++ 52203 52202 Bordetella holmesii clin. isolate 6 (~ 5x10 CFU/mL) Bordetella pertussis ATTC 12742 5 (~ 1x10 CFU/mL) 52202 62 Inhibition 52201 Ø Probennummer n = 57 Befund 52204 52201 148 Probenzusammensetzung 52203 Erwartet 52202 Gruppe A Tabelle 2: Häufigkeit der Mitteilung verschiedener Befunde. 52201 Tabelle 1: Probenzusammensetzung und erwartetes Ergebnis. Positiv 46 56 0 42 n.d. 3 3 3 3 Negativ 11 1 57 14 nein 54 54 54 54 Fraglich 1 1 0 1 ja 0 0 0 0 Tabelle 3: Häufigkeit richtig positiver und richtig negativer NAT-Befunde bei Anwendern verschiedener Methoden. NAT richtig positiv NAT richtig negativ NAT-Methode [Code] (total number *) Absolut Relativ In house PCR assay [28] (n = 48) % Absolut Relativ % 100 133 133 / 144 92 48 48 / 48 AmpliWell Pertussis [21] (n = 2) 6 6/6 100 2 2/2 100 Other commercial tests [27] (n = 6) 14 14 / 18 77 6 6/6 100 Andere / k.A. [29] (n = 1) 1 1/2 50 2 2/2 100 * Durch Mehrfachnennung oder fehlende Angabe kann die absolute Zahl der Ergebnisse (Tab.2) von der Anzahl der Teilnehmer abweichen. RV 433: Helicobacter pylori Die Verfügbarkeit gut evaluierter NAT-gestützter Analysesysteme und die relativ hohe Menge an Zielorganismen in den positiven Proben # 52302 und # 52304 führte beim Nachweis von H. pylori zu insgesamt sehr hohen Richtigkeitsquoten. Probe # 52301 enthielt diesmal eine Kultursuspension der Spezies Helicobacter salomonis, deren DNA mit den NAT-Testsystemen der insgesamt 15 Teilnehmer offensichtlich keine "spezifischen" Amplifikationsprodukte erzeugte. Daher lagen die Richtigkeitsquoten der positiven und der negativen Befunde diesmal erfreulicherweise bei 100 %. Alle Teilnehmer verwendeten zum NAT-gestützten Nachweis von H. pylori selbst entwickel- te, sog. in house Testsysteme (bei 12 der 15 Teilnehmer beinhalteten diese Testsysteme auch eine Inhibitionsund/oder Positivkontrolle) und bei keiner der untersuchten Proben wurden dabei signifikante Inhibitionsereignisse beobachtet. Wie in der Beschreibung des Ringversuchs 433 vermerkt, konnten die Teilnehmer auf freiwilliger Basis auch die vermeintliche Clarithromycin-Resistenz der untersuchten H. pylori Isolate mitteilen. Diese Spezialuntersuchung zur molekularbiologischen Resistenztestung erfolgt in der Regel über die Amplifikation und Sequenzierung von charakteristischen Bereichen innerhalb der H. pylori 28S rDNA. Ergebnisse wurden hier von 10 der 15 Teilnehmer mitgeteilt, und diese waren auch durchwegs korrekt. PCR-/NAT Helicobacter pylori (RV 433) September 2005 Tabelle 1: Probenzusammensetzung und erwartetes Ergebnis. 5 52303 Ø 62 52304 + 61 / 71 Helicobacter pylori (~ 1x10 CFU/mL) Clarithromycin susceptible (wildtype 28S rDNA sequence) 52304 61 / 72 52303 ++ Befund 52302 52302 Helicobacter salomonis 4 (~ 5x10 CFU/mL) 52301 62 52304 Ø Inhibition 52303 52301 Probennummer n = 15 Probenzusammensetzung 52302 Erwartet 52301 Gruppe A Tabelle 2: Häufigkeit der Mitteilung verschiedener Befunde Positiv 0 15 0 15 n.d. 3 3 3 3 Negativ 15 0 15 0 nein 12 12 12 12 Fraglich 0 0 0 0 ja 0 0 0 0 Escherichia coli K12 4 Helicobacter pylori (~ 1x10 CFU/mL) Clarithromycin resistant (GGA mutation in 28S rDNA) Tabelle 3: Häufigkeit richtig positiver und richtig negativer NAT-Befunde bei Anwendern verschiedener Methoden. NAT richtig positiv NAT richtig negativ NAT-Methode [Code] (total number *) In house PCR assay [28] (n = 15) Andere / k.A. [29] (n = 0) * Absolut Relativ % Absolut Relativ % 30 30 / 30 100 30 30 / 30 100 - - - - - - Durch Mehrfachnennung oder fehlende Angabe kann die absolute Zahl der Ergebnisse (Tab. 2) von der Anzahl der Teilnehmer abweichen. MIKROBIOLOGE 16.Jg. 2006 149 RV 434: EHEC / STEC Wie bei den vorhergegangenen Runden dieses Ringversuchs mehrfach diskutiert, besteht die eigentliche Herausforderung bei dem Nukleinsäure-gestützten Nachweis von EHEC/STEC prinzipiell nicht so sehr in dem gezielten Nachweis sehr geringer Mengen an Zielorganismen sondern vielmehr in der differenzierten Analyse und der Typisierung unterschiedlicher Shiga-Toxin Gene und anderer putativer Pathogenitätsfaktoren (wie das für Intimin codierende eae-Gen oder das für Enterohämolysin codierende hlyA-Gen) von entsprechenden Zielorganismen. Aus diesem Grund werden bei der Probenkonfektionierung von uns meist nicht nur die klassischen "Prototyp" EHECStämme (wie z.B. O157:H7) sondern relativ willkürlich auch Routineisolate aus einer inzwischen sehr umfangreichen Sammlung von stx-positiven E. coli ausgewählt. Da wir uns innerhalb des gesamten Ringversuchsprogramms gelegentlich auch mit einzelnen Proben an die derzeit technisch machbare untere Nachweisgrenze annähern wollen (Anmerkung: wir sind uns dabei sehr wohl bewusst, dass bei vielen Fragestellungen das "technisch machbare" nicht unmittelbar gleichbedeutend mit dem "diagnostisch sinnvollen" ist), wurden die beiden positiven Proben des aktuellen Probensets (# 52401; E. coli O146: H21, stx1-positiv, eae- und hlyA-negativ; sowie # 52402; E. coli O76:H19, stx1- und stx2-positiv, eae-negativ und hlyA-positiv) mit relativ geringen Mengen der entsprechenden Zielorganismen versetzt. Offensichtlich stellte vor allem der gezielte Nachweis des stx1-positiven E. coli O146:H21 aus der Probe # 52401 eine echte Herausforderung an die analytische Sensitivität der individuellen NAT-gestützten Testsysteme dar. Obwohl sie nahezu gleich viele (bzw. wenige) Erreger wie die Probe # 52402 enthielt, wurde sie nur von 38 der insgesamt 49 Teilnehmer als positiv befundet. Dies spiegelt sich bei der statistischen Auswertung natürlich unmittelbar in den entsprechend niedrigen Richtigkeitsquoten für die positiven Ergebnisse wider. Aufgrund der relativ geringen Menge an Zielorganismen in den beiden positiven Proben und dem Umstand, dass derzeit noch keine verbindlichen Untergrenzen für die analytische Sensitivität von diagnostischen Nachweissystemen für EHEC definiert sind, wurde bei der Erstellung der Zertifikate ein negatives Ergebnis bei Probe # 52401 hier nicht als "falsch-negativ" bewertet. Entsprechende Zertifikate wurden lediglich solchen Teilnehmern vorenthalten, die negative Ergebnisse für alle 4 der ausgesandten Einzelproben mitteilten. Da in den meisten der teilnehmenden Laboratorien ein NAT-gestützter Nachweis von Shiga-Toxin Genen im Umfeld der EHEC-Diagnostik primär als Kulturbestätigungstest eingesetzt wird, werden bei zukünftigen Ringversuchen die meisten der positiven Proben auch wieder deutlich höhere Mengen an Zielorganismen enthalten, und der Schwerpunkt wird wieder auf der Abprüfung der Spezifität der eingesetzten Testsysteme und weniger auf der dabei erzielten unteren Nachweisgrenze liegen. Werden in bestimmten Laboratorien solche Nachweisverfahren in einigen Fällen jedoch auch zum gezielten Direktnachweis von EHEC in klinischem Untersuchungsmaterial oder in Lebensmittelproben eingesetzt, so sollten falsch-negative Ergebnisse bei den Proben # 52401 und # 52402 Anlass zur Überprüfung und Optimierung des jeweiligen Testsystems sein. Abgesehen von den zuvor diskutierten 13 falsch-negativen Ergebnissen wurden bei den übrigen Proben erfreulicherweise hohe Richtigkeitsquoten erzielt. Die Mehrzahl der Teilnehmer verwendete dabei selbst entwickelte (in house) oder "andere" Testsysteme mit Inhibitions- und/oder Positivkontrollen zum NATgestützten Nachweis von EHEC, und bei keiner der ausgesandten Proben wurden signifikante Inhibitionsereignisse beobachtet. Lediglich 7 Teilnehmer gaben hier die Verwendung von kommerziellen NAT-Testsystemen für die Nukleinsäure-gestützte EHEC-Diagnostik an - leider wurden die Hersteller der entsprechenden Testkits nicht durchgehend spezifiziert. Zudem wurden von 32 der 49 Teilnehmer in gewissem Umfang die Ergebnisse der molekulargenetischen ShigaToxin Subtypisierung sowie des gezielten Nachweises von Intimin- (eae) und/oder Enterohämolysin (hlyA)-Genen mitgeteilt. Wenn auch die Typisierung nicht immer vollständig durchgeführt wurde, so waren diese Angaben bei der Mehrzahl der Teilnehmer, zumindest in dem mitgeteilten Umfang, korrekt. PCR-/NAT EHEC / STEC (RV 434) September 2005 61 /71 52403 Ø 62 52404 Ø 62 150 MIKROBIOLOGE 16.Jg. 2006 Befund 52404 + 52403 52402 3 EHEC (~ 1x10 CFU/mL) (O146:H21; stx-1) 3 EHEC (~ 5x10 CFU/mL) (O76:H19; stx-1 ; stx-2; hlyA) Escherichia coli K12 (negative for eae and hlyA) Escherichia coli K12 (negative for eae and hlyA) Inhibition 52402 61 /71 Probennummer 52401 + n = 49 52404 52401 Probenzusammensetzung 52403 Erwartet 52402 Gruppe A Tabelle 2: Häufigkeit der Mitteilung verschiedener Befunde 52401 Tabelle 1: Probenzusammensetzung und erwartetes Ergebnis. Positiv 38 13 2 2 n.d. 3 3 3 3 Negativ 11 2 47 47 nein 46 46 46 46 Fraglich 0 0 0 0 ja 0 0 0 0 Tabelle 3: Häufigkeit richtig positiver und richtig negativer NAT-Befunde bei Anwendern verschiedener Methoden. NAT richtig positiv NAT richtig negativ NAT-Methode [Code] (total number*) * Absolut Relativ % Absolut Relativ % In house PCR assay [28] (n = 41) 70 70 / 82 85 80 80 / 82 97 Other commercial tests [27] (n = 7) 14 14 / 14 100 13 13 / 14 93 Andere / k.A. [29] (n = 1) 1 1/2 50 1 1/2 50 Durch Mehrfachnennung oder fehlende Angabe kann die absolute Zahl der Ergebnisse (Tab. 2) von der Anzahl der Teilnehmer abweichen. RV 435: Borrelia burgdorferi Wie im Rahmen dieser Ringversuchsserie bereits mehrfach angesprochen, sind die starken Schwankungen vieler etablierter Testsysteme hinsichtlich ihrer Sensitivität und Spezifität bei der Erfassung von unterschiedlichen Borrelia Genotypen, die, zumindest außerhalb den Vereinigten Staaten von Amerika, mit relativ hoher Inzidenz gefunden werden, nach wie vor ein zentrales Problem der NATgestützten Borrelien-Diagnostik. Diese Situation spiegelte sich auch in gewissem Umfang bei der Auswertung der bisherigen Ringversuche zum Nachweis von BorrelienDNA wider. Wie bereits bei den vorhergegangenen Probenpanels praktiziert, so wurden auch diesmal bei der Konzeption der 4 Einzelproben nicht nur Verdünnungen des amerikanischen "Prototyp"-Isolates von Borrelia burgdorferi sensu stricto angefertigt, sondern vielmehr Proben mit den in Europa relativ häufig beobachteten Genotypen Borrelia garinii und Borrelia afzelii versandt. Diese beiden Borrelia-Spezies unterscheiden sich auf Nukleinsäureebene, zumindest innerhalb einiger populärer PCR-Zielgene in gewissem Umfang von Borrelia burgdorferi sensu stricto. Borrelia garinii und Borrelia afzelii sind in unseren Breiten die wohl am weitesten verbreiteten Spezies mit bekanntermaßen pathogener Relevanz. Dagegen handelt es sich bei Borrelia recurrentis um Rückfallfieber-Borrelien und nicht um einen Erreger aus dem Borrelia burgdoferi sensu lato Komplex. Grundsätzlich muß dieser Erreger natürlich nachgewiesen werden - aber nicht im Zusammenhang mit einer Borrelia burgdorferi sensu lato-spezifischen PCR. Probe # 52502 enthielt diesmal eine relativ hohe Menge an Borrelia garinii, die auch von 67 der insgesamt 72 Teilnehmer als positiv getestet wurde. Lediglich 5 Teilnehmer berichteten hier ein falsch-negatives Ergebnis. Zwei dieser 5 Teilnehmer verwendeten dabei ein TaqMan real-time PCR Protokoll und das Flagellin (fla)-Gen als spezifische Zielsequenz, ein Teilnehmer den kommerziellen RealArt Borrelia Testkit, und zwei Teilnehmer gaben hier die Verwendung eines nested Block-Cycler PCR- Protokolls zur Amplifikation von spezifischen Bereichen der 16S rDNA und anschließender DNA-Sequenzierung zur Charakterisierung der Amplifikationsprodukte an. Probe # 52504 enthielt eine (im Vergleich zu manch typischem klinischen Probenmaterial) doch noch recht ansehnliche Menge an Borrelia afzelii - die im Rahmen dieses Ringversuchs erfreulicherweise von 69 Teilnehmern zuverlässig und eindeutig nachgewiesen werden konnte. Bis auf 20 Teilnehmer haben alle selbstentwickelte (in house) Testsysteme mit Inhibitions- und/oder Positivkontrollen zum NAT-gestützten Nachweis von BorrelienDNA verwendet; eine signifikante Inhibition der PCRReaktion wurde dabei lediglich von einem Teilnehmer bei zwei Einzelproben beobachtet. Überraschenderweise wurden diesmal eine relativ hohe Zahl von falsch-positiven Ergebnissen bereichtet. Von den insgesamt 23 falsch-positive Ergebnissen entfielen 13 auf die Probe # 52503 (Treponema phagedenis) und 10 auf Probe # 52501 (Borrelia recurrentis). In ersterem Fall lassen sich diese wohl am ehesten mit Kontaminationsereignissen während der individuellen Probenaufarbeitung bzw. mit einer mangelhaften Spezifität der eingesetzten Testsyteme erklären. Aufgrund der leider immer noch relativ geringen Anzahl von kommerziellen Testsystemen im Teilnehmerfeld lassen sich im Rahmen dieses Ringversuchs derzeit noch keine seriösen Vergleiche zwischen bestimmten kommerziellen Kits und der, zumindest aus methodischer Sicht, relativ heterogenen Gruppe von selbst entwickelten (in house) Testsystemen hinsichtlich Sensitivität, Spezifität oder Kontaminationsanfälligkeit führen. Aus der differenzierten Aufstellung in Tabelle 3 wird jedoch zweifelos hervor, dass die 11 Teilnehmer mit dem RealArt Borrelien Testsystem der Fa. Artus, zumindest im Durchschnitt, ganz respektable Ergebnisse erzielen konnten. MIKROBIOLOGE 16.Jg. 2006 151 PCR-/NAT Borrelia burgdorferi (RV 435) September 2005 52503 Ø 62 Treponema phagedenis 52504 + 61 Borrelia afzelii strain PKo 4 (~ 1x10 organisms /mL) 52504 61 52503 + 52502 52502 Befund 52504 62 52503 Ø Inhibition 52502 Borrelia recurrentis 5 (~ 1x10 organisms /mL) Borrelia garinii strain PBr 5 (~ 5x10 organisms /mL) 52501 Probennummer n = 72 Probenzusammensetzung Erwartet 52501 Gruppe A Tabelle 2: Häufigkeit der Mitteilung verschiedener Befunde 52501 Tabelle 1: Probenzusammensetzung und erwartetes Ergebnis. Positiv 10 67 13 69 n.d. 1 1 1 1 Negativ 60 5 59 3 nein 70 71 70 71 Fraglich 2 0 0 0 ja 0 0 0 0 Tabelle 3: Häufigkeit richtig positiver und richtig negativer NAT-Befunde bei Anwendern verschiedener Methoden. NAT richtig positiv NAT richtig negativ NAT-Methode [total number *] (Code) * Absolut Relativ % Absolut Relativ % In house PCR assay [28] (n = 50) 95 95 / 102 93 84 84 / 102 82 RealArt Borrelia [20] (n = 11) 20 20 / 22 91 21 21 / 22 95 Other / commercial tests [27] (n = 9) 16 16 / 18 88 22 18 / 18 100 Durch Mehrfachnennung oder fehlende Angabe kann die absolute Zahl der Ergebnisse (Tab. 2) von der Anzahl der Teilnehmer abweichen. RV 436: Legionella pneumophila Ein möglichst sensitiver und spezifischer Nachweis von Legionella pneumophila ist sowohl im Rahmen der mikrobiologischen Patientendiagnostik als auch im Bereich umwelthygienischer Untersuchungen (Wasseranalytik) von besonderem Interesse. Anmerkung: auch wenn im Rahmen dieses Ringversuchs aus formellen und auswertungstechnischen Gründen (Zielorganismus ist L. pneumophila) die Anwesenheit von non-pneumophila Legionellenspezies im Untersuchungsgut als negativ zu befunden ist (Code [62]), können einige dieser Spezies sehr wohl von humanpathogener Relevanz sein. Die relativ hohe Menge an Zielorganismen und die Verfügbarkeit gut evaluierter NAT-gestützter Analysensysteme führte zumindest bei der positiven Probe # 52604 (L. pneumophila, ~ 5x103 CFU/ml) und der negativen Probe # 52601 zu hohen Richtigkeitsquoten innerhalb des Teilnehmerfeldes. Um im Rahmen dieses Ringversuchs die diagnostische Situation mit manch schwach-positivem klinischem Probenmaterial widerzuspiegeln, wurde auch diesmal eine der Proben (# 52603) mit einer sehr geringen Menge an L. pneumophila versetzt (~ 5x102 CFU/ml). Die Konzentration der Zielorganismen in dieser Probe war somit nahezu identisch zu der schwach positiven Probe # 51604 des vorhergegangenen Ringversuchs im April 2005. Bei dieser schwach-positiven Probe konnten lediglich 19 der insgesamt 38 Teilnehmer L. pneumophila DNA nachweisen. Abgesehen von den hohen Anforderungen an die untere Nachweisgrenze von NAT-gestützten Legionella-spezifischen Testsystemen im Umfeld der Wasseranalytik kann auch im Umfeld der Humandiagnostik bei den betroffenen Patienten die Menge an Legionella DNA in geeignetem klinischen Probenmaterial (BAL, Urin, o.ä.) erfahrungsgemäß stark variieren - und in Einzelproben auch sehr gering sein. 152 MIKROBIOLOGE 16.Jg. 2006 Auch wenn für die Erteilung der entsprechenden Zertifikate ein falsches Ergebnis innerhalb des Probensatzes ja prinzipiell toleriert wird und negative Ergebnisse bei der Probe # 52603 aufgrund der sehr geringen Menge an Zielorganismen in diesem Zusammenhang nicht als "falschnegativ" bewertet wurden, so stellt ein falsch-negatives Ergebnis bei Probe # 52604 jedoch einen relativ deutlichen Hinweis auf ernstzunehmende Mängel innerhalb der eingesetzten Verfahren zur Nukleinsäure-Extraktion, Amplifikation und Detektion dar. Und selbst wenn dieser Ringversuch seitens INSTAND e.V. als "bestanden" zertifiziert wird, so sollte es dem verantwortungsbewussten Laborleiter dennoch Anlass geben, sein jeweiliges NATTestsystem zu überprüfen und gegebenenfalls zu optimieren. Eine der Proben (# 52602) des aktuellen Sets enthielt diesmal eine nennenswerte Menge an Legionella gormanii, was bei der Mehrzahl der Teilnehmer erfreulicherweise zu keinen falsch-positiven NAT-Ergebnissen führte. Nur bei 4 der insgesamt 38 Teilnehmer zeigten sich offenkundige Spezifitätsprobleme bei den eingesetzten Testsystemen - unter der Rubrik "Zielsequenz" wurden hier von 3 Teilnehmern ribosomalen Zielsequenzen aufgeführt und auch durchwegs die Verwendung von Block-Cycler PCR-Protokollen mit anschließender Agarosegel-Elektrophorese zur Charakterisierung der Amplifikationsprodukte angegeben. Kommerzielle NAT-Testsysteme für den Nachweis von Legionella pneumophila DNA im Untersuchungsmaterial kamen bei 5 Teilnehmern zum Einsatz - leider wurden die Hersteller der entsprechenden Testkits im Auswertungsbogen nicht näher spezifiziert. Von den übrigen Teilnehmern wurden selbst entwickelte (in house) NAT Testsysteme mit Inhibitions- und/oder Positivkontrollen verwendet und von keinem der Teilnehmer wurden vermeintliche Inhibitionsereignisse bei der Aufarbeitung und Analyse der Ringversuchsproben beobachtet. PCR-/NAT Legionella pneumophilia (RV 436) September 2005 Tabelle 1: Probenzusammensetzung und erwartetes Ergebnis. (+) 61 52604 + 61 52604 52603 52603 62 Befund 52602 Ø Legionella gormanii 5 (~ 1x10 CFU/mL) Legionella pneumophila SG1 2 (~ 5x10 CFU/mL) Legionella pneumophila SG1 3 (~ 5x10 CFU/mL) 52601 52602 Escherichia coli K12 52604 62 52603 Ø Inhibition 52602 52601 Probennummer n = 38 Probenzusammensetzung Erwartet 52601 Gruppe A Tabelle 2: Häufigkeit der Mitteilung verschiedener Befunde Positiv 1 4 19 35 n.d. 2 2 2 2 Negativ 37 34 18 3 nein 36 36 36 36 Fraglich 0 0 1 0 ja 0 0 0 0 Tabelle 3: Häufigkeit richtig positiver und richtig negativer NAT-Befunde bei Anwendern verschiedener Methoden. NAT richtig positiv NAT richtig negativ NAT-Methode [total number *] (Code) * Absolut Relativ % Absolut Relativ % In house PCR assay [28] (n = 33) 47 47 / 66 71 62 62 / 66 94 Other / commercial tests [27] (n = 5) 8 8 / 10 80 9 9 / 10 90 Andere / k.A. [29] (n = 0) - - - - - - Durch Mehrfachnennung oder fehlende Angabe kann die absolute Zahl der Ergebnisse (Tab. 2) von der Anzahl der Teilnehmer abweichen. RV 437: Salmonella enterica Salmonella enterica Serovar Typhimurium enthält. Das aktuelle Set an Ringversuchsproben enthielt je eine Probe mit hoher Menge an Zielorganismen (# 52701; Salmonella enterica Serovar Typhimurium O:4 (B), ~1x106 CFU/ml), eine Probe mit relativ geringer Menge (# 52703; Salmonella enterica Serovar Typhimurium O:4 (B), ~1x104 CFU/ml), sowie zwei Proben ohne Zielorganismen (# 52702 und # 52704) die ausschließlich E. coli enthielten. Zusammenfassend wurden im Rahmen dieses Ringversuchs zum NAT-gestützten Nachweis von Salmonellen von den insgesamt 8 Teilnehmern kein falsch-positiver und lediglich ein falsch-negativer Befund mitgeteilt. Von je einem der 8 Teilnehmer wurde die Verwendung eines "kommerziellen Testsystems / Kit" bzw. des "RealArt Salmonella" Kits angegeben. Es wird auch weiterhin interessant sein zu verfolgen, inwieweit sich im Laufe der nächsten Ringversuchsrunden Unterschiede in der analytischen Sensitivität von selbst entwickelten und kommerziellen Testsystemen abzeichnen. Basierend auf den bisherigen Erfahrungen mit dieser neuen Ringversuchsserie werden auch die kommenden Ringversuchsrunden gewisse Herausforderungen an die jeweiligen Testsysteme zum NAT-gestützten Nachweis von Salmonella enterica darstellen. In enger Abstimmung mit unseren SollwertLaboratorien werden wir auch weiterhin versuchen, zumindest eine der 4 Proben mit einer relativ geringen Menge an Zielorganismen zu versetzen - auch wenn im Rahmen der gesetzlichen Vorschriften und/oder Richtlinien der einzelnen Fachgesellschaften derzeit noch keine genauen unteren Nachweisgrenzen für den NAT-gestützten Salmonellen-Nachweis festgelegt wurden. Die relativ hohe Menge an Zielorganismen in Probe # 52701 sowie die Verfügbarkeit von spezifischen und gut evaluierten selbst entwickelten bzw. kommerziellen NATgestützten Analysesystemen führte diesmal bei allen 4 Ringversuchsproben zu hohen Richtigkeitsquoten. Ein zuverlässiger Nachweis der relativ geringen Menge an Zielorganismen in Probe # 52703 bereitete lediglich einem der Teilnehmer etwas Schwierigkeiten. Mit dieser Probe scheint nun die untere Nachweisgrenze hochsensitiver NAT-gestützter Testsysteme für die zuverlässige Detektion von Salmonella enterica erreicht. Für Kollegen die an einer aussagekräftigen Abprüfung der Sensitivität von neu- oder eigen entwickelten Testsystemen interessiert sind steht somit wieder eine Rückstellprobe zur Verfügung, die definitiv eine "grenzwertig" geringe Menge an MIKROBIOLOGE 16.Jg. 2006 153 PCR-/NAT Salmonella enterica (RV 437) September 2005 Tabelle 1: Probenzusammensetzung und erwartetes Ergebnis. Probennummer Ø 62 Escherichia coli K12 52703 + 61 S. enterica Typhimurium O:4(B) (~ 1x104 CFU/mL) 52704 Ø 62 Escherichia coli K12 52704 52702 Befund 52703 S. enterica Typhimurium O:4(B) (~ 1x106 CFU/mL) 52702 61 52701 + 52704 52701 Inhibition 52703 n=8 Probenzusammensetzung 52702 Erwartet 52701 Gruppe A Tabelle 2: Häufigkeit der Mitteilung verschiedener Befunde Positiv 8 0 7 0 n.d. 0 0 0 0 Negativ 0 8 1 7 nein 8 8 8 8 Fraglich 0 0 0 1 ja 0 0 0 0 Tabelle 3: Häufigkeit richtig positiver und richtig negativer NAT-Befunde bei Anwendern verschiedener Methoden. NAT richtig positiv NAT richtig negativ NAT-Methode [total number *] (Code) * Absolut Relativ % Absolut Relativ % In house PCR assay [28] (n = 6) 12 12 / 12 100 12 12 / 12 100 RealArt Salmonella [20] (n = 1) 2 2/2 10 2 2/2 100 Other / commercial tests [27] (n = 1) 2 2/2 10 1 1/2 50 Andere / k.A. [29] (n = 1) 2 2/2 100 2 2/2 100 Durch Mehrfachnennung oder fehlende Angabe kann die absolute Zahl der Ergebnisse (Tab. 2) von der Anzahl der Teilnehmer abweichen. RV 438: Listeria spp. Neben der wohl prominentesten Spezies L. monocytogenes sind auch eine Reihe weiterer Listerienspezies bekannt, für die inzwischen auch einige selbst entwickelte und kommerzielle NAT-gestützte Nachweisverfahren zur Verfügung stehen. Auch wenn diese Spezies (mit Ausnahme von L. ivanovii) nicht von humanpathogener Relevanz sind, werden wir uns bei der Konzeption des Probenmaterials für RV 438 vor allem zur Abprüfung der Spezifität individueller Testsysteme nicht nur auf L. monocytogenes beschränken. Daher werden gelegentlich auch andere Listerienspezies in der einen oder anderen Probe dieses Ringversuchs zu finden sein. Die Verfügbarkeit von gut evaluierten selbst entwickelten bzw. kommerziellen NAT-gestützten Analysesystemen führte bei dem aktuellen Ringversuch zumindest bei der stark positiven Probe # 52803 (Listeria monocytogenes, ~5x105 CFU/ml) sowie der beiden negativen Proben # 52802 und # 52804 (jeweils E. coli) zu relativ hohen Richtigkeitsquoten. Da wir uns innerhalb dieses Ringversuchsprogramms gelegentlich auch mit einzelnen Proben an die derzeit technisch machbare untere Nachweisgrenze annähern wollen (Anmerkung: wir sind uns dabei sehr wohl bewusst, dass bei vielen Fragestellungen das "technisch machbare" nicht unmittelbar gleichbedeutend mit dem "diagnostisch sinnvollen" ist), bestand die eigentliche Herausforderung des aktuellen Listerien-Ringversuchs nicht in der Detektion bzw. differenzierten Erfassung von non-monocytogenes Listerienspezies als vielmehr in der Abprüfung der analytischen Sensitivität individueller Testkonzepte. Ähnlich wie bei dem zuvor diskutierten Ringversuch RV 437 scheint mit der Probe # 52801 die 154 MIKROBIOLOGE 16.Jg. 2006 untere Nachweisgrenze hochsensitiver NAT-gestützter Testsysteme erreicht bzw. bei der Mehrzahl der von den Teilnehmern verwendeten Testkonzepte bereits etwas unterschritten zu sein. Wie aus Tabelle 2 der statistischen Auswertung zu entnehmen ist, bereitete der Nachweis einer sehr geringen Menge an Zielorganismen in Probe # 52801 (Listeria monocytogenes, ~1x103 CFU/ml) vielen Teilnehmern Schwierigkeiten: bei dieser Probe wurden nur von 3 der insgesamt 13 Teilnehmer positive NATErgebnisse mitgeteilt. Aufgrund der sehr geringen Menge an Zielorganismen und dem Umstand, dass keine verbindlichen Untergrenzen für die analytische Sensitivität von NAT-gestützten diagnostischen Nachweissystemen für L. monocytogenes vorgegeben sind, wurde bei der Erstellung der Zertifikate ein negatives Ergebnis für Probe # 51801 hier nicht als "falsch-negativ" bewertet. Für Kollegen die an einer aussagekräftigen Abprüfung der Sensitivität von neu- oder eigen entwickelten Testsystemen interessiert sind, steht hiermit ebenfalls eine Rückstellprobe zur Verfügung, die definitiv eine "grenzwertig" geringe Menge an L. monocytogenes enthält. Von allen 13 Teilnehmern wurden Testsysteme mit Inhibitions- und/oder Positivkontrollen verwendet und vermeintliche Inhibitionsereignisse bei der Aufarbeitung und Analyse der Ringversuchsproben wurden nicht beobachtet. Bei diesem Ringversuch besteht explizit die Option einer differenzierten Befundmitteilung. Hält ein Teilnehmer lediglich ein L. monocytogenes-spezifisches NATVerfahren vor, so kann er dies über den Zusatzcode [71] im Ergebnisfeld angeben - für die Erstellung des individuellen Zertifikats seitens INSTAND e.V. werden dann auch nur die L. monocytogenes-spezifischen Ergebnisse zur Bewertung herangezogen. PCR-/NAT Listeria spp. (RV 438) September 2005 Tabelle 1: Probenzusammensetzung und erwartetes Ergebnis. Probennummer Ø 62 Escherichia coli K12 52803 ++ 61 Listeria monocytogenes ATCC 7644 5 (~ 5x10 CFU/mL) 52804 Ø 62 Escherichia coli K12 52804 52802 Befund 52803 Listeria monocytogenes ATCC 7644 (~ 1x103 CFU/mL) 52802 61 52801 + 52804 52801 Inhibition 52803 n = 13 Probenzusammensetzung 52802 Erwartet 52801 Gruppe A Tabelle 2: Häufigkeit der Mitteilung verschiedener Befunde Positiv 3 1 13 0 n.d. 0 0 0 0 Negativ 10 12 0 13 nein 13 13 13 13 Fraglich 0 0 0 0 ja 0 0 0 0 Tabelle 3: Häufigkeit richtig positiver und richtig negativer NAT-Befunde bei Anwendern verschiedener Methoden. NAT richtig positiv NAT richtig negativ NAT-Methode [total number *] (Code) In house PCR assay [28] (n = 12) “L. monocytogenes PCR” (n = 9) * 2) Absolut Relativ % Absolut Relativ % 23 23 / 24 96 9 14 / 24 58 18 18 / 18 100 10 10 / 18 55 Other / commercial tests [27] (n = 1) 2 2/2 100 2 2/2 100 RealArt L. monocytogenes [20] (n = 1) 2 2/2 100 2 2/2 100 Durch Mehrfachnennung oder fehlende Angabe kann die absolute Zahl der Ergebnisse (Tab. 2) von der Anzahl der Teilnehmer abweichen. RV 539: MRSA Dieser neue Ringversuch wurde in der aktuellen Ringversuchsrunde probeweise an 30 angemeldete Teilnehmer versandt. Er ist ausschließlich für den Direktnachweis von MRSA aus geeignetem klinischem Untersuchungsgut (wie beispielsweise Nasenabstrichen) konzipiert. Die positiven Proben innerhalb des ausgesandten 4-er Sets enthalten daher typischerweise relativ geringe Mengen an entsprechenden Zielorganismen. Für interessierte Teilnehmer soll an dieser Stelle noch einmal explizit darauf hingewiesen werden, dass sich mit Testsystemen die üblicherweise für die Kulturbestätigung von S. aureus und/oder MRSA ausgelegt sind, diese geringen Mengen nicht immer zuverlässig nachweisen lassen werden. Eine Teilnahme an diesem Ringversuch ist daher nur für solche diagnostische Laboratorien Erfolg versprechend und sinnvoll, die hochsensitive und spezifische NAT/PCR-gestützte Verfahren zum Direktnachweis von MRSA etabliert haben bzw. im Zuge dieses Ringversuchs evaluieren wollen. Wie Tabelle 1 der Auswertung zu entnehmen ist, enthielt das aktuelle Set an Ringversuchsproben je eine Probe mit hoher Menge an Zielorganismen (# 52904; MRSA, PVLpositiv, ~1x104 CFU/ml), eine Probe mit etwas geringer Menge an MRSA (# 52903; MRSA, PVL-negativ, ~1x103 CFU/ml) und der gleichzeitigen Anwesenheit einer Koagulase-negativen Staphylokokkenspezies (S. epidermidis; mecA-negativ), eine Probe mit der gleichzeitigen Anwesenheit eines mecA-negativen S. aureus und eines mecApositiven S. epidermidis Stammes (# 52902; je ~5x104 CFU/ml), sowie eine Probe ohne Staphylokokken (# 52413; E. coli). Da der NAT-gestützte Direktnachweis von MRSA im Umfeld der medizinischen Mikrobiologie zunehmend an Aktualität und Attraktivität gewinnt, sind bereits einige Testsysteme bzw. Testkits kommerziell verfügbar. Deren Verwendung wurde im Zuge dieses Ringversuchs systematisch abgefragt. Auch wenn es sich diesmal "nur" um einen Probe-Ringversuch gehandelt hat, so zeigt die Auswertung der Ergebnisse bereits auf eindrucksvolle Weise die spezifischen Limitationen der unterschiedlichen Testformate und -konzepte. Bedingt durch die diagnostische Fragestellung bestehen die spezifischen Anforderungen hier in einem möglichst sensitiven Nachweis von geringsten Mengen an Zielorganismen und gleichzeitig in der Speziesdifferenzierung von mecA-positiven Staphylokokken. Wie bereits aus Tabelle 3 der Auswertung dieses Probe-Ringversuchs ersichtlich wird, scheinen die SCCmec-basierten Testkonzepte hier einen gewissen Vorteil gegenüber Testsystemen mit einer getrennten Erfassung von speziesspezifischen Markern und dem mecA Gen zu besitzen. So berichteten beispielsweise die 3 Anwender des kommerziellen Hyplex StaphyloResist Testsystems 3 falsch-negative Ergebnisse für Probe # 52903 (MRSA und mecA-negativer S. epidermidis) und 2 fragliche Ergebnisse für Probe # 52902 (S. aureus und mecApositiver S. epidermidis). Einige Ringversuchsteilnehmer aus den USA haben routinemäßig einen Workflow mit dem S.E.T.S. II Kit (Roche Molecular Diagnostics Inc.) verwendet, bei dem das STUARTS Transportmedium der Abstrichröhrchen durch den Neutralization Buffer für die PCR zugänglich gemacht wird (Pufferkonzentration in der Probe: 22 mM Tris pH 8,3; 1,5 mM EDTA). Unterschiedliche Keime oder auch andere Transportmedien (wie beispielsweise die komplexe Matrix der von uns versandten Ringversuchsproben) könnten für den direkten Einsatz in die PCR eine MIKROBIOLOGE 16.Jg. 2006 155 Modifikation des Puffers (Pufferkonzentration in der Probe: Tris von 0,1 mM bis 60 mM; EDTA von 0,1 mM bis 4 mM und pH 7,8 bis 8,8) erfordern. Die Optimierung des Puffers ist einfach durchführbar und kann über die Effizienz der Amplifikationsreaktion vorab überprüft werden. Optional wird im Rahmen dieses neuen Ringversuchs auch der molekulargenetische Nachweis des Pathogenese- faktors PVL (Panton-Valentin Leukozidin) bzw. dessen codierenden Gens lukFS abgefragt. Entsprechende Ergebnisse wurden von 6 der 31 teilnehmenden Laboratorien mitgeteilt - und diese waren erfreulicherweise durchwegs korrekt. Nähere Informationen zu der aktuellen cMRSA bzw. CA-MRSA Problematik bekommen Sie in der Auswertung des ersten regulären MRSA/cMRSA Ringversuchs im Frühjahr 2006. PCR-/NAT MRSA / cMRSA (RV 539) September 2005 Ø 62 /73, 76 52903 + 61 /71, 73, 76 Positiv 1 8 21 52904 ++ 62 Negativ 30 26 9 Fraglich 0 5 **) 1 *) 52904 52902 52903 Befund R S. aureus + CoNS (S.epiderm.; oxa ) (~ 5x104 CFU/mL) S MRSA + CoNS (S.epidermidis; oxa ) 3 (~ 1x10 CFU/mL) 4 MRSA (PVL-pos.) (~ 5x10 CFU/mL) MLST:30; spa: t019 52902 Escherichia coli K12 Inhibition 52901 62 52903 Ø Probennummer n = 31 Probenzusammensetzung 52902 52901 Erwartet 52901 Gruppe A Tabelle 2: Häufigkeit der Mitteilung verschiedener Befunde 52904 Tabelle 1: Probenzusammensetzung und erwartetes Ergebnis. n.d. 0 0 0 0 0 nein 31 31 31 31 0 ja 0 0 0 0 31 *) Tabelle 3: Häufigkeit richtig positiver und richtig negativer NAT-Befunde bei Anwendern verschiedener Methoden. NAT richtig positiv NAT richtig negativ NAT-Methode [total number *] (Code) In house PCR assay [28] (n = 21) Relativ % Absolut Relativ % 12 *) 31 / 36 **) 86 38 38 / 42 90 IDI-MRSA (GeneOhm) [20] (n = 2) 4 4/4 100 4 4/4 100 GenoType MRSA Direct [21] (n= 6) 12 12 / 12 100 12 12 / 12 100 Hyplex StaphyloResist [22] (n = 3) 3 3/6 50 7 3 / 4 **) 75 4 **) 80 LightCycler Kits [23] (n = 3) * Absolut 5 5/6 83 4/5 Durch Mehrfachnennung oder fehlende Angabe kann die absolute Zahl der Ergebnisse (Tab. 2) von der Anzahl der Teilnehmer abweichen. RV 540: Chlamydia pneumoniae Dieser neue Ringversuch wurde in der aktuellen Ringversuchsrunde probeweise an 18 Teilnehmer versandt. Er ist ausschließlich für die Abprüfung von NAT-gestützten Methoden und Protokollen zum Direktnachweis geringer Mengen an C. pneumoniae aus geeignetem klinischem Untersuchungsgut (wie beispielsweise respiratorischem Probenmaterial) konzipiert. Die positiven Proben innerhalb des ausgesandten 4-er Sets enthalten daher typischerweise relativ geringe Mengen der entsprechenden Zielorganismen. Da diese diagnostische Fragestellung zunehmend an Aktualität gewinnt, sind bereits einige Testsysteme bzw. Testkits kommerziell verfügbar. Deren Verwendung wurde im Zuge dieses Ringversuchs auch systematisch abgefragt. Aufgrund der limitierten Teilnehmerzahl dieses Probe-Ringversuchs sind zum gegenwärtigen Zeitpunkt aber noch keine grundlegenden Bewertungen hinsichtlich der Sensitivität und Spezifität von individuellen Testkonzepten zu treffen. Die in den Tabellen dargestellten Zahlenwerte haben eher orientierenden Charakter. 156 MIKROBIOLOGE 16.Jg. 2006 Das aktuelle Set an Ringversuchsproben enthielt je eine Probe mit hoher Menge an Zielorganismen (# 52414; C. pneumoniae, ~1x105 IFU/ml), eine mit relativ geringer Menge (# 52411; C. pneumoniae, ~10 IFU/ml), eine ohne Zielorganismen (# 52413; E. coli), sowie eine Probe mit relativ hoher Menge an einer mit dem Zielorganismus verwandten Spezies (# 52412; C. trachomatis, ~1x105 IFU/ml). Auch wenn es sich hier nur um einen ProbeRingversuch gehandelt hat, so zeigt die Auswertung der Ergebnisse bereits auf eindrucksvolle Weise die untere Nachweisgrenze der gegenwärtig eingesetzten und z.T. auch bereits sehr gut evaluierten NAT-gestützten Analysesystemen für den Nachweis von C. pneumoniae DNA auf. Während alle Teilnehmer die Zielorganismen in der Probe # 52414 sicher nachweisen konnten, so gelang dies bei der Probe # 52411 nur noch 6 der insgesamt 18 Teilnehmer. Erfreulicherweise wurden bei den restlichen Proben keine falsch-positiven Ergebnisse berichtet, was für ein gutes Funktionieren von Test- bzw. laborspezifischen Maßnahmen zur Vermeidung von Kontaminationsereignissen, sowie bei Probe # 52412 auch für eine hinreichende Spezifität der eingesetzten Testsysteme spricht. PCR-/NAT Chlamydia pneumoniae (RV 540) September 2005 Tabelle 1: Probenzusammensetzung und erwartetes Ergebnis. Tabelle 2: Häufigkeit der Mitteilung verschiedener Befunde n = 13 Befund 52413 52414 52411 52412 52413 52414 Positiv 6 0 0 18 n.d. 2 2 2 2 62 Escherichia coli K12 Negativ 11 17 18 0 nein 16 16 16 16 61 Chlamydia pneumoniae (~ 1x105 IFU/mL) Fraglich 1 0 0 ja 0 0 0 0 (+) 61 52412 Ø 62 52413 Ø ++ Inhibition Chlamydia pneumoniae (~ 10 IFU/mL) Chlamydia pneumoniae (~ 1x105 IFU/mL) 52411 52414 Probennummer Probenzusammensetzung 52412 Erwartet 52411 Gruppe A *) 1 **) Tabelle 3: Häufigkeit richtig positiver und richtig negativer NAT-Befunde bei Anwendern verschiedener Methoden. NAT richtig positiv NAT-Methode [total number *] (Code) Absolut In house PCR assay [28] (n = 15) * 20 NAT richtig negativ Relativ % Absolut Relativ % *) 69 30 30 / 30 100 **) 100 20 / 29 Other / commercial tests [27] (n = 3) 5 5/6 83 5 5/5 Andere / k.A. [29] (n = 0) - -/- - - -/- - Durch Mehrfachnennung oder fehlende Angabe kann die absolute Zahl der Ergebnisse (Tab. 2) von der Anzahl der Teilnehmer abweichen. An dieser Stelle möchten wir uns recht herzlich bei allen Kollegen in den zahlreichen nationalen und internationalen Sollwertlaboratorien sowie bei den Kollegen und Mitarbeitern in Jena, Lübeck, Berlin und Regensburg bedanken, die nach wie vor hoch motiviert an der praktischen Umsetzung unseres gemeinsamen Vorhabens zur externen Qualitätssicherung mitarbeiten. Zugleich hoffen wir auf einen reibungslosen Ablauf der zukünftigen Ringversuchsrunden. Korrespondenzadresse: PD Dr. Udo Reischl Ringversuchsleiter und Mitglied der Qualitätssicherungskommission der DGHM Institut für Medizinische Mikrobiologie und Hygiene Universitätsklinikum Regensburg Franz-Josef-Strauß-Allee 11, 93053 Regensburg Tel: 0941-944-6450 e-mail: [email protected] BUCHBESPRECHUNG Krankheit im Labor Robert Koch und die medizinische Bakteriologie Christoph Gradmann. Wallstein Verlag, Göttingen 2005. ISBN 3-89244-922-8. Euro 38,00. Was haben Heidelbeersaft, gekochte Hundefäkalien und Köstritzer Schwarzbier gemeinsam? Nun, Ernst Hallier (1831-1904), Botaniker an der Universität Jena nutzte sie als Kulturmedien zum Nachweis des Pleomorphismus von Mikroorganismen als Grundlage für seine Arbeiten zur Ätiologie der Infektionskrankheiten Mitte der 60-er Jahre des 19. Jahrhunderts. Er entwickelte ein dynamisches System mikrobiologischen Formenwandels und Polymorphismus, was er als das Naturgesetz mikrobiologischen Lebens ansah. Pilze, Hefen und Bakterien waren nach seiner Theorie keine Gattungen, die sich wiederum in Arten unterteilen ließen, sondern Entwicklungsstadien, so genannte Morphen, in die sich Grundformen von Pilzen je nach Umwelt- und Ernährungsbedingungen hineinentwickeln konnten. Er konnte somit, ausgehend von Hautkrankheiten eine Reihe von Infektionserregern identifizieren. Seine größte Popularität erreichtet Hallier 1867, als er während der Choleraepidemie aus Cholerafäkalien und Darmresten einen Kokkus züchtete, den er als Morphe eines auf indischen Reispflanzen wachsenden Pilzes namens Urocystis cholerae identifizierte. Wir können uns heutzutage ein gewisses Schmunzeln über dieses Theoriegebäude nicht verkneifen, müssen uns aber andererseits auch bewusst sein, dass diese Forschergeneration die Grundlage für unser Fachgebiet schuf. Gemeinhin wird der Beginn der Beginn der Mikrobiologie als wissenschaftlich fundierte Wissenschaft mit der Entdeckung des Milzbranderregers durch Robert Koch angesehen, doch kam diese zweifellos epochale Leistung nicht aus dem Nichts, sondern baute auf den Forschungen einer Reihe hervorragender Wissenschaftler (u.a. Henle, Birch-Hirschfeld, Cohn, Schwann) seit ca. 1840. Die Einmaligkeit und die herausragende Leistung von Robert Koch bestand in der Entwicklung von Untersuchungsmethoden wie der Mikrophotographie oder der Reinkultur von Mikroorganismen sowie der Formulierung von Modellen der bakteriellen Ätiologie einer Reihe von Infektionskrankheiten. Er leitete damit einen Paradigmenwandel ein, indem er die Medizin ins (mikrobiologische) Labor brachte. Dies ist das Thema des vorliegenden Bandes des Heidelberger Medizinhistorikers Ch. Gradmann, der sich seit vielen Jahren mit Robert Koch befasst und hier sozusagen sein Opus magnum vorlegt. Es handelt sich nicht um eine landläufige Biographie, sondern Gradmann verfolgt einen wissenschaftshistorischen Ansatz auf der Grundlage einer Überlegung, dass Tagebücher, Labornotizen und ähnliche Materialien als Quellen besonders geeignet sind, um die Kreativität und den persönlichen Stil des Wissenschaftlers zu erhellen. Hierzu hat sich Gradmann über lange Zeit hinweg durch die immense Menge der Kochschen Aufzeichnungen im Archiv des Robert-Koch-Institutes durchgearbeitet, eine Sysiphusarbeit, da Robert Koch praktisch keine 158 MIKROBIOLOGE 16.Jg. 2006 systematischen Labortagebücher führte, sondern alles auf unzähligen Zetteln dokumentierte. Auf diese Weise gewinnt man Einblicke in Arbeitsabläufe und Denkschemata, die bislang meist außer Acht gelassen wurden. Diese Quellen werden weiterhin ergänzt durch eine beeindruckende Zitaten- und Literatursammlung, die zeigen, wie intensiv sich der Autor mit dem komplexen Thema auseinandergesetzt hat. Das Buch gliedert sich in 5 Kapitel (Einleitung, Stichworte zur Biographie; Niedere Pilze und Krankheiten – Infektionskrankheiten zwischen Botanik und pathologischer Anatomie 18401878; Tuberkulose und Tuberkulin: Geschichte eines Forschungsprogrammes; Von Menschen und Mäusen. Medizinische Bakteriologie und experimentelle Therapie 1890-1908; Auf Reisen. Forschungsexpeditionen Robert Kochs als private und wissenschaftliche Praxis), wobei der Fokus nicht nur alleine auf der wissenschaftlichen Leistung von Robert Koch gerichtet ist, sondern auch einige Aspekte des Menschen Koch, sein ärztliches Wirken, sein Verhältnis zur Klinik und Universität oder seine Probleme mit der preußischen Verwaltung in eindrücklicher Weise dargestellt werden. Interessant ist sicherlich, dass Robert Koch sich nie explizit mit theoretischen Fragestellungen seiner Forschung auseinandergesetzt hat: die Bezeichnung als Koch’sche Postulate geht auf Friedrich Löffler zurück, der 1907 zum 25. Gedenktag der Entdeckung der Tuberkulose 1907 erstmals formuliert hat. Seine regelrechte Theorieabstinenz geht auch einher mit einer an Rechthaberei grenzende Sturheit auch gegenüber klinischen Kollegen. Er hatte ein mehr als zwiespältiges Verhältnis zur Universität, ebenso schien er nicht recht glücklich mit der Leitung des im Rahmen der TuberkulinEuphorie für ihn geschaffenen Instituts für Infektionskrankheiten zu sein, so dass seine tropenmedizinischen Forschungsreisen manchmal wie eine Flucht aus dem für ihn viel zu engen Deutschland zu sein schienen. Gradmann setzt sich auch sehr kritisch mit den therapeutischen Experimenten (Tuberkulin oder Atoxyl zur Behandlung der Schlafkrankheit) Kochs und seiner Anhänger auseinander. Interessant ist die Einstellung Kochs zu Tierversuchen, indem er die Versuchstiere mehr oder weniger als eine andere Art von Kulturmedium betrachtete und damit natürlich Zielscheibe von Anti-Vivisektionisten wurde. Insgesamt handelt es sich hier um ein Werk, das jedem Medizinischen Mikrobiologen als Pflichtlektüre dienen sollte, zeigt es doch in beeindruckender Weise die Anfänge unseres Faches mit all seinen positiven und negativen Aspekten. Bei der Lektüre wird es offensichtlich, dass die heutige Diskussion über die Zukunft der Medizinischen Mikrobiologie und ihre Stellung innerhalb der Medizin eine Widerspiegelung des „Koch’schen Urknalles“ darstellt, nur dieses Mal mit umgekehrten Vorzeichen, indem die Mikrobiologie als Medizinische Wissenschaft wieder mehr den Patienten im Mittelpunkt des Interesses sieht. H. K. Geiss, Heidelberg QUALITÄTSSICHERUNG Abschlußbericht über den Ringversuch 491 (Dermatomykologie) des Jahres 2005 Hans-Jürgen Tietz, Institut für Pilzkrankheiten, Berlin Gesamteinschätzung Der Ringversuch Dermatomykologie des Jahres 2005 war der bislang schwierigste und der am meisten diskutierte. Damit wurde ein Grundanliegen der Qualitätssicherung erreicht: Die intensive Auseinandersetzung in einem diagnostisch anspruchsvollen Bereich auf höchstem fachlichen Niveau. Trotz aller Probleme meisterten 579 Teilnehmer (50,9%) die Prüfung mit Bravour, 960 erhalten ein Zertifikat (84,4%) und nur 178 bestanden den Test nicht (15,6%). Ebenso erfreulich war die hohe Teilnehmerzahl (1138). Bemerkenswert ist der Zuwachs unter den niedergelassenen Ärztinnen und Ärzten (929) um 61 Personen zum Vorjahr. Es konnten wiederum Gäste aus der Schweiz, Holland, Österreich, der Slowakei und erstmals auch aus Luxemburg begrüßt werden, für deren Teilnahme wir ganz besonders danken. angabe 12,5 Punkte. Teilnehmer mit der Gesamtpunktzahl 75 erhielten ein Zertifikat. Tabelle 1 informiert über die Bezugsquellen der Keime. Probe Herkunft A: T. rubrum B: C. albicans 69jährige Patientin mit Onychomykose, Großzehennagel links 35jähriger Patient mit Onychomykose, Großzehennagel rechts, Mischinfektion aus T. interdigitale und C. albicans Tinea pedis interdigitalis bei einem 48jährigen Diabetiker, Mischinfektion aus E. floccosum und T. ajelloi Candidosis intertriginosa, ausgehend von einer chronisch rezidivierenden Vulvovaginalmykose bei einer 30jährigen Patientin C: T. ajelloi D: C. tropicalis Methodik Der Ringversuch stand unter dem Motto „Mykosen der Füße und der freien Haut“. Dem entsprechend wurden folgende Erreger geprüft: A – T. rubrum, B – C. albicans, C – T. ajelloi und D – C. tropicalis. Mit den Referenzlaboren aus Hamburg (Dr. D. Reinel), Gießen (Prof. P. Mayser), Mölbis (Prof. P. Nenoff) und München (Dr. H.P. Seidl) wurde ein Vorringversuch durchgeführt. Besonderer Dank gebührt meiner Assistentin Frau S. Schmidt aus Berlin. Für jede korrekte Identifizierung wurden 25 Punkte vergeben, bei richtiger Gattungsbezeichnung ohne Spezies- Ergebnisse Insgesamt wurden 3644 richtige Diagnosen (80,1%) gegenüber 780 fehlerhaften und 128 Enthaltungen abgegeben. Am erfolgreichsten waren die Kliniken mit durchschnittlich 3,5 richtigen Antworten (3,2 von allen). Tabelle 2 dokumentiert das arztgruppenspezifische Abschneiden. Die Mehrheit der Teilnehmer (50,9%) erreichte den Idealwert von 4 richtigen Identifikationen. Tabelle 2: Berufsgruppenspezifische Auswertung des Ringversuches Dermatomykologie im Jahre 2005. Teilnehmer n Anzahl korrekter Identifizierungen 4 n Dermatologische Kliniken 3 % n 2 % n Zertifikat 1 % n 0 % n % n % 1,3 71 92,2 121 91,7 77 48 62,3 22 28,6 5 6,5 1 1,3 1 Labordiagnostische Institute 132 62 47,0 48 36,4 21 15,9 1 0,7 0 Dermatologische Niederlassungen 929 469 50,5 258 27,7 117 12,6 63 6,8 22 2,4 768 82,7 1138 579 50,9 328 28,8 143 12,6 65 5,7 23 2,0 960 84,4 Gesamt Die erregerspezifischen Ergebnisse werden nachfolgend im Detail besprochen. MIKROBIOLOGE 16.Jg. 2006 159 Stamm A: Trichophyton rubrum (719 richtige Antworten [63,2%], 291 fehlerhafte Diagnosen [25,6%], 128 Enthaltungen [11,2%], Tabelle 3) Die Kommentare der Teilnehmer reichten von „Endlich mal wieder ein T. rubrum, der wirklich rubrum ist“ (Dr. H.P. Seidl, München), über „Sie haben uns das mykologische Leben ganz schön schwer gemacht – brauchte mehrere Neuanimpfungen“ (PD Dr.Dr. J. Kreusch, Lübeck) bis hin zu „Stamm A hat einen ganz gestressten Eindruck gemacht“. Diese Einschätzung trifft den Kern. Nach der glänzenden Bewertung des Stammes durch die Referenzlabore im Vorversuch musste das Zentrallabor auf Wunsch von INSTAND die beimpften Röhrchen bereits 12 Tage vor dem eigentlichen Probenversand nach Düsseldorf schicken und somit luftdicht verschrauben. In dieser und zuzüglich der Zeit bis zur Anzüchtung im Ziellabor nahm der Stamm Schaden, so dass er in insgesamt 347 Fällen (30,5%) nicht mehr anwuchs, oder nur unter Schwierigkeiten züchtbar war. Dies wurde den Teilnehmern nicht angelastet und mit 25 Punkten bewertet. Dadurch ergibt sich eine „falsch positive“ Diskrepanz zwischen der Anzahl der Zertifikate und der tatsächlichen Identifikationsrate. Respektabel war die Leistung derjenigen 151 Teilnehmer, denen es trotzdem misslungener Anzüchtung gelang, die richtige Diagnose zu stellen. Da ausreichend Biomasse gewachsen war, konnte man anhand der Direktmikroskopie, der Makromorphe und des klinischen Bildes zu diesem Ergebnis kommen. Vorteile hatten Teilnehmer, die in dieser Situation mit der PCR arbeiten konnten. Stamm B: Candida albicans (978 richtige Antworten [85,9%], 160 fehlerhafte Diagnosen [14,1%], Tabelle 3) Mit der Qualität des ursprünglich von Patient B ausgewählten T. interdigitale waren die Referenzlabore nicht einverstanden. Diesem Votum folgend, wurde T. interdigitale von der Ringversuchsleitung disqualifiziert und durch den Zweitkeim des Patienten, Candida albicans ersetzt. Die in der Aussendung im Bild dargestellte weiße superfizielle Onychomykose ist ein Paradebeispiel für eine schwer zu behandelnde Mischinfektion aus T. interdigitale und C. albicans. Als weniger problematisch erwies sich die Erregeridentifikation. 85,9% der Teilnehmer kamen zur richtigen Diagnose. Es hätte ein noch besseres Ergebnis erzielt werden können, wenn nicht 31 Teilnehmer, aus welchen Gründen auch immer, die Diagnosen der Stämme B und D miteinander vertauscht hätten. Ein logistischer Fehler ist ausgeschlossen und eher ein Übermittlungsfehler unter miteinander korrespondierenden Teilnehmern zu vermuten. Stamm C: Trichophyton ajelloi (997 richtige Antworten [87,6%], 141 fehlerhafte Diagnosen [12,4], Details siehe Tabelle 3) Dieser Keim war der Hit des Ringversuchsjahres 2005. „Ein wahrer mykologischer Leckerbissen“, wie uns Herr Dr. H.P. Seidl, München, schrieb. Als ausgesprochener Exot erzielte er die beste Identifikationsrate (87,6%!) überhaupt und gelangte damit auf Platz 5 der „ewigen Bestenliste“ (siehe Tabelle 4). Für viele Teilnehmer waren der erdige Geruch, das besondere Pigment und die eindrucksvollen Makrokonidien die Highlights des diesjährigen Ringversuchs. An dieser Stelle möchte ich allen danken, die aus der Begeisterung uns ihre Fotos von den Ringversuchsstämmen geschickt haben. Solche Gesten machen das schwierige Amt der Ringversuchleitung durchaus zu einer auch freudigen Beschäftigung. Bitte genießen Sie daher stellvertretend die Mikromorphologie von T. ajelloi auf Abbildung 1, eingesandt vom Team von Herrn Prof. Dr. med. R. Ansorg aus Essen. Das Ergebnis hätte noch besser ausfallen können, wenn das Patientenfoto zuvor nicht in einem Lehrbuch mit der Erregerdiagnose „E. floccosum“ erschienen wäre. Es handelte sich bei diesem Patienten um eine Mischinfektion, bei der wir annahmen, dass nur E. floccosum medizinisch relevant und T. ajelloi nur Satellit sei. Im Buch wurde deshalb nur E. floccosum als Erreger angegeben. Es war nicht der Versuch, „die Sorgfalt der Buchleser mit der Sorgfalt der Pilz-Kultivierer zu vergleichen“ (vielen Dank lieber Herr Kollege Kreusch für diesen köstlichen Satz). Natürlich freut sich der Autor, wenn seine Bücher gelesen werden. T. ajelloi taucht nach wie vor in keiner Gefahrenklasseneinteilung auf. Dies, die Schönheit des Erregers und der Wunsch einiger Kollegen, diesen aufstrebenden Keim „endlich einmal zu bringen“, haben zur Aufnahme in den Ringversuch 2005 geführt. Es hat sich gelohnt. Tabelle 3: Übersicht über die Identifizierungsraten der Stämme A, B, C und D und die jeweils 5 häufigsten Fehldiagnosen. (n = 1138, Zahlenangaben in %) Stamm A Stamm B Stamm C T. rubrum 63,2 C. albicans 86,0 keine Angabe 11,2 C. tropicalis 3,7 T. ajelloi Stamm D 87,6 C. tropicalis 83,5 E. floccosum 4,6 C. albicans 5,2 T. interdigitale 5,5 C. parapsilosis 3,0 M. gypseum 4,2 C. krusei 4,0 T. tonsurans 5,2 C. glabrata 2,1 T. mentagrophytes 1,1 C. ssp. 2,5 T. mentagrophytes 3,9 C. ssp. 2,0 T. rubrum 0,6 C. parapsilosis 2,4 E. floccosum 3,1 C. guilliermondii 1,3 T. tonsurans 0,4 C. glabrata 1,5 160 MIKROBIOLOGE 16.Jg. 2006 Stamm D: Candida tropicalis (950 richtige Antworten [83,5%], 188 fehlerhafte Diagnosen [16,5%], Tabelle 3) Candida tropicalis ist ein klassischer Erreger von Mykosen der freien Haut und der hautnahen Schleimhäute. Speziell die Fähigkeit zur Ausprägung von Pseudomyzel qualifizieren diesen Keim, der als Pendant zu C. albicans gelten darf. Erfreulicherweise lag die Identifikationsrate deshalb nur unwesentlich hinter der von C. albicans. Eine sichere Identifizierung gelang den meisten Teilnehmern anhand des typischen Pseudomyzels mit charakteristischen lateralen Blastosporen. Chlamydosporen fehlten im Unterschied zu C. albicans und C. dubliniensis. Chromogene Medien wie der Candida ID 2 Agar zeigten einen zuverlässigen Indikatorumschlag nach rosa. Gute Ergebnisse wurden ebenfalls mit den biochemischen Testsystemen ID 32 C (Code: 5147 3401 17) und Auxacolor (Code: 71470 05) erzielt. Tabelle 4: Identifikationsraten (in %) aller Ringversuchsprüfstämme seit 2000. Rang Spezies Rate Jahr 1 Scopulariopsis brevicaulis 95,6 2002 2 Microsporum gypseum 94,1 2004 3 Microsporum canis 93,7 2003 4 Microsporum gypseum 92,1 2001 5 Trichophyton ajelloi 87,6 2005 6 Trichophyton mentagrophytes 87,4 2000 7 Candida glabrata 87,3 2000 8 Candida albicans 86,0 2005 9 Candida albicans 85,9 2003 10 Trichophyton mentagrophytes 85,6 2004 11 Trichophyton soudanense 85,3 2004 12 Candida tropicalis 83,5 2005 13 Aspergillus niger 82,5 2000 14 Trichophyton tonsurans 82,0 2001 15 Trichophyton rubrum 81,8 2003 16 Candida parapsilosis 80,9 2002 17 Trichophyton interdigitale 75,8 2002 18 Candida guilliermondii 75,6 2004 19 Epidermophyton floccosum 74,1 2001 20 M. audouinii 71,2 2003 21 Trichophyton terrestre 70,9 2002 22 Trichophyton tonsurans 67,2 2000 23 Trichophyton rubrum 63,2 2005 24 Candida guilliermondii 58,1 2001 Abbildung 1: Makrokonidien von Trichophyton ajelloi (nach einer Einsendung von Prof. Dr. R. Ansorg, Essen) Ausblick Die Ringversuchsleitung dankt allen Kolleginnen und Kollegen für die rege Teilnahme, die schönen Ergebnisse und die hilfreichen, aufmunternden und stets konstruktiven Kommentare. Da der bestgemeinte Ringversuch ohne engagierte Teilnehmer nichts wert ist, laden wir Sie ein, auch im kommenden Jahr mitzuwirken. Der kommende Ringversuch wird das Thema „Mykosen bei Kindern“ haben. Auch 2006 werden mit Unterstützung der Firma sanofi-Aventis bundesweite Vorbereitungsseminare angeboten, die in diesem Jahr von 872 Interessenten besucht wurden. Neuer stellvertretender Ringversuchsleiter ist Herr Prof. Dr. P. Nenoff. Ich würde mich sehr freuen, Sie auch im nächsten Jahr beim Ringversuch 491 begrüßen zu dürfen. Mit kollegialen Grüßen Ihr Prof. Dr. med. habil. Hans-Jürgen Tietz Korrespondenzadresse: Prof. Dr. med. habil. Hans-Jürgen Tietz (Ringversuchsleiter), Institut für Pilzkrankheiten, Berlin, Luisenstr. 50, 10117 Berlin Tel.: 030 28873650 E-Mail: [email protected] MIKROBIOLOGE 16.Jg. 2006 161 TAGUNGSBERICHT Tagungsbericht Klinische Mykologie Am zweiten Februar-Wochenende des Jahres fand in Göttingen in der Medizinischen Mikrobiologie die 38. Jahrestagung der Arbeitsgemeinschaft „Klinische Mykologie“ der DmykG statt. Am Anfang berichtete U. Reichard (Göttingen) über das Aspergillus-Genom- und Proteom-Projekt, einem von England her organisierten internationalen Vorhaben, an dem der Vortragende selbst mitgewirkt hat. Die meisten der etwa 10.000 Gene des Pilzes konnten annotiert werden, 3000 sind bisher aber ohne bekannte Funktion. Reichard und Mitarbeiter konnten bei ihrer Suche nach potentiellen Aspergillose-Impfstoffen in experimentell infizierten Kaninchen eine Reihe von Oberflächenproteinen auskeimender Aspergillus-Konidien im Genom und Proteom identifizieren, die mit der protektiven Immunität der Tiere assoziiert waren und die bereits z.T als Allergene bekannt waren; die Proteine konnten gentechnisch exprimiert und massenspektrometrisch charakterisiert werden Eine Rolle dieser Aspergillus-Antigene bei der Immunantwort des Menschen wird derzeit untersucht. Sehr gegenwartsbezogen beleuchtete der Beitrag von J. Lugauer vom Zentralinstitut der Bundeswehr in Koblenz die Möglichkeiten der mikrobiologisch-mykologischen Diagnostik, die dort für die neuerdings global tätigen Bundeswehrangehörigen vorgehalten werden. Daran beteiligt sind Fachpersonale, die in die Einsatzländer gebracht werden und dort in mobilen Einrichtungen (speziell ausgestatteten Containern) tätig werden. Vor Ort kann beginnend mit der Malaria-Diagnostik- fast alles geleistet werden, was auch in Deutschland diagnostisch verfügbar ist. Die Beratung durch spezialisiertes ärztliches Personal erfolgt dabei in „Visiten“ per Internet. Der folgende Beitrag führte zurück nach Südhannover: Silvia Schauder (Göttingen) berichtete von einem ungewöhnlichen Fall von Dermatomykose, die einen Familienvater betraf, der sich am gesamten Körper mit heftigen Entzündungszeichen präsentierte, die durch Trichophyton mentagrophytes ausgelöst worden waren. Es zeigte sich, dass die Mykose auch andere Familienmitglieder betroffen hatte; sie war auf ein infiziertes Meerschweinchen zurückzuführen, das in einem Waschbecken gebadet worden war, das auch von dem Patienten und seinen Angehörigen benutzt wurde. Einmal erkannt, bereitete die Therapie dann keine Probleme. Das Innenleben von Patienten interessierte Dagmar Rimek (Erfurt), die über eine begonnene Studie berichtete, die eine mögliche Beziehung zwischen viraler oder bakterieller Enteritis einerseits und andererseits der folgenden persistierenden Hefepilzbesiedlung im Darm von Patienten Aufschluss geben soll. Die Wirksamkeit von Azol-Antimykotika auf die intestinale Candida-Flora unter anaeroben Bedingungen wurde von Hannelore Bernhardt und Manfred Knoke (Greifswald) untersucht. In diesem Milieu können die Hefen ihre Energie durch Gärung gewinnen und bei örtlich negativem Redoxpotential sind Azole auch in Abszessen besonders wirksam. Die zunehmend flächendeckende Epidemiologie von 162 MIKROBIOLOGE 16.Jg. 2006 Candidaisolaten aus Blutkulturen wird seit zwei Jahren vom Nationalen Referenzzentrum für Systemmykosen in Göttingen unter Hilfe von derzeit 50 Einsendern verfolgt. Über den Stand der sich dabei abzeichnenden Entwicklung berichtete Margarethe Borg-v. Zepelin. Danach ist C. albicans mit über 50% weiterhin der dominante Auslöser von Fungämie; die Isolate waren nur selten gegen Triazole resistent. Das Spektrum neuer Textilien, die das Anheften von Candida und anderen Mikroben im Milieu des Menschen minimieren, wurde von Uta-Christina Hipler (Jena) um besondere Zellulosefasern bereichert. Diese werden mittels Algen und Silbernitrat mit „Nanosilber“ getränkt. Das modifizierte Fasermaterial hält etwa 60 Waschgänge aus, ist antimikrobiell wirksam und z.B. als Verbandsmaterial einsetzbar. Über die Resistenz-Testung von Fusarium-Arten gegen Antimykotika berichtete M. Seibold (Berlin). Diese Hyalohyphomyzeten können in neutropenischen Patienten schwerste Infektionen auslösen; sie sind nur begrenzt zu behandeln. Dabei sind solche Isolate (im Gegensatz zu Aspergillen) recht gut in Blutkulturen anzuzüchten; ihre Empfindlichkeit ist dann im Einzelfall sorgfältig zu ermitteln. Danach kann die kombinierte Behandlung mit liposomalem Amphotericin und Terbinafin wirksam sein. Gegenwärtige Grenzen der medikamentösen Therapie einer Fusariose wurden offenbar, als Gudrun Schröder (Greifswald) von einer neutropenischen Patientin berichtete, die trotz Behandlung mit Posaconazol einer disseminierten Fusariose erlag, obwohl dieses neue Triazol für die Behandlung der Fusariose zugelassen ist. Der bei der in vitro-Testung von antimikrobiellen Substanzen zu gewärtigende Eagle-Effekt (verminderte Wirkung bei erhöhter Konzentration des Wirkstoffs) kann auch bei Antimykotika auftreten, wie R. Fleck (Mannheim) an Caspofungin beobachtete. Der Effekt konnte in Mikrotestplatten mit Redoxindikator-Farbstoffen darstellt werden; er war nicht an Substanzklassen gebunden und war sowohl bei Sprosspilzen als auch bei Schimmelpilzen nachzuweisen Ob ein ähnliches Phänomen für das Versagen von Caspofungin in vivo verantwortlich war, das im Rahmen einer letalen Aspergillose beobachtet wurde, konnte nur vermutet werden. Über den entsprechenden Fall einer stammzell-transplantierten Patientin berichtete J. Bäsecke (Göttingen); in diesem Fall konnte der Pilz postmortal (bei unklarer in-vitro Empfindlichkeit) noch aus der Lunge angezüchtet werden. Die Bedeutung bestimmter mykologischer Befunde für das öffentliche Gesundheitssystem (obwohl vom Infektionsschutzgesetz nicht besonders erwähnt) hob Kathrin Tintelnot (Berlin) am Beispiel von ScopulariopsisMykosen hervor. Fälle von nosokomialen Infektionen am Auge durch den schwer zu behandelnden Schimmelpilz wurden aus einem Mittelmeerland eingeschleppt; entsprechende Warnungen an die Fachwelt sind über das Epidemiologische Bulletin ergangen. Über die geänderte Bewertung der Ergebnisse des Aspergillus-Galaktomannan EIAs berichtete R. Rüchel (Göttingen). Danach sind hämato-onkologische Patienten bereits ab Index-Werten von > 0,5 verdächtig. Der Hersteller hat auf diese (zuerst in den USA bemerkten) Verhältnisse reagiert und die Testbeschreibung verändert. Danach steigt durch diese Maßnahme die Empfindlichkeit des Tests auf > 90%, während die Spezifität nur wenig sinkt. Wolfgang Fegeler (Münster) summierte eine kooperative Resistenz-Studie an drei Triazol-Antimykotika und Flucytosin, die 8590 Candida-Isolate umfasste. Besonders interessant erschien dabei im Ergebnis, dass Kreuzresistenzen unter allen Candida-Isolaten nur bei 1,8%, bei C. albicans sogar nur bei 0,9% der Isolate vorkam. Der additive Effekt von Flucytosin als Kombinationspartner von Triazolen wurde hervorgehoben. Michael Seibold (Berlin) berichtete schliesslich über die Empfindlichkeitsprüfung von Candidahefen gegenüber Caspofungin (zu dem es leider immer noch keine interpretierbaren Schwellenwerte gibt). Amerikanische Studien und eigene Erfahrungen liessen dabei an cut-off Werte im Bereich von 0,5 – 2 µg/ml denken; es wird aber auch die Meinung vertreten, dass es prinzipiell keine Korrelation von in vitro und in vivo Effekten des Echinocandins gäbe. Die Tagung wurde freundlich unterstützt von der Fa. Pfizer und organisiert von R. Rüchel & Mitarbeiterinnen (Fax. 0551-39-5860, [email protected]) R. Rüchel, Göttingen Durch die hohe Resistenz gegen die meisten Antibiotika waren die Therapieoptionen extrem eingeschränkt. Unter dem Selektionsdruck auf Intensivstationen kann es bei multiresistenten Stämmen zur Akkumulation weiterer Resistenzdeterminanten mit der Gefahr untherapierbarer nosokomialer Infektionen kommen. Diese Beispiele verdeutlichen, wie wichtig die mikrobiologische Überwachung von Risikopatienten und die Kontrolle von Resistenzen ist, nicht nur für eine adaequate Therapie akuter Infektionen, sondern auch, um solche Gefahren frühzeitig zu erkennen und eliminieren zu können. Burak S, Engelhart S, Exner M, Marklein G, Purr I, Putensen C, Wiegand I, Wiedemann B. Nosokomiale Ausbrüche multiresistenter Klebsiella-pneumoniae-Stämme auf Intensivstationen. Chemotherapie Journal 15 (2006) 112-118 Roswitha Füssle, Giessen MITTEILUNGEN Das Robert Koch-Institut hat die folgende Publikation als Druckausgabe und als PDF über seine Internetseite (www.rki.de) freigegeben: Steckbriefe seltener und importierter Infektionskrankheiten. 173 S. ZEITSCHRIFTENREFERAT Herausgeber: Robert Koch-Institut, Berlin 2006, ISBN 389606-095-3. Nosokomiale Ausbrüche multiresistenter Klebsiella-pneumoniae-Stämme auf Intensivstationen Zwei Ausbrüche durch multiresistente Klebsiellapneumoniae-Stämme, die innerhalb von 26 Monaten bei 51 Patienten auf drei Intensivstationen eines Universitätsklinikums in Deutschland auftraten, wurden epidemiologisch und molekularbiologisch untersucht. Die beiden isolierten Ausbruchstämme wiesen ein besorgniserregendes Resistenzmuster auf. Stamm I war durch den Erwerb von 12 überwiegend plasmidkodierten Resistenzgenen und mehreren chromosomalen Mutationen resistent gegen Cephalosporine der Gruppen 1,2,3a und 3b, allen Penicillinen, Gentamicin, Tobramycin, allen Chinolonen, Tetracyclinen, Antifolaten und Chloramphenicol. Sensibel waren lediglich Carbapeneme; gegen Amikacin bestand eine intermediäre Empfindlichkeit. Der zweite Ausbruchstamm hatte das gleiche Resistenzmuster, war aber sensibel gegen Amikacin. Ein zweiter Klon wurde im Verlauf des Ausbruchs durch eine chromosomale Mutation mit Verlust eines Porins zusätzlich resistent gegen Carbapeneme. Beide Stämme produzierten ESBL (extendedspectrum-beta-lactamase). In Umgebungsuntersuchungen wurden die Ausbruchstämme aus Stuhl verschiedener Patienten sowie aus Umgebungsproben isoliert, z.B. Siphons der Waschbecken, Patientenbett, Thermoskanne mit vorbereitetem Tee. Diese Quellen werden als Infektionsreservoir diskutiert. Die Beendigung der beiden Ausbrüche wurde durch konsequente Kontaktisolierung und intensive Desinfektionsstrategien erreicht. STELLENANZEIGE Facharzt/in für Mikrobiologie Kleiner Hersteller von IVD sucht erfahrene/n Berater/in in den Bereichen Hygiene Desinfektion Controlling mit Lebensmittelpunkt in München oder Umgebung von München. Auch Ruheständler sind willkommen. Der Zeitaufwand beträgt ca. 1/2 Tag pro Woche. Stellen Sie sich bitte kurz schriftlich vor bei: Bios GmbH, Postfach 70 03 32, 81303 München MIKROBIOLOGE 16.Jg. 2006 163 FORTBILDUNGSVERANSTALTUNGEN Mainzer Hygiene- und Infektiologie-Tag Themen: sinnvolle und nicht sinnvolle Umgebungsuntersuchungen, MRSA, ESBL, VREPrävention und Hygienemaßnahmen, Legionellen - was ist zu tun, MRSA im OP Termin: Freitag, 10.11.2006 - 9:00 Uhr - 15:00 Uhr Ort Hilton Hotel, Mainz Anmeldung/Auskunft: Frau Andrea Schreyer Bioscientia Hygiene Akademie Konrad- Adenauer-Straße 17 55218 Ingelheim Tel: 06132-781-143 Fax: 06132-781-373 E-Mail: [email protected] www.bioscientia-hygiene.de 6. Leipziger Workshop Dermatologische Laboratoriumsdiagnostik - wissenschaftlich begründet, praxisrelevant und wirtschaftlich Themen: Allergologische In vitro-Diagnostik, Autoimmundiagnostik in der Dermatologie, Dermatologische Mikrobiologie (u. a. Chlamydien-Infektionen, Mykologie) Termin: Sonnabend, 20. Januar 2007 9:00 bis 15:00 Uhr Ort Marriott Hotel Leipzig Am Halleschen Tor 1, D-04109 Leipzig Leitung: Dr. med. Gudrun Hamm, Halle & Prof. Dr. med. habil. Pietro Nenoff, Mölbis Anmeldung/Auskunft: Prof. Dr. Pietro Nenoff Laboratorium für medizinische Mikrobiologie Straße des Friedens 8, D-04579 Mölbis Tel. (034347) 50323, Fax (034347) 50123 e-mail: [email protected] Weiterbildung an der UNIVERSITÄT TÜBINGEN Onkologie Grundseminar (V10) Entstehung, Diagnostik und Therapie von Krebs Termin: 11. Dezember 2006 Leitung: Prof. Dr. Diethard Baron, Fachhochschule Weihenstephan, Lehrgebiete: Biochemie, Gentechnik, Immunologie Gebühr: Euro 160,Onkologie Aufbauseminar (V11) Moderne Möglichkeiten der Krebs-Therapie Termin: 12. Dezember 2006 Leitung: Prof. Dr. Diethard Baron, Fachhochschule Weihenstephan, Lehrgebiete: Biochemie, Gentechnik, Immunologie Gebühr: Euro 160,Auskunft: WiT - WissensTransfer Universität Tübingen, Wilhelmstr. 5, 72074 Tübingen, Tel.: 07071 - 29-76439, -75010 und -76872, Fax: 07071 - 29-5101, e-mail: [email protected] http://www.uni-tuebingen.de/wit BEZUGSQUELLEN 164 MIKROBIOLOGE 16.Jg. 2006 TAGUNGSKALENDER Würzburg: 01. bis 04. Oktober 2006 – 58. Jahrestagung der Deutschen Gesellschaft für Hygiene und Mikrobiologie (DGHM) – 100 Jahre DGHM. Themen: Nationales Genomforschungsnetzwerk (NGFN), Symposium: Lebensmittelmikrobiologie und – hygiene (zusammen mit der VAAM), Symposium: “Neue Antibiotika” (zusammen mit PEG), Vortrag des DGHM-Preisträgers, Plenarsession: Host-Pathogen-Interaction (zusammen mit DGP), Symposium. Resistenzentwicklung als therapeutische Herausforderung (Firma Wyeth), Symposium Impfstoffe (zusammen mit DGPI), Symposium: Gram-positive Erreger - Antibiotika und Resistenzen (Firma Novartis), Immune Responses at Interfaces (zusammen mit DGFI), Symposium: Molecular Épidemiology and Modeling, Symposium: Therapie invasiver Pilzinfektionen (zusammen mit PEG, DMykG), Plenarsession: Genomics (zusammen mit VAAM), Symposium (Pfizer): Pilzinfektionen, Symposium BD, Symposium „Händedesinfektion und Hautantiseptik“, Klinische Falldemonstrationen, Symposium:„Novel Antibiotics by Analysing and Directing Antibiotic Biosynthesis“, Plenarsession: Emerging Infectious Diseases (zusammen mit GfV und GHU), u.a. Auskunft: Weitere Informationen siehe www.DGHM.org Terminänderung Die 16. Frühjahrstagung des BÄMI in Kloster Banz, Staffelstein, muss aus organisatorischen Gründen um eine Woche verschoben werden. Der neue Termin ist Donnerstag, 26. April – Samstag, 28. April 2007 Wir wollen Sie schon jetzt darauf aufmerksam machen, dass im Anschluss an die Tagung durch den Feiertag am Dienstag den 1. Mai 2007 die Möglichkeit für ein „langes Wochenende“ gegeben ist. Sie haben die Möglichkeit Ihren Aufenthalt in Kloster Banz um diese Tage zu verlängern. Weitere Informationen dazu erhalten Sie im Dezemberheft des MIKROBIOLOGEN. BERUFSVERBAND DER ÄRZTE FÜR MIKROBIOLOGIE UND INFEKTIONSEPIDEMIOLOGIE E.V. Bundesvorsitzender: Prof. Dr. med. H. K. Geiss, Hygieneinstitut der Universität, MUA, Im Neuenheimer Feld 324, 69120 Heidelberg, Tel.: 06221 - 568317, Fax: 06221 - 563688, e-mail: [email protected] Stellv. Vorsitzende: Prof. Dr. med. Gottfried Mauff, LADR GmbH, Medizinisches Versorgungszentrum, Labor Dr. Kramer und Kollegen, Lauenburger Strasse 67, 21502 Geesthacht, Tel. 04152 - 803 147, Fax: 04152 - 803 347, e-mail: [email protected] Prof. Dr. med. Dieter Neumann-Haefelin, Institut für Med. Mikrobiologie und Hygiene, Abteilung Virologie, Hermann-Herder-Str. 11, 79008 Freiburg, Tel.: 0761 - 203-6600,-6601, Fax: 0761 203-6626, email: [email protected] Schriftführerin: Dr. med. Waltraud Römmler, Gemeinschaftspraxis Dr. I. Kragenings, Dr. W. Römmler und Koll., Sonnenstraße 19, 80331 München, Tel.: 089 - 55 143-0, Fax: 089 - 55 143-240 e-mail: [email protected] Schatzmeister: Dr. med. Dr. rer. nat. Anton Hartinger, Institut für Med. Mikrobiologie und Immunologie, Krankenhaus München-Harlaching, Sanatoriumsplatz 2, 81545 München, Tel.: 089 - 6210 2480, Fax: 089 - 6210 3024, e-mail: [email protected] Impressum: Herausgeber: DER MIKROBIOLOGE Berufsverband der Ärzte für Mikrobiologie und Infektionsepidemiologie e.V. Bundesvorsitzender: Prof. Dr. med. H. K. Geiss, Hygieneinstitut der Universität, MUA, Im Neuenheimer Feld 324, 69120 Heidelberg, Tel.: 06221 - 568317, Fax: 06221 - 563688, e-mail: [email protected] Schriftleiter: Prof. Dr. F.- B. Spencker, Scheffelstraße 31a, 04277 Leipzig, Tel.: 0341 - 3012523, Fax: 0341 3081640, e-mail: [email protected] Redaktionsmitglieder: Dr. med. Frank Berthold, Frankfurt/Oder; Prof. Dr. med. Holger Blenk, Fürth; Prof. Dr. med. vet. Roswitha Füssle, Gießen; Dr. Anton Hartinger, München; Prof. Dr. med. Manfred Kist, Freiburg; Dr. med. Eberhard Kniehl, Karlsruhe; Dr. med. Paul C. Lück, Dresden; Prof. Dr. med. A. Schmidt, Witten/Herdecke Verlagsservice: Büro-, Verlags- und Tagungsservice Dagmar Strebel, Belfortstraße 10, 76133 Karlsruhe Tel.: 0721 - 920 3436, Fax: 0721 - 920 3437, e-mail: [email protected] Die namentlich gekennzeichneten Beiträge, geben nicht unbedingt die Meinung des Berufsverbandes wieder. Die Zeitschrift und alle in ihr veröffentlichten Beiträge sind urheberrechtlich geschützt. Nachdruck, auch auszugsweise, nur mit Genehmigung der Redaktion und mit Quellenangabe gestattet. Erscheinungsweise: Zweimonatlich (6 Hefte jährlich) Bezugsbedingungen: Bezugspreis ab 01.01.2002 jährlich 30,- Euro, Einzelpreis 6,50 Euro einschl. Versandkosten und MWSt. Für Mitglieder des Berufsverbandes ist der Bezugspreis im Mitgliedsbeitrag enthalten. Bestellungen: Büro-, Verlags- und Tagungsservice Dagmar Strebel, Belfortstraße 10, 76133 Karlsruhe Fax: 0721 - 920 3437, e-mail: [email protected] Das Abonnement verlängert sich jeweils um ein Jahr, sofern nicht eine Abbestellung bis zum 30. September des laufenden Jahres erfolgt. ISSN 0943-674X