ppt - Userpage
Werbung

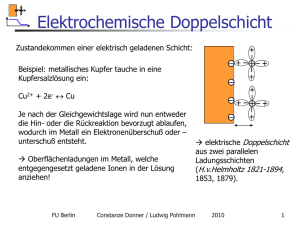
Elektrochemische Kinetik FU Berlin Constanze Donner / Ludwig Pohlmann 2010 1 Elektrochemische Kinetik Was war: Die Nernst-Gleichung beschreibt das thermodynamische Gleichgewicht: Ruhespannung, Leerlaufspannung, OCP kein Stromfluss kein Nettoumsatz Jede Phase ist im EC-Gleichgewicht ! + - + - + + + - + + - + + + - - FU Berlin - + - + + Keine Prozesse! + + + + Kein elektrischer Kontakt + - - +- + - + - - - - - + + + + + + Constanze Donner / Ludwig Pohlmann EC-Gleichgewicht: das sich aufbauende Gegenpotential verhindert das Erreichen des chemischen Gleichgewichts! 2010 2 Gleiche Elektrodenmetalle Herstellen eines elektrischen Kontaktes: keine Reaktion! Cu Cu R Metall + - + - + + + - - + + - - + + FU Berlin + CuSO4 - - - Df = U I=0 - + + + + - - - ++ + + + - + + - - - Zelle ist im chem. Gleichgewicht und ec GGW Keine Potentialdifferenz zwischen den Elektroden DG = 0 Df Constanze Donner / Ludwig Pohlmann Es gibt keinerlei energetische Veränderungen bei Elektrischem Kontakt! 2010 4 Galvanisches Element Cu (-) - + - + - + + + - + + - - + - CuSO4 Ionenfluss + - Anode - + + + + Pt (+) R Metall e- Fluss + - - +- + + + + - + + - - + + + + + + Prozess ist freiwillig DG < 0 Kathode Kupfer wird oxidiert Protonenreduktion : H+ + e- ! H2 Umwandlung von chemischer in elektrische Energie! Elektrischer Kontakt EC GGW Chem. GGW FU Berlin Constanze Donner / Ludwig Pohlmann 2010 6 Elektrochemische Kinetik Df Kathode Chem. GGW Df Anode FU Berlin Constanze Donner / Ludwig Pohlmann 2010 7 Elektrochemische Kinetik Freiwilliger Prozess Entladung I Anode Chem. GGW Kathode FU Berlin Constanze Donner / Ludwig Pohlmann 2010 E 8 Elektrolysezelle e- - fluss e- Cu (-) - + - + - + + U1 + + + + e- R Metall - - - + Stromfluss I = X Zelle ist nicht im chem. Gleichgewicht - + - - + CuSO4 + - Ionen fluss + - + + + IR = U2 Cu2+ wird reduziert Externe Zufuhr von elektrischer Energie In Form von Spannung/Potential zFU Cu (+) + - + ++ + ++ + + + + - - Potentialdifferenz zwischen den Elektroden DG > 0 U3 Cu wird oxidiertDer Prozess wird erzwungen! Umwandlung von elektrischer in chemische in Energie! EC GGW FU Berlin Entfernung vom GGW Constanze Donner / Ludwig Pohlmann 2010 9 Elektrochemische Kinetik Df Anode Df Kathode FU Berlin Constanze Donner / Ludwig Pohlmann 2010 10 Elektrochemische Kinetik Elektrolyse I Kathode Anode EC Chem. GGW FU Berlin E EC Chem. GGW Constanze Donner / Ludwig Pohlmann 2010 11 Zusammenfassung Erzwungene Prozesse Freiwillige Prozesse Keine energetische Änderung DG = 0 Elektrische Energie Chemische Energie Chemische Energie DG> 0 Elektrische Energie DG <0 Stromfluss = 0 Stromfluss Anode zu Kathode Stromfluss Anode zu Kathode Anode ( +) Kathode (-) Kathode (+) Anode (-) Gleichgewicht Elektrolyse Korrosion Galvanische Reinigung Stromlos Batterie FU Berlin Constanze Donner / Ludwig Pohlmann 2010 12 Elektrochemische Kinetik Wodurch wird die Strom- Spannungsbeziehung bestimmt? FU Berlin Constanze Donner / Ludwig Pohlmann 2010 13 Überspannung FU Berlin Constanze Donner / Ludwig Pohlmann 2010 14 Begrifflichkeit: Über-Spannung Definition 1: Überspannung = Maß der Abweichung vom Gleichgewicht (thermodynamische Kraft) = E E0 angelegte Spannung – Nernst-Potential Ursache der Bewegung i - Stromfluss Reaktion auf die Auslenkung vom Gleichgewicht (thermodynamischer Fluss) Wirkung i = i( ) FU Berlin Was bestimmt diese Beziehung? Constanze Donner / Ludwig Pohlmann 2010 15 Überspannung Definition 2: Überspannung = Maß für die Hemmung des Stromflusses Antwort auf die Frage : Welche „Überspannung“ muss angelegt werden, damit eine vorgegebene Stromdichte i0 erreicht wird? U I1 = 1 R1 I2 = U2 R2 In = Un Rn c GGW d.h. bei jeder dieser „Überspannungen“ wird ein anderer Teilprozess der geschwindigkeitsbestimmende Schritt oder auch Der größte (elektrische) Widerstand eines der elektrochemischen Teilprozesse ist der geschwindigkeitsbestimmende Schritt FU Berlin Constanze Donner / Ludwig Pohlmann 2010 16 Überspannung Besser und logischer: der elektrische Widerstand (Systemeigenschaft) als Maß für die Hemmung des jeweiligen Teilschrittes: i = Rgesamt = RDurchtritt RDiffusion R....... FU Berlin Constanze Donner / Ludwig Pohlmann 2010 17 Kinetik der Durchtrittsreaktion Grundlegende Prinzipien abgeleitet aus den Faradayschen Gesetzen Elektrischer Stromfluss und Elektrodenreaktionen Strom ~ heterogenen Reaktionsrate DQ zFDn I=A =A Dt Dt Q = Ladung; n : Stoffmenge; A:Fläche Dn mol = v heterogeneReaktionsrate [ ] Dt s cm2 n = k C (t,x = 0) FU Berlin k [ cm/s)] X Constanze Donner / Ludwig Pohlmann 2010 18 Kinetik der Durchtrittsreaktion Fragen? Wie schnell ist die Durchtrittsreaktion? Wie hängt sie vom Elektrodenpotential ab? Annahmen: 1 Elektron wird übertragen, Transportprozesse ( Migration, Diffusion spielen keine Rolle, erzwungener Prozess = Elektrolyse Ox e Re d Redoxelektrode Me Me e Metallionenelektrode FU Berlin Constanze Donner / Ludwig Pohlmann 2010 19 Kinetik der Durchtrittsreaktion Analogie zwischen chemischer und elektrochemischer Kinetik Erzwungene Reaktionen- Elektrolyse FU Berlin Constanze Donner / Ludwig Pohlmann 2010 20 Potential und Aktivierungsenergie # Chemische Kinetik Arrhenius: k = k0 exp ( - DG# / DG = DG # FDf Elektrochemische Kinetik Df = U RT) n=kC Anfang Ende FU Berlin Constanze Donner / Ludwig Pohlmann 2010 21 Potential und Aktivierungsenergie # DG = DG # FDf ElektroChemische Kinetik Df = U = (felektrode)- f (elektrolyt) Positives Vorzeichen für Reduktion # Negatives Vorzeichen für Oxidation Je negativer Df um sogilt kleiner DG # Je positiver Df um so kleiner DG Df I I Df FU Berlin Constanze Donner / Ludwig Pohlmann 2010 22 Potential und Aktivierungsenergie # DG = DG # FDf ElektroChemische Kinetik k = k0 exp ( - DG# / RT) n=kC Df = (felektrode)- f (elektrolyt) Oxidation ( Hin) i = AzFn = AzF CA k0 exp( - DG#Hin / RT) exp(FDf) Reduktion (Rück) i = AzFn =Az F CB k0 exp( - DGRück# / RT) exp(-(1-)FDf) Die Aktivierungsenergie ist eine lineare Funktion der Potentialdifferenz! Die Reaktionsgeschwindigkeit und damit der Strom hängen exponentiell von der Potentialdifferenz ab! FU Berlin Rückreaktion Cu2+ Cu Hinreaktion z. B. Cu Cu2+ Constanze Donner / Ludwig Pohlmann 2010 23 Bedeutung von + Struktur der Phasengrenze Ort in der Doppelschicht, an der der aktivierte Komplex gebildet wird oder auch Anteil des gesamten Potentialabfalles, der zur Bildung des aktivierten Komplexes benötigt wird + - + + + + + + + + zFD zFD 1 ) zFD ist der „Transferkoeffizient“ FU Berlin Constanze Donner / Ludwig Pohlmann 2010 24 Strom-Spannungs-Gleichung Der gemessene Gesamtstrom ergibt sich aus der Summe der Einzelströme!! Dynamisches Gleichgewicht FU Berlin Constanze Donner / Ludwig Pohlmann 2010 25 Strom-Spannungs-Gleichung Summe der beiden Teilströme (vorzeichenbehaftet!) 0 FD 1 )FD 0 i = F k f exp C A kb exp CB RT RT Df - Galvanipotential Butler-Volmer-Gleichung (kinetische Schreibweise) hierbei: CA, CB – Konzentrationen an der Grenzfläche x = 0!!! 0# DGHin k = k exp RT 0 f 0# DGRück k = k exp RT chemischer Anteil der Geschwindigkeitskonstanten 0 b FU Berlin Constanze Donner / Ludwig Pohlmann 2010 26 Butler Volmer Gleichung FU Berlin Constanze Donner / Ludwig Pohlmann 2010 27 Butler – Volmer- Gleichung 0 FD 1 )FD 0 i = F k f exp C A kb exp CB RT RT FU Berlin Constanze Donner / Ludwig Pohlmann 2010 Df - Galvanipotential 28 Butler – Volmer- Gleichung Austauschstromdichte: Austauschstromdichte: Maß für die Reversibilität des Prozesses, für die heterogene Reaktionsgeschwindigkeit - enthält den chemischen Anteil der Aktivierung! FU Berlin Constanze Donner / Ludwig Pohlmann 2010 29 Butler – Volmer- Gleichung FU Berlin Constanze Donner / Ludwig Pohlmann 2010 30 Butler – Volmer- Gleichung FU Berlin Constanze Donner / Ludwig Pohlmann 2010 31 Butler-Volmer-Gleichung Vergleich thermisch und elektrochemisch aktivierter Reaktionen: Thermisch: 80 KJ / mol, DT = 100 K 1.6104 Steigerung elektrochemisch: Df = 1 V FU Berlin 4.5108 Steigerung Constanze Donner / Ludwig Pohlmann 2010 0# DGRück k = k exp RT 0 b FD exp RT 32 Grenzfälle- Bedeutung der Austauschstromdichte kleine Austauschstromdichte hoher Durchtrittswiderstand U = I R polarisierbare Elektrode hohe Spannungsdifferenzen („Polarisation“) in der Doppelschicht FU Berlin Constanze Donner / Ludwig Pohlmann 2010 33 Polarisierbarkeit große Austauschstromdichte kleiner Durchtrittswiderstand U = I R nicht polarisierbare Elektrode in der Doppelschicht können sich keine Spannungsdifferenzen aufbauen! FU Berlin Constanze Donner / Ludwig Pohlmann 2010 34 Beispiel: Polarographie Bu tl er-Vol mer-G lei ch un g 100 0 0.23 Stromdichte (mA ) 50 0 An Quecksilber kann z.B. Umso größer die Austauschstromdichte, Nickel abgeschieden Um so kinetisch reversibler werden, obwohl der es Prozess!! unedler als Wasserstoff ist! 50 100 0.2 0 0.2 0.4 0.6 (negative) Ü berspannung in V 0.8 i 0 = 0.0 00 0 1, E0 = 0 V (Wasserst off) i 0 = 0.5 , E0 = 0 .23 V (Ni ckel ) Begriff: Zersetzungsspannung!! FU Berlin Constanze Donner / Ludwig Pohlmann 2010 35 geringe Entfernung vom GGW FU Berlin Constanze Donner / Ludwig Pohlmann 2010 36 größere Entfernung vom GGW kathodischer Anteil vernachlässigt! Anodischer Anteil vernachlässigt! FU Berlin Constanze Donner / Ludwig Pohlmann 2010 37 Tafel Gleichung FU Berlin Constanze Donner / Ludwig Pohlmann 2010 38