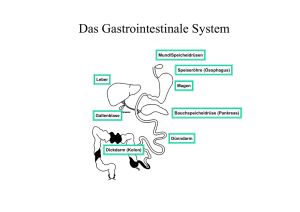
Maximilian MuellerDissertation
Werbung

1 Die Modulation immunologisch relevanter endogener Antigene und ihre prognostische Bedeutung in Speicheldrüsenkarzinomen Aus dem Pathologischen Institut der Friedrich-Alexander-Universität Erlangen-Nürnberg Zur Erlangung der Doktorgrades Dr. med vorgelegt von Maximilian Müller aus Fürth 2 Als Dissertation genehmigt von dem Pathologischen Institut der Friedrich-Alexander-Universität Erlangen-Nürnberg Tag der mündlichen Prüfung: 16.12.2014 Vorsitzender des Promotionsorgans: Prof. Dr. med. Dr. h.c. J. Schüttler Gutachter: Prof. Dr. med. Arndt Hartmann Gutachter: Prof. Dr. med. Christoph Alexiou Gutachter: Prof. Dr. med W.L. Winfried Neuhuber 3 Meinem Großvater Prof. Dr. med. Volker Becker gewidmet, der mir stets zur Seite stand. 4 Inhaltsverzeichnis 1 Zusammenfassung/ Summary 2 1-4 Einleitung 2.1 Anatomische und physiologische Vorbemerkungen 5-7 2.2 Theorien zur Histogenese der Tumoren 7-9 2.3 Epidemiologie und Ätiologie der Speicheldrüsentumore 9-11 2.4 Lokalisationen, klinische Symptome, Therapieoptionen, makroskopische sowie mikroskopische Aspekte, Immunexpressionsmuster, genetische Variationen, Prognose und prädiktive Faktoren verschiedener Speicheldrüsenkarzinome 11-13 2.4.1 Azinuszellkarzinome 13-16 2.4.2 Adenoidzystische Karzinome 16-19 2.4.3 Polymorphe low-grade Adenokarzinome 19-21 2.4.4 Myoepitheliale Karzinome 22-23 2.4.5 Epithelial-myoepitheliale Karzinome 23-25 2.4.6 Basalzelladenokarzinome 25-27 2.4.7 Onkozytäre Karzinome 27-28 2.4.8 Mukoepidermoidkarzinome 28-32 2.4.9 Speichelgangkarzinome 32-34 2.4.10 Plattenepithelkarzinome 34-36 2.4.11 Nicht näher klassifizierbare Adenokarzinome 36-38 2.4.12 Carcinoma ex pleomorphes Adenom 38-40 2.4.13 Karzinosarkome 40-41 2.4.14 Zystadenokarzinome 42-43 2.4.15 Undifferenzierte Karzinome 43 2.4.15.1 Großzellige Karzinome 43-44 2.4.15.2 Lymphoepitheliale Karzinome 44-45 5 2.4.15.3 Kleinzellige Karzinome 2.5 45-46 Immunhistochemische Marker: β2-Mikroglubulin, Calnexin, Calreticulin, ERp57, HLA-A, LMP-2, LMP-7, TAP-1, TAP-2, 2.6 Tapasin und HC-10 46-51 Fragestellung der vorliegenden Arbeit 51-52 3 Patienten und Methoden 4 3.1 Datenerhebung 52-53 3.2 Methodik und Material 53-56 3.3 Statistische Analyse 56 Ergebnisse 4.1 Häufigkeitsverteilung aller Karzinomarten 56-58 4.2 Deskriptive Analyse der Therapievarianten 59 4.3 Deskriptive und prognostische Analyse der einzelnen Speicheldrüsenkarzinome hinsichtlich immunhistochemischer und klinischer Daten 60 4.3.1 Azinuszellkarzinome 60-61 4.3.2 Adenoidzystische Karzinome 61-64 4.3.3 Polymorphe low-grade Adenokarzinome 64-65 4.3.4 Myoepitheliale Karzinome 65-68 4.3.5 Basalzelladenokarzinome 68-69 4.3.6 Epithelial-myoepitheliale Karzinome 69 4.3.7 Onkozytäre Karzinome 69-70 4.3.8 Mukoepidermoidkarzinome 70-73 4.3.9 Speichelgangkarzinome 73-75 4.3.10 Plattenepithelkarzinome 75-77 4.3.11 Nicht näher klassifizierbare Adenokarzinome 77-79 4.3.12 Carcinoma ex pleomorphes Adenom 80-83 6 4.3.13 Karzinosarkome 83-84 4.3.14 Zystadenokarzinome 85 4.3.15 Undifferenzierte Karzinome 85 4.4 Unterschiedliche immunhistochemische Expressionen zwischen Normal- und Tumorgewebe des gesamten Kollektivs 85-90 4.5 Prognose und Überleben aller Speicheldrüsenkarzinome 4.5.1 Überlebensanalyse anhand immunhistochemischer Eigenschaften 90-92 4.5.2 Einbeziehen klinischer Parameter 93-96 4.5.3 Immunhistochemische und klinische Faktoren als gemeinsame Parameter der Überlebenszeit 5 90 Diskussion 96 97 5.1 Methodik und Material 97-99 5.2 Deskriptive Analyse 99- 5.3 Pathologische Parameter 100-101 5.4 Klinische Parameter 101 5.5 Immunexpressionsprofil 101-104 5.6 Überleben und Prognose 100 5.6.1 Kaplan-Meier-Analyse 104-106 5.6.2 Cox-Regressionsanalyse 106-107 6 Literaturverzeichnis 108-138 7 Abkürzungsverzeichnis 139 9 Danksagung und Lebenslauf 140-153 1 1 Zusammenfassung/Summary A Hintergrund und Ziele Damit ein Tumor entstehen, wachsen und überleben kann, sind molekulare Dysregulationen notwendig, die einerseits die zelluläre Proliferation und Differenzierung beeinflussen und andererseits eine Immunantwort des Körpers unterdrücken. Den Proteinen β2-Mikroglobulin, Calnexin, Calreticulin, ERp57, HLA-A, LMP-2, LMP-7, TAP-1, TAP-2, Tapasin und HC-10 kommt beim Entkommen der Immunabwehr („immune escape“) eine entscheidende Rolle zu, da sie die Fremdantigenexpression an Zelloberflächen und die anschließende Erkennung durch T-Zellen steuern. Ziel der vorliegenden Arbeit war die Untersuchung des Expressionsprofils dieser Proteine in Speicheldrüsenkarzinomen, um zu analysieren, ob „Immun escape“-Mechanismen eine Rolle spielen, es innerhalb der verschiedenen Entitäten diesbezüglich Unterschiede gibt und ob eine prognostische Bedeutung abzuleiten ist. B Methoden Für die Untersuchung wurden Proben von paraffineingebetteten Tumor- und korrespondierenden Normalgeweben der Speicheldrüse aus einem Kollektiv von 288 Patienten, die seit 1984 in den Universitätskliniken Regensburg, Erlangen und am Klinikum Nürnberg behandelt worden waren, herangezogen. Die klinischen Daten wurden durch das Erlanger Speicheldrüsenregister (Leiter: Prof. Dr. H. Iro) in Zusammenarbeit mit den Tumorzentren Regensburg und Erlangen-Nürnberg erhoben und zur Verfügung gestellt. Durch eine besondere Stanztechnik wurden Multi-Gewebe-Blöcke („Tissue microarrays“) erstellt, die eine immunhistochemische Untersuchung des Kollektivs ermöglichten. Mit Hilfe einer Polymerkonjugatfärbemethode (EnVisionTM) wurden die immunhistochemischen Objektträger zu den oben genannten Markern angefertigt. Die weitere statistische Analyse (SPSS 18.0) stützte sich auf Punktewerte, in die Färbeanteil und –intensität einflossen. Dadurch konnten Abweichungen zwischen Normal- und Tumorgewebe (mit dem t-Test für unabhängige Variablen mit p<0,05) und diesbezügliche Überlebensunterschiede der Patienten retrospektiv analysiert werden (univariat mit der Kaplan-Meier-Analyse mit p<0,05, multivariat mit Hilfe einer rückwärts bedingten Cox-Regression mit schrittweiser Elimination bei p<0,05 und Konfidenzintervall 95 %). C Ergebnisse und Beobachtungen Hinsichtlich des Geschlechts der Patienten, der Tumorlokalisation und der Karzinomtypen (Entitäten) konnte ein, verglichen mit den von der Weltgesundheitsorganisation veröffentlichten Daten, repräsentatives Fallkollektiv zusammengestellt werden. Bei den häufigsten Karzinomen ließen sich statistisch signifikante Über- und Unterexpressionen der untersuchten Marker dokumentieren. Dabei zeigen sich unter Berücksichtigung der 2 Tumorhistogenese Parallelen der Expressionsmuster bei Karzinomen mit derselben Entstehungslokalisation. Weiterhin wurde die Änderung der Expression einzelner immunologisch relevanter Parameter in ihrem Einfluss auf das Überleben der Patienten untersucht und im Kontext etablierter klinischer Parameter multivariat analysiert. In der univariaten Analyse aller 288 Tumoren waren Tumoren mit Unterexpressionen von nukleärem LMP-7 (p=0,005), Überexpressionen von β2-Mikroglobulin (p=0,024), HLAA (p<0,001), TAP-1 (p=0,01) und Tapasin (p<0,001) mit einem schlechteren Überleben der Patienten assoziiert. Bezogen auf einzelne Entitäten ließen sich hier hingegen Abweichungen dokumentieren. Hinsichtlich klinischer Parameter zeigten Patienten mit einem Alter über 60 Jahre (p<0,001), männlichem Geschlecht (p=0,002), einer Lokalisation des Tumors in der Gl. parotis (p=0,005) und hinsichtlich histopathologischer Faktoren wie einem hohen pT/N- und UICC-Stadium (p<0,001) sowie mit einem hohen Malignitätsgrad G2/3 (p<0,001), Residualtumoren R1/2 (p<0,001) und innerhalb einzelner Entitäten ein schlechteres Überleben. In der multivariaten Analyse beeinflussten ein hoher Malignitätsgrad (Hazard Ratio, HR 4,1), hohes Tumorstadium T3/4 (HR 1,46) sowie Fernmetastasierung (HR 1,95), eine Überexpressionen von Tapasin (HR 1,51) sowie von HLA-A (HR 1,95) negativ das Überleben, eine Überexpression von LMP-7 in der nukleären Auswertung (HR 0,58) stellte einen positiven Überlebensfaktor dar. D Praktische Schlussfolgerung Die Expression immunologisch bedeutsamer Proteine differiert zwar bei den biologisch sehr unterschiedlichen Karzinomtypen der Speicheldrüse erheblich, dennoch ließen sich einzelne Marker (HLA-A, LMP-7 und Tapasin) als auch etablierter klinischpathologische Parameter als prognostisch bedeutsam herausstellen. Diese Erkenntnisse könnten gegenwärtig als zusätzliche Entscheidungshilfen bei der Festlegung der individuellen Tumortherapie in der Adjuvanz (Strahlentherapie, Chemotherapie) fungieren, ob auf der Basis der Untersuchungen zukünftig auch immunologische Therapieansätze verfolgt werden können, ist hingegen auch von funktionellen Studien abhängig. 3 A Background and Aims For a tumor to develop, grow and survive, molecular dysregulations which not only affect cellular proliferation and differentiation but also suppress an immunologic response of the organism are considered a prerequisite. With the proteins β2-Microglobulin, Calnexin, Calreticulin, ERp57, HLA-A, LMP-2, LMP-7, TAP-1, TAP-2, Tapasin and HC10 regulating antigen presentation on cell surfaces and their subsequent discovery by T-cells, these molecules play a decisive role in immune escape. In this context, the purpose of this investigation was to study the expression profile of these proteins in salivary gland carcinomas and to determine, whether immune escape mechanism appear in these carcinomas, if there are differences between subtypes and to analyse a prognostic impact. B Methods Paraffin embedded samples of tumor and corresponding healthy salivary gland tissue obtained from 288 patients who had been treated at the universities of Regensburg and Erlangen as well as at Nuremberg hospital served as a basis for this investigation. Clinical data were obtained and provided by the salivary gland registry Erlangen (Head: Prof. Dr. H. Iro) in cooperation with the cancer centers Erlangen-Nuremberg and Regensburg. Applying a special punch technique, tissue microarrays were fabricated and subsequently stained by means of a polymer conjugate staining method (EnVisionTM) for visualizing the above mentioned markers. Point scores based on the degree of staining and staining intensity served as a basis for statistical analysis (SPSS 18.0). This approach allowed for a retrospective analysis of both, differences between regular tissue and tumor tissue (t-test for independent variables α = 0.05) and expression profile related differences in survival rate of the patients (univariate Kaplan-Meier analysis, α = 0.05; multivariate backwards Cox-regression with stepwise elimination at α = 0.05 and confidence interval, CI 95%). C Results and observations In terms of patient gender, tumor localisation and tumor entity, a representative patient population comparable to the data reported by the world health organization could be compiled. In the most frequent carcinomas statistically significant above und below average expressions of the markers examined were found. Taking into account the histogenesis of the tumors, carcinomas from identical localisations showed comparable expression profiles. Furthermore, the effect of changes in the expression of specific immunologically relevant parameters on patient survival was studied and subject to multivariate analysis in context with already established clinical parameters. Univariate analysis of all of the 288 tumors revealed that tumors with below average expression of LMP-7 in nuclear analysis (p=0.005) as well as above average expression of β2- 4 Microglobulin (p=0.024) and HLA-A (p<0.001), TAP-1 (p=0.01) and Tapasin (p<0.001) were associated with a lower survival rate. However, in some entities, deviations from these findings were found. In terms of clinical parameters, patients aged above 60 years (p<0.001), male patients (p=0.002), patients with tumors in the parotid gland (p=0.005) as well as patients with histopathologic factors such as high pT/N- and UICC-stage (p<0.001) high level of malignity G2/3 (p<0.001), residual tumors R1/2 (p<0.001) and entities among each other showed lower survival rates. Multivariate analysis revealed that a high level of malignity (Hazard Ratio, HR 4.1), advanced staging of local tumour (HR 1.3) or distant metastasis (HR 1.95), above average expression of Tapasin (HR 1.7) and HLA-A (HR 1.95) had a negative effect on the relative risk of death, a below average expression of LMP-7 in nuclear analysis seems to be a positiv factor of survival (HR 0.58). D Conclusion Although the expression of immunologically important proteins differs greatly between the biologically different types of salivary gland carcinomas, the prognostic value of specific markers (HLA-A, LMP-7 and Tapasin), also in context with established clinical and pathologic parameters, could be shown. Currently, these findings may be used as additional determinants in developing a patient specific adjuvant tumortherapy (radiation therapy, chemotherapy). Functional studies should be conducted to clarify whether immunologic therapies are feasible based on the current findings. 5 2 Einleitung 2.1 Anatomische und physiologische Vorbemerkungen Die Speicheldrüsen lassen sich verschieden unterteilen: Einerseits in große und kleine Drüsen, andererseits hinsichtlich ihres Aufbaus sowie ihrer physiologischen Funktion. Auch zelluläre Bestandteile sind differenzierbar. Im 6.-10. Embryonalmonat werden drei große, paarige Kopfspeicheldrüsen, bestehend aus der Gl. parotis, der Gl. submandibularis und der Gl. sublingualis, angelegt [16]. Hinzu kommen die kleinen, oft nur mikroskopisch erkennbaren, unpaaren Speicheldrüsen der Lippen, Wange, Zunge, des Gaumens und des Rachens [57]. Die Größte hiervon, die Gl. parotis, gibt ihr Sekret über den 6-8 cm langen Stenon-Gang in das Vestibulum oris über eine Mündung ab, der Papilla parotidea, die gegenüber dem zweiten oberen Molaren liegt. Diese Drüse wird zum einen durch Bindegewebssepten in Läppchen unterteilt, zum anderen führt die Durchsetzung des Nervus fazialis dazu, dass sich die Drüse in einen sog. Außen- und Innenlappen aufzweigt [57]. Sie produziert ca. 25% des täglichen Speichelsekrets (insgesamt bis zu einem Liter) und hat vorwiegend Bedeutung bei der stimulierten Sekretion, die durch Geruchs- oder Geschmackstoffe gefördert wird und dann bis 34 % des Gesamtspeichels produzieren kann [296]. Mit ungefähr 65% übernimmt die Gl. submandibularis den größten Anteil der Speichelproduktion sowohl in der Ruhe- als auch in der stimulierten Phase [296]. Aufgrund der Form, die einem nach vorne offenem Hufeisen gleicht, nimmt der Wharton-Gang über den Processus sublingualis einen gebogenen Verlauf und endet in der sublingualen Ebene medial zur Papilla salivaria [57]. Die anliegende oder verwachsene Gl. sublingualis liegt, von lockerem Bindegewebe umgeben, in der Fossa sublingualis, einer Vertiefung des Unterkiefers, und bildet mit ihrer Gangmündung die Plica sublingualis [57]. Sie macht nur etwa 5 % der Speichelsekretion aus [296]. Im Wesentlichen ist trotz einiger charakteristischen Unterschiede der Aufbau der kleinen und großen Speicheldrüsen ähnlich: Die kleinste Untereinheit ist den Azini zuzuweisen, diesem folgen Schalt- und Streifenstück und letztlich der extra- bzw. interlobuläre Ausführungsgang, der in den Hauptausführungsgang mündet [300]. In der Gl. parotis sind die Azini rein serös und zeigen basal gelegene, PAS positive Kerne mit zytoplasmatischen Zymogengranula. Dies ist v.a. Korrelat der Amylaseproduktion (Ptyalin) [58]. Auch antibakterielle Substanzen 6 wie Lysozym und Laktoferrin, weiterhin saure Phosphatasen und Esterasen, bei Säuglingen auch noch Lipasen, werden dort synthetisiert [300]. Muköse Azini finden sich in den Gaumendrüsen sowie den Drüsen der Zungenwurzel und -ränder in reiner Form und bieten ebenfalls basal gelegene flache Nukleolen, allerdings mit klarem Zytoplasma und Schleimvakuolen [282]. In der seromukösen Gl. submandibularis, der mukoseröse Gl. sublingualis, den Drüsen der Lippen und Wangenschleimhaut sowie in den Gll. apicis linguae ist die Architektur aus serösen und mukösen Azini gemischt [300]. Zu den intralobulären Kompartimenten gehören weiterhin das Schalt- und Streifenstück, wobei sich Erstgenanntes durch einreihig kubisches Epithel mit meist kurzer Bauweise auszeichnet [51]. Typisch für die Streifenstücke sind hingegen Zylinderepithelien mit Mikrovilli, basale Zytoplasmaeinstülpungen sowie zahlreiche Mitochondrien mit einem korrelierenden onkozytäreren Aspekt [57]. Im Gegensatz zu den beschriebenen Einheiten weist der interlobuläre Ausführungsgang an seiner Außenseite keine Myoepithelzellen, sondern glattlongitudinale, weiter distal zusätzlich zirkuläre Muskelfasern auf. Dies deutet auf seine peristaltische Transportfunktion hin. Ebenso werden die mehrreihigen bis mehrschichtigen Gangepithelien von vereinzelten Becherzellen abgelöst. Nahe der Mündung in den Hauptausführungsgang ist vorwiegend unverhornendes Plattenepithel sichtbar [300]. Neben den Myoepithelzellen, die Actinomyosin, Glykogengranula, Lipofuszin und pinozytische Vesikel sowie Zytokeratin 14 exprimieren, kommen im Speichelgangverband helle Zellen oder Reservezellen vor: Diese stehen aufgrund ihres ähnlichen Keratinexpressionsmusters in Beziehung zu den Myoepithelzellen, jedoch sollen diese als Vorläuferzellen ebenfalls eine Rolle in der Tumorentstehung haben [195]. Diese werden in den nachfolgenden Kapiteln näher besprochen. Vorhandene Becherzellen dienen einer entsprechenden Muzinproduktion. Weitere Zelleinheiten sind Fettzellen, die im Alter und auch bei Alkoholabusus stromal zunehmen [300]. Betont werden soll das Vorkommen von Lymphozyten, die neben dem unspezifischen, enzymatischsekretorischen Immunsystem (z.B. Lysozym), eine Rolle als spezifische und zelluläre Immuneinheit spielen [57]: Durch Stimulation der lymphatischen Schleimhaut werden B-Zellen in das Drüsengewebe angelockt, die mithilfe eines im rauhen Endoplasmatischen Retikulums lokalisierten Transporters über einen endozytotischen Mechanismus vorwiegend IgA in das Drüsenlumen sezernieren können. Besonders in den kleinen Speicheldrüsen wurde diese Anti- 7 körpersezernierung gehäuft beobachtet [47]. Plasmazellen infiltrieren hingegen am stärksten in die Speicheldrüsen der Oberlippe. Die am zahlreichsten vertretende Untergruppe der Lymphozyten sind in allen Speicheldrüsen mit 2/3 die TLymphozyten, die sich wiederum zur Hälfte aus T-Helferzellen und aus den periazinär gelegenen T-Suppressorzellen zusammensetzen [164]. Im gesunden Speicheldrüsengewebe exprimieren v.a. die Schaltstücke, Myoepithelzellen und die serösen Azini HLA-DR- Antigene. Die zahlreichen intra- sowie periglandulären Lymphknoten verdeutlichen weiterhin, dass die Speicheldrüsen Lokalisationsort für lymphatische und systemische Erkrankungen sein können. Der Speichel hat die Aufgabe das Eindringen infektiöser Keime zu verhindern und die Nahrung zu transportieren, indem dieser Sialomuzine und Speichelproteine hinzufügt [300]. Weitere Funktionen liegen in einer enzymatisch beginnenden Verdauung und einer geschmacksvermittelnde Funktion [17, 296]. Der letztlich plasmaisotone Speichel enthält weiterhin überwiegend Wasser (99%), Proteine (v.a. Amylase), Ionen (Kalium, Natrium, Chlorid, Jodid), Gerinnungssubstanzen, Blutgruppenfaktoren und auch die Sezernierung von Viren wie Mumps- oder Zytomegalieviren wurde beschrieben [233]. Das vegetative Nervensystem beeinflusst mit seinem sympathischen System die Bildung von viskösem, somit wasserarmen Speichel, wohingegen das parasympathische System v.a. für einen wässrigen, eiweißreicheren Speichel verantwortlich ist [87, 296]. Neben der nervalen Steuerung sind aber auch Faktoren wie zirkadiane Rhythmik, Alter, Geschlecht, Ernährungszustand, Hormone wie das ADH, Nikotin und Medikamente wie Psychopharmaka, Antidepressiva, parasympathisch und sympathisch modulierende Arzneien von entscheidender Bedeutung für eine adäquate Speichelexkretion [245]. 2.2 Theorien zur Histogenese der Tumoren Über die Histogenese der Speicheldrüsentumore sind im Laufe der Zeit verschiedene Theorien veröffentlicht worden. Die erste Theorie wird „pluripotente unizelluläre Reservezellhypothese“ genannt und geht davon aus, dass alle Tumoren von basal gelegenen Stammzellen (Progenitorzellen oder helle Zellen) aus dem Ausführungsgang entstehen [75]. Eine weitere Auffassung, die „pluripotente bizelluläre Theorie“, vertritt den Standpunkt, dass diese Reservezellen oder Basalzellen ebenso in den Schaltstücken vorkommen, wobei sich aus diesen kubische oder azinäre Zellen bilden 8 können, während die Reservezellen des Ausführungsganges sich zusätzlich zu Plattenepithel, schleimbildenden und zylindrischen Zellen differenzieren können [75]. Demzufolge wird eine Entstehung von Tumorzellen aus Reservezellen des Schaltstückes abgeleitet. Dazu zählen der Wharthintumor, das Onkozytom, das kanalikuläre Adenom, das adenoidzystische Karzinom, das polymorphe lowgrade Adenokarzinom, das Basalzelladenokarzinom, das myoepitheliale sowie das epithelial-myoepitheliale Karzinom und bei manchen Autoren sogar das Azinuszellkarzinom [75, 242]. Andere Tumoren werden auf Ausführungsgangreservezellen zurückgeführt: dazu gehören das pleomorphe Adenom, das intraduktale Papillom, das Mukoepidermoidkarzinom, das duktale Adenokarzinom, das Plattenepithelkarzinom und das nicht näher klassifizierbare Adenokarzinom (NOS=not otherwise specified) [75]. Eine Modifikation erfuhr diese Theorie, als gezeigt wurde, dass sich ebenfalls Myoepithelzellen aus Reservezellen ableiten lassen, da sich in den duktalen Basal- und Myoepithelzellen das Zytokeratinexpressionsmuster bei Normalgewebe sehr ähnelt [14]. Auf dem Weg der weiteren Differenzierung kann es ebenfalls zu Entartungen kommen. Myoepitheliale Tumorzellen zeigen dabei verschiedene Veränderungen hinsichtlich der Struktur und überexprimieren immunhistochemische Marker wie Keratin, Vimentin, saures Gliafaserprotein (GFAP), S-100 und eine Neuronen spezifischen Enolase (NSE) [57]. Die multizelluläre Theorie leitet sich vorwiegend aus rein experimentellen Beobachtungen an Ratten ab und geht davon aus, dass alle differenzierten Zellen der Speicheldrüsen zur Tumorbildung befähigt sind. Die Gabe von noradrenergen Substanzen führt dabei in allen Zellgruppen der Speicheldrüsen, auch der Azinuszellen, zu Proliferationen, die unter Umständen zu einer potentiellen Entartung führen können [52]. Die letzte Theorie der „duktal azinären Einheit“ sieht die Zellen des Azinus und der einreihig angeordneten duktalen Abschnitte −mehrreihig angeordnete Abschnitte fallen somit hinaus− als wesentliche Tumorgenesebestandteile. Eine Kombination von duktal-luminalen, azinären, myoepithelialen und basalen Zellen sowie deren spezifische Differenzierung sei Ursache der Vielfältigkeit einzelner Tumoren [49]. Beim pleomorphen Adenom sollen somit die duktalluminalen Zellen gangartige Strukturen bilden, während Myoepithelzellen diese unregelmäßig umgeben [49]. Gegenwärtig wird die bizelluläre Theorie −mit geringen Modifikationen− anerkannt: Dabei wird angenommen, dass auch die Myoepithelzellen aus Reserve- 9 zellen abstammen und eine Entartung auch von Myoepithelzellen ausgehen kann [1]. Azinuszellkarzinome können, wie an Zytokeratinfärbungen dargestellt wurde, neben Vorläuferzellen der Azini auch aus Vorläuferzellen der Schaltstücke entstehen und Tumoren wie das Onkozytom oder onkozytäre Karzinom entstehen aus pluripotenten Zellen des Streifenstücks [1, 242]. 2.3 Epidemiologie und Ätiologie der Speicheldrüsentumore In der Literatur finden sich hinsichtlich der Epidemiologie unterschiedliche Angaben der Inzidenz sowie der Tumorverteilung, was letztendlich auf Studien mit nur kleinen Fallzahlen sowie deren Beschränkung auf entweder benigne oder einzelne maligne Tumoren zurückzuführen ist [273]. Für alle Speicheldrüsentumore beläuft sich die Inzidenz daher auf 0,4 - 13,5 pro 100.000 Einwohner, wohingegen sich die malignen Tumoren auf 0,4 - 2,6 pro 100.000 Einwohner beschränken [64]. Laut dem Hamburger Speicheldrüsenregister ist die Gl. parotis mit insgesamt 80 % betroffen, gefolgt von der Gl. submandibularis (10 %) bzw. den kleinen Speicheldrüsen (10 %) und der Gl. sublingualis (0,5- 1%) [222]. Dabei ist das Verhältnis benigne zu maligne in jeder Drüse unterschiedlich: Es beträgt 4:1 in der Gl. parotis, 1:1 in der Gl. submandibularis sowie in den kleinen Speicheldrüsen und ist am schlechtesten mit 1:9 in der Gl. sublingualis [222]. Benigne Tumoren stellen beim Erwachsenen insgesamt 70 % dar, am stärksten durch das pleomorphe Adenom (85%) und den Wharthintumor (10%) vertreten [64]. Bei den mit ca. 30 % vorkommenden malignen Tumoren, werden je nach Literaturangabe das Mukoepidermoidkarzinom, das Azinuszellkarzinom und das adenoid-zystische Karzinom am häufigsten angegeben [57, 67, 71, 77, 108]. Das polymorphe niedrig-maligne Adenokarzinom und das adenoidzystische Karzinom sind hingegen in den kleinen Speicheldrüsen am zahlreichsten zu finden [222]. Das Adenokarzinom NOS mit etwa 17% und das primäre Plattenepithelkarzinom der großen Speicheldrüsen mit 5 % stellen weitere Gruppen dar [222]. Allerdings sind bei der epidemiologischen Betrachtung auch geographische Unterschiede zu beachten: In Pennsylvania und Dänemark übertraf das Mukoepidermoidkarzinom mit 30 % den erwartete Inzidenzwert um das siebenfache [189, 224]. In der britischen Bevölkerung hingegen ist das Mukoepidermoidkarzinom mit einer Gesamtinzidenz von 2,1 % deutlich niedriger als der weltweit angesetzte Wert von 5-15 % [77, 78, 193, 286]. Gehäuft treten Spei- 10 cheldrüsentumoren bei Malaysiern im Vergleich zu Chinesen und Indianern auf [163] und auch Zusammenhänge mit einer höheren Krankheitsentstehung hinsichtlich des Wohnorts sind beschrieben [177]. Betrachtet man alle Tumoren der Speicheldrüsen, sind Frauen mit ca. 60 % etwas mehr betroffen, wobei dieser Wert innerhalb einzelner Tumorentitäten variiert. So sind beispielsweise der Wharthintumor und das primäre Plattenepithelkarzinom gehäuft beim männlichen Geschlecht zu finden [57]. Dies deutet auf einen Zusammenhang mit Genussmitteln wie Nikotin und Alkohol hin. Beim Erwachsenen sind 95 % der Tumoren epithelialen Ursprungs − es überwiegen hier benigne Tumoren− und manifestieren sich mit einem durchschnittlichen Alter zwischen 46 und 47 Jahren [222]. Das Verhältnis bei Kindern unter 17 Jahren ist zwischen mesenchymaler und epithelialer sowie benigner und maligner Tumorentstehung dagegen beinahe ausgeglichen [6, 222]. Im Kindes- und Jugendalter sind diese Tumoren besonders selten, treten vorwiegend in der Gl. parotis auf und beschränken sich meist auf die Diagnosen Angiom, pleomorphes Adenom, Mukoepidermoidkarzinom, Azinuszellkarzinom oder Rhabdomyosarkom [57, 145, 154, 246]. Ätiologisch wurden mehrere Faktoren untersucht: Viren wie das Epstein-BarrVirus spielen nur für lymphoepitheliale Karzinome, vor allem bei der asiatischen und grönländischen Bevölkerung, eine Rolle [115, 136, 239]. Auch das Syncytial Virus 40, das Zytomegalie-, Polyoma- und Papillomavirus stehen in keinem Zusammenhang mit der Tumorgenese [297]. Hingegen konnte bei ionisierenden Strahlen eine Assoziation mit einer Tumorentwicklung hergestellt werden [19, 284]: Menschen, die in Hiroshima und Nagasaki radioaktiver Strahlung über einen längeren Zeitraum ausgesetzt waren, zeigten ein erhöhtes relatives Risiko von 3,5 für benigne bzw. von 11 für maligne Tumoren. In diesen Fällen besonders für Wharthintumore und Mukoepidermoidkarzinome. Auch Röntgenstrahlung und radioaktiv markiertes Jod131 bedeuten ein erhöhtes Risiko [128, 181]. Ebenso eine langjährige Exposition mit Gummi, Metall, Nickel, Asbest und Stoffen aus der Friseur- und Kosmetikindustrie [128, 130, 183, 274, 275]. 11 2.4 Lokalisationen, klinische Symptome, Therapieoptionen makroskopische sowie mikroskopische Aspekte, Immunexpressionsmuster, genetische Variationen, Prognose und prädiktive Faktoren verschiedener Speicheldrüsenkarzinome Wie bereits erwähnt, ermöglichen immunhistochemische Marker Aussagen über die Histogenese. Die Vielfältigkeit der Speicheldrüsenkarzinome bedingt für eine exakte Diagnose ebenfalls immunhistochemischer Zusatzfärbungen. Doch auch genetische Marker spielen zunehmend eine wichtige Rolle. Klinisch äußern sich Tumoren der Speicheldrüsen mit zunehmender Schwellung, die je nach ihrem aggressiven Verhalten langsam oder schnell wachsen können. Der Tastbefund kann als eine knotige, nicht verschiebliche, derbe Schwellung auffallen. Hier muss eine Entzündung differentialdiagnostisch ausgeschlossen werden [65]. Auch Schmerzen, insbesondere bei Beteiligung des Nervus fazialis sowie dessen Lähmung können Indizien sein, treten jedoch nicht obligat auf. Während in der Gl. parotis Tumoren meist oberflächlich präaurikulär entstehen, ist neben einer Fazialisparese auf eine zervikale Lymphknotenschwellung zu achten [65]. Wenn tiefe Anteile dieser Drüse befallen sind, kann sich der Tumor als sog. Eisbergtumor in den retromolaren und parapharyngealen Bereich ausdehnen, dabei handelt es sich fast immer um ein pleomorphes Adenom. Bei der Gl. submandibularis ist neben einem typischen Tastbefund (s.o.) eine Schwellung des Mundbodens beobachtbar [65]. Die kleinen Speicheldrüsen zeigen eine Gewebsvermehrung sowie häufige Ulzerationen [65]. Diagnostisch bietet sich v.a. zum Ausschluss einer Entzündung die Sialendoskopie an, seltener auch die Sialographie [65], mit der eine Beurteilung suspekter Lymphknoten möglich ist. Die Computertomographie (CT) eignet sich zur Beurteilung von Knocheninfiltrationen, die Magnetresonanztomographie (MRT) ist Mittel der Wahl für eine Darstellung der Weichgewebsinfiltration und einer Nervenbeteiligung [57]. Die MRT-Untersuchung ist wegen der geringeren Strahlenbelastung vorteilig und kann in der T2-Gewichtung sogar Hinweise auf flüssigkeitsreiche Schwellungen wie Parotidzysten, Wharthintumoren, Zystadenome und zystische Mukoepidermoidkarzinome geben [65]. Überlegen hinsichtlich der Tumorklassifikation sind die Feinnadelaspirationszytologie und die Stanzenbiopsie [65]. Die Feinnadelaspirationszytologie ist oft erster Wegweiser, ob es sich um eine Entzündung oder um einen Tumor handelt. Die falsch positiven sowie die falsch negativen Biopsien belaufen sich da- 12 bei auf nur ca. 5 %, wobei die Treffsicherheit in den letzten Jahren durch eine Ultraschall gesteuerte Entnahme erhöht wurde [65]. Eine spezifische Diagnose kann hingegen in bis zu 90 % gestellt werden [57]. Eine Stanzbiopsie bietet den Vorteil, dass Gewebe histopathologisch aufgearbeitet werden kann und sollte ebenfalls wegen möglicher Verletzungsgefahr des Nervus fazialis ultraschallgesteuert durchgeführt werden [149]. Dann liegt die Treffsicherheit bei 90 % [149]. In der Praxis kommen diese Verfahren in Deutschland regional unterschiedlich zum Zug, da viel Erfahrung für eine Diagnosestellung auf Seiten des Pathologen erforderlich ist und bei einer suspekten Raumforderung −auch bei einer negativen Zytologie bzw. Biopsie− eine chirurgische Intervention als Therapie der Wahl eingesetzt wird. Dabei kommt die lokale Tumorexzision bei kleinen sowie niedrig malignen Tumoren oder vorzugsweise bei den malignen Neoplasien der kleinen Speicheldrüsen zur Anwendung [65]. Diese unterscheidet sich von der lateralen Parotidektomie. Bei dieser wird lateral der Nervenebene ohne Berührung des Nervus fazialis das Drüsengewebe der Gl. parotis entfernt [65]. Die totale konservative Parotidektomie versucht die komplette Drüse unter Schonung des Nervus fazialis zu beseitigen, während bei der totalen, radikalen Parotidektomie die komplette Drüse zusammen mit dem Nervus fazialis bzw. dessen Äste oder sogar auch Nachbarstrukturen, wie beispielsweise Kieferknochen, entnommen wird [65]. Diese drei Verfahren werden bei aggressiveren, größeren und Nerven infiltrierenden Tumoren angewendet. Die Submandibulektomie wird bei bösartigen Tumoren der Gl. submandibularis durchgeführt. Die Entfernung der Halslymphknoten (= Neck-Dissektion) bietet sich bei aggressiveren Tumoren oder bei dem diagnostischen Befund suspekter Lymphknoten an, wobei nach der American Academy of Otolaryngology- Head and Neck Surgery VII Gruppen und weitere 6 Sublevel in Gruppe I, II und V unterschieden werden und zwischen einem radikalen, einem radikal-modifiziertem, einem funktionellen und einem selektiven Vorgehen zu trennen ist. In manchen Zentren werden Lymphknotenausräumungen routinemäßig bei jedem malignen Speicheldrüsentumor durchgeführt. Die Strahlentherapie eignet sich adjuvant ebenfalls bei größeren und aggressiveren Tumoren. Die Chemotherapie hingegen ist meist Situationen mit Fernmetastasierung vorbehalten, wobei klare Hinweise auf eine Verlängerung des Gesamtüberlebens noch ausstehen. Ein weiterer Ansatz ist in einer Antikörper- 13 therapie zu sehen: Imatinib, Gefitinib und Trastuzumab zeigten bislang jedoch keine signifikante Überlebenverbesserung [199]. 2.4.1 Azinuszellkarzinome Während früher das Synonym Azinuszelltumor verwendet wurde, ist das maligne Verhalten dieser Tumorentität eindeutig nachgewiesen, so dass man ausschließlich vom Azinuszellkarzinom spricht, da es sich um eine epitheliale, bösartige Neubildung handelt [248]. Es macht 2-4 % aller Speicheldrüsentumore aus, wobei dieses je nach Tumorregister mit einem Gesamtanteil von ca. 10 % der Speicheldrüsenmalignome eine große Gruppe der Speicheldrüsenkarzinome stellt [245]. Charakteristisch sind zum einen serös differenzierte sowie duktal ähnliche Zellen, zum anderen zeichnet es sich durch seinen niedrigen Malignitätsgrad und durch seine starke Rezidivneigung mit möglicher Metastasenbildung aus [57]. Interessanterweise sind in einem Verhältnis von 3:2 mehr Frauen betroffen, eine Häufung bei ethnischen Gruppen tritt jedoch nicht auf [67]. Dabei kann es in der ersten bis siebten Lebensdekade vorkommen: 4 % aller Patienten sollen sogar unter 20 Jahren sein [64, 145]. In der Literatur werden sie mit einer Beteiligung von 70-90 % in der Gl. parotis, mit 17 % intraoral in den kleinen Speicheldrüsen, mit 4 % in der Gl. submandibularis und mit 1 % in der Gl. sublingualis angegeben [63]. Auch die kleinen Speicheldrüsen der Nasenschleimhaut, des Larynx, der Trachea, des Bronchialsystems, der Lunge, des Pankreas und der Tränendrüse können befallen sein [46, 48, 63, 82, 144, 148, 267]. Klinische Verläufe von 2 bis 3 Jahren bis zum Arztbesuch sind der Regelfall, wobei durch das langsame Wachstum Verläufe von zwei bis über drei Jahrzehnte beschrieben sind [46, 64]. In der Gl. parotis ist der Knoten oft frei verschieblich, seltener an der Haut bzw. am Muskel fixiert oder multinodulär [67]. Ein Drittel der Patienten klagt über Schmerzen, 5-10 % haben eine Fazialisparese [67]. Makroskopisch handelt es sich durchschnittlich um einen 1-3 cm großen, einheitlichen Geschwulstknoten, bei Rezidiven ist oft ein multinodulärer Aufbau zu sehen [57]. Seltener kommt es beim histologischen papillär-zystischen Muster zu Zystenbildungen [120]. Mikroskopisch ergeben sich beim Azinuszellkarzinom verschiedene zelluläre Einheiten, die morphologisch den Tumor dominieren können, aber auch in 14 Kombinationen untereinander vorkommen: Die azinären Zellen sind groß, polygonal und haben ein basophiles, granuläres Zytoplasma mit meist runden exzentrischen Nukleolen [67]. Sie ähneln mitunter den Azinuszellen des Normalgewebes der Parotis, besitzen PAS anfärbbare Zymogengranula und sind am Tumoraufbau in ca. 45 % der Fälle ausschließlich beteiligt [63]. Schaltstück ähnliche Zellen (siehe Abb. 1) kommen in beinahe allen Azinuszellkarzinomen vor und überwiegen in ungefähr 30 % der Fälle [63]. Sie sind kleiner, kuboidal mit zentralen Nukleolen und umgeben oft gangartige Lumina [67]. Vakuoläre Zellen (siehe Abb. 2) haben ein klares, mit Vakuolen (Mukopolysaccharide, keine Lipide oder Glykogen) gefülltes Zytoplasma und divergieren in ihrer Größe [67]. Sie sind in weniger als 10 % die überwiegende Zellpopulation und stellen sich PAS negativ dar. Ebenfalls PAS negativ sind die hellen Zellen, die zwar hinsichtlich ihrer Größe und ihrer Form den Azinuszellen ähneln, jedoch ein nicht anfärbbares Zytoplasma besitzen und oft in Zellverbänden vorliegen [57]. Sie sind nur in etwa 1 % die dominierende Tumorzellpopulation [57]. Nicht spezifische Drüsenzellen sind hingegen eosinophil und besitzen eine rundliche bis polygonale Form [67]. Auch sie sind häufig in Synzytien angeordnet, ihre Zell- 1 Abb. 1: Schaltstück ähnliche Zellen umgeBen Lumina und bilden kleine Zysten aus (mikrozystische Variante, HE-Färbung). 2 12 Abb. 2: Vakuoläre Zellen (HE-Färbung). 12 grenzen sind dabei schwierig auszumachen. Sie sind die dominierende Zellform in ungefähr 10 % der Fälle [57]. Weiterhin gibt es vier verschiedene Wachstumsmuster der Azinuszellkarziome, die Raum für mehrere Differentialdiagnosen geben, jedoch für die Prognose keine klinische Relevanz besitzen: Der solide Subtyp ist das vorherrschende Wachstumsmuster und hat Ähnlichkeiten zum gesunden Parenchym der Parotis (Abb. 35, S. 61). Hochdifferenzierte azinäre Zellen mit Zymogengranula sind typisch, dazwischen befinden sich häufig helle Zellen. Das mikrozystische 15 Wachstumsmuster (Abb. 1) zeigt Hohlräume bis zu 1 mm und auch Zysten, die eosinophiles Sekret enthalten [66]. Beim papillär-zystischen Wachstum (Abb. 36, S. 61) zeigen sich noch größere Freiräume als beim mikrozystischen Muster. Diese Lumina sind mit papillär-epithelialen Zellen ausgekleidet, seltener können Hämorrhagien oder Hämosiderinphagozytosen der luminalen Tumorzellen gesehen werden [67]. Der follikuläre Subtyp ist die seltenste Form [66]. Die Follikel ähnlichen Hohlräume sind von zylindrischen Zellen begrenzt und das Kolloid imitierende Sekret ist für seinen Namen verantwortlich. Seltener sind auch Psammoma-Körperchen beobachtbar [66]. Eine Besonderheit der Azinuszellkarzinome ist eine häufige lymphoide Infiltration [67]. Während eine desmoplastische Reaktion keine Prognoseverbesserung zeigt, deutet vieles darauf hin, dass eine starke lymphoide Infiltration zusammen mit einem mikrofollikulären Wachstumsmuster mit einem weniger aggressiven Wachstum verbunden ist [179]. Entsprechend der verschiedenen Bauformen ergeben sich unterschiedliche immunhistochemische Expressionsmuster: Amylase ist spezifisch für azinäre Zellen [57]. Besonders in glandulären und mikrozystischen Arealen sind Laktoferrin, α1- Antichymotrypsin, IgA, Carcinoembryogenes Antigen (CEA) für eine Diagnose hilfreich [57]. Interessant ist, dass neoplastische Azinuszellen die Fähigkeit zur Anfärbbarkeit für anti-α-Amylase auch verlieren können [67]. Manchmal werden auch Östrogen-, Progesteronrezeptoren sowie PSA ausfindig gemacht [158, 179]. Zytokeratine, Transferrine, Cyclooxygenasen und vasoaktives intestinales Polypeptid (VIP) stellen weitere immunhistochemische Marker dar. Eine Färbung mit S-100 (-A1) gibt Hinweise auf vorhandene Myoepithelzellen und ist nur in ca. 10 % der Fälle positiv [278]. Elektronenmikroskopisch fallen besonders das reiche Endoplasmatische Retikulum und der prominente Golgi-Apparat sowie die stark gebildeten Zymogengranula der azinären Zellen auf [57]. Histogenetisch entstehen die Zellen nach der bizellulären Theorie aus Reservezellen des Schaltstücks, die auf dem Weg zu einer serösen Differenzierung maligne entarten [75]. Da es auch Azinuszellen gibt, die Zytokeratin 7 negativ sind, entsteht dieser Tumor auch aus Vorläuferzellen, die direkt um die Azini liegen [242]. Genetische Anomalien sind häufig beschrieben, wobei es keine spezifische Genaberration zu geben scheint: 6q-Deletionen, Y-Chromosomen Verluste und mehrere Trisomien 21 wurden nachgewiesen [236]. In einer Metaanalyse 16 ist in 84 % der Studien (21 Studien) ein loss of heterogenity (=LOH) bei den Chromosomen 1, 4, 5, 6, 17 beschrieben [70]. Differentialdiagnostisch kommen vor allem Wharthintumoren bei lymphoiden und onkozytären Zellen, Schilddrüsenmetastasen beim papillär-zystischen oder follikulären Mustern (Thyreoglobulinreaktion negativ), das papilläre Zystadenokarzinom, v. a. in den kleinen Speicheldrüsen (Amylase negativ), das hellzellige Mukoepidermoidkarzinom, das epithelial-myoepitheliale Karzinom, das hellzellige Onkozytom oder eine Metastase eines hellzelligen Nierenkarzinoms in Betracht, die durch immunhistochemische Marker abzugrenzen sind. Das Azinuszellkarzinom wird mit einer Rezidivrate von 35 % und eine Metastasierung von 2 % der Fälle angesetzt [214, 255]. Bei der Metastasierung sind meist zuerst die zervikalen Lymphknoten betroffen, anschließend können sich Absiedelungen in Lunge, Skelettsystem und Gehirn entwickeln [66]. Rezidive sowie Metastasen sind ebenso prognostisch ungünstig wie Schmerzen aufgrund einer Neuralinvasion [67, 113]. Das Gleiche gilt für rasches Wachstum, Fixation mit der Umgebung, Tumorgröße von über 3 cm, zahlreiche Nekrosen, stromale Hyaliniserung und einem Proliferationsindex (MIB-1) von über 5 % [67]. Es konnte gezeigt werden, dass die Rezidivrate bei einem Mitoseindex kleiner 5 % drastisch reduziert ist [124]. Prognostisch günstige Faktoren sind eine Tumorentfernung im Gesunden (R0-Situation) und eine Tumorlokalisation in den kleinen Speicheldrüsen [84]. In der Gl. submandibularis sind die Verläufe am aggressivsten, gefolgt von der Gl. parotis [84]. 2.4.2 Adenoidzystische Karzinome Das adenoidzystische Karzinom wurde aufgrund seines scheinbar gutartigen Aussehens als „Zylindrom“ bezeichnet, der klinische Verlauf entpuppt dieses Karzinom allerdings als „Wolf im Schafspelz“, weswegen die ältere Bezeichnung nicht mehr verwendet werden sollte [57]. Dieser Tumor gehört zu den häufigsten bösartigen Speicheldrüsentumoren [71]. Die Gl. parotis, die Gl. submandibularis und die kleinen Speicheldrüsen, vorwiegend des Gaumens, sind zu je 20 % betroffen [57]. Zunge, die Wangenschleimhaut, die Lippen und der Mundboden werden prozentual weniger involviert, letztlich resultiert jedoch eine Beteiligung von ca. 60 % in den kleinen Speicheldrüsen [57, 71]. Auch außerhalb der kleinen Speicheldrüsen kann diese Tumorentität in den Zeruminal- 17 drüsen des äußeren Gehörganges, in den Tränendrüsen, im Nasensinus, in den oberen Luftwegen, den Schweiß- und Brustdrüsen sowie der Vulva vorkommen [94, 155, 220]. Der Altersgipfel liegt dabei zwischen dem 5. und 7. Lebensjahrzehnt und auch wenn insgesamt keine Geschlechtspräferenz besteht, wurde beobachtet, dass die Gl. submandibularis häufiger bei Frauen betroffen ist [211, 266]. Typischerweise breitet sich der Tumor perivaskulär und -neural aus, wobei er bevorzugt den N. fazialis oder den N. auricularis magnus als Leitschiene verwendet [57]. Dabei äußern sich klinische Symptome wie Schmerzen oft erst nach einer Fazialisparese. Makroskopisch fällt eine solide, gut umschriebene, unbekapselte, weißgraue Schnittfläche auf [71]. Histopathologisch dominieren 2 Zelltypen den Tumor: Basal gelegene myoepitheliale sowie luminal duktale Zellen, die drüsig differenziert sind [57]. Histogenetisch leiten sich diese Tumorzellen von Vorläuferzellen des Schaltstückes ab und treten in unterschiedlichen Mustern in Erscheinung, wobei ein Muster häufig vermehrt vorkommt und dementsprechend wesentlich für die prognostisch relevante Unterscheidung ist [75]. Neben dem tubulären Wachstumsmuster gibt es das cribriforme und das solide. Der tubuläre Typ (Abb. 37, S. 63) weist Drüsenlumina auf, die gut umschrieben sind und von epithelialen sowie weiter außen gelegenen myoepithelialen Zellen umgeben sind. Das Stroma zeigt oft desmoplastische, hyaline Strukturen, die Lumina enthalten PAS- positives Material [71]. Die cribriforme Variante (Abb. 3) ist der häufigste Typ und bietet das Bild des „Schweizer-Käse-Musters“. Zellnester bilden zylindrische, mikrozystische Räume, die mit hyalinem oder basophil, mukösem Material gefüllt sind. Die vorkommenden 3-schichtigen Pseudozysten werden von Myoepithelzellen begrenzt, während kleinere, echte Zysten von gangartigen kubischen Zellen umgeben werden. Die solide Variante (Abb. 4) hat keine Drüsenlumina und ist gekennzeichnet durch uniforme, basaloide Zellen und hyperchromatische Zellkerne. Während bei den erst genannten Varianten selten Mitosen auftreten, zeigt der solide Typ einen höheren Mitoseindex, sogar zentrale Nekrosen sind häufiger [71]. Bereits diese Merkmale deuten auf eine schlechtere Prognose des soliden Subtyps im Vergleich zu den anderen Mustern hin. Immunhistochemisch lassen sich diese Tumoren mit mehreren Markern anfärben: C-Kit und E-Cadherin sind mit dem biologischen Verhalten des Tumors assoziiert [140, 168]. Auch CEA (=Carcinogenes embryonales Antigen), EMA 18 (=epitheliales membranes Antigen), Zytokeratine, Laktoferin, IgA, Lektine, Antitrypsin und -antichymotrypsin können verwendet werden [71]. S-100 und Aktin sind für die Anfärbung der Myoepithelzellen geeignet [57]. Seltener werden auch Östrogen- und Progesteronrezeptoren gefunden, ihre biologische Bedeutung ist allerdings noch unklar [71]. 3 4 Abb. 3: Cribriforme Variante des ACC´s Abb. 4: Solide Variante mit basophilen Zellen (HE-Färbung). (HE-Färbung). Differentialdiagnostisch kommen v.a. für die tubuläre Variante das polymorphe low-grade Adenokarzinom und für das solide Muster das Basalzelladenokarzinom in Frage. Weitere Ähnlichkeiten können zum pleomorphen Adenom, dem epithelial-myoepithelialen Adenokarzinom oder zum basaloid squamösen Karzinom bestehen. Besonderes Interesse kommt der Unterscheidung zwischen dem adenoidzystischen Karzinom und dem polymorphen low-grade Adenokarzinom zu, da Letzteres oftmals eine wesentlich bessere Prognose zeigt [53, 150, 216, 225]. Hilfreich ist hier C-kit, ein Antikörper gegen einen Tyrosinkinaserezeptor, und auch SMA (= smooth muscle Actin), die in adenoidzystischen und seltener in polymorphen low-grade Adenokarzinomen exprimiert werden [53, 216, 225]. Auch Vimentin ist hilfreich, da es in adenoidzystischen Karzinomen meist negativ, bei polymorphen low-grade Adenokarzinomen oft positiv ist [53]. Genaberrationen sind derzeitiger Gegenstand der Forschung: Die meisten Aberrationen wurden über die Chromosomen 6q, 9p, 17p12-13 und auch über eine Translokation t(6; 9) (q21-24; p13-23) berichtet [69]. Andere Studien sprechen von einer hohen Anzahl von LOH´s bei 6p23-25 und einer entsprechenden Assoziation mit dem histologischem Grading sowie dem klinischem Verhalten [227, 264]. In 20 % der Fälle wurde in einer weiteren Studie eine p16 Promotor-Methylierung beobachtet [174]. 19 Neben einer lokalen Knochen- und Nerveninvasion des adenoidzystischen Karzinoms sind vorwiegend hämatogene Metastasen in Lunge, Knochen, Gehirn und Leber typisch, wobei nur ca. 20 % der Patienten mit Metastasen überleben [71]. Die höhere Lymphknotenmetastasierung bei der Gl. submandibularis wird durch eine direkte Tumorausbreitung über angrenzendes Weichteilgewebe erklärt [15]. Während das 15-Jahresüberleben beim tubulären und cribriformen Muster bei 40 % liegt, ist das Überleben bei Tumoren mit soliden Anteilen von mehr als 30 % bei gerade 5 % [57]. Die Prognose ist neben der Variante und der Metastasierung allerdings auch abhängig von dem klinischen Stadium, der Knocheninvasion und den Resektionsrändern [219, 266, 277]. Therapie der Wahl ist die großzügige Tumorexzision mit eventuell ein- oder beidseitiger Neck-Dissektion [266]. Im Anschluss erfolgt oft eine Strahlentherapie, wobei dieser Tumor häufig Strahlen resistent ist [277]. Die Chemotherapie ist palliativen Situationen vorbehalten. 2.4.3 Polymorphe low-grade Adenokarzinome Das polymorphe low-grade Adenokarzinom ist definiert als ein Malignom mit uniformen Zellen, jedoch morphologischer Vielfalt sowie infiltrativem Wachstumsmuster [170]. Die Polymorphie zeigt sich in verschiedenen Strukturen, die von soliden Zellsträngen, gangartigen und papillären Formationen bis hin zu drüsigen Zellverbänden reichen. Myoepitheliale Zellen sowie luminale Gangepithelien sind für die Uniformität verantwortlich [57]. Die Prognose ist aufgrund der niedrigen Metastasierung (9-15 % lokale Metastasenrate), einer seltenen Rezidivbildung (5-17 %) und einer beinahe nie vorkommenden Fernmetastasierung relativ gut [35, 170]. Es kommt beinahe ausschließlich in den kleinen Speicheldrüsen vor [170]. Der Gaumen ist in 60 % betroffen, daneben noch Wange, retromalore Region, untere Lippe und Zungenbasis [35, 170]. Die großen Speicheldrüsen sind selten beteiligt und eine Entartung lässt sich meist auf dem Boden eines vorbestehenden pleomorphen Adenoms erkennen [57, 291]. Das polymorphe low-grade Adenokarzinom macht ca. 7 % aller Tumoren in den kleinen Speicheldrüsen aus, ca. 20 % der malignen [264]. Die WHO spricht sogar vom zweithäufigsten Speicheldrüsenmalignom der intraoralen Region, wobei Frauen doppelt so häufig wie Männer betroffen sind [170]. Die Altersverteilung reicht vom 19. bis zum 94. Lebensjahr, der Mittelwert beträgt 59 Jahre, jedoch sind 70 % über 59 Jahre alt [35, 170]. 20 Klinisch ist oft eine schmerzlose Raumforderung typisch. Blutungen, Teleangiektasien und seltener Ulzerationen können auftreten [245]. Makroskopisch kann ein unbekapselter Tumor mit gelb lobulierten Knötchen auffallen [170]. Am Rande sollen noch einige Bemerkungen zur Terminologie erwähnt werden: Manche Autoren sprechen auch vom terminalen Gangkarzinom und deuten damit auf die histogenetische Entwicklung aus Progenitorzellen des Schaltstückes hin [13]. Andere Wissenschaftler nennen diesen Tumor lobuläres Karzinom und leisten damit der Ähnlichkeit zum lobulären Brustkarzinom einen Beitrag, da in beiden einreihige Zelllagen („Gänsemarsch“, „Indian-like“, siehe Abb. 6) sowie eine infiltrative Ausbreitung in soliden Zellsträngen beobachtet wird [91]. In Anlehnung an das papilläre Adenokarzinom, das eine schlechtere Prognose hat, sprechen wieder andere von einem low-grade papillären Adenokarzinom und möchten damit eine eigene Entität für eine Subgruppe des polymorphen low-grade Adenokarzinoms einführen [264]. Der Begriff low-grade wird teilweise kritisiert, da diese Bezeichnung mit dem lokal destruktivem Wachstum nicht zu vereinbaren sei, es nicht immer geringgradig ist, sondern auch dedifferenziert vorkommt und folglich mit einer deutlich schlechteren Prognose einhergehen kann [74, 150]. Histopathologisch fallen kleine bis mittelgroße, aber einheitliche Zellen auf, die leicht hyperchromatische und spindelförmige Nuklei mit seltenen Nukleolen be- 5 6 Abb. 5: PLGC (papillär-zystisches Abb. 6: Gänsemarschartige Zellanordnung Wachstumsmuster). ähnlich zum lobulären Mammakarzinom (HE). sitzen. Mitosen und Nekrosen sind nicht häufig. Auch bei dieser Tumorentität lassen sich lobuläre, papilläre, papillär-zystische (Abb. 5), cribriforme (meist nur Areale) und trabekuläre Wachstumsmuster unterscheiden. Aufgrund der schlechteren Prognose des papillären Typs hat diese Einteilung klinische Rele- 21 vanz [170]. Weiterhin können sich um Blutgefäße konzentrische Zellgruppierungen finden. Foci von onkozytären, klarzelligen, squamösen oder mukösen Zellen sind evtl. auszumachen [170]. Im Stroma zeigen sich auch Muzine und Hyaliniserungen. Die Tumorzellen sind oft nur blass angefärbt und lassen den Eindruck eines Färbeartefakts entstehen [156]. Das infiltrative Wachstum umfasst Muskulatur, Fett, Knochen, Nerven und Gefäße. Differentialdiagnostisch ist −wie bereits beschrieben− das adenoidzystische Karzinom von Bedeutung, wobei die Zellen des polymorphen low-grade Adenokarzinoms kuboidal oder säulenartig mit vesikulären Nukleolen sind, ein eosinophiles Zytoplasma aufweisen und keine pseudozystisch-cribriformen Lücken oder gar einen nukleären Polymorphismus besitzen. Nekrosen, Mitosen sowie tubuläre Strukturen sind ebenfalls untypisch. Eine weitere Differentialdiagnose stellt das pleomorphe Adenom. Dieses zeigt jedoch das zelluläre Spektrum von proliferierten stromalen, epithelialen und myoepithelialen Zellen. Ein myxochondroides Wachstum ist ebenfalls typisch für das pleomorphe Adenom. Der immunhistochemische Marker GFAP (=saures Gliafaserprotein) ist bei dieser Entität positiv und nur selten beim polymorphen low-grade Adenokarzinom [184]. Weitere immunhistochemische Marker des polymorphen low-grade Adenokarzinoms sind Zytokeratine, die in 100 % der Fälle als positiv angegeben werden, Vimentin (100 %), S-100 Protein (97 %), das auf die myoepitheliale Beteiligung hindeutet, CEA (54 %) und das meistens überexprimierte bcl-2 [35, 217, 301]. Genetische Aberrationen sind in einer Metaanalyse bei 8q12 in 2 von 8 Studien beschrieben, 12q Rearrangements sogar in 5 von 8 Studien [170]. Zwei Arbeiten zeigten eine Translokation t(6; 9) und auf eine Monosomie 22 wies eine weiteren Studie hin [170, 173]. Therapeutisch ist eine komplette Tumorentfernung mittels Chirurgie der Goldstandard, gegebenenfalls ist eine Neck-Dissektion anzuschließen [65]. 2.4.4 Myoepitheliale Karzinome Beim myoepithelialen Karzinom entsteht der Tumor ausschließlich aus myoepithelialen, neoplastischen Zellen [260]. Dieses Karzinom zeichnet sich durch sein infiltrativ-destruktives Wachstumsmuster aus, wobei ein längeres Bestehen die Metastasierungsrate steigert [260]. Während die Geschlechtsverteilung in etwa gleich ist, liegt der Altersdurchschnitt bei 55 Jahren, die Inzidenz jedoch zwischen 14-86 Jahren [260]. Damit handelt es sich um einen Tumor 22 fast jedes Lebensalters [260]. Vorwiegend ist er in der Gl. parotis lokalisiert, weniger in der Gl. submandibularis oder den kleinen Speicheldrüsen [83]. Beim meist unspektakulären Verlauf steht die Schwellung der entsprechenden Speicheldrüse im Vordergrund, Schmerzen werden meist negiert. Makroskopisch ist der Tumor nicht bekapselt. Knotige, grau-weiße bis glasige Schnittflächen, ebenso wie nekrotische und teils zystische Bereiche sind beschrieben [260]. Pathohistologisch ist zunächst der multilobuläre Aufbau charakteristisch (Abb. 43, S. 67). Neben den sternförmigen können auch epitheloide (Abb. 8), hyaline, vakuolisierte (Abb. 9), seltener auch klare Myoepithelzellen die Diagnosefindung erschweren [179]. Dies wird ebenfalls durch verschiedene Wachstumsmuster begünstigt, die solide, trabekulär und retikulär in Erscheinung treten. Vorkommendes myxoides sowie hyalines Stroma sind wie nekrotische Bereiche, Pseudozysten und echte Zysten ebenfalls Bestandteil mancher Tumore [260]. 7 8 Abb. 7: spindelförmige Tumorzellen eines MYEC (HE-Färbung). Abb. 8: Runde, epitheloide Zellen (HE). Abb. 9: Vakuolisierte Zellen mit teilweise 9 fischschwarmartigen Muster (HE). Differentialdiagnostisch zum benignen Myoepitheliom sind das infiltrativdestruktives Wachstum als entscheidendes Malignitätskriterium, eine hohe Proliferation (MIB-1) und die Zellpleomorphie. Eine wichtige Differentialdiagnose ist wegen der schlechten Prognose weiterhin das Sarkom, genauer noch das 23 Leiomyosarkom, das immunhistochemisch mit einer negativen Zytokeratinsowie einer negativen S-100-Färbung diagnostiziert werden kann [57]. Kaum anfärbbar mit S-100 sind ebenfalls Spindelzellkarzinome [57]. Bei Verdacht auf ein malignes Melanom oder dessen Filiae ist der HMB-45-Melanomantikörper zu prüfen. Letztlich ist auch das maligne Schwannom differentialdiagnostisch zu beachten, das negativ für S-100 und Aktin ist [57]. Daraus lässt sich erkennen, dass die Immunhistochemie einen großen Stellenwert in der Identifizierung des myoepithelialen Karzinoms einnimmt. Zytokeratine (insbesondere CK 14), SMA (=Smooth muscle actin), GFAP, CD-10, Calponin und SM-MHC (smooth muscle myosin heavy chain) können den Verdacht bestätigen [54, 208]. Jedoch wurde bislang kein Marker gefunden, der einen prognostischen Einfluss hat [157]. Auch die Elektronenmikroskopie kann die Diagnose bestätigen, da klassischer Weise Myoepithelzellen mit Mikrofilamenten wie dichte Körper („dense bodies“), Hemi- und Desmosomen, eine Basallamina und v.a. Pinozytosevesikel sowie Intermediärfilamente erkannt werden können [2, 69]. Während ein Drittel „de novo“ entsteht, bilden sich die myoepithelialen Karzinome zu je einem Drittel aus pleomorphen Adenomen und aus Myoepitheliomen [54, 209, 238]. In der Literatur ist bislang umstritten, ob eine „de novo“Karzinomentstehung mit einer schlechteren Prognose einhergeht [57] oder nicht [3, 54, 209]. Genetische Untersuchungen konnten nur wenige Ergebnisse hinsichtlich Alterationen erbringen, dabei weist eine Studie auf Alterierungen im Chromosom 8 hin [134]. Die Prognose des myoepithelialen Karzinoms ist relativ schlecht: Ein Drittel verstirbt, das andere Drittel bildet Rezidive, das letzte Drittel bleibt von beiden verschont [260]. 2.4.5 Epithelial-myoepitheliale Karzinome Das epithelial-myoepitheliale Karzinom ist ein seltener Tumor (1% aller Speicheldrüsentumore) [40, 129]. Frauen sind doppelt so häufig betroffen, während bei einem Mittelwert zwischen der sechsten bis siebten Lebensdekade, eine Altersverteilung vom 13.-89. Lebensjahr, nur zwei Fallberichte bei Kindern beschrieben sind [40, 129, 195]. Am stärksten sind die großen Speicheldrüsen betroffen, allen voran die Gl. parotis (60 %) und die Gl. submandibularis [88]. 24 Der Tumor kommt auch in den kleinen Speicheldrüsen, wie denen der Mundschleimhaut, der unteren Lippe oder sogar des oberen Respirationstraktes vor [40, 59, 129]. Erst durch Donath wurde dieser terminologische Begriff eingeführt, um das ähnlich aufgebaute Karzinom des Bronchialsystems sowie der Brustdrüse, welches immer noch die frühere Bezeichnung des „Adenomyoepithelioms“ besitzt, abzugrenzen [57]. Klinische Symptome treten selten auf: Die Raumforderung (in der Regel 4-5 cm) zeigt evtl. Ulzerationen, oft bei den kleinen Speicheldrüsen [88]. Makroskopisch ist eine unbekapselte, multinoduläre Tumormasse mit Ausläufern ins umliegende Gewebe zu beobachten [88]. Das epithelial-myoepitheliale Karzinom ist histopathologisch durch zwei Zelltypen charakterisiert (Abb. 10): Die innere Schicht wird von kleinen, dunklenkuboidalen Zellen mit fein granulärem bis eosinophilen Zytoplasma unter Einschluss rundlicher Kerne gebildet und entspricht luminalen Epithelien. Außen aufliegende ovale, helle-glykogenreiche Zellen mit exzentrisch gelagerten hellen Kernen gehören in die Gruppe der Myoepithelzellen. Das meist lobuläre Wachstumsmuster zeigt tubuläre und solide Bereiche, papillär-zystische Areale ergeben sich in etwa 20 % [88]. Infiltrationen ins umgebende Gewebe (Nerven, Gefäße, Knochen) sind klassisch, Nekrosen und squamöse Differenzierungen eher selten [88]. Immunhistochemisch gelten die Marker für die Gangepithelien (CK, EMA, seltener CEA, Amylase) sowie myoepitheliale Marker (smooth muscle actin, Calponin, S-100: Abb. 11) [169]. 11 Abb.10: EMC mit heller Außen- und dunkler Innenschicht (double-layer, HE). Abb. 11: IHC-Färbung mit S-100 ist für die randständigen myoepithelialen Tumorzellen positiv (Detergenz ist AEC =3-Amino-9Ethylcarbazol). 25 Differentialdiagnostisch kommen vieleTumoren in Betracht, besonders diejenigen, die durch ihre klaren Zellen auffällig sind: das pleomorphe Adenom (meist chondroide und mukoide Bereiche), das Myoepitheliom, das Onkozytom, das hellzellige Azinuszellkarzinom (keine biphasische Differenzierung), das Mukoepidermoidkarzinom (Vorkommen von epidermoiden, intermediären und Schleim produzierenden Zellen), das klarzellige Karzinom NOS, Nierenmetastasen (positiv für CD-10), sowie das Schilddrüsenkarzinom (positiv für Thyreoglobulin-Antikörper). Die Prognose ist mit einer 5-Jahresüberlebenswahrscheinlichkeit von 80 % gut, jedoch abhängig von der Tumorgröße (über 4 cm), dem Resektionsrand, dem Proliferationsindex (MIB-1) sowie einer möglichen Dedifferenzierung [3, 88]. 2.4.6 Basalzelladenokarzinome Dem Namen nach handelt es sich beim Basalzelladenokarzinom um einen Tumor mit vorwiegend basaloiden Epithelzellen. Weiterhin weist es zytologische und histomorphologische Gemeinsamkeiten mit dem Basalzelladenom auf, ist aber darüber hinaus sowohl durch sein infiltratives Wachstum, v.a. ins perineurale, vaskuläre und Weichteilgewebe, als auch durch seine mäßige Tendenz zur Metastasierung gekennzeichnet [62]. Ellis und Wiscovitch führten zu einer besseren Differenzierung hinsichtlich des Basalzelladenoms und weiteren Basalzelltumoren diesen Begriff ein [68]. Es gibt keine Geschlechtspräferenz und bis jetzt sind ausschließlich Erwachsene bei einem mittleren Alter von 60 Jahren betroffen [64, 68]. Am Häufigsten ist dieser Tumor in der Gl. parotis lokalisiert (90%), vor allem im lateralen Lappen, weniger in den anderen Speicheldrüsen [64, 68]. Klinisch verläuft die Erkrankung oft symptomfrei, ein Spannungsgefühl kann auftreten, seltener ist es mit Schmerzen verbunden [62]. Makroskopisch wird eine grau-weiße, sogar bräunliche Schnittfläche beobachtet, wobei der Tumor meist homogen und kapsellos ist und seltener zystische Bereiche besitzt [62]. Histopathologisch dominieren die basaloiden Epithelzellen, die jedoch von kleinen, dunklen bis zu großen, blass angefärbten Zellen variieren (Abb. 12). Das Muster zeigt membranöse (Abb.13), solide (Abb. 14), trabekuläre und tubuläre (Abb. 15) Wachstumsformen, die jedoch auch kombiniert in Erscheinung treten können. Solide Varianten äußern sich durch dicht aneinander liegende Zellen, die inselartig angeordnet sind und durch Septen oder Kollagenbänder getrennt 26 werden [60]. Das trabekuläre Muster hat seinen Namen aufgrund der Ähnlichkeit zu Knochentrabekeln bei fibröser Dysplasie erhalten, anastomisierende Zellbänder sind in diesem Fall auffällig [57]. Der tubuläre Typ wird durch schmale Lumina, die nicht von Gangepithelzellen, sondern von Basalzellen begrenzt werden, charakterisiert. Das membranöse Muster erinnert an ein Puzzle, hyalines Basallaminamaterial an der Außenseite der Zellverbände ist weiterhin typisch [57]. In allen Varianten können meist Keratinisierungen, palisadenförmige Kernanordnungen, niedrige Mitoseraten und infiltratives Wachstum beobachtet werden, jedoch ist eine klinisch-prognostische Bedeutung bislang nicht belegt [57]. Insgesamt 25 % der Patienten zeigen eine Perineuralinvasion [62]. Die Immunhistochemie untermauert die These, dass sich Basalzelltumoren aus pluripotenten Gangepithelien der Schaltstücke mit einem geringeren Anteil myoepithelialer Differenzierung entwickeln [77]. Demzufolge ergeben sich positive Färbungen bei mehreren Zytokeratinen (besonders in den luminalen Abschnitten), Aktin, S-100 und Vimentin, das v.a. periphere Tumorzellen markiert [226, 303]. Darüber hinaus noch EMA und CEA [303]. Während dieses Karzinom „de novo“ entstehen kann, sind auch Fälle beschrieben, bei denen es sich aus einem Basalzelladenom entwickelte [38, 197]. 12 14 13 15 Abb. 12: BCC mit Variation der Zellhelligkeit. Abb. 13: Membranöse (=puzzleartige) Variante (HE). Abb. 14:Solide Variante mit Kollagenbändern (HE). Abb. 15: Tubuläre Variante mit nur engen Lumina und teils trabekulären Anteilen. 27 Genetische Veränderungen wurden zum einen in einer „gain of function“ bei 9p21.1-pter, 18q21.1-q23, 22q11.23-q13.31 nachgewiesen [289]. Interessanterweise ist eine Alteration von 22q12.3-q13.1 auch beim adenoidzystischen Karzinom beschrieben [289]. Genverluste wurden hingegen auf 2q24.2, 4q25q27 illustriert [289]. Bei zwei Familien wurde durch einen Verlust des CYLDGens (Alteration 16q12-13) dieselbe Alteration wie bei dem dermalen Zylindrom beobachtet [41]. Prognostisch stellt sich das Basalzelladenokarzinom durch seine geringe Metastasierung und trotz seiner hohen Rezidivrate als günstig dar [68, 197]. Differentialdiagnostisch ist aufgrund der wesentlich schlechteren Prognose die solide Variante des adenoidzystischen Karzinoms von Bedeutung. Weiterhin auch das basaloide Plattenepithelkarzinom, v.a. wenn es an der Zungenbasis bei älteren Männern mit gleichzeitig langjähriger Nikotinanamnese lokalisiert ist. 2.4.7 Onkozytäre Karzinome Dabei handelt es sich um einen seltenen Tumor (weniger als 1 % aller Speicheldrüsentumore und nur 5 % aller eosinophilen Neoplasien), der durch atypische-onkozytäre Zellen mit einer hohe mitotischen Proliferation, Infiltration sowie durch eine hohe Lokalrezidiv16 und Metastasierungsrate gekennzeichnet ist [57, 107]. Epidemiologisch sind Männer doppelt so häufig wie Frauen Abb. 16: Eosinophile Zellen mit Gefäßinfiltration (HE-Färbung). betroffen [243]. Das Alter reicht vom 25.91. Lebensjahr und liegt bei einem Mit- telwert von 62,5 Jahren. 80 % der Tumoren sind in der Gl. parotis lokalisiert, 8 % in der Gl. submandibularis, der Rest findet sich in den kleinen Speicheldrüsen, v.a. in der Gingiva und im Gaumen [33, 243]. Ansonsten sind Fälle von onkozytären Karzinomen im Nasensinus, in intrathorakalen Regionen, in den Ovarien sowie der Niere und Schilddrüse bekannt [171, 175, 280]. Eine Schwellung tritt beinahe immer auf, Schmerzen dagegen können aufgrund von Nerveninfiltration mit konsekutiver Parese vorkommen. Eine längere Vorgeschichte 28 spricht nicht für eine „de novo“- Entstehung, sondern für eine Bildung aus einem Onkozytom heraus [228]. Makroskopisch findet sich ein kapselloser Tumor, mit einer grauen Schnittfläche und teilweise nekrotischen Bereichen [243]. Pathohistologisch ähneln diese Zellen denen des Onkozytoms: große mitochondrienreiche (=eosinophile) Zellen mit großen Kernen und prominenten Nukleolen (Abb. 16). Entscheidender Unterschied sind die zahlreichen Mitosen, die Ausbildung von soliden bis glandulären Formationen und v. a. die Infiltration zusammen mit nekrotischen Bereichen. Die Mitochondriendichte ist durch „phosphatungstic acid (PTA) haemotoxylin“, durch die Novelli-Technik, Cresylecht Violet V, Kluver-Barrera Luxol oder antimitochondriale Antikörper darstellbar [254, 287]. Immunhistochemisch ist der Proliferationsmarker MIB-1 für die Abgrenzung zwischen Onkozytom und onkozytärem Karzinom hilfreich [137]. Auch α1-Antitrypsin, Laktoferrin und CEA werden exprimiert [45]. Myoepitheliale Marker sind negativ und belegen, dass diese Zellen nicht am Tumoraufbau beteiligt sind [243]. Metastasen sind eher in den lokalen Lymphknoten, seltener auch als hämatogene Fernmetastasen in Lunge, Leber, Knochensystem oder der Haut zu erwarten. Dieser Faktor ist erheblich für das weitere Überleben [114]. Bei vorhandener Metastasierung sterben 20-40 % tumorbedingt [306]. Es handelt sich um einen mittelgradig-malignen Tumor, der weiterhin durch multiple Lokalrezidive gekennzeichnet ist [243]. 2.4.8 Mukoepidermoidkarzinome Das Mukoepidermoidkarzinom zeigt auf der Zellebene eine biphasische bzw. triphasische Differenzierung aus mukösen sowie epidermoiden (=squamoiden) oder auch intermediären Zellen. Histogenetisch leitet es sich von Vorläuferzellen des Ausführungsganges ab und pathogenetisch geht man von einer Epithelmetaplasie aus, die zu Schleim bildenden, epidermoiden und intermediären Zellen führt [57]. Doch auch reaktive Veränderungen (z.B. Parotitis) führen zu verstärkten Vorkommen von Becherzell- und Plattenepithelmetaplasien in den Ausführungsgängen, so dass dies zwar die Histogenese bestätigt, jedoch kein charakteristisches Indiz für die Pathogenese eines Mukoepidermoidkarzinoms sein kann [57]. 29 Epidemiologisch handelt es sich wahrscheinlich um den häufigsten bösartigen Speicheldrüsentumor sowohl bei Erwachsenen als auch bei Kindern [64, 166, 295]. Der Mittelwert liegt bei 45 Jahren, auffällig ist, dass sehr junge und sehr alte Patienten weniger häufig betroffen sind, so dass sich ein Gipfel zwischen dem 4. und 7. Lebensjahrzehnt ergibt [106]. Frauen sind dabei doppelt so häufig wie Männer befallen [106]. Beim Mukoepidermoidkarzinom handelt es sich um einen Tumor, der gleichermaßen die großen und kleinen Speicheldrüsen betrifft [106]. Dabei lassen sich 53 % in den großen finden, wobei die Gl. parotis 45 %, die Gl. submandibularis 7 % und die Gl. sublingualis 1 % ausmachen [57]. Bei den kleinen Speicheldrüsen ist v.a. der Gaumen und die Wangenmukosa beteiligt [106]. Extraorale Mukoepidermoidkarzinome wurden in der Schleimhaut und im Sinus der Nase, dem Larynx, dem Bronchialsystem, dem Ösophagus, dem Magen, der Brustdrüse, der Analregion, der Cervix uteri, dem Thymus und der Haut beschrieben [21, 58, 60, 93, 108, 119, 175, 191, 244, 290, 310]. Anamnestische Symptome können von wenigen Monaten bis Jahren eruiert werden, da es meist mit einer langsam zunehmenden, nicht verschieblichen Schwellung beginnt [244] und bis zur Otorrhoe, Parästhesie, seltener Fazialisparese, Dysphagie (v.a. bei Zungenbeteiligung), Blutung und Trismus reichen kann [79]. Eine bläulich rote Hautfarbe kann zusammen mit einer großen zystischen Schnittfläche das Bild einer Mukozele imitieren [106]. Meist handelt es sich durchschnittlich um einen 3-5 cm unregelmäßig begrenzten Knoten, der eine weiße bis pinke Schnittfläche hat und manchmal auch zystische Bereiche aufweist [106]. Histopathologisch zeigen sich dem Namen nach muköse und epidermoide Zellen. Diese biphasische Differenzierung (Abb. 18) wird durch einen meist seltener vorkommenden Typ, den Intermediärzellen, ergänzt [240, 241]. Die Kombinationen der Triade variieren in ihrer Häufigkeit tumorabhängig, ebenso wie die Zusammensetzung von zystischen Bereichen. Die PAS positiven mukösen Zellen sind kubisch oder zylindrisch, zeigen ein schaumiges Zytoplasma mit peripheren Kernen und können sich bis zu einer Becherzelle differenzieren. Sie umgeben ein- oder mehrreihige Zysten, die sie durch ihr produziertes Sialomuzin füllen. Bei einer Ruptur der Zysten kommt es zur Inflammation und eventuell sogar zu Einblutungen. Zwischen den Schleim produzierenden Zellen sind ab und zu basaloide oder kuboidale Intermediärzellen eingeschoben, die Chromatin dichte Zelllkerne und eine Größe von Plasmazellen haben. Sie kön- 30 nen in synzytialen Verbänden eine Zellschicht um die mukösen Zellen bilden und es wird ein zytogenetischer Zusammenhang mit Myoepithelzellen diskutiert [241]. Die Epidermoidzellen dagegen können durch ihre intrazellulären Brücken und ihre soliden Verbände identifiziert werden, seltener zeigen sich Keratinisierungen [57]. Die klassische Variante zeigt mit allen 3 Zelltypen zumindest im ersten und zweiten Malignitätsgrad ein typisches, triphasisches Bild. Im G3 Stadium sind die drei Zelltypen oft nicht sichtbar, dass die Differentialdiagnose auf ein nicht weiter klassifizierbares Adenokarzinom oder Plattenepithelkarzinom (bei Dominanz von epidermoiden Zellen) erweitert wird [240, 241]. Demgegenüber stehen die nicht klassischen Varianten, die durch ein vermehrtes Vorkommen 18 19 Abb. 18: klassische Variante mit biphasischer Differenzierung aus Schleim bildenden Zellen (weiss) und epidermoiden Zellen (basophil). Abb. 19: Hellzellige Variante in der HE-Färbung. spezieller Zellen gekennzeichnet sind, die aus squamoiden (epidermoiden Zellen), eosinophilen (onkozytären=mitochondrienreichen Zellen) oder klarzelligen Varianten (glykogenreich) gebildet werden (Abb. 19) [240]. Während die aktuelle WHO-Klassifikation (siehe Tab.1) über ein Punktesystem die Graduierung zwischen low-, intermediate- und high-grade erleichtert, wird die Variante in dieser nicht berücksichtigt, obwohl gezeigt wurde, dass die klassische im Vergleich zu den anderen eine deutlich bessere Prognose aufweist [241]. Neuralinvasionen, Nekrosen, zahlreiche Mitosen sind abhängig vom Tumorgrad, gesamt gesehen, jedoch eher selten. Während die HE-Färbung immer noch der Goldstandard für die Diagnostik ist, kann die PAS-Färbung v.a. die Becherzellen, Zytokeratine die epidermoiden (CK 5/6) und die intermediären Zellen (CK 5/7) darstellen [239]. Somit kann die triphasische Struktur aufgezeigt werden. Eine Doppelexpression von Zytokeratinen und Vimentin ist in 30-40 % v.a. bei den 31 Zystische Komponente > 20 % 2 Intermediärzellen beschrieben worden Neuralinvasion 2 [231]. Bei der Expression von verschie- Nekrose 3 4 oder mehr Mitosen pro Gfe. 3 Anaplasie 4 Punkte: Tumor Grad denen Muzinen (MUC) konnte ein Zusammenhang mit dem Differenzierungsgrad und weiteren klinischen Daten hergestellt werden [163, 231]. Während die low (G1) 0 bis 4 intermediate (G2) 5 bis 6 7 oder mehr high (G3) verstärkte Expression von MUC-1 mit einem signifikant schlechteren Überleben, mit einem höheren Tumorgrad, ei- Tab.1: WHO-Graphik zur Bestimmung des ner stärkeren Metastasierung sowie Tumorgrades (Gfe= Gesichtsfeldeinheit). Rezidivbildung und einem kürzeren krankheitsfreien Intervall assoziiert zu sein scheint, wird MUC-4 besonders in low-grade Mukoepidermoidkarzinomen gebildet, während MUC-5AC meist in high-grade Differenzierungen zu finden ist [118, 163]. Tumorgrades (Gfe=Gesichtsfeldeinheit). Neben den immunhistochemischen Markern kann allerdings auch eine genetische Untersuchung die Diagnosefindung erleichtern: In ungefähr 40 % der Mukoepidermoidkarzinome kann eine Translokation t(11; 19)(q21; p13) −ähnlich wie bei der akuten Leukämie− nachgewiesen werden [131, 213]. Dadurch kommt es zu einer Fusion zwischen dem 1. Exon des MECT-1 Gens (=Mukoepidermiod carcinoma translocated gene 1) auf Chromosom 19q13 und dem 2.-5. Exon des MAML2-Gens (Mitglied der Familie des mammalian mastermind-like) auf Chromosom 11q21 [240]. Dieses entstandene Transkript hat eine Aktivierung der CREB-Gene und eine Störung des Notch-Signaltransduktionsweges zur Folge, zeigt jedoch eine bessere Prognose [240, 241]. Auch das Vorkommen von mutierten H-ras Proteinen, bevorzugt in high-grade Tumoren, konnte nachgewiesen werden [309]. Im Großen und Ganzen ist die Prognose insgesamt relativ gut, wobei der Differenzierungsgrad (mehr in der Gl. parotis und den kleinen Speicheldrüsen als in der Gl. submandibularis), der Residualtumor, Fernmetastasen und ein MIB-1 Wert über 10 % wesentlich sind [106, 108]. Somit ergibt sich ein 5-Jahresüberleben bei gut- und mittelgradig differenzierten Tumoren über 90 %, während bei schlecht differenzierten Karzinomen dieses auf etwa 50 % abfällt [106]. Ähnlich wie beim Azinuszellkarzinom ist das Vorkommen von Spätrezidiven mit etwa 25 % besonders hoch [64]. Differentialdiagnostisch kommen −wie bereits erwähnt− bei G3 Tumoren das Plattenepithelkarzinom und das Adenokarzinom NOS in Betracht, bei der hellzelligen Variante kann Gemeinsamkeit zu der gleichnamigen Variante des 32 Azinuszellkarzinoms bestehen. Der Wharthintumor zeigt ebenfalls onkozytäre Zellen, die jedoch durch den typischen bizellulären Charakter und der häufigen Lokalisation in Lymphknoten abgegrenzt werden können. Auch eine nekrotisierende Sialometaplasie, ein invertiertes Papillom oder ein Zystadenom können Ähnlichkeiten aufweisen [32, 244]. Therapeutisch steht die chirurgische Entfernung im Vordergrund, oft wird eine Neck-Dissektion angeschlossen. Bei aggressiveren G2/G3-Tumoren ist meist eine adjuvante Bestrahlung erforderlich [65]. 2.4.9 Speichelgangkarzinome Hierbei handelt es sich um ein Adenokarzinom, das histogenetisch aus pluripotenten Stammzellen der interlobulären Ausführungsgänge entweder „de novo“ oder aus einem pleomorphen Adenom entsteht und durch sein hochmalignes Verhalten, seine starke Metastasierung sowie Rezidivbildung charakterisiert wird [57]. Dieses Karzinom wird nach seinem Erstbeschreiber, dem Marburger Hals-Nasen-Ohren-Arzt, „Kleinsasser“-Tumor genannt und ist mit einem Anteil von 3 % aller Speicheldrüsentumoren bzw. 9 % aller Speicheldrüsenmalignome mit 90 % vorwiegend in den großen Drüsen (80 % Gl. parotis, 10 % Gl. submandibularis) zu finden [31]. Der Rest verteilt sich auf die kleinen Speicheldrüsen (10 %). Weiterhin wurden einzelne Fälle in Maxilla und Larynx beschrieben [86, 313]. Männer sind viermal häufiger als Frauen betroffen, wobei der Altersgipfel zwischen dem 6.-8. Lebensjahrzehnt bei einem Erkrankungsbeginn meist nach dem 50. Lebensjahr liegt [12, 30, 31]. Klinisch äußert sich der Tumor aufgrund seines schnellen und infiltrativen Wachstums oft mit Schmerzen, einer Fazialisparese sowie einer zervikalen Lymphadenopathie [31]. Makroskopisch findet sich eine kapsellose, unscharf-solide und mehrknotige Masse, die eine grau-weiße Schnittfläche mit vereinzelten zystischen Bereichen aufweist [31]. Histopathologisch imitiert dieser Tumor das Bild des duktalen in-situ-Karzinoms der Brustdrüse (=DCIS), das sich in bogenförmigen Strukturen („Römische Brücken“) und Komedonekrosen (Abb. 20) äußert. Typisch sind die deutlichen Zellund Kernpleomorphien, die zahlreichen Mitosen, Lichtungen der gangartigen Tumorzellen und eine Infiltration ins Perineuralgewebe sowie der Einbruch in Gefäße, so dass auch Mikroemboli in 31 % entstehen [31]. Zum einen bilden 33 sich intraduktale Formationen mit cribriformen, papillären und bogenförmigen Strukturen unter Einschluss von Komedonekrosen aus [57]. Andererseits zeigen sich intraduktale Komplexe mit vorwiegend soliden Zellverbänden und desmoplastischer Hyaliniserung des Stromas [81]. Epidermale Zellen mit Keratiniserung sowie Psammomkörperchen in soliden und papillären Bereichen können weiterhin auftreten [31]. Die Tumorzellen haben des Öfteren ein granuläres, PAS positives Zytoplasma. Ein spindelzelliges Wachstumsmuster erinnert an Metaplasien des duktalen Mammakarzinoms [204]. Daneben sind eine muzinreiche und mikropapilläre Varianten als Subtypisierungen beschrieben, wobei Ersteres wohl eine bessere und Letzteres eine schlechtere Prognose bedeutet [204, 256]. Daneben gibt es noch eine eosinophile Variante (Abb. 21), die Ähnlicheiten zum onkozytärem Karzinom aufweist. 20 Abb. 20: Kommedonekrose mit cribriformen Wachstumsmuster (HE). 21 Abb. 21: Eosinophile Variante (HE). Es sind zahlreiche immunhistochemische Marker bekannt: Zytokeratine, CEA, LeuM1, EMA und v.a. die Reaktivität für Androgenrezeptorantikörper, wobei Männer eine stärkere Expression als Frauen (79 % vs. 39 %) aufweisen [158, 304]. Während Antikörper für S-100 oder Progesteronrezeptoren, weniger dagegen für Östrogenrezeptoren (nur 8 %), oft positiv sind, konnte gezeigt werden, dass wohl ein Mangel an Androgen- und Östrogenrezeptoren (ER-β) mit einer schlechteren Überlebenschance bzw. einer erhöhten Rezidivrate verbunden ist [30, 304]. Bei Markern wie GCDFB-15, MIA (=Mitochondriales Antigen), konnte ein apokrines Verhalten dieser Tumoren nachgewiesen werden [31]. Gegenwärtig großes Interesse erfährt auch die Expression des Wachstumsrezeptors Her-2/neu [261, 262]. Die folgliche Therapie mit Trastuzumab konnte bis jetzt keine Prognoseverbesserung erreichen [199]. Genetische Veränderungen zeigten sich in einem Verlust der Heterogenität (=LOH) bei Chromosom 9q21, ein Abschnitt der für das Tumorsuppressorgen CDKN2A/p16 kodiert und 34 in 6q, 16q, 17p, 17q [41, 127]. Ebenfalls wurde eine häufige Alteration bei TP53 beobachtet [127]. Mit einem 5-Jahresüberleben zwischen 20-40 %, einer meist frühen Fernmetastasierung von 50 % (bevorzugt in Leber, Lunge, Knochen, Gehirn und einer zervikalen Lymphknotenbeteiligung von 60 %) stellt das Speichelgangkarzinom eines der aggressivsten Speicheldrüsenmalignome dar [31]. Daher wird versucht, diesem Verhalten eine möglichst umfassende Therapie, wie komplette Entfernung der Drüse, Neck-Dissektion, Bestrahlung und in metastasierten Fällen auch eine Chemotherapie entgegenzusetzen [65]. Differentialdiagnostisch abzugrenzen ist die Metastasierung eines Mammakarzinoms, Varianten des Mukoepidermoidkarzinoms (Becherzellen, Makro-und Mikrozysten) besonders im Vergleich zur muzinen Variante des Gangkarzinoms, das onkozytäre und das Plattenepithelkarzinom. 2.4.10 Plattenepithelkarzinome Das primäre Plattenepithelkarzinom ist ein Tumor bestehend aus Epidermoidzellen, die Keratinisierungen und interzellulare Brücken aufweisen [158]. Primär wird hinzugefügt, da es sich per Definitionem um ein Karzinom ausschließlich der großen Speicheldrüsen handelt, da in den kleinen Speicheldrüsen nicht mehr beurteilt werden kann, ob der Tumor sekundär aus der darüber gelegenen Schleimhaut eingewachsen ist [57]. Die Datenlage ist hinsichtlich der Gesamthäufigkeit aller Speicheldrüsentumoren schwankend und somit lassen sich Werte zwischen 1 und 5 % finden, für den Anteil nur an den bösartigen zwischen 6 und 14 % [57, 157, 159]. In der eigenen Fallserie sind es dabei fast 9 %. Ein Altersgipfel besteht zwischen dem 6. und 8. Lebensjahrzehnt bei einem Mittelwert zwischen 60 und 65 Jahren, wobei Männer etwa doppelt so häufig wie Frauen betroffen sind [57]. Auch einige wenige Fälle von Kindern sind beschrieben und im eigenen Kollektiv befindet sich ein 15-jähriger Jugendlicher, wobei bereits im UICC-Stadium 1 eine chirurgische Therapie erfolgte [65]. Ätiologisch wird eine frühere Bestrahlung der Kopf- und Halsregion diskutiert, dann mit einer Latenzzeit von ein bis drei Jahrzehnten [253]. Ebenso eine weitere Dedifferenzierung aus einem höhergradigen Mukoepidermoidkarzinom kann nach Expertenmeinung für eine Entstehung in Betracht kommen [240, 253]. Zu 80 % kommt es hierbei zu einer Beteiligung in der Gl. parotis, 20 % 35 ereignen sich in der Gl. submandibularis, seltener hingegen ist eine Lokalisation im Stenon-Gang möglich [159]. Da es sich klinisch um einen schnell wachsenden Tumor handelt, der häufig eine Fazialisparese und Schmerzen verursachen kann, handelt es sich zum Zeitpunkt der Diagnose meist um einen high-grade (G3) Tumor [253, 272]. Makroskopisch lässt sich eine solide hellgraue und weißliche Schnittfläche mit teilweise fokalen Nekrosen erkennen, die Tumorgrenzen sind dabei unregelmäßig [159]. Histopathologisch lassen sich wie bei anderen Lokalisationen die22 ser Entität Zellen mit plattenepithelialer Differenzierung Abb. 22: Epidermoide Zellen mit Hornperlen. sowie möglicher Bildung von Hornperlen (Abb. 22), Infiltrationen ins Gewebe, irreguläre bis trabekuläre Zellnester und Stromadesmoplasien erkennen [57]. Als Differentialdiagnose gilt es in erster Linie, eine Metastasierung auszuschließen [159]. Auch high-grade Mukoepidermoidkarzinome, speziell die squamoide Variante, stellen aufgrund ihrer häufig verlorenen trizellulären Komponente ein diagnostisches Problem dar, das mithilfe von immunhistochemischen und genetischen Markern gelöst werden kann [240]. Ein abgelaufener Infarkt mit konsekutiver Narbenbildung und squamöser Metaplasie ist ebenso als differentialdiagnostische Überlegung miteinzubeziehen [159]. Genetische Untersuchungen wiesen darauf hin, dass primäre Plattenepithelkarzinome, wie auch andere Speicheldrüsenmalignome, eine 6q-Deletion zeigen, währenddessen dies bei Plattenepithelkarzinomen in der Kopf-Halsregion (z.B. Larynx, Pharynx) nicht nachweisbar war [141]. Prognostisch handelt es sich meist um einen hoch malignen Tumor, der aufgrund seines aggressiven Verhaltens (Lokalrezidivrate bei 50 %, lokale Lymphknotenmetastasierung bei ungefähr 35 % und Fernmetastasierung bei circa 25 %) ein 5-Jahresüberleben zwischen 25 und 30 % hat, wobei die 15 Jahresüberlebensrate bei ca. 15 bis 20 % liegt und es sich somit um einen Tumor handelt, der meistens in den ersten Jahren zum Tod führt [57, 65, 159, 253]. Therapeutisch ist die vollständige Entfernung der Drüse, aufgrund der hohen 36 zervikalen Lymphknotenbeteiligung auch eine Neck-Dissektion mit nachfolgender Bestrahlung indiziert. 2.4.11 Nicht näher klassifizierbare Adenokarzinome Das Adenokarzinom NOS (=not otherwise specified) entsteht vermutlich aufgrund seiner duktalen und tubulären Strukturen aus den epithelialen Vorläuferzellen des Ausführungsganges. Während historisch eine Reihe von Tumorentitäten der Speicheldrüsen schlicht als Adenokarzinome bezeichnet wurden, klassifizierte man einige davon um: Das polymorphe low-grade Adenokarzinom, das myoepitheliale sowie das epithelial-myoepitheliale Karzinom, das papilläre Zystadenokarzinom, das Speichelgangkarzinom und das onkozytäre Karzinom [138, 207, 247, 270]. Diese Subtypisierung erfolgte meist basierend auf histopathologischen Kriterien und zeigt klinische Relevanz, jedoch war dies nicht bei allen möglich, so dass der „Sammeltopf“ nicht näher klassifizierbaren Adenokarzinom für all die übriggebliebenen Adenokarzinome geboren war [57]. Neben dieser Tatsache erfüllt diese Entität jedoch auch eigene Kriterien, auf die eingegangen werden soll: Das Armed Forced Institute of Pathology (=AFIP) gab diesen Tumor als dritthäufigstes Malignom der Speicheldrüsen an, während dieselben Autoren fünf Jahre danach sogar vom zweithäufigsten Speicheldrüsenmalignom −mit 17 % der bösartigen und 9 % aller Speicheldrüsentumoren direkt dem Mukoepidermoidkarzinom folgend− sprechen [8, 64]. Während Frauen wohl geringfügig öfters betroffen sind, werden Kinder beinahe ausgespart, so dass sich ein durchschnittliches Alter um die 58 Jahre ergibt [10]. Die großen Speicheldrüsen, allen voran die Gl. parotis, sind mit 60 %, die kleinen Speicheldrüsen mit immerhin 40 % beteiligt, hier v.a. der harte Gaumen, die Wangenschleimhaut und die Lippen [9]. Ebenfalls kommt dieser Tumor in der Nasenhöhle, dem paranasalen Sinus und dem Larynx vor, sollte aber aufgrund seines klinisch aggressiveren Verhaltens als separate Gruppe bewertet werden [265]. Klinische Symptome sind in erster Linie zunächst stumm, Schmerzen werden in 20 %, eine Fazialisschwäche etwas seltener angegeben, wobei der Schmerz intensiver bei einer Beteiligung der Gl. submandibularis zu sein scheint und eine Beteiligung der kleinen Speicheldrüsen häufiger mit Ulzerationen assoziiert ist [265]. 37 Makroskopisch findet sich eine 2 bis 8 cm messende Tumormasse, die in der Hälfte der Fälle mit Gewebe, wie der Haut, verwachsen ist [10]. Die weißgelben Schnittfläche betont nekrotische und hämorrhagische Bereiche [10]. Dabei handelt es sich bei Diagnosefindung meist um high-grade (G3) Tumoren seltener auch um G2-Tumore, deren Aggressivität lässt sich mithilfe des Proliferationsmarkers (MiB-1) und der Zelldiferenzierung abschätzen.High-grade Karzinome fallen durch hyperchromatische und polymorphe Zellkerne in Verbindung mit fokalen Nekrosen und pathologischen Mitosefiguren auf (Abb. 25) [10], während bei einem G2-Malignitätsgrad weniger Kernvariabilitäten (Abb. 24) und Mitosen (Abb. 23) vorhanden sind. Neben der prognostisch relevanten Tumorgraduierung lassen sich glanduläre und gangartige Strukturen differenzieren, wobei der Aufbau von „einigen kleineren ineinanderfließende Zellnestern“ bis hin zu „großen Gebilden von Zellgruppen mit fibrös verbundenen Trabekeln“ reichen kann [10]. Das morphologische Muster ist vielfältig und umfasst anaplastische, solide, tubuläre, papilläre und zystische Strukturen. Oft zeigen sich kuboidale und ovale Zellnester, seltener auch einzelne onkozytäre, klare oder myoepitheliale Zellen. Gangartige Strukturen gehen dabei eher mit dem selteneren Grad 2 einher, solide Bereiche entsprechen eher Grad 3 [57]. 23 24 Abb. 23: Einheitliche Zellen mit wenigen Mitosen (HE). Abb. 24: Glanduläres Muster mit mittelgradig differenzierten Zellen (=G2). Abb. 25: Kollagenartige Bänder und schlecht differenzierte Zellen mit atypische Mitoseiguren (=G3). 25 38 Differentialdiagnostisch kommen eben wegen dieser duktalen Differenzierung auch das Speichelgangkarzinom in Betracht, während dieses Merkmal auch zum Ausschluss für ein undifferenziertes Adenokarzinom dient [10, 57]. Doch genauso Adenokarzinome aus anderen Bereichen des Körpers sind unter immunhistochemischer Aufarbeitung abzugrenzen: Jedoch wurde Prostata spezifisches Antigen (=PSA) ebenfalls in primär entstandenen, nicht näher klassifizierbaren Adenokarzinomen der Speicheldrüsen nachgewiesen und ist daher eher unspezifisch [257, 283]. Abhängig vom Grad 1/2/3 wird das 15-Jahresüberleben mit 54 %/ 31 %/ 3 % angegeben und ist für die meist als high-grade Tumoren klassifizierten Adenokarzinome NOS denkbar schlecht, wobei ein gut differenzierter Tumor in Etwa der Überlebenschance des Azinuszellkarzinoms gleichkommt [10, 265]. Sind diese an den kleinen Speicheldrüsen der Schleimhaut lokalisiert, haben diese −womöglich aufgrund der schnelleren Therapie− eine bessere Prognose [65]. Therapeutisch bieten sich wie auch beim primären Plattenepithelkarzinom und dem Speichelgangkarzinom die chirurgische Entfernung und eine zervikale Lymphknotenausräumung in Kombination mit einer Bestrahlung an [55, 64]. 2.4.12 Carcinoma ex pleomorphes Adenom Das Carcinoma ex pleomorphes Adenom transformiert aus einem pleomorphen Adenom in ein epitheliales Malignom, das durch anaplastische Epithelzellen mit atypischen Mitosen, einen progressiven Verlauf, ein infiltratives Wachstum und durch lokale Rezidiv- sowie Metastasenbildung gekennzeichnet ist [57, 101]. Epidemiologisch ergeben sich bei diesem starke Unterschiede, wobei das 26 Armed Forced Institute of Pathology dieses mit einem Anteil von 2,2 % aller Spei- Abb. 26: ADC NOS mit chondroidem Stroma (als Hinweis cheldrüsentumore und auf eine Enstehung aus dem pleomorphen Adenom). 6,5 % aller bösartigen an- gibt [64]. Einig ist man sich hinsichtlich des betroffenen Alters zwischen dem 60. 39 und 70. Lebensjahr: Das pleomorphe Adenom besteht in diesem Fall ein Jahrzehnt vorher, wobei auch Verläufe mit einer benignen Vorstufe von ca. 2 bis zu 20 Jahren beschrieben sind [15, 161, 264]. Betroffen ist besonders die Gl. parotis, seltener die Gl. submandibularis oder die kleinen Speicheldrüsen, dann aber v.a. der Gaumen [101]. Extraorale Manifestationen sind in der Haut als „chondroide Syringome“, in der Tränendrüse, in der Epiglottis, in der Trachea, in der Gallenblase und in der Prostata beschrieben worden [125, 126, 152, 167, 172, 183, 193]. Klinischen Symptomen geht oft eine schmerzlose Drüsenschwellung voraus, danach kann ein rapides Wachstum begleitet von Schmerzen und Fazialisschwäche in bis zu 40 % auftreten [57, 264]. Makroskopisch geben einige Autoren den Tumor mit einer doppelten Größe des pleomorphen Adenoms zwischen 1,5 und 25 cm an, wobei der Tumor ein buntes Bild aus soliden, zystischen, nekrotischen und kalkhaltigen Bereichen bieten kann [57, 89, 256]. Es können sich eine Reihe von bösartigen Tumoren aus dem pleomorphen Adenom bilden, weswegen lange Zeit eine Diskussion hinsichtlich der Anerkennung des Carcinoma ex pleomorphen Adenoms als eigenen Entität herrschte [264]. Es bieten sich zur näheren Unterscheidung zwei Subtypisierungen sowohl aus histopathologischer als auch aus klinisch-prognostischer Sicht an: Diese Karzinome können aus dem pleomorphen Adenom primär oder sekundär aus einem Rezidiv entstehen. Es entwickeln sich meist Adenokarzinome NOS oder Speicheldrüsengangkarzinome, gefolgt von myoepithelialen Karzinomen. Wesentlich seltener kommen auch andere Entstehungen vor (Mukoepidermoidkarzinom, adenoidzystische Karzinom, Plattenepithelkarzinom, polymorphe lowgrade Adenokarzinom, epithelial-myoepitheliale Karzinom, Karzinosarkom) [23, 96, 104, 111, 185, 264, 269]. Die Diagnose kann dabei durch eine Kombination der Entitäten erschwert werden [264]. Entsprechende Charakteristika der Tumoren sind in den jeweiligen Kapiteln nachzulesen, wobei in der kompletten pathologischen Aufarbeitung als wesentliches Kriterium das pleomorphe Adenom zu finden ist, welches allerdings in wenigen Fällen kaum noch nachweisbar sein kann. Die nächste Einteilung, die Prognose und das klinische Verhalten besser berücksichtigt, richtet sich nach der Invasionstiefe. Das nicht invasive Carcinoma ex pleomorphes Adenom ist mit einem Carcinoma in situ gleichzusetzen, das fokale oder diffuse Anordnungen von Zellkomplexen mit meist atypischen Gangepithelien, zahlreichen Mitosen und hyalinen Stromabereichen 40 aufweist [23]. Epitheliale Zellen können die myoepithelialen Zellgrenzen an einigen Stellen bereits durchbrechen [269]. Das minimal invasive Karzinom ist über eine Invasion ins extrakapsuläre Gewebe ≤ 0,5 cm definiert, wobei diese beiden Subtypen eine hervorragende Prognose zeigen [299]. Das invasive Karzinom, definiert als eine Invasion über 0,8 cm, äußert sich mit einem infiltrativdestruktivem Wachstum [299]. Perineurale, vaskuläre sowie seltener auch in das Knochengewebe reichende Infiltrationen, Nekrosen, Blutungen und Hyalinisierungen sind beobachtbar. Daneben kommen Kernhyperchromasien und -pleomorphien stärker zum Vorschein [101]. Die Prognose ist dabei deutlich schlechter, auch Rezidive werden zwischen 23 und 50 % angegeben [101, 161]. Die lokale und die Fernmetastasierung betragen sogar bis zu 70 % [96, 101]. Das 5-/10-/15-/20-Jahresüberleben wird beim invasiven Karzinom mit 2565%/ 18-50 %/ 10-35 %/ 0-38 % angegeben [96, 160, 291]. Tumorgröße, WHOGrad sowie v. a. die Invasion und die histomorphologische Typisierung mit entsprechend tumorspezifisch aggressiven Verhalten sind wesentliche prognostische Faktoren [57, 291]. Genetische Veränderungen sind zahlreich beschrieben. Mit der Frage, wieso ein benignes Adenom in ein malignes Karzinom transformiert, beschäftigte sich Brandwein et al. und konnte in 70 % des nicht-invasiven Karzinoms aneuploide DNA im Gegensatz zu seinem benignen Vorläufer ermitteln [28]. Everson und Yeudal entwarfen dagegen ein Tumormodell, bei dem es zunächst zu einem Verlust der Heterogenität (=LOH), zu einer Aktivierung vom PLAG-1 Gen, zu einer Mutation des c-myc Gens, gefolgt von p21 und p53 kommt [81]. Mithilfe neuer genetischer Techniken (Homogenously stained region und double minutes) konnten in 40 % Amplifikationen des Transkriptionsfaktors HMGIC und des p53-Inhibitors MDM-2 gefunden werden, ebenso Translokationen und Deletionen dieser beiden Gene [72, 229, 235]. 2.4.13 Karzinosarkome Das Karzinosarkom wird als „echter maligner Mischtumor“ bezeichnet, da eine maligne Differenzierung von epithialen und sarkomatoiden Bereichen vorkommt [98]. Es handelt sich um einen sehr seltenen Tumor, dessen Beschreibung sich auf wenige Fälle in der Literatur beschränkt [4, 100, 105, 110, 122, 152, 259, 271]. Bei einer Altersverteilung zwischen dem 14. und 84. Lebensjahr tritt im Mittel die Erkrankung um das 58. Lebensjahr auf, wobei die Karzinome häufig, 41 aber nicht ausschließlich aus einem pleomorphen Adenom entstehen [98, 125, 144]. Einige Autoren zählen jedoch diese Entität als eine Untergruppe des Carcinoma ex pleomorphen Adenoms, wobei sich die Rarität des Karzinosarkoms mit einer Gesamthäufigkeit in dieser Gruppe von 5 % wiederspiegelt [57, 100]. Sie werden mit zwei Dritteln in der Gl. parotis angegeben, mit 19 % in der Gl. submandibularis und am seltensten in den kleinen Speicheldrüsen, dann besonders am Gaumen [100]. Manifestationen an der Zunge und im supraglottischen Bereich beruhen auf Fallberichten [73]. Unspezifisch sind sowohl klinische Symptome, die sich in Schmerzen äußern, als auch die Makroskopie, die eine gut bis schlecht umschriebene Raumforderung zeigt [78]. Histopathologisch sind die epitheliale und die sarkomatoide Differenzierung charakteristisch. Während die epitheliale Komponente das Bild eines niedrig differenzierten Adenokarzinoms mit gangartigen Strukturen, eines undifferenzierten Karzinoms oder eines Plattenepithelkarzinoms bieten kann, zeigt der sarkomatoide Teil chondrosarkomatoide, mitosereiche Zellverbände mit mehrkernigen chondroiden Zellen [98]. Seltener, aber ebenfalls mit zahlreichen Mitosen, sind auch Osteosarkome mit Bildung von Osteoid sichtbar [57]. Auf Einzelfallbeschreibungen beruhen Myxo- und 27 Abb. 27: Nebeneinander von adenokarzinomatösen und sarkomatoiden Zellen (HE). Fibrosarkome, bis hin zu analogen Zellen eines malignen Zellen eines malignen fibrösen Histiozytoms [279]. Genetische Veränderungen sind in einem Heterozygotenverlust bei Chromosom 17p13.1, 17q21.3, 18q21.3 sowie in einer TP53-Mutation und Inaktivierung des Tumorsuppressorgens auf dem kurzen Arm des Chromosoms 17p13 beschrieben [110]. Das hoch aggressive Karzinosarkom wird durch eine großzügige chirurgische Exzision mit einer postwendenden Chemotherapie behandelt, wobei die Prognose mit einer Lokalrezidivrate zusammen mit einer Metastasenbildung (v.a. Lunge, Leber, ZNS) insgesamt bei 60 % liegt und die meisten Patienten innerhalb von 30 Monaten versterben [4, 73, 271]. 42 2.4.14 Zystadenokarzinome Das Zystadenokarzinom bildet verschieden große Zysten aus und weist öfters papilläre Proliferationen, Kernatypien, atypische Mitosefiguren auf und lässt sich daneben durch sein infiltratives Wachstum von seinem benignen Gegenspie28 ler, dem Zystadenom, abgrenzen [7, 57]. Andere Bezeich- Abb. 28: Papilläres Muster mit intrazystischen Bereichen. nungen lauten „papilläres Zystadenokarzinom“ oder „low- grade papilläres Adenokarzinom“ und beziehen sich zum einen auf das papilläre Wachstumsmuster (Abb. 28), zum anderen auf den niedrigen Malignitätsgrad, der sich in der seltenen Lymphknotenmetastasierung (ungefähr 10 %) und in der nur vereinzelten Rezidivbildung (ca. 10 %) äußert [90]. Dabei sind zu etwa zwei Dritteln die großen Speicheldrüsen betroffen, allen voran die Gl. parotis. Die Gl. sublingualis ist im Vergleich zu anderen Tumoren verhältnismäßig oft befallen, bei den kleinen Speicheldrüsen dominiert der Gaumen als Lokalisation [6, 90]. Der Tumor manifestiert sich bei mehr als 70 % der Patienten über dem 50. Lebensjahr, eine Geschlechtsdisposition liegt dabei nicht vor [90]. Makroskopisch beeindrucken bei einem Tumordurchmesser von 0,5 bis 6 cm vor allem die Zysten, die nicht selten mit Muzin angereichert sind und in denen auch Einblutungen sichtbar sein können [7, 57]. Auch histopathologisch treten Zysten, die mit kuboidalen oder zylindrischen Epithel ausgekleidet sind und durch Anastomosen verbunden werden, in den Vordergrund. Darin befinden sich sehr häufig papilläre Proliferationen, die histologisch ähnliches Epithel mit bindegewebigem Stroma und seltener auch mit Hyalinisierungen aufweisen. Verkalkungen und intrazystische Blutungen durch deren Ruptur sind ebenso wie das Vorkommen von klaren, onkozytären oder sogar Schleim bildenden Zellen möglich, welche die Differentialdiagnose zum low-grade Mukoepidermoidkarzinom erschweren [90]. Während sich Letzteres durch seine größere Zellvariation abgrenzen lässt, kann die weitere Differentialdiagnose, der papillär-zystischen Variante des Azinuszellkarzinoms, aufgrund 43 einer stärkeren Epithelproliferation in Verbindung mit PAS-positiven Zymogengranula ausgeschlossen werden. Metastasen eines papillären Schilddrüsenkarzinoms würden darüber hinaus eine Positivität für Thyreoglobulin zeigen. Das polymorphe low-grade Adenokarzinom äußert sich dagegen meist in einem größeren Spektrum an Zell- und Konfigurationsvariationen [6, 247]. 2.4.15 Undifferenzierte Karzinome Als undifferenzierte Karzinome werden mehrere Tumoren zusammengefasst. Das großzellige Karzinom, das undifferenzierte Karzinom mit lymphoidem Stroma und das kleinzellige Karzinom, das nur von einigen Autoren dazu gezählt wird [74]. Ihre Anaplasie in der Lichtmikroskopie macht sie einzigartig. 2.4.15.1 Großzellige Karzinome Das großzellige Karzinom kommt relativ selten vor, ist jedoch häufiger als das kleinzellige Karzinom [57] und betrifft als ein high-grade Tumor vorwiegend die großen Speicheldrüsen, besonders die Gl. parotis und nur selten die kleinen Speicheldrüsen [135, 208, 233]. Eine Geschlechtsdisposition scheint nicht zu bestehen, wobei v.a. Personen um das 60. Lebensjahr betroffen sind [208]. Aufgrund seines hochmalignen Verhaltens wächst der Tumor schnell und auch eine Fazilisparese sowie Schwellungen zervikaler Lymphknoten können symptomatische Anzeichen sein [201]. Makroskopisch findet sich eine solide Tumormasse mit weiß-grauer Schnittfläche sowie häufige Infiltrationen in das Nachbargewebe (Haut, Muskel, Fett), ebenso nekrotische und hämorrhagische Bereiche [57, 201]. Pathohistologisch bestimmen große Tumorzellen (>30 μm) das Bild. Diese besitzen vorwiegend eosinophiles, seltener klares Zytoplasma in rundlichen bläschenförmig aufgehellten Zellkernen mit prominenten und bis zu drei fassenden Nukleolen [133]. Das Wachstumsmuster reicht von trabekulären bis palisadenoder gar rosettenartigen Formen, dabei treten Mitosen und Nekrosen häufig, duktale oder squamoid differenzierte Bereiche eher seltener auf [209]. Perineurale und vaskuläre Infiltrationen verdeutlichen die Malignität. Immunzytochemisch können teilweise neuroendokrine Marker (Chromogranin A, Synaptophysin, Leu-7) nachgewiesen werden, Ki-67 ist bei 50 % sehr hoch [57, 201]. 44 Weitere ergänzende genetischen Untersuchungen wiesen auf eine diffuse Expression von bcl-2 sowie EGFR, Cyclin D1 und auf Störungen von p21, p27, TP53 hin [198, 263]. Prognostisch handelt es sich um einen Tumor vergleichbar mit dem hoch aggressiven Speichelgangkarzinom mit hoher Lokalrezidivrate, zervikaler und starker Fernmetastasierung. Günstigere Faktoren sind dabei eine geringere Tumorgröße (< 4 cm), wobei die Tumorzellgröße keinen Einfluss hat [133]. 2.4.15.2 Lymphoepitheliale Karzinome Es handelt sich um ein Karzinom, bei dem die epitheliale Tumordifferenzierung zu einer reaktiven Lymphozytenproliferation führt, die reaktiv und nicht maligne ist (Abb. 29) [293]. Begriffe wie undifferenziertes Karzinom mit lymphoidem Stroma oder bösartige lymphoepitheliale Läsion sind weiterhin gebräuchlich [25, 43, 248]. Viermal häufiger tritt es bei Eskimos und Südchinesen auf, weniger stark auch bei Finnen, Franzosen, Spaniern und Italienern [25, 85, 206, 240, 252]. Eskimos zeigen bei einer weibliche Disposition einen klinischaggressiveren Verlauf [85, 252]. Während bei den endemisch nicht erhöhten Risikogruppen eine männliche Disposition vorherrscht, sind hauptsächlich (80 %) die Gl. parotis und Menschen fast jeden Alters betroffen [25, 57]. Analog zum lymphoepithelialen Karzinom des Nasopharynx lässt neben der morphologischen Gemeinsamkeiten auch der Nachweis von Epstein-Barr-Virus-RNA Rückschlüsse auf eine Tumorgenese zu, wobei im Gegensatz dazu, ethnisch häufig betroffende Völker diesen Virusbefall kaum zeigten [25, 252]. Somit ist eine multifaktorielle Ätiologie hinsichtlich ethnischer, genetischer (HLA-System), geographischer, viraler und ernährungsspezifischer (roher Fisch) Gesichtspunkten zu diskutieren. Klinische Warnsymptome sind unspezifisch und äußern sich in Drüsenschwellung, zervikaler Lymphknotenschwellung, Fazialisparese und Fixierung der Haut. Makroskopisch kann der Tumor zwischen 1 und 10 cm aufweisen [248]. Pathohistologisch sind synzytiale gro29 Abb. 29 Epitheloide Tumorzellen werden von reaktiven Lymphozyten umgeben. ße Tumorzellen mit aufgehelltem Zytoplasma, vesikuläre Zellkerne, Mito- 45 sen und Nekrosen charakteristisch [76]. Als Begleitreaktion finden sich daneben viele Lymphozyten und einige Plasmazellen oder manchmal sogar sekundäre Lymphfollikel [293]. Auch vorkommende Histiozyten bieten gelegentlich das Bild eines Sternenhimmels [252]. Andere Beobachtungen sind nicht verkäsende Granulome, Amyloid-Ablagerungen und zystische Formationen [252]. Gelegentlich ist auch eine squamoide Differenzierung möglich [293]. Immunzytochemisch positive Zytokeratinfärbungen zeigen die maligne epitheliale Komponente an. Genetisch sind Mutationen von Tumorsuppressoren beschrieben [293]. Während Lymphknotenmetastasen und Fernmetastasen (20 %) in Lunge, Leber, Knochen und Gehirn relativ häufig sind, liegt die Prognose bei einem 5Jahresüberleben von ca. 80 % mit entsprechender Therapie der Drüsen- und zervikalen Lymphknotenentfernung und Bestrahlung relativ gut [25, 153]. 2.4.15.3 Kleinzellige Karzinome Für diese sehr seltene Entität (2 % der malignen Speicheldrüsentumoren) sind kleine anaplastische, uniforme Zellen, die nur wenig Zytoplasma sowie unauffällige Nukleolen und feingränulares Chromatin enthalten, typisch [64, 203]. Morphologisch und immunzytochemisch vergleichbar sind diese mit den Haferkornzellen („Oat cells“) des kleinzelligen Bronchialkarzinoms, so dass eine Metastase in die Speicheldrüse auszuschließen ist [57]. Weitere Gemeinsamkeiten bestehen darin, dass es sich auch hier um einen schnell wachsenden Tumor handelt, eine männliche Disposition besteht und die Erkrankung zwischen dem 5. und 6. Lebensjahrzehnt auftritt [57]. Eine paraneoplastische Hormonproduktion bei dem kleinzelligen Karzinom der Speicheldrüse scheint jedoch keine Rolle zu spielen [185]. Betroffen sind v.a. die großen Speicheldrüsen, besonders die Gl. parotis, seltener auch die kleine Speicheldrüsen [202]. Klinische Symptome sind unspezifisch. Makroskopisch ist ein gut umschriebener Tumor erkennbar, der mit einer grau-weißen Schnittfläche meist ins Parenchym eingewachsen ist und auch Nekrosen und Hämorrhagien bietet [202]. Histopathologisch zeigen sich infiltrativ wachsende Tumorzellnester, wobei anaplastische, kleine Zellen (< 30 μm) mit rundlich, einheitlicher Struktur und wenig Zytoplasma dominieren [202]. Weiterhin sind zahlreiche atypische Mitosen, Nekrosen, Infiltrationen ins Perineurium, Gefäße und seltener auch HomerWright-Rosetten (James Homer Wright, Pathologiedirektor Masachuchetts, 46 1869-1928) mit zentraler fibrillärer Knäuelbildung [135]. Auch fokal-drüsige und squamöse Differenzierungen sind beschrieben [102, 123]. Nachweisbar sind öfters immunzytochemische Übergänge zu kleinzelligen Tumoren mit neuroendokriner Bildung (Chromogranin A und Synaptophysin positiv) und dies unterstützt die Hypothese, dass eine multipotente Stammzelle mit möglicher squamoider oder neuroendokriner Differenzierung Ausgangspunkt der Tumorbildung ist [57, 104, 203]. Eher gangartige Tumorzellen sind hingegen negativ für neuroendokrine Marker, zeigen aber Reaktionen mit Zytokeratinen, EMA und Vimentin [104, 203]. Differentialdiagnostisch zum Ausschluss einer Metastase eines kleinzelligen Bronchialkarzinoms bieten sich CK 20, S-100 und HMB-45 an, die in diesem Fall negativ wären [57, 203]. Weiterhin gilt es weitere undifferenzierte Karzinome, endokrine Karzinome, aber auch die solide Variante des adenoidzystischen Karzinoms abzugrenzen, wobei Letzteres mehr glanduläre Strukturen zeigen würde. Mit einer Lokalrezidiv- und Metastasierungsrate von 50 % ist das 5Jahresüberleben mit 19-46 % immer noch höher als beim kleinzelligen Bronchialkarzinom (5-10 %) [203, 208]. 2.5 Immunhistochemische Marker: β2-Mikroglubulin, Calnexin, Calreticulin, ERp57, HLA-A, LMP-2, LMP-7, TAP-1, TAP-2, Tapasin und HC-10 Bei Tiertransplantationen wurden bei genetisch nicht identischen Tieren Abstoßungen von Transplantaten beobachtet. Dabei wurde erkannt, dass Haupthistokompatibilitätsantigene (=Major-Histocompatibility-Antigens, MHC) eine wichtige Rolle spielen [232]. Erst in den ´50iger Jahren konnten diese beim Menschen nachgewiesen werden, und nach Transplantationen waren Antikörper gegen humane Leukozyten am einfachsten darstellbar, weswegen man die MHC-Antigene als „humane Leukozyten Antigene (=HLC-Antigene)“ bezeichnete [221]. Dies geschah allerdings ohne Berücksichtigung der Tatsache, dass diese Antigene an der Oberfläche auf fast allen kernhaltigen Zellen vorkommen [221]. Die nach den Mendel´schen Gesetzen vererbten genetischen Merkmale bzw. Antigene sind auf dem kurzen Arm des sechsten Chromosom kodiert und weisen einen großen Polymorphismus auf, der auf alternatives Splicing zurückzuführen ist [18]. Dabei werden nach ihrer Entdeckung und nicht nach ihrer genetischen Lokalisation zwei Klassen unterschieden: Die Klasse-I-Antigene bil- 47 den einen Genkomplex aus drei Loci, HLA-A, HLA-B, HLA-C, und konnten im Gegensatz zu HLA-D serologisch nachgewiesen werden, da Letzteres innerhalb gemischter Leukozytenkulturen zellulär bestimmt wurde [220]. Dieses wiederum bildet einen vierten Komplex, zu dem HLA-DR (= D related), HLA-DQ und HLA-DP-Antigene zählen [221]. Die Klasse-I-Antigene setzen sich aus einer schweren Kette (44kD) und einer jeweils immer gleichen leichten Kette (12 kD), dem β2-Mikroglobulin, zusammen [298]. Über eine nicht kovalente Bindung sind die β- Kette und die α-Kette, die aus drei Domänen (α1, α2, α3) und einem Transmembranen und intrazellulären Anteil bestehen, verbunden [297]. Bei den Klasse-II-Antigenen gibt es hingegen verschiedene Isotypen, die für eine α-Kette (DRA, DQA, DPA) bzw. für eine β-Kette (DRB, DQB, DPB) kodieren, die sich aus je zwei extrazellulären Domänen mit einem transmembranen und intrazellulären Anteil zusammensetzen [232]. Dadurch bilden kombinierte und unterschiedliche β-Ketten der DR-Antigene verschiedene polymorphe Gruppen. Zwischen den Exonen der MHC-I bzw. -II Antigene liegen noch Komplementfaktoren, ursprünglich als MHC-Klasse-III-Komplex bezeichnet, und auch Gene für den Tumornekrosefaktor α und β sowie TAP-1 und TAP-2 sind dort lokalisiert [221]. Auf den funktionellen Weg und die Bedeutung der untersuchten immunhistochemischen Marker soll im Folgenden eingegangen werden, wobei diese Marker vorwiegend mit dem MHC-Klasse-I-Komplex, weniger mit dem MHCKlasse-II-Komplex, assoziiert sind: Die MHC-Klasse-I Antigene können Peptide binden und letztlich an der Oberfläche CD-8+ T-Zellen präsentieren [37]. Die Peptide stammen dabei von intrazellulären Viren, Bakterien, aber auch von Tumorproteinen oder falsch zusammengebauten körpereigenen Proteinen [37, 95]. Diese Proteine werden mit Ubiquitin markiert und in den Proteasomen zu Peptiden und einzelnen Aminosäuren abgebaut [221, 294]. Der Proteasomenkomplex besteht aus einer fassförmigen 20S (=Svedberg) Einheit sowie aus zwei äußeren Ringen mit je 19S [221]. Das 20S Protein besteht aus je zwei α- und zwei β-Untereinheiten, wohingegen bei lymphatischen Geweben oder bei IFN-γ exponierten Zellen die βEinheit oft durch LMP-2 und LMP-7 ersetzt ist [307]. Dies ist wohl verantwortlich für die stärkere proteolytische Aktivität der Immunproteasomen [221]. Im Lumen der Proteasomen befindet sich eine regelrechte Enzymmaschinerie [37]. Die wenigen übrig gebliebenen Peptide sind meist ca. 9 Aminosäuren lang und werden mit einem Transporter, dem sog. „transporter associated with antigen 48 processing (=TAP)“, der sich wiederum aus TAP-1 und TAP-2 zusammensetzt und für seine Aufgabe ATP (Adenosintriphosphat) benötigt, ins Endoplasmatische Retikulum geschleust [187]. Dort binden die Peptide mit ihren Ankeraminosäuren an die MHC-Klasse-I Proteine bzw. mit der normalerweise passenden α-Kette des Komplexes [188], wobei die HLA-Komplexe, vorwiegend HLA-A und HLA-B durch das Molekül HC-10 gebunden werden, weniger die schweren Ketten von HLA-D [218]. MHC-I wird zu Beginn noch durch „Chaperon“-Mole- B2-MG Zytoplasma Calreticulin TAPTransporter Ubiquitin Heavy Chain MHC-I Tapasin Calnexin Proteasom ERp-57 rER cis-Golgi Peptide Protein Abb. 30: Vereinfachte schematische Darstellung einer Zelle und ihrer MHC-I-Präsentation. Ubiquitinierte Proteine gelangen in das Proteasom. Von dort werden wenig verbleibende Peptide über den TAP-Transporter ins raue Endoplasmatische Retikulum (=rER) geschleust. MHC-I wird im rER über mehrere Proteine stabilisiert, bis der MHC-Klasse-I-Komplex mit der Peptidkette beladen wird. Nach Ausschleusung gelangt dieser mit seiner Fracht über den GolgiApparat an die Zellmembranoberfläche. küle wie Calnexin, Calreticulin und ERp57 stabilisiert [116]. Nach Eintreffen des entsprechenden Peptids greifen diese ebenfalls unterstützend in die Bindung zwischen Peptid und α-Kette des MHC-I ein [221]. Dabei vermittelt Tapasin zwischen der α-Kette sowie TAP und dient als eine Art Brücke [237]. Der nun beladene MHC-Klasse-I-Komplex verlässt daraufhin das Endoplasmatische Retikulum, wird im Golgi-Apparat posttranslational modifiziert und an der Zelloberfläche CD-8+ T-Zellen präsentiert [232]. Mehrere Viren und auch Tumoren sind jedoch in der Lage diesen Mechanismus zu umgehen [294] und man spricht in diesem Zusammenhang von einem „Immunescape“: Das humane Zytomegalievirus (HCMV) interagiert beispiels- 49 weise mit den neu synthetisierten MHC-Klasse-I-Proteinen und degradiert diese [37]. Das Herpes simplex Virus kann den Transporter TAP hemmen und so eine Oberflächenpräsentation eigener viraler Peptide umgehen [37]. Mindestens so einfallsreich scheinen mehrere Tumoren zu sein, wobei viele Mechanismen der Immunflucht beschrieben wurden. Manche Tumorzellen produzieren erst gar keine Tumorpeptide, die in MHC-Moleküle passen [221]. Andere Tumorzellen weisen vielfältige Defekte benötigter Proteine, wie beispielsweise TAP oder auch ERp57, Calnexin, Calreticulin, LMP-2 und LMP-7 auf, wohingegen bei Erstgenanntem in Zellexperimenten beobachtet wurde, dass eine Oberflächenpräsentation ganz fehlt, während bei Letztgenannten eine Oberflächenpräsentation reduziert ist [192, 215]. Experimentell konnte diese Reduzierung ebenfalls mit einem Absinken der Temperatur beobachtet werden [249]. Da es sich bei Tumorzellen nicht um professionelle Antigen präsentierende Zellen handelt, fehlen diesen eventuell auch kostimulatorische Moleküle wie CD-80 und CD-86, die für den Trimeren Komplex, bestehend aus MHC-Klasse-I, Peptid und T-Zellrezeptor und für eine adäquate Immunantwort benötigt werden [218, 251]. Eine Folge wäre in diesem Fall eine Anergie oder eine Tumorzelltoleranz. Bei anderen Tumoren ist beobachtet worden, dass sie die Synthese von Tumorpeptiden einstellen können oder mit immunsuppressiven Substanzen wie IL-10 oder Transforming Growth Factor β (TGF-β) eine T-Zellantwort unterdrücken können [61, 311]. IL-10 führt darüber hinaus zu einer Reduzierung von TAP [95]. Der MHC-Klasse-II-Komplex wird vorwiegend bei Zellen verwendet, die sich auf Phagozytose spezialisiert haben. Es werden exogene Antigene aufgenommen, in endosomalen Vesikeln mithilfe von Kathepsinen und fallendem pH-Wert in Peptide gespalten [221]. Nach deren Verschmelzung mit Endosomen, die reich an MHC-Klasse-II Proteinen sind, werden diese erst nach deren Beladung ins Endoplasmatische Retikulum transportiert [221]. Für die Passage ist eine Faltung obligat und nach dem folgenden Zusammenbau sorgt ein Peptid, das sog. „class-II associated invariant chain peptid (=CLIP)“ dafür, dass nicht andere im ER vorkommende Peptide gebunden werden [223]. Calnexin stabilisiert diesen Komplex, bis die korrekte Beladung abgeschlossen ist und dissoziiert nach geleisteter Arbeit wieder [221]. Über den Golgi-Apparat und dortigen Modifikationen und Abspaltungen gelangt das beladene MHC-Klasse-II-Molekül an die 50 Zelloberfläche und ist für eine Präsentation gegenüber CD-4+ T-Zellen bereit [223]. Neben dem funktionellen Zusammenhang zeichnen sich einige untersuchte Marker durch andere Eigenschaften aus: β2-Mikroglobulin als Bestandteil des MHC-Klasse-I-Komplexes ist nicht mit der Zytomembran verankert und ist nicht wie die anderen Bestandteile auf Chromosom 6, sondern auf Chromosom 15 lokalisiert [302]. Es kann außerdem als Marker bei Leukämien, Pankreastumoren, Leberzellkarzinomen, bei Erkrankungen mit erhöhtem Zellumsatz (wie Infektionen oder Autoimmunkrankheiten), Hepatitis, Leberzirrhose und AIDS verwendet werden und ist auch bei Dialysepatienten erhöht, was letztlich mit zeitlicher Verzögerung zu intrazellulären Amyloidfibrillen führt [302]. Auch ein Einfluss auf den Knochenstoffwechsel, die Gefäßsteifigkeit und auf die Prognose bei Karpaltunnelsyndrom wird diskutiert [132, 302]. Das Membran gebundene Calnexin wird durch seinen im Endoplasmatischen Retikulum vorkommenden Partner Calreticulin nach Stabilisierung des beladenen MHC-Klasse-I Komplexes abgelöst [18]. Beide Lektine können Zuckerreste von unvollständig gefalteten Proteinen erkennen und greifen als „Chaperon“-Moleküle in diesen Faltungsprozess ein [39]. Calnexin wurde als Bestandteil des Proteins Calmegin in männlichen Keimzellen nachgewiesen, spielt als Kalziumregulator eine Rolle in der Apoptose und wird als ein eigenständiger Marker als Indikator einer früheren Rezidivrate bei Prostatakarzinomen diskutiert [39, 116, 251]. Calreticulin bindet darüber hinaus ein weiteres „Chaperon“-Molekül, das ERp57, eine Oxidoreduktase, das ebenfalls den Kalziumhaushalt innerhalb des Endoplasmatischen Retikulums reguliert und von Tapasin rekrutiert wird [37, 234]. Auch HC-10 scheint bei HLA-B27 positiven Spondylarthropathien einen Stellenwert einzunehmen [218]. Darüber hinaus dient es bei einer Minderexpression als Korrelat einer möglichen Verringerung/Verlustes der schweren Ketten (vorwiegend HLA-B und –C) des MHC-I-Komplexes und scheint ein Schlüssel für den Immunescape zahlreicher Tumore zu sein [55]. Die untersuchten Marker β2-Mikroblobulin, Calnexin, Calreticulin, LMP-2, LMP-7, TAP-1, TAP-2, HC-10, HLA-A zeigten bei verschiedenen Tumoren eine entsprechende Minderexpression und sind wesentlicher Bestandteil für den Mechanismus des Immunescapes [37, 61, 178, 251]: Bis jetzt wurde diese Unterexpression bei Bronchial-, kolorektalen, hepatozellulären, Nierenzell-, Ösophagus-, Cervix-, Mamma- sowie in Plattenepithelkarzinomen der Kopf- und 51 Halsregion sowie bei malignen Melanomen nachgewiesen [143]. Bemerkenswert ist hierbei, dass einige Marker und deren verminderte Expression mit klinischen Daten wie Überleben und frühen Rezidivbildungen einhergehen, wobei die Expression und die klinische Korrelation stark nach Tumortyp divergieren [250]. Bei Nierenzellkarzinomen ist eine TAP-Defizienz nicht mit dem histopathologischen Grading oder Staging assoziiert, währenddessen beim Prostatakarzinom ein Fehlen entsprechender Proteine (Calnexin und Tapasin) mit einem höheren Gleason Grading und einer früheren Rezidivbildung vergesellschaftet ist [37, 251]. Auch die Proteinexpression schwankt innerhalb einzelner Tumorentitäten. So zeigen Nierenzellkarzinome einen stärkeren LMP-7-Verlust als für LMP-2, bei Melanomzellen konnte eine häufige LMP-7- „Downregulation“ beobachtet werden, wohingegen LMP-2 verstärkt gebildet wurde [37]. Bei mehreren Tumoren wie Plasmozytomen oder hepatozellulären Karzinomen wurden darüber hinaus Defekte in der MHC-Klasse-II Maschinerie nachgewiesen [143]. Auch hier ist ein Defekt in Abhängigkeit der Tumorentitäten mit einer schlechteren Prognose assoziiert: Bei Osteosarkomen und Melanomen geht eine MHC-Klasse-II-Präsentation mit einer schlechteren, bei Plattenepithel-, Mamma-, kolorektalen und Cervixkarzinomen sogar mit einer besseren Prognose einher [294]. Die Mechanismen eines Funktionsverlustes der MHC-Komplexe beruhen dabei auf HLA-Gendeletionen, einhergehend mit einem Verlust der Heterogenität, Genmutationen und Dysregulationen hinsichtlich einer Hypermethylierung, transkriptionalen sowie posttranslationalen Elementen [294]. Nach dem bisherigen Erkenntnisstand wurden die vielfältigen Speicheldrüsentumoren noch nicht auf eine derartige Immunexpression untersucht. 2.6 Fragestellung der vorliegenden Arbeit Um sich einer Erkennung und einer konsekutiven Zerstörung durch Lymphozyten zu entziehen, sind viele Tumorzellen in der Lage, einen „Immunescape“ anzuwenden: Körpereigene und Fremdproteine werden intrazytoplasmatisch zu Peptiden mit einer Länge von 9-12 Aminosäuren abgebaut, um über das Transportersystem TAP (=transporter associated with antigen processing) zunächst in das Endoplasmatische Retikulum zu gelangen und dann mit MHC-Klasse-I- 52 Molekülen beladen an der Zelloberfläche präsentiert zu werden. Einige Tumoren bringen es dabei auf unterschiedlichste Arten fertig, sich diesem Ablauf zu entziehen und einer entsprechenden Fremdantigenpräsentation zu entkommen [218]. Während des Transports bis hin zu einer MHC-Klasse-I Oberflächenpräsentation ist eine Maschinerie zahlreicher Moleküle, wie β2-Mikroglobulin (=β2MG), ERp57, Calnexin (=Cnx), Calreticulin (=Crt), TAP-1 sowie TAP-2, Tapasin (=Tps), HC-10, HLA-A, LMP-2 und LMP-7, erforderlich. Wie unter 2.5 dargestellt, sind mehrere Tumore auf ihre Expression hinsichtlich dieser Schlüsselmoleküle des „Immunescapes“ untersucht worden. Dabei wurde gezeigt, dass je nach Tumorart die immunhistochemische Expression der genannten Marker im Vergleich zu Normalgewebe aber auch ihr Zusammenhang mit klinischen Parametern wie beispielsweise Rezidivbildung und Prognose stark variiert [37, 143, 250, 251, 294]. Nach eigenem Erkenntnisstand wurden die seltenen Speicheldrüsenkarzinome weder auf ihr Expressionsverhalten von β2 Mikroglobulin, Calnexin, Calreticulin, ERp57, TAP-1, TAP-2, Tapasin, HC-10, HLA-A, LMP-2 und -7, noch auf ihren Zusammenhang mit klinischen Faktoren untersucht. Daher sollte in der vorliegenden Arbeit untersucht werden, ob Speicheldrüsenkarzinome im Vergleich zu Speicheldrüsennormalgewebe signifikant verschiedene immunhistochemische Expressionen der eben genannten Marker aufweisen. Von Interesse ist dabei, ob gemeinsame Expressionsmuster verschiedener Entitäten auftreten und ob eine signifikante Korrelation mit klinischen Faktoren vorliegt. Besonders der prognostische Einfluss soll dabei untersucht werden, um letztlich immunhistochemische und klinische Überlebensvariablen darstellen zu können. 3 Patienten und Methoden 3.1 Datenerhebung Von 300 Patienten wurde der klinische Verlauf recherchiert, wobei auf 12 Patienten aufgrund von mangelnden Follow-up-Daten oder fehlendem, bösartigem Tumorgewebe verzichtet werden musste, so dass 288 Patienten verblieben. Diese wurden ab 1984 an der Universität Erlangen (110 Fälle aus der HalsNasen-Ohrenklinik, 25 Fälle der Mund-Kiefer-Gesichtschirurgie) bzw. der Universität Regensburg (85 Fälle) sowie am Nürnberger Klinikum (57 Fälle aus der Hals-Nasen-Ohren-Klinik, 11 Fälle aus der Mund-Kiefer-Gesichtschirurgie) behandelt. In Zusammenarbeit mit den Regensburger und Erlanger Tumorzentren, 53 den pathologischen Instituten (durch Befundungseinsicht), den jeweiligen Kliniken (durch Akteneinsicht) und durch Befragen der Hausärzte, der Betroffenen oder deren Angehörigen sowie der Einwohnermeldeämter, konnten klinische Daten ermittelt werden: dazu zählen Alter, Geschlecht, Tumorlokalisation, Tumorgröße, Lymphknotenbefall, Fernmetastasierung sowie sekundäre Fernmetastasierung, Rezidivbildung, Therapie einschließlich Chemo- und Strahlentherapie, Resektionsstatus, Tumor bedingtes Versterben, klinische und pathologische TNM-Klassifizierung der Union Internationale Contre le Cancer (UICC). Diese Daten wurden im mittelfränkischen Speicheldrüsenregister (Leitung: Prof. Dr. Iro) und dem bayerischen Krebsregister hinterlegt und pseudonymisiert eingegeben. 3.2 Methodik und Material Ohne die vorbestehende Diagnose zu kennen, wurden von zwei pathologischen Oberärzten auf Hämatoxilin-Eosin-, PAS- bzw. Immunfärbungen basierend, alle Fälle neu befundet. Nachdem auf diesen Schnitten Bereiche von Tumor- und Normalgewebe markiert waren, wurden die entsprechenden Paraffinblöcke identifiziert, um aus diesen anschließend Formalin fixierte und in Paraffin eingebettete Tissue microarray-Konstruktionen von Tumor- (300 TMA´s) und Normalgewebe (72 TMA´s) anzufertigen. Ein Gewebszylinder stanzte mit einer Hohlnadel ( 2,0 mm Durchmesser) aus den Paraffinblöcken Gewebe innerhalb der Markierungen, so dass Tumor- und Normalgewebe zunächst auf einen vorgestanzten Paraffinblock in dessen Hohlräume übertragen werden konnte, um diese anschließend neu in Paraffin zu gießen. Die Anordnung der Stanzgewebe wurde schriftlich und graphisch dokumentiert (Abb. 31 A). Eine Stanze Tumorgewebe (=M) wurde als Positivkontrolle mitgeführt. Von den fertigen Multiblöcken wurden zunächst HE-Schnitte angefertigt (siehe Abb. 31 B), um zu kontrollieren, ob sich auf diesen repräsentatives Gewebsmaterial befindet. Danach wurde die immunhistochemische Färbung vorbereitet: Das Prinzip der Immunhistochemie basiert auf dem Prinzip, dass spezifische und affine Antikörper Epitope der gesuchten Antigene binden. Bei der direkten Methode bindet ein primärer Antikörper, der mit einem Enzym gekoppelt und unter einem speziellen Substrat/Chromogen einen Farbumsatz ermöglicht, das Antigen. Bei der indirekten Methode kommt ein sekundärer Antikörper zum Einsatz, der an den vorhandenen Antigen-Antikörper-Komplex bindet und ebenfalls mit einem ge- 54 bundenen Enzym durch Verwendung eines Substrats/Chromogens zu einer Färbereaktion führt. In dieser Arbeit gebrauchte man die direkte Methode, wobei die primären Antikörper enzymatisch konjugierte Polymere enthielten. Um zunächst an die Antigene zu gelangen, wurden die Schnitte des Multiblocks in ein warmes Wasserbad gegeben, auf einen Objektträger (SuperFrostTMPlus; Menzel GmbH, Braunschweig, Deutschland) aufgezogen und für 30 Minuten in einem Brutschrank inkubiert, wodurch ein späteres Abschwimmen verhindert Abb. 31 A: Reihenfolge der TMA-Stanzen. Abb. 31 B: TMA-Objektträger (HE-Färbung). werden sollte. Um vollständig zu entparaffinisieren, wurde dreimal für 5 Minuten Xylol und danach eine absteigende Alkoholreihe verwendet. Im Anschluss wurden die Schnitte mehrmals mit destilliertem Wasser gewaschen. Im Schnellkochtopf wurde das Gewebe für 5 Minuten bei 120 Grad zusammen mit einem Tris-EDTA Puffer gekocht. Daran anknüpfend wurde eine Peroxidase für 5 Minuten verwendet, um die endogene Peroxidase im Gewebe auszuschalten. Anschließend wurden die primären Antikörper in spezifischen Verdünnungsverhältnissen hinzugegeben (β2-MG, Cnx, Crt, ERp57, HLA-A, LMP-2 und -7, TAP-1 und TAP-2, Tps, HC-10). Dabei wurde darauf geachtet, dass es sich um spezifische Antikörper handelt, so war beispielsweise der murine monoklonale Antikörper HC-10 frei von β2-Microglobulin-Einheiten, die auch HLA–A3, –A10, –A28, –A29, –A30, –A31, –A32, –A33, and –B beinhalten können. B2- Mikroglobulin war hingegen spezifisch für L368, LMP2 für SY-1, LMP7 für HB2, TAP-1 für NOB-1, TAP-2-für NOB-2, Calnexin für TO-5, Calreticulin für TO-11, anti-ERp57 für TO-2. Im nächsten Schritt wurde durch Hinzunahme von Polymeren, an die das Enzyms HRP (=horserabish-peroxidase) gebunden war, bewirkt, dass die Polymere an den Antigen-Antikörper Komplex anhaften. Das Enzym Peroxidase, das sich innerhalb der Polymeraggregate befand, musste 55 jedoch mithilfe des Färbereagenz Diaminobenzidintetrahydrochlorid (=DAB) sichtbar gemacht werden, weswegen dieses für 10 Minuten hinzugegeben wurde und zu einem braunen Färbeergebnis führte. Nachdem zwischen jedem Schritt mit Waschpuffer abgespült wurde, musste noch mit dem Farbstoff Hämatoxilin gefärbt und danach mit Leitungswasser gebläut werden, so dass die immunhistochemischen TMA-Schnitte fertiggestellt waren. Dieselbe Technik wurde auch bei Normalgewebsblöcken angewendet, wobei aus 72 Stanzen je 30 Azini, Schaltstücke, Streifenstücke und 20 Ausführungsgänge zufällig aufgesucht wurden. Insgesamt ergaben sich somit 110 gefärbte Referenzwerte, die später mit Tumoren der entsprechenden histogenetischen Lokalisation verglichen wurden. Das Normalgewebe wurde unter Einsicht von HE-Schnitten bestimmt. Dieses stammt von denselben Patienten, bei denen auch entsprechende Tumoren gefunden wurden. Im Anschluss wurde jeder Stanze ein Punktwert zugeteilt, dieser setzte sich zum einen aus einem prozentualen Wert zwischen 0 und 100 % zusammen und gibt Auskunft über die quantitive Färbung des Zellmaterials. Zum anderen ging auch die Färbeintensität mit ein, wobei eine fehlende Färbung 0 Punkte, leicht gefärbte Stanzen eine 1, mittelgradig gefärbte Stanzen eine 2 und starke Färbungen eine 3 erhielten. Die Zahlenwerte wurden multipliziert, dass sich Werte zwischen 0 und 300 %-Punkten ergaben. Bei der Auswertung wurde das funktionelle Vorkommen der Proteine berücksichtigt, da die verwendeten Marker Zellen zytoplasmatisch oder nukleär färben können. Während die meisten Proteine zytoplasmatisch exprimiert werden, zeigt sich bei den Proteasomenuntereinheiten LMP-2 und LMP-7 ein zytoplasmatisches und nukleäres Muster. Eine subjektive Bewertung sollte ohne Wissen der Diagnose ausgeschaltet werden, die Doppeleinsicht durch einen Pathologen versuchte eine möglichst objektive Punktevergabe zu gewährleisten. Nachdem jeder Stanze ein Wert zugewiesen war, konnten die verschiedenen Tumorentitäten mit den immunhistochemischen Färbungen der Normalgewebsstanzen verglichen werden. Hierbei wurde einerseits das Normalgewebe mit der entsprechenden Histogenese des Tumors, andererseits eine Normalgewebskollektiv aus den oben beschriebenen 110 Fällen benutzt, um parallel eine histogenetisch unabhängige Auswertung vorzunehmen. 56 3.3 Statistische Analyse Mithilfe von SPSS Statistics 18.0 für Windows wurden die statistischen Analysen durchgeführt: Der t-Test für unabhängige Variablen (Signifikanzniveau mit p<0,05) untersuchte das Normal- und das Tumorgewebe anhand ihres Punktewertes hinsichtlich der Signifikanz. Immunzytochemische Veränderungen der verschiedenen Tumoren wurden bezüglich ihrer Prognose mit einer univariaten Überlebensanalyse dargestellt, wofür auf die Kaplan-Meier-Analyse (Log-rankMantel-Cox-Test, Signifikanzniveau p≤0,05) zurückgegriffen wurde. Das Gesamtüberleben vom Diagnosezeitpunkt bis zur letzten Überlebensinformation wurde dabei verwendet. Auch klinische Parameter wurden diesbezüglich untersucht. Hierfür wurden jeweils zwei Gruppen gebildet, wie Punktewert zwischen 0 %- und 150 %- bzw. 151%- und 300 %-Punkten oder beispielsweise für das Alter ≤ 60 oder > 60 Jahre. Um prognostisch unabhängige Variablen (klinisch und immunhistochemisch) zu bestimmen, sollte eine multivariate Cox-Regression Aussagen über das relative Risiko anhand der Hazard-Ratio zulassen. Dabei kam ein rückwärts bedingtes Modell mit schrittweiser Elimination zum Einsatz (Ausschluss des am wenigsten signifikanten Faktors mit p>0,1, Signifikanzniveau p≤0,05, KI 95 %). Zum Schluss wurde eine hierarchische Clusteranalyse durchgeführt und bestimmt, ob gewisse Tumorarten anhand ihres immunhistochemischen Expressionsmusters Gruppen bilden und ob diese Gruppenbildung un- bzw. abhängig von der histopathologischen Entität ist. 4 Ergebnisse 4.1 Häufigkeitsverteilung aller Karzinomarten In der deskriptiven Auswertung ergab sich ein Geschlechtsverhältnis von 138 Männern (47,8 %) und 150 Frauen (52,2 %). Dies entspricht somit der in der Literatur beschriebenen Geschlechtsverteilung [57]. Die jeweiligen Tumorlokalisationen sind Abb. 32 zu entnehmen, und auch in diesem Fall ergeben sich, außer bei der Gl. submandibularis (7-11%), Häufigkeiten, die in den von der WHO angegebenen Intervallen liegen und somit für ein repräsentatives Patientengut sprechen [79]. Die Altersverteilung (Abb. 33) bezogen auf den Diagnosezeitpunkt liegt zwischen dem 11. und 99. Lebensjahr und hat einen Mittelwert von 60,7 bzw. ei- 57 nen Median von 63,5 sowie einen Modalwert von 72 Jahren, der mit Werten aus einer anderen statistischen Metaanalyse korreliert [78]. Die WHO (Weltgesundheitsorganisation) unterscheidet derzeit 24 epitheliale maligne Tumoren [11]. In der eigenen Fallserie (n=288) konnten 15 der 24 Karzinomtypen diagnostiziert werden. Am stärksten war bei 50 Patienten das adenoidzystische Karzinoms, gefolgt vom Mukoepidermoidkarzinom (n=43) vertreten. 43 Patienten erhielten die Diagnose eines Mukoepidermoidkarzinoms (14,5 %) und bei 40 weiteren konnte ein Azinuszellkarzinom (13,8 %) pathologisch gesichert werden. Abbildung 34 bezieht sich auf das zusammengestellte Kollektiv und gibt einen Überblick über weitere Tumorarten sowie deren Histogenese. Zu den 24 verschiedenen Karzinomarten zählt die WHO weiterhin das klarzellige, nicht näher klassifizierbare Karzinom, das sebazeöse sowie das Lymphadenokarzinom, das niedrig maligne, cribriforme Zystadenokarzinom, das muzinöse Adenokarzinom, das metastasierte pleomorphe Adenom, das Sialoblastom und das großzellige sowie das lymphoepitheliale Karzinom [11]. Die beiden letzteren werden in dieser Arbeit als undifferenzierte Karzinome zusammengefasst. (n=201) Abb. 32: Entsprechende Tumorlokalisationen der Fallserie (n=288). 58 n=5 Abb. 33: Dezimale Altersverteilung in Jahren. Tumore mit Ursprung aus den Azini n=40 Azinuszellkarzinom n=40 Tumoren mit Ursprung aus dem Schaltstück n=93 Adenoidzystisches Karzinom n=50 Myoepitheliales Karzinom n=18 Polymorphes low-grade Adenocarcinom n=13 Basalzelladenokarzinom n=8 Epitheliales-myoepitheliales Carcinom n=4 Tumore mit Ursprung aus dem Streifenstück n=4 Onkozytäres Carcinom n=4 Tumore mit Ursprung aus dem Ausführungsgang n=137 Mukoepidermoidcarcinom n=43 Adenocarcinom NOS n=36 Speichelgangcarcinom n=33 Plattenepithelcarcinom n=25 Tumore mit unklarem Ursprung n=14 Karzinosarkom n=5 Undifferenziert/großzellig/kleinzellig n=7 Zystadenocarcinom n=2 Abb. 34: Häufigkeiten der Tumorentitäten. 59 4.2 Deskriptive Analyse der Therapievarianten Bei Speicheldrüsenkarzinomen steht die chirurgische Therapie im Vordergrund. Bei Parotistumoren ist zu entscheiden, ob eine totale, partielle oder laterale Parotidektomie durchzuführen ist, dies sollte vom Tumorgrad und dem Tumorstadium abhängig gemacht werden [63]. Eine totale Parotidektomie wurde bei 49 % durchgeführt, wobei sich 54% in fortgeschrittenen Stadien (3 und 4) befanden. Die Submandibulektomie, also die komplette Entfernung der Gl. submandibularis, wurde bei Beteiligung dieser Drüse immer durchgeführt. Bei den kleinen Speicheldrüsen kam die lokale Tumorexzision zum Einsatz. Die einseitige oder beidseitige Neck-Dissektion wurde insgesamt bei 71% angewendet, hauptsächlich wegen eines hohen Tumorgrades bzw. eines hohen Stadiums. Die adjuvante Bestrahlung wurde bei 58,1 % der Patienten durchgeführt und kommt somit der Forderung einer größeren Studie von 498 Patienten nach, die bei dieser Therapie eine bessere lokale Tumorkontrolle beobachtete [284]. Mit einer Chemotherapie wurde −trotz einer bislang noch spärlich belegten Überlebensverbesserungen− immerhin in 17,6 % therapiert, jedoch vorwiegend in einem palliativen Ansatz. Zur Rezidivbildung kam es bei insgesamt 24,8 %. Dies entspricht Werten aus anderen Studien mit 20-43 % [122, 161]. Davon machten das adenoidzystische Karzinom und das Adenokarzinom NOS je 21 % aus. Dies verdeutlicht, dass adenoidzystische Karzinome aufgrund ihrer perineuralen und Adenokarzinome NOS wegen ihres aggressiven, grenzenüberschreitenden Wachstumsverhaltens eine große Herausforderung für eine kurative Therapie darstellen. Residualtumoren (R1 und R2) finden sich bei 21,1 %, dabei macht das adenoidzystische Karzinom 32%, das Adenokarzinom NOS 21 % aus. Dies veranschaulicht wiederum, wie schwierig ein freier Tumorrand bei diesen Entitäten zu erreichen ist, da destruktives und infiltratives Verhalten mit Beteiligung von Nachbarstrukturen (Knochen, Nerven, etc.) dies oft unmöglich macht. 60 4.3 Deskriptive Analyse der verschiedenen Speicheldrüsenkarzinome hinsichtlich immunhistochemischer und klinischer Daten 4.3.1 Die Azinuszellkarzinome Die Diagnose eines Azinuszellkarzinoms wurde vierzig Mal vergeben. Zwei Patienten, wobei das Karzinom nur in einem Fall den Tod verursachte, verstarben. Dies entspricht somit einem 5-Jahresüberleben von 90% und liegt in dem vom Hamburger Speicheldrüsenregister angegebenen Wert von 78-100% [57]. Frauen stellten 26 (65 %) der 40 Fälle, dies korreliert mit anderen Beschreibungen [66]. Bei den eigenen Daten lag der Mittelwert bei 53 Jahren, der jüngste Patient war zum Zeitpunkt der Diagnosestellung 32 Jahre jung und somit lässt sich nicht bestätigen, dass 4 % unter 20 Jahren sein sollen [66, 145]. Es ergaben sich Werte von 90 % für eine Lokalisation in der Gl. parotis und je 5 % in der Gl. submandibularis sowie in den kleinen Speicheldrüsen. Dies stimmt in Etwa mit den Werten der WHO überein [63]. Bei 7 Patienten traten Rezidive (17,5 %) auf, die Metastasierung machte 5 % aus. Somit liegt die Rezidivrate (35 %) etwas niedriger und die Metastassierung höher (2 %) als beschrieben [214, 255]. Die Seitenlokalisationen waren ausgeglichen. Beinahe die Hälfte (47,5 %) der Tumoren befanden sich zum Diagnosezeitpunkt im UICC-Stadium I. Stadium II und III lagen bei je 22,5 %, Stadium IV bei 7,5 %. Das WHOACCC Acini Schs. Sts. β2-MG p= 0,97 0,01↑ <0,001↑ <0,001↑ AG Gesamt <0,001↑ Cnx p= <0,001↑ 0,1 0,072 0,183 0,031↑ LMP-2n p= 0,001↑ 0,001↑ 0,001↑ LMP-2z p= 0,001↑ 0,007↑ 0,01↑ LMP-7n p= 0,15↓ 0,001↓ 0,001↓ LMP-7z p= 0,05↓ 0,001↓ 0,001↓ Tap-1 p= 0,001↑ 0,001↑ 0,001↑ Tap-2 p= 0,05↑ 0,001↓ 0,001↓ Tps p= 0,001↑ 0,811 0,421 HC-10 p= 0,006↑ 0,008↓ 0,001↓ 0,001↑ 0,001↑ 0,001↓ 0,001↓ 0,001↑ 0,001↓ 0,001↑ 0,001↑ 0,001↓ 0,001↓ 0,001↑ 0,006↓ 0,443 0,34 0,551 0,15 Tab. 2: p-Werte aus dem t-Test für unabhängige Variablen, resultierend aus dem immunhistochemischen TMA des jeweiligen Antikörpers (β2-MG=β2-Mikroglobulin, Cnx=Calnexin, Tps=Tapasin, n=nukleäre Auswertung, z=zytoplasmatische Auswertung). Die Werte ergeben sich aus dem Vergleich zwischen Tumor- (ACCC=Azinuszellkarzinom) und Normalgewebswert der entsprechenden Speicheldrüsenlokalisation (Schs.=Schaltstück, Sts.=Streifenstück, AG=Ausführungsgang) sowie im Vergleich zu allen Normalgewebslokalisationen (=Gesamt). Überexpressionen (↑) und Unterexpressionen (↓) beziehen sich auf das ACCC. Grading zeigte, dass 70 % (28 Patienten) einen gut differenzierten Tumor, also Grad 1 hatten, während Grad 2 und 3 je 15 % einnahmen. Die signifikanten Unterschiede zu den immunhistochemischen Markern und der entsprechenden Normalgewebslokalisation lassen sich aus Tab. 2 entnehmen. 61 Aus den mittels t-Test für unabhängige Variablen berechneten Signifikanzen folgt ein spezifisches Expressionsprofil für das Azinuszellkarzinom, wobei LMP-7 (Abb. 35), teilweise TAP-2 und HC-10 eine Unterexpression zeigen, wohingegen bei Markern wie β2-MG, Cnx (Abb. 37), LMP-2, TAP-1, Tps und seltener bei TAP-2 eine Überexpression des Azinuszellkarzinoms beobachtet wird. Eine Erklärung für die relativ gute Prognose dieser Entität wäre somit eine hohe Immunität, die durch Erkennung von T-Zellen eine Zerstörung der Tumorzellen bedingen könnte. 35 36 Abb. 35: Solide Variante mit IHC-Färbung für LMP-7: kaum positives Zytoplasma, seltener positive Kernbeteiligung. Abb. 36: Positive Zellen einer papillär-zystischen Variante für Cnx. Entscheidend für eine bessere Überlebensprognose war in der Kaplan-Meier Analyse nur β2-MG (p=0,024), wobei eine derartige Analyse bei nur zwei eingetretenen Ereignissen nicht aussagekräftig ist. Es lässt sich festhalten, dass sich hinsichtlich des MHC-Klasse-I-Weges neben Unterexpressionen auch Überexpressionen beobachten lassen. Die KaplanMeier-Analyse ist bei dem sehr guten Outcome nicht aussagekräftig. 4.3.2 Adenoidzystische Karzinome Das Patientenkollektiv setzt sich aus 50 adenoidzystischen Karzinomträgern zusammen: Davon entsprechen 38 der cribriformen, 8 der soliden, 2 der tubulären Variante. Zwei Fälle konnten, da sie im entdifferenzierten Stadium waren, keiner Variante zugeordnet werden. Die Altersverteilung reichte von 30 bis 98 Jahren, der Mittelwert liegt bei 59,6. Hinsichtlich der Geschlechtsverteilung ergibt sich in der eigenen Serie eine weiblich Prädisposition (66 %). Mit 42,6 % ist die Gl. parotis am stärksten beteiligt (n=20), von den kleinen Speicheldrüsen mit 31,9 % (n=15). Die Gl. submandibularis macht 23,4 % (n=11), die Gl. sublingualis 2,1 % (n=1) aus. Dreizehn Patienten (27,7 %) starben während der 62 retrospektiven Untersuchung, bei vierzehn (33,3 %) traten Lokalrezidive auf. Metastasen waren im Vergleich zu den in der Literatur angegebenen Werten etwas niedriger, denn nur vier kamen vor (8,5 %), allerdings in den typischen Lokalisationen Knochen (n=2) und Lunge (n=2). Das pT-Stadium zeigt, dass sich die meisten im Stadium 2 befanden (35 %), gefolgt vom pT3-Stadium (28 %), wohingegen das pT1-Stadium (25 %) und pT4-Stadium (12 %) etwas weniger ausmachten. Eine Lymphknotenbeteiligung war klassischer Weise nur in insgesamt 16,5 % aufzufinden, wobei eine pN2-Situation häufiger war (11 %) als eine pN1-Situation (6,5 %). Die UICC-Stadien verteilten sich mit 32,5 % auf Stadium vier, zwei wurde in 26 % der Fälle vergeben, drei kam in 21,5 % vor. Das frühe Stadium eins wurde in 20 % erreicht. Bezüglich des Gradings ergab sich eine deutliche Beteiligung des intermediären Grades 2 mit 84 %, der hohe Malignitätsgrad war der zweithäufigste mit 16 %. Während die Seitenlokalisation ausgeglichen war, zeigten die R0-Resektatränder die stärkste Beteiligung (55 %), gefolgt von R1 (30 %) und R2 (15 %). Bei ca. einem Viertel (25,5 %) lag aufgrund der Perineuralinvasion bereits präoperativ bzw. nach der Operation eine Fazialisparese vor, bei 34 Patienten wurde im kurativen Ansatz eine Bestrahlung durchgeführt. ACC Cnx HLA-A LMP-7 (n) LMP-7 (z) Tap-2 Tps HC-10 Acini Schs. Sts. p= <0,001↓ 0,37 0,316 p= <0,001↓ <0,001↓ <0,001↓ p= 0,462 <0,001↓ <0,001↓ p= 0,493 <0,001↓ <0,001↓ p= 0,018↑ <0,001↓ <0,001↓ p= 0,369 <0,001↓ <0,001↓ p= 0,179 <0,001↓ <0,001↓ AG 0,505 0,009↓ 0,035↓ 0,019↓ <0,001↓ <0,001↓ 0,068 Gesamt 0,002↓ <0,001↓ 0,01↓ <0,001↓ <0,001↓ <0,001↓ <0,001↓ Tab. 3: Analog zum Azinuszellkarzinom ergeben sich für das adenoidzystische Karzinom (=ACC) entsprechende signifikante Über- (↑) und Unterexpressionen (↓) des immunzytochemisch gefärbten Tumormaterials im Vergleich zur jeweiligen Normalgewebslokalisation. Analog zum Azinuszellkarzinom wurde auch beim adenoidzystischen Karzinom ein t-Test für unabhängige Variablen durchgeführt (siehe Tab. 3). Auffällig ist, dass diese Tumorentität zahlreiche Unterexpressionen (Cnx, HLA-A, LMP-7 in der nukleären und zytoplasmatischen Auswertung, Tap-2, Tps, HC-10) aufweist. Lediglich TAP-2 zeigt im Vergleich zum Normalgewebe der Azini eine Überexpression. Dies deutet auf einen „Immunescapemechanismus“ hin. 63 37 38 Abb. 37: Tubuläre Variante mit IHC-Färbung für HLA-A: Farbintensität mit 2 und Zellanteil mit 40 % ergibt einen Gesamtwert von 80 % Punkten. Abb. 38: Cribriforme Variante in einer Färbung für TAP-2: kaum positive Zellen. In einer Kaplan-Meier-Analyse konnte jedoch nicht bestätigt werden, dass diese Unterexpressionen mit einer schlechteren Prognose einhergehen. Eine Tatsache, die auch bei anderen Tumoren beschrieben wurde [249]. Hingegen ist eine Überexpression von β2-MG (Abb. 40) und Tps mit einem signifikant schlechteren Überleben assoziiert (log rank Werte bei p<0,001 bzw. p=0,003). In weiteren Kaplan-Meier-Analysen konnten signifikante log-rank Werte hinsichtlich des Abb. 39 Abb. 40 Abb. 39: Kaplan-Meier-Analyse, beim ACC geht eine Metastasenbildung mit einem signifikant niedrigeren Überleben einher. Abb. 40: Eine Unterexpresssion von β2-MG bedingt eine schlechtere Prognose. Alters mit p=0,023 ermittelt werden, wobei zwei Altersgruppen mit ≤ 60 Jahren Alters mit p=0,023 ermittelt werden, wobei zwei Altersgruppen mit ≤ 60 Jahren und > 60 Jahren gebildet wurden. Eindeutig war ein Auftreten von Metastasen mit einem log-rank Wert von p<0,001 mit einem schlechteren Überleben vergesellschaftet (Abb. 39). Geschlecht, Tumorlokalisation, pT-, pR- sowie das UICC-Stadium, WHO- 64 Grading und eine Rezidivbildung wiesen hingegen keine signifikanten Werte auf. Das 5-Jahresüberleben für alle Typen beträgt 75 % und ist somit deutlich besser als dies von der WHO angegeben wird (35 %) [71]. Das adenoidzystische Karzinom fällt somit durch die deutlich schlechtere Prognose bei Metastasierung auf. Die häufige Fazialisparese konnte als ein klassisches klinisches Symptom beobachtet werden. Auffällig ist weiterhin die signifikante Unterexpression mehrerer Marker bezüglich des MHC-Klasse-I-Weges. 4.3.3 Polymorphe low-grade Adenokarzinome In der eigenen Fallserie waren 13 Patienten von diesem Tumor betroffen. Die Altersverteilung reicht von 39-99 Jahren zum Diagnosezeitpunkt mit einem Mittelwert von 61,5. Untypischerweise waren Männer mehr als doppelt so häufig wie Frauen betroffen (69,2 %: 30, 8 %). Die kleinen Speicheldrüsen stellten 8 Fälle, wobei 6 davon im Gaumen aufzufinden waren und jeweils einer in der Wange sowie im Oropharynx. In der Gl. parotis waren die restlichen fünf Fälle lokalisiert, ohne dass ein pleomorphes Adenom nachweisbar war. Zwei Patienten starben, nur einer jedoch Tumor bedingt und ebenfalls zwei Patienten entwickelten ein Rezidiv. Sogar eine Fernmetastase konnte bei einer Person in der Pleura und dem Knochen detektiert werden. Dabei handelte es sich um die an den Tumor verstorbene Person. Die UICC-Stadienverteilung war sehr ausgeglichen: Jeweils dreimal wurde das erste, zweite und vierte Stadium vergeben, das dritte Stadium hingegen viermal. Das Grading zeigte der Terminologie folgend neunmal Grad eins, high grade blieb somit zweimal der dediferenzierten Variante vorbehalten. Residualtumoren wurden in drei Fällen als R1 vom Pathologen bestimmt. Interessanterweise waren die großen Speicheldrüsen immer rechts beteiligt. Der t-Test für unabhängige Variablen brachte zum Vorschein, dass mehrere Marker (β2-MG, Cnx, LMP-7 in der nukleären Detektierung, TAP2, Tps und HC-10) im Tumor unterexprimiert werden (Abb. 41). Die signifikanten p-Werte ergeben sich jedoch meist nur im Vergleich zum Schalt- und Streifenstück, wobei Erstgenanntes den wesentlich histogenetischen Referenzwert darstellt. Wenige Überexpressionen konnten bei Calnexin, LMP-7 z (Abb. 42) sowie TAP-2, allerdings nur im Vergleich zum Azinusnormalgewebe, beobachtet werden. 65 β2-MG p= 0,029↓ PLGAC Acini Schs. Strs. 0,61 0,71 AG 0,96 Gesamt 0,4 Cnx p= <0,001↑ 0,028↓ 0,018↓ LMP-7 (n) p= 0,53 0,014↓ 0,017↓ LMP-7 (z) p= 0,038↑ 0,88 0,63 TAP-2 p= 0,025↑ 0,013↓ 0,008↓ Tps p= 0,13 0,09 0,034↓ HC-10 p= 0,037↑ 0,027↓ <0,001↓ 0,06 0,002↓ 0,12 0,35 0,004↓ 0,09 0,054 0,28 0,22 0,28 0,29 0,04↓ Tab. 4: p-Werte aus dem t-Test für unabhängige Variablen des polymorphen low-grade Adenokarzinoms (=PLGAC) und der jeweiligen immunhistochemischen Normalgewebslokalisation. Bei nur zwei eingetretenen Ereignissen (Todesfällen), wobei nur eines davon Tumor bedingt war, wurde auf eine prognostische Analyse immunhistochemischer Marker abgesehen. Das 5-Jahresüberleben liegt bei 90 % und zeigt damit eine ähnlich gute Prognose wie dies auch in anderen Arbeiten veröffentlicht wurde [74, 291]. 41 42 Abb. 41: Einheitliche Zellen mit spindelförmigen Nukleolen: Eine Färbung mit Cnx ergibt bei einer Farbintensität von 2 und einem Anteil von immerhin 40 % einen Gesamtwert von 80%Punkten. Abb. 42: LMP-7 zeigt nukleär und zytoplasmatisch positive Tumorzellen. 4.3.4 Myoepitheliale Karzinome Aus Nürnberg, Erlangen und Regensburg konnten 18 Fälle zusammengestellt werden. Der Mittelwert lag bei 61,8 Jahren, mit einer Spanne von 34 bis 88 Jahren. Es ergab sich eine stärkere weibliche Beteiligung (n=11). Die Gl. parotis war −wie in der Literatur beschrieben− vorwiegend mit 72 % beteiligt, danach die Gl. submandibularis mit 28 %. In der klinischen Beobachtung ergaben sich drei Rezidive und ebenso bildeten sich drei Metastasen, vorwiegend in Lunge und Knochen (Wirbelkörper, Rippe). Sieben Patienten starben, fünf davon tumorabhängig. Im pT-Stadium zeigte sich eine stärkere Beteiligung im zweiten und drittem Stadium (pT1=2 Fälle, pT2= 10 Fälle, pT3= 8 Fälle, pT4=1 Fall), wohingegen im pN-Stadium die meisten Patienten ein pN0-Situation aufwiesen 66 (pN0=15 Fälle, pN1=1 Fall, pN2= 2 Fälle). Das UICC-Stadium war relativ ausgeglichen (Stadium 1= 3 Patienten, Stadium 2= 6 Patienten, Stadium 3= 5 Patienten, Stadium 4= 4 Patienten). Ebenso gleichmäßig verteilt war das Grading: es zeigte sich eine Beteiligung von fünf Fällen mit einem niedrigen, sechs Fälle mit einem mittleren und sieben mit einem hohen Malignitätsgrad. In der Literatur ist der freie Resektionsrand als prognostisch wichtigster Marker angegeben, wobei dreizehn Patienten in einen R0-Zustand operativ gebracht werden konnten [258]. Bei zwei Patienten wurde R1 vom Pathologen diagnostiziert, R2 wurde einmal vergeben und in zwei Fällen war der Tumorabstand unsicher (RX). Das infiltrative Wachstum des myoepithelialen Karzinoms zeigte sich sowohl histologisch in einer Invasion von Knochen, Fett und Gefäßen, aber auch klinisch in einer Nervenbeteiligung mit einer Fazialisparese bei vier Patienten. Fünf Patienten wurden aufgrund der bestehenden Tumorränder bzw. aufgrund der Beseitigung von Tumorzellen postoperativ bestrahlt. Besondere Bedeutung hat das Expressionsmuster bezüglich der Proteine des MHC-Klasse-I-Weges (vgl. Tab. 5): Unterexprimiert wurden in den Tumoren Crt (im Vergleich zum histogenetisch relevanten Schaltstück und auch zum Streifenstück (Abb. 43), ERp57 (i.V.z. Azinusnormalgewebe), HLA-A (i.V.z. Schaltund Streifenstück), LMP-7 (in der nukleären und zytoplasmatischen Auswertung sogar im Vergleich zu allen Normalgewebslokalisationen), TAP-2 und HC-10 (i.V.z. Schalt-, Streifenstück- und Ausführungsgangnormalgewebe). ÜberexMyo-Ca. β2-MG Calnexin Calreticulin Erp57 HLA-A LMP-2 (n) LMP-2 (z) Acini Schs. Sts. p= 0,49 0,31 0,044↑ p= <0,001↑ p= 0,19 0,006↓ 0,012↓ p= 0,023↓ p= 0,07 0,01↓ 0,002↓ p= 0,015↑ p= 0,017↑ 0,08 0,03↑ 0,32 0,13 AG. 0,12 0,47 0,33 0,74 0,11 0,018↓ 0,051 Gesamt 0,08 0,15 0,016↓ 0,06 0,036↑ 0,06 0,04↑ Acini Schs. Sts. LMP-7 (n) p= 0,038↓ <0,001↓ <0,001↓ LMP-7 (z) p= 0,018↓ <0,001↓ <0,001↓ Tap-1 p= 0,012↑ 0,012↑ 0,012↑ Tap-2 p= 0,97 <0,001↓ <0,001↓ Tapasin p= 0,003↑ 0,26 0,11 HC-10 p= 0,52 <0,001↓ <0,001↓ AG. <0,001↓ <0,001↓ 0,012↑ <0,001↓ 0,17 0,036↓ Gesamt <0,001↓ <0,001↓ 0,012↑ <0,001↓ 0,72 <0,001↓ 0,49 0,51 0,07 0,13 Tab. 5: Werte aus dem t-Test für unabhängige Variablen zwischen dem myoepithelialen Karzinom (=MYEC) und der Speicheldrüsennormalgewebslokalisation mit Über- (↑) und Unterexpressionen (↓) des Tumors. 67 43 44 Abb. 43: Unterexpression von Crt (Gesamtwert 70 %-Punkte) bei multilobulärem Aufbau (IHC). Abb. 44: LMP-2 zeigt zytoplasmatisch mehrere positive Zellen mit geringerer Farbintensität, während wenige Zellen nukleär mit einer höheren Intensität angefärbt sind (IHC-Färbung). pressionen hingegen ergaben sich bei den Antikörpern β2-MG (Streifenstück), Cnx (Azini), TAP-1 (bei allen Normalgewebslokalisationen), Tps (Azini) und LMP-2 (Abb. 44). 45 46 Abb. 45 und 46: Kaplan-Meier-Analyse. Prognostisch ungünstig sind ein hohes Tumorstadium (45) und eine Cnx-Unterexpression (46). Schlechtere Überlebenschancen wurden bei einer Unterexpression von Cnx (Abb. 46) und einer Überexpression von LMP-2 (n) (p=0,002) ermittelt. Auch klinische Parameter wie hohes WHO-Grading (log rank p=0,006), Metastasierung (log rank p=0,008) und auch ein hohes Stadium (Abb. 45) konnten in einer dichotomen Analyse als prognostisch Faktoren heraus gearbeitet werden. Das am stärksten mit der Prognose negativ korrelierende Ergebnis zeigte, wie in der Literatur beschrieben, der tumorfreie Resektionsrand mit p<0,001 [57]. 68 Das Alter, das Geschlecht sowie die Rezidivbildung gingen mit keinem statistisch signifikanten Überlebensunterschied einher. Das schlechte 5-Jahresüberleben mit einer Letalität von einem Drittel [260], konnte in der eigenen Fallserie bestätigt werden. 4.3.5 Basalzelladenokarzinome Acht Basalzelladenokarzinome wurden zusammengestellt: Der Altersmittelwert lag bei 60,5 Jahren. Mit einer Verteilung von 43-87 Jahren waren auch hier nur Erwachsene betroffen. Während die Geschlechtshäufigkeit eine weibliche Disposition aufweist (fünf Frauen, drei Männer), zeigte die Lokalisation mit sieben Fällen eine Häufung in der Gl. parotis (87,5%) und weniger in der Gl. submandibularis (n=1). Zwei Patienten entwickelten ein Rezidiv, alle blieben aber von Metastasen verschont, obwohl ein Patient, jedoch nicht Tumor abhängig, verstarb. Das pT1-Stadium wurde einmal, pT2 fünfmal, pT3 und pT4 je einmal vergeben. Das Stadium pN0 wurde in allen acht Fällen diagnostiziert. Es ergaben sich UICC-Stadien von 17 % (1), von 50 % (2) und von je 16,5 % (3 und 4), wobei diese im Wesentlichen von den pT-Stadien beeinflusst wurden. Der WHO-Grad 1 zeigte sich bei allen Fällen, Dedifferenzierungen wurden nicht beobachtet. Neben einer R147 Abb. 47: TAP-2 Färbung mit nur wenig stark angefärbten Zellen (Insgesamt erhielt diese Stanze einen Wert von nur 40%-Punkten). Situation wurde siebenmal eine R0Situation erreicht. Die linke Seite war mit 87,5% (n=6) deutlich häufiger betroffen. Trotz vorhergehender Perineuralinvasion hatte kein Patient prä- bzw. postoperativ eine Fazialisparese. 40%-Punkten). Der t-Test für unabhängige Variablen ergab eine Vielzahl von signifikanten Über- bzw. Unterexprimierungen, wobei diese Werte aufgrund des kleinen Kollektivs kaum bewertbar sind: Unterexprimiert wurde Crt, HLA-A, LMP-2 in der nukleären Auswertung, ebenfalls LMP-7 (n und z), (siehe Abb. 47) und HC-10. Überexprimiert wurde hingegen Cnx und HC-10 jeweils im Vergleich zum Azinusnormalgewebe. Eine Kaplan-Meier-Analyse hat aufgrund des einen Todesfalls und des kleinen Gesamtkollektivs keine Aussagekraft. 69 β2-MG p= 0,68↑ BCC 0,53 0,21 Cnx Crt p= p= 0,021↑ 0,29 0,005↓ 0,3 0,013↓ 0,28 HLA-A p= 0,09 0,021↓ 0,001↓ LMP-2 (n) p= 0,38 0,001↓ 0,003↓ LMP-7 (n) p= 0,037↓ <0,001↓ <0,001↓ LMP-7 (z) p= 0,32 0,003↓ 0,012↓ TAP-2 p= 0,75 0,002↓ <0,001↓ HC-10 p= 0,035 ↑ 0,001↓ <0,001↓ AG 0,33 0,3 0,23 0,044↓ <0,001↓ 0,012↓ 0,055 0,011↓ 0,22 Gesamt 0,85 0,06 0,18 0,001↓ 0,64 0,002↓ 0,06 0,24 0,84 Acini Schs. Stst. Tab. 6: t-Test für unabhängige Variablen des Basalzelladenokarzinoms (=BCC). 4.3.6 Epithelial-myoepitheliale Karzinome Im Kollektiv fanden sich vier Fälle des seltenen epithelial-myoepithelialen Karzinoms. Die Alterspanne lag dabei zwischen dem 60. und 72. Lebensjahr, das Patientengut blieb frei von Rezidiven und Metastasen. Keiner verstarb während des Beobachtungszeitraumes. Das UICC-Stadium verteilte sich ausgeglichen mit je 2 Fällen auf das erste und zweite. Aufgrund des kleinen Kollektivs muss auf die weitere statistische Analyse verzichtet werden. 4.3.7 Onkozytäre Karzinome Dieser überaus seltene Tumor konnte in 4 Fällen diagnostiziert werden. Wie in der Literatur beschrieben wurde auch im eigenen Kollektiv eine Häufung bei den Männern (n=3) beobachtet [242]. Die Gl. parotis war in drei Fällen betroffen (75 %), die Gl. submandibularis in einem Fall (25 %). Das Alter reichte von 3979 Jahren und es resultierte ein Mittelwert von 63,7. Bei zwei Patienten bildeten sich Lokalrezidive, eine Metastase im Ovar trat auf. Sekundäre Fernmetastasen, also Filiae des Rezidivs, wurden bei zwei Personen gesehen, wobei zum einen der Lymphknoten befallen war, zum anderen die Situation mit paralleler Beteiligung der Knochen, der Lunge, des ZNS wesentlich fortgeschrittener war. Drei Patienten verstarben in der retrospektiven Betrachtung, zwei davon Tumor abhängig. Das pT-Stadium war sehr ausgeglichen, die pN0-Situation war in zwei Fällen zu beobachten. Drei Patienten hatten eine Fazialisparese, zwei von Ihnen bereits vor dem operativen Eingriff. In drei Fällen folgte der Tumorexzision bzw. der Glandektomie eine Bestrahlung. In einem Fall wurde in einer palliativen Situation eine Chemotherapie eingesetzt. Der t-Test für unabhängige Variablen ergab deutliche Überexpressionen der Marker des MHC-Klasse-I Weges. B2-MG (Abb. 48) wurde im Vergleich zum Schalt- und Streifenstück signifikant überexprimiert (p= 0,024 bzw. p=0,047). 70 Auch Cnx (Abb. 49) zeigte in den Tumorstanzen eine höhere Expression zum Azinusnormalgewebe (p<0,001), ebenso wie Tps (p= 0,043) und HC-10 (p=0,043). HLA-A wurde beim Tumor im Vergleich zum Schaltstückgewebe stärker gebildet (p=0,025). 48 49 Abb. 48: Tumorzellen sind stark positiv für β2-MG, während das nicht tumoröse Nachbargewebe (links oben) negativ ist. Abb. 49: Typische Zellform (große Zellen mit prominenten Nukleolen) und solidem Muster: mit Positivität für Cnx (Insgesamt 90% der Zellen angefärbt und Intensität von 2) bei lobulärem Muster. Ein prognostisch signifikanter Marker zeigte sich in LMP-7 (zytoplasmatisch) mit einem log rank-Werten von p=0,025. Eine Überexpression ging dabei mit einer schlechteren Prognose einher. In Anbetracht der kleinen Fallzahl ist dieses Ergebnis vorsichtig zu betrachten. 4.3.8 Mukoepidermoidkarzinome Mit 43 Fällen stellte diese Entität im eigenen Kollektiv die dritthäufigste dar, wobei 26 der klassischen, 10 der squamoiden, 4 der eosinophilen und 3 der hellzelligen Variante entsprachen. Das Alter zum Diagnosezeitpunkt war bei zwei Patienten im elften Lebensjahr, der älteste Patient war 94 Jahre. Bei einem Mittelwert von 51,5 Jahren waren 32,6 % unter 40 Jahren. Dagegen waren Frauen zu 65,1 % im Gegensatz zu Männern (34,9 %) beinahe doppelt so häufig vertreten. In der Gl. parotis wurden fünfundzwanzig Karzinome (58,1 %), in der Gl. submandibularis vier (9,3 %) und in den kleinen Speicheldrüsen vierzehn (32,6 %) gefunden. Rezidive konnten nur bei 16,3 % (sieben Patienten) in Erfahrung gebracht werden, während es bei drei Personen zu Metastasen in Pleura, Knochen, Knochen/Lymphknoten kam. PT1 wurde in 37,2 %, pT2 in 39,5 %, pT3 in 14 % und pT4 in 9,3 % vergeben. Das UICC-Stadium 1 wurde in 39,5 %, Stadium 2 in 30,2 %, Stadium 3 in 16,3 %, Stadium 4 immerhin noch mit 14 % 71 erreicht. Einundzwanzig Mal wurde Grad 1 vergeben (81 % der klassischen Variante entsprechend), Grad 2 elfmal und Grad 3 wurde vorwiegend bei der squamoiden Zellvariante (zu 91 %) diagnostiziert. In 39 Fällen wurde das Karzinom im Gesunden exzidiert, lediglich ein bzw. zwei Patienten wiesen einen R1oder R2-Tumor auf. Eine Fazialisparese wurde in zehn Fällen prä- und postoperativ angegeben, während nur zwei Personen über eine Parästhesie klagten. Die Chirurgie wurde in 39 Fällen als Therapie der Wahl angewendet, in vier Fällen wurde in einem palliativen Ansatz auf eine Chemotherapie ausgewichen. Insgesamt verstarben dreizehn Patienten, wobei sieben Todesfälle auf das Mukoepidermoidkarzinom zurückzuführen waren. Eine Neck-Dissektion wurde bei insgesamt dreißig Patienten (ungefähr 70 %) durchgeführt, eine postoperative Bestrahlung kam in achtzehn Fällen zum Zug. Zweittumoren in der Schilddrüse, der Mamma und am Zungenrand traten auf, werden aber nicht als typische synchrone Tumoren in der Literatur beschrieben. Wie geschildert, können sich verschiedene Varianten des Mukoepidermoidkarzinoms präsentieren, so dass es sinnvoll ist, die weitere statistische Auswertung in klassische versus nicht klassische Typen (squamoid, eosinophil, hellzellig) vorzunehmen. 51 52 Abb. 51: Klassische Variante: Cnx färbt besonders kräftig die Schleim bildenden Zellen. Abb. 52: Große, runde Zellen bei der squamoiden Variante: B2-MG ist mit einem Gesamtwert von 200%-Punkten (Intensität 2 bei Anfärbung aller Zellen) deutlich positiv. Betrachtet man alle MEC´s (siehe Tab. 8) ist eine Überexpression von Cnx (Abb. 51), β2-MG (Abb. 52), LMP-2 (nukleär und zytoplasmatisch) sowie TAP-1, jedoch eine Unterexpression im Vergleich zu Schalt- und Streifenstück bei HC-10 auffällig. Spaltet man die MEC´s in 2 Gruppen (klassisch versus nicht klassisch) zeigt sich, dass beide eine Überexpression von β2-MG, LMP-2 (n und z) und Tps aufweisen, während Cnx nur in der nicht klassischen Variante überexprimiert wird, LMP-7 hingegen nur in der nicht klassischen Variante unterexprimiert wird und TAP-1 ein gegenläufiges Muster aufweist. Doch reicht 72 Acini Schs. Stst. β2-MG p= 0,08 <0,001↑ <0,001↑ Cnx p= <0,001↑ AG <0,001↑ Gesamt <0,001↑ kl. MEC Gesamt n. klass. Gesamt LMP-2 (n) p= <0,001↑ <0,001↑ <0,001↑ LMP-2 (z) p= <0,001↑ Tap-2 p= <0,001↑ Tps p= <0,001↑ 0,11 0,02↑ TAP-1 p= <0,001↑ <0,001↑ <0,001↑ 0,08 0,054 0,13 0,32 0,79 0,005↑ <0,001↑ 0,008↑ <0,001↑ <0,001↓ <0,001↑ 0,32 <0,001↑ 0,91 0,52 0,002↓ β2-MG p= Cnx p= LMP-2 (n) p= LMP-2 (z) p= LMP-7 (z) p= Tap-1 p= Tps p= <0,001↑ 0,063 <0,001↑ 0,008↑ 0,624 0,035 ↑ 0,016↑ 0,009↑ 0,015↑ 0,031↑ 0,011↑ 0,025↓ <0,0001↓ 0,016↑ 0,65 0,58 HC-10 p= <0,001↑ 0,046 ↓ 0,007 ↓ 0,98 0,75 Tab. 8: Alle Mukoepidermoidkarzinome (=MEC) werden mit der entsprechenden Normalgewebslokalisation im t-Test für unabhängige Variablen verglichen. Gesamt bedeutet, dass alle Normalgewebslokalisationen gegen die MEC´s verglichen wurden. Untere Tabelle spaltet die klassische Variante versus nicht klassische Varianten auf und erlaubt genauere Typ spezifische Aussagen (als Vergleich dienten dabei die Punktwerte aller Normalgewebslokalisationen). Antikörper MEC (n=43) a klassische Variante (n=26) Andere Varianten (n=17) p=0,561 p=0,031 a p=0,307 p=0,011 b Calnexin p=0,012 ERp57 p=0,683 HLA-A p=0,014 a p=0,228 p=0,06 LMP-7n p=0,002 b p=0,246 p=0,277 Tapasin p=0,002 a p=0,683 p=0,009 a HC-10 p=0,18 p=0,277 p=0,008 a p=0,002 p=0,001 p=0,53 p=0,29 p=0,246 p=0,267 p=0,4 p=0,61 p=0,58 p=0,09 p=0,441 p=0,34 p=0,047 p=0,08 p=0,647 p=0,007 p=0,25 p=0,2 p=0,032 p=0,014 p=0,44 p<0,0001 p<0,0001 p<0,0001 Alter c Geschlecht d Lokalisation e pT-Klassifikation Stadium Grade f g h Rezidiv i Residualtumor Metastase Variante p=0,71 p=0,001 - j a p=0,67 k a) Überexpression ist mit einem schlechteren Überleben assoziiert. g) UICC-Stadien I,II vs. III,IV b) Untexpression ist mit einem schlechteren Überleben assoziiert. h) Tumorgrad 1 vs. 2,3 c) Alter >60 Jahre zeigt im Vgl. zu Alter ≤60 eine schlechtere Prognose. i) Residualtumor R0 vs. R2,3 d) Männlich versus weiblich j) keine Metastasenbildung e) Gl. parotis und submandibularis versus kleine SD f) pT-Stadien 1,2 vs.3,4 k) Nicht klassische Varianten zeigen schlechtere Prognose. Tab. 9: Kaplan-Meier-Analyse des Mukoepidermoidkarzinoms aufgeteilt nach Varianten. dieser minimale Unterschied für eine prognostisch signifikante Aussage aus? Dies lässt sich mit einer Kaplan-Meier-Analyse klären (siehe Tab. 9). 73 Während die Antikörper Cnx, HLA-A, Tps bei allen Mukoepidermoidkarzinomen bei einer Überexpression mit einer schlechteren Prognose assoziiert sind, zeigt sich diese Assoziation auch bei einer Unterexpression von LMP-7 (n). 4.3.9 Speichelgangkarzinome Für das Speichelgangkarzinom konnte insgesamt eine Fallzahl von 33 Patienten zusammengestellt werden, wobei vier davon aus pleomorphen Adenomen entstanden und eine mikropapilläre sowie eosinophile Variante klassifiziert wurde. Bei einem Mittelwert von 68 Jahren, reichte der Erkrankungsbeginn vom 34.-91. Lebensjahr, wobei Männer und Frauen etwa gleichhäufig betroffen waren (zwölf Männer, dreizehn Frauen). Wie in der Literatur beschrieben, war die Gl. parotis mit 76 % am häufigsten befallen, die Gl. submandibularis folgte mit 20 % und 4 % verteilten sich auf die kleinen Speicheldrüsen [31]. Sechs Patienten entwickelten ein Rezidiv (24 %), während vier Patienten (16 %) Metastasierungen in Lymphknoten, Pleura, Muskel/Haut und Knochen ausgesetzt waren. Insgesamt sechzehn Patienten verstarben innerhalb der klinischen Beobachtung, wobei acht davon (50 %) Tumor bedingt verschieden und dies innerhalb zwischen zehn Monaten und neun Jahren nach Diagnosestellung. Dazu zählte auch die Patientin, bei der ein mikropapilläres Gangkarzinom diagnostiziert wurde. Trotz Drüsenentfernung, Neck-Dissektion und anschließender Bestrahlung verstarb diese Tumor abhängig innerhalb von 2 Jahren nach der Diagnose. Das 5-Jahresüberleben lag insgesamt bei nur 40 % und ähnelt damit dem von der WHO angegebenen Wert mit 35 % [78]. Rezidive bildeten bei zwei Patienten sekundäre Fernmetastasen (Lunge, Knochen). Das UICC-Stadium lag zum größten Teil (64 %) im Stadium 4, Stadium 1 und 2 wurde nur in insgesamt fünf Fällen vergeben, welches Ausdruck des schnellen Wachstums ist. Eine noch ungünstigere Verteilung zeigte sich im WHO-Grading: 32 Patienten wiesen high-grade (G3) Tumoren auf, bei einem Patienten wurde eine G2-Differenzierung (mittelgradig) vergeben. Chirurgisch wurde bei neunzehn Erkrankten eine R0-Situation erreicht, bei einem Fall war der Resektionsstatus nicht beurteilbar (=RX). Eine Bestrahlung erfuhren im Anschluss achtzehn Patienten (72 %), palliativ behandelt wurden dagegen sieben mit einer Chemotherapie (28 %). Klinische Symptome äußerten sich bei sieben Patienten in einer Fazialisparese, zwei litten unter einer Parästhesie. Der t-Test für unabhängige Variablen (Tab. 10) zeigte Überexpressionen bei 74 β2-MG (Abb. 53), Cnx, LMP-2 (z und n), TAP-1, TAP-2 sowie HC-10 (nur hinsichtlich des Azinusnormalgewebes) und Tps. TAP-2 (hinsichtlich des Schaltstückes und des Ausführungsganges), HC-10 (bezüglich des Schalt-und Streifenstückes) und LMP-7 in der zytoplasmatischen sowie nukleären Punktebestimmung wurden hingegen unterexprimiert (Abb. 54). Interessanterweise wurde LMP-7 auch im Azinuszellkarzinom, in Tumoren des Schaltstückes und anderen Vertretern von Ausführungsgangtumoren unterexprimiert, so dass es sich wohl vorweggenommen um einen Universalmarker zu handeln scheint. Bei keinem immunhistochemischen Marker konnte ein prognostischer Zusammenhang ermittelt werden. Klinische Faktoren wie Lokalisation äußerten sich jedoch in der Reihenfolge Gl. parotis>Gl. submandibularis> Kleine Speicheldrüsen in einer signifikanten besseren Prognose (log rank p=0,003, vgl Abb. 55). Acini Schs. Stst. β2-MG p= 0,19 0,001↑ <0,001↑ Cnx p= <0,001↑ LMP-2 (n) p= <0,001↑ LMP-2 (z) p= 0,007↑ 0,08 0,06 0,08 0,019↑ 0,28 0,09 LMP-7 (n) p= 0,09 <0,001↓ <0,001↓ AG <0,001↑ 0,15 0,001↑ 0,049↑ 0,035↑ 0,01↓ 0,02↓ 0,17 0,001↓ Acini Schs. Stst. LMP-7 (z) p= 0,2 <0,001↓ <0,001↓ Tap-1 p= 0,005↑ 0,005↑ 0,005↑ Tap-2 p= <0,001↑ 0,042↓ 0,027↓ Tps p= <0,001↑ HC-10 p= 0,001↑ 0,04↓ 0,006↓ AG 0,002↓ 0,005↑ <0,001↓ Gesamt 0,001↓ 0,005↑ 0,88 0,56 0,03↑ SDC Gesamt 0,001↑ 0,15 0,34 0,99 0,66 Tab. 10: Werte aus dem t-Test für unabhängige Variablen. 53 54 Abb. 53: Stark positive Zellen bei β2-MG. Abb. 54: Tumorzellen sind für LMP-7 negativ (0 %-Punkte), bei den gefärbten Zellen handelt es sich nicht um Tumorzellen. Eine Rezidivbildung verschlechtere dagegen das Überleben (p=0,017). Alter, Geschlecht, Stadium, Grading, Metastasierung und Residualtumor erbrachten kein signifikantes Ergebnis. Ein Erklärungsversuch ist das meist ohnehin 75 höhere Alter zum Diagnosezeitpunkt, das häufige Vergeben 55 eines Stadium 4 bzw. eines Grades 3 und des R0-Resektionsrands, so dass eine prognostische Relevanz aufgrund der gesammelten Daten nicht zu verwerten ist. Abb. 55: Kaplan-Meier-Analyse: Die Gl. parotis zeigt die beste Prognose bei dieser Entität, gefolgt von der Gl. submandibularis und den kleinen Speicheldrüsen. 4.3.10 Plattenepithelkarzinome Bei der eigenen Fallserie wurden von insgesamt 25 Plattenepithelkarzinomen zwei hellzellige und eine akantholytische Variante diagnostiziert. Es zeigte sich bei einer Altersverteilung von 15-94 Jahren ein Mittelwert von 73,8. Wie in der Literatur beschrieben, waren Männer häufiger betroffen (84 %), die Gl. parotis hauptsächlich (96%) und die Gl. submandibularis in einem Fall (4 %) [57]. Acht Patienten (32 %) bildeten in der retrospektiven Analyse Rezidive, bei zwei Patienten ließen sich Metastasen in der Lunge nachweisen und bei je zwei Patienten wurden sekundäre Lymphknoten- und Fernmetastasen (Kopfhaut, Larynx) diagnostiziert. Innerhalb der Beobachtung starben siebzehn Patienten, bei sechs konnte das Karzinom als Todesursache nachgewiesen werden, bei drei weiteren war kein endgültiger Zusammenhang nachweisbar. Während die Chirurgie in 72 % einen R0-Status erreichte, wies das UICC-Stadium zweimal Stadium 1, je siebenmal Stadium 2 und 3 sowie neunmal das Stadium 4 auf. Das WHO-Grading äußerte sich in 26 Fällen mit dem höchsten Grad, lediglich das 15-jährige Kind zeigte Grad 1. Während 72 % (18 Fälle) eine uni- oder bilaterale Neck-Dissektion erhielten, wurde eine Bestrahlung in 68 % angewendet, während die Chemotherapie für vier Patienten als palliative Therapie zum Einsatz kam. Nur vier Personen zeigten prä- bzw. postoperativ eine Fazialisparese, eine davon klagte zusätzlich postoperativ über Empfindungsstörungen im trigeminalen Bereich. 76 Der t-Test für unabhängige Variablen (Tab. 11) offenbarte signifikante Unterschiede zwischen Normal- und Tumorgewebe der entsprechenden Lokalisationen (vgl. auch Abb. 56, 57, 58). β2-MG Cnx LMP-2 (n) LMP-2 (z) LMP-7 (n) LMP-7 (z) p= p= p= p= p= p= Acini 0,004↑ <0,001↑ <0,001↑ <0,001↑ 0,19 0,07 Schs. <0,001↑ 0,54 <0,001↑ <0,001↑ <0,001↓ <0,001↓ Stst. <0,001↑ 0,56 <0,001↑ <0,001↑ <0,001↓ <0,001↓ AG <0,001↑ 0,49 <0,001↑ <0,001↑ 0,017↓ <0,001↓ Gesamt <0,001↑ 0,2 <0,001↑ <0,001↑ <0,001↓ <0,001↓ PEC Tap-1 Tap-2 Tps HC-10 p= p= p= p= Tab. 11: T-Test für unabhängige Acini <0,001↑ <0,001↑ <0,001↑ <0,001↑ Variablen für das Plattenepithel- Schs. <0,001↑ 0,01↓ 0,032↑ 0,164 karzinom (=PEC). Stst. <0,001↑ 0,006↓ 0,085 0,052 AG <0,001↑ <0,001↓ 0,221 0,672 Gesamt <0,001↑ 0,326 0,001↑ 0,731 PEC 56 57 Abb. 56: Tumorzellen sind stark positiv für TAP-1 (Intensität 2, alle Tumorzellen gefärbt, ergibt 200%-Punkte). Abb. 57: Negatives Ergebnis bei LMP-7. 58 Abb. 58: Bei stärkster Intensität (=3) sind alle Tumorzellen für β2-MG gefärbt. Wie auch beim hoch aggressiven Speichelgangkarzinom konnte jedoch kein signifikanter Prognoseunterschied auch nur eines Markers ermittelt werden. 77 Klinisch prognostisch Faktoren waren der Residuumstatus (p=0,047), die Seite (Abb. 59) sowie der pN-Status (Abb. 60). Das 5-Jahresüberleben gesamt beträgt 35 % und ähnelt dem Ergebnis aus einer anderen großen Studie [251], das 10-Jahresüberleben ist mit 20 % schlecht. 59 60 59 Abb. 59, 60: Eine rechte Beteiligung innerhalb der großen Speicheldrüsen sowie eine Infiltration lokaler Lymphknoten zeigen eine schlechteres Überleben in der Kaplan-Meier-Analyse. 4.3.11 Nicht näher klassifizierbare Adenokarzinome Während in der Literatur die Inzidenz des nicht näher klassifizierbaren Adenokarzinoms als zweithäufigste angegeben wird, ist diese Entität mit 36 Fällen die vierthäufigste Entität (12,5 %) der gesamten Serie [64]. Der jüngste Patient war zum Zeitpunkt der Diagnose 21 Jahre, der älteste 86 Jahre. Es ergab sich ein Mittelwert von 63 Jahren. Dieser Tumor sparte demzufolge beinahe keine Lebensdekade aus. Männer waren etwas häufiger als Frauen betroffen (56 % versus 44 %). Die Gl. parotis war mit 30 Fällen (83,3 %) die häufigste Lokalisation, gefolgt von der Gl. submandibularis mit vier Fällen (11,1 %), die kleinen Speicheldrüsen waren dagegen nur bei zwei Personen (5,6 %) Wachstumsort. Dabei wurde meistens die linke Seite der großen Drüsen befallen (62 %). Bei vierzehn Personen bildeten sich Rezidive, acht Patienten wiesen mehrere Metastasen auf (fünfmal in der Leber, viermal in der Lunge, dreimal im Knochen, zweimal im Gehirn, je einmal in Niere und Haut). Sekundäre Fernmetastasen ent- 78 standen bei zehn Patienten (je dreimal in Lunge und Lymphknoten, zweimal in Knochen, einmal in Haut, Leber, Gehirn, Weichteile). Aus diesem aggressiven Verhalten resultierte, dass vierundzwanzig Personen innerhalb des Beobachtungszeitraums starben, wobei nur bei dreizehn Patienten mittels Todesbescheinigung der Tumor als Ursache nachgewiesen werden konnte. Das pT1Stadium wurde vom Pathologen zehnmal, das pT2-Stadium siebenmal, pT3 elfmal und pT4 achtmal vergeben. Hingegen wurde beim pN-Stadium meist pN0 mit 60 % diagnostiziert, pN2 hingegen in 31 % und pN2 in 9 % der Fälle. Im UICC-Stadium überragte das vierte mit 55,5 % bei Weitem die anderen (Stadium 3 mit 20,5 %, Stadium 2 mit 9 % und Stadium 1 mit 15 %). Die chirurgische Therapie konnte in 75 % eine R0-Situation schaffen, danach verblieben eine R1-Situation mit 19,2 % und eine R2-Situation mit 5,8 %. Klinische Symptome wie eine Fazialisparese waren von 15 Patienten (28,8 %) und eine Parästhesie bei vier Patienten (7,7 %) anamnestisch zu erfragen. Eine NeckDissektion wurde bei 84,6 % durchgeführt, eine Bestrahlung immerhin noch bei 70 % und eine Chemotherapie kam bei 85 % zum Einsatz. Die signifikanten Unterschiede zwischen Tumor- und Normalgewebe wurden mithilfe des t-Tests für unabhängige Variablen bestimmt (Tab. 12). Überexpressionen traten bei β2MG, LMP-2 (zytoplasmatisch und nukleär) und TAP-1 auf. Unterexpressionen zeigen sich bei Crt, HLA-A, HC-10 und dem Universalmarker LMP-7 (nukleär und zytoplasmatisch). Acini Schs. Stst. AG β2-MG p= 0,61 0,06 0,001↑ 0,015↑ Gesamt 0,029 0,7 0,63 0,84 0,007↑ ADC NOS Acini Schs. Stst. LMP-7 (n) p= <0,001↓ <0,001↓ <0,001↓ LMP-7 (z) p= 0,11 <0,001↓ <0,001↓ Tap-1 p= 0,001↑ 0,001↑ 0,001↑ Tap-2 p= <0,001↑ 0,006↓ 0,003↓ Tps p= <0,001 ↑ 0,65 0,29 HC-10 p= 0,023↑ <0,001↓ <0,001↓ AG <0,001↓ <0,001↓ 0,01↑ <0,001↓ 0,33 Gesamt <0,001↓ 0,001↓ 0,001↑ 0,24 0,37 0,07 0,005↓ ADC NOS Cnx p= <0,001↑ Crt p= 0,4 0,006↓ 0,017↓ 0,19 0,027↓ HLA-A p= 0,27 0,067 0,009↓ 0,5 0,041↓ LMP-2 (n) p= 0,004↑ LMP-2 (z) p= 0,004↑ 0,06 0,024↑ 0,033↑ 0,005↑ 0,32 0,08 0,04 0,008↑ Tab. 12: t-Test für unabhängige Variablen bezüglich des Adenokarzinoms NOS (ADC NOS ). Aus der Kaplan-Meier Analyse ergibt sich (Tab. 13), dass eine Überexpression von HLA-A (Abb. 61), LMP-7 (zytoplasmatische Auswertung), Tapasin und HC10 mit einer geringeren Überlebenswahrscheinlichkeit vergesellschaftet ist. 79 Prognostisch klinische Faktoren sind die Lokalisation, Alter, das UICC-Stadium, eine Rezidivbildung (Abb. 62), die Resektionsränder, die Metastasen- und sekundäre Fernmetastasenbildung. Das 5-Jahresüberleben war ungeachtet der Graduierung bei 55 %, das 10-Jahresüberleben bei 50 %. Antikörper log-rank Werte Prognose HLA-A p=0,002 Überexpression assoziiert mit einer schlechteren Prognose LMP-7 (z) p=0,004 " Tapasin p=0,012 " HC-10 p=0,048 " Klinische Daten Beste Prognose> mittlere Prognose> schlechtere Prognose: Lokalisation p=0,027 Kleine Speicheldrüsen>Gl. submandibularis > Gl. parotis Alter p=0,015 Alter (≤ 60 Jahre) > Alter (> 60 Jahre) pT-Klassification p=0,7 pT1/pT2 versus pT3/pT4 pN-Klassifikation p=0,055 pN0 versus pN1/pN2 UICC-Stadium p=0,046 Stadium 1,2 > Stadium 3,4 WHO-Graduierung p=0,17 Grad I/II versus Grad III Rezidiv p=0,001 Rezidiv nichtgebildet > gebildet Resektionsrand p< 0,001 R0 > R1/R2 Metastase p=0,014 Metastase nicht gebildet > gebildet Sekundäre Fernmet. p=0,002 Fernmetastase nicht gebildet > gebildet Tab. 13: Die Kaplan-Meier Analyse ergibt, dass zum einen Überexpressionen von HLA-A, LMP-7 (z), Tapasin und HC-10, zum anderen klinische Daten wie Lokalisation, Alter, Stadium, Rezidiv, Residuum, Metastase und eine sekundäre Fernmetastasierung mit dem Überleben im Zusammenhang stehen. E61 F 62 Abb. 61, 62: HLA-A Überexpression (61) und Rezidivbildung (62) sind mit einer schlechteren Prognose assoziiert. 80 4.3.12 Carcinoma ex pleomorphes Adenom Insgesamt wurden 27 Fälle gefunden, in denen Karzinome aus einem pleomorphen Adenom entstanden: Siebzehn Adenokarzinome NOS, fünf Karzinosarkome, zwei Speichelgangkarzinome und je ein Azinuszellkarzinom, ein Plattenepithelkarzinom und ein myoepitheliales Karzinom ließen Anteile eines pleomorphen Adenoms erkennen. Diese Entitäten wurden jedoch, entsprechend ihrer histomorphologischen und immunhistochemischen Eigenschaften, in den entsprechenden Gruppen belassen. Zählt man diese verschieden Karzinome als eine Gruppe, ergibt sich eine Altersverteilung von 15 bis 88 Jahren und eine Lokalisation vorwiegend in der Gl. parotis (70 %), weniger in der Gl. submandibularis (23,3 %) oder gar in den kleinen Speicheldrüsen (6,7 %). Auffällig ist jedoch, dass in dieser Gruppe siebzehn nicht näher klassifizierbare Adenokarzinome zu finden waren, so dass auf einen Vergleich innerhalb dieser Gruppe zwischen der „De novo“-Entstehung und einer Bildung aus einem pleomorphen Adenom eingegangen werden soll: Interessant ist die Tatsache, dass Adenokarzinome NOS „De novo“ bei zahlreichen Markern des MHC-Klasse-I Komplexes konstant Überexpressionen zeigten, wohingegen die Gruppe der „ex pleomorphen Adenome“ bei diesen Markern signifikant unterexprimiert werden (Tab. 14). Weiterhin wurde untersucht, ob dieses homogene Bild auch einen prognostischen Wert aufweist. In der Gruppe der „De novo“-Tumoren ist dies für keinen einzelnen immunhistochemischen Marker der Fall (siehe auch Abb. 63), sehr wohl aber in der Gruppe der „ex pleomorphen Adenome“ (siehe auch Abb. 64). Marker β2-MG HLA-A LMP-2 (n) LMP-2 (z) TAP-1 Tapasin De Novo ↑ ↑ ↑ ↑ ↑ ↑ Ex pl. Adenom ↓ ↓ ↓ ↓ ↓ ↓ p-Werte p=0,042 p=0,038 p=0,012 p=0,002 p=0,027 p=0,003 Tab. 14: T-Test für unabhängige Variablen. Signifikante Überexpression zeigen sich bei den Adenokarzinomen NOS mit einer Entstehung „de novo“, wohingegen bei einer Entstehung „ex pleomorphes Adenom“ (=ex pl. Adenom) Unterexpressionen vorliegen. Dabei ist festzuhalten, dass innerhalb der Adenokarzinome ex pleomorphes Adenom jeweils eine Überexpression mit einer schlechteren Prognose vergesellschaftet ist, sich diese Gruppe bei einer starken Expression der „de novo“Karzinome (siehe Tab. 15) annähert. 81 Marker Calnexin Calreticulin ERp57 HLA-A LMP-2 (n) LMP-2 (z) TAP-2 HC-10 De Novo Log-rank p=0,87 p=0,38 p=0,44 p=0,65 p=0,80 p=0,41 p=0,95 p=0,33 Ex pl. Ad. Log-rank a p=0,019 a p=0,006 p=0,08 a p=0,002 p=0,08 p=0,08 a p=0,007 a p=0,018 Tab. 15: Dargestellt sind die Marker aus der Gruppe Adenokarzinom "ex pleomorphes Adenom" und "de-novo" hinsichtlich ihrer signifikanten prognostischen Marker (Kaplan-Meier-A.). Überexpressionen aus der Gruppe "ex pleomorphes Adenom" gehen mit einer schlechteren Prognose einher, während die "de novo" Tumore unabhängig von dem Immunprofil sind. a) Überexpression der jeweiligen Marker sind mit einer schlechteren Prognose assoziiert. Daneben konnte gezeigt werden, dass sich die klinischen Verläufe hinsichtlich der Rezidivbildung, des höheren pTN- sowie des UICC-Stadiums und der To63 64 Abb. 63, 64: Kaplan-Meier-Analysen aus der Gruppe des Adenokarzinoms NOS: „de novo“ entstandene Karzinome zeigen im Gegensatz zur Gruppe „ex pleomorphes Adenom“ keinen signifikanten Überlebensunterschied hinsichtlich der Cnx-Expression (E). Bei einer Entstehung aus einem pleomorphen Adenom zeigt diese Gruppe jedoch einen signifikanten Überlebensunterschied bei einer Überexpression von Cnx (F). deswahrscheinlichkeit signifikant (mittels Exakter-Test nach Fisher, Tab. 16) unterscheiden, wobei immer das Adenokarzinom „De novo“ den aggressiveren Verlauf zeigt. Darüber hinaus äußert sich dieser Zusammenhang auch in der Kaplan-Meier-Analyse (siehe Abb. 65, Tab. 17), wobei hohes Alter (> 60 Jahre), Metastasierung und sekundäre Metastasierung aus einem Rezidiv in einer geschichteten Kaplan-Meier-Analyse beider Gruppen ein deutlich niedrigeres Überleben bedingt. Schichtung bedeutet, dass „De novo“ gegen „Ex pleomorphes Adenom“ verglichen wird und zusätzlich eine weiterer Parameter, wie bei- 82 spielsweise Alter< 60 Jahre ergo Alter ≥60, mit einbezogen wird (Tab. 17, Spalte a). Somit können prognostische Aussagen über die zwei Gruppen hinsichtlich eines weiteren Faktors getroffen werden. Bei den Adenokarzinomen NOS „ex pleomorphes Adenom“ ist darüber hinaus der Resektionsrand R0 mit einer deutlichen Prognoseverbesserung assoziiert (siehe Tab. 17, Spalte b). Das „pleomorphe Adenom“ zeigt in der Einzelstatistik einen besseren prognostischen Verlauf als das hochmaligne Adenokarzinom NOS und ist in der Gesamtstatistik für ein besseres Outcome verantwortlich. Abb. 65: Kaplan-Meier-Kurve mit signifikant schlechterem Überleben der Adenokarzinome NOS bei einer De novo-Entstehung. Kommt es jedoch bei den Adenokarzinomen ex pleomorphes Adenom zu einer R1- oder R2- Situation oder gar zu einer sekundären Fernmetastasenbildung, wird dieses prognostisch weniger aggressive Verhalten wiederum aufgehoben (siehe Tab. 17). Exakter Test nach Fisher (2-seitige Signifikanz) Tab. 16: Klinik Rezidiv Tod pT3/4 pN1/2 UICC-Stadium 3/4 De Novo 42% 64% 60% 50% 91% Ex pl. Ad. 0% 26% 32% 21% 47% p-Werte p<0,001 p=0,01 p=0,05 p=0,038 p=0,001 Klinische Parameter. Die Prozentzahlen beziehen sich auf das eingetretene Ereignis. Die höhere Expression von Markern des MHC-Komplexes, die sich in einer Überexpression bei den „De novo“ Tumoren äußert und dadurch einen stärkeren Erkennung des Immunsystems mit konsekutiver Zerstörung zeigen sollte, haben paradoxer Weise eine schlechtere Prognose. Demzufolge muss diese 83 Kaplan-Meier Analyse Klinik Alter ( c ) Metastase Resektionsrand ( d ) Sek. Fernmetastase (a) p=0,018 p=0,039 p=0,173 p=0,012 (b) p=0,049 p=0,049 p<0,001 p<0,001 ( a ) Log rank Wert mit Schichtung aus Gruppe Adenokarzinom NOS "De Novo" und "ex pl. Adenom" ( b ) Log rank Wert bezüglich ADC NOS " ex pleomorphes Adenom" ( c ) Alter ≤ 60 Jahre versus Alter > 60 Jahre ( d ) R0 versus R1/2 Tab. 17: Kaplan-Meier-Analyse aus einer Schichtung (a) und für die Adenokarzinome NOS „ex pleomorphes Adenom“ (b). Karzinomform über weitere unbekannte Mechanismen verfügen, um einer Zellerkennung zu entgehen oder per se so entartet sein, dass sie auf wachstumshemmende und eliminierende Einflüsse nicht mehr reagiert. Weiterhin ist es denkbar, dass durch die stärkere Erkennung quasi ein Gegenangriff des Tumors eingeleitet wird und das Immunsystem (durch eine ständige Tumorantigenpräsentation dendritischer Zellen) sich an den Fremdling im Laufe der Zeit sogar gewöhnt, die Zerstörung durch das Immunsystem somit eingestellt wird. Kritisch gesehen werden muss die Tatsache, dass eine Entstehung aus einem pleomorphen Adenom eine Klassifizierung „Carcinoma ex pleomorphes Adenom“ zulassen würde. Dazu kommt, dass die Entität Adenokarzinom NOS eine Ausschlussdiagnose darstellt. Da jedoch der prognostische Verlauf einer niedrig malignen Entität (z.B. des Azinuszellkarzinoms) und eines hoch aggressiven Karzinoms wie das Adenokarzinom NOS trotz gleichzeitiger Entstehung aus einem pleomorphen Adenom völlig verschieden ist, rechtfertigt dies die jeweilige Diagnose. Festgestellt werden kann somit, dass „De novo“-Adenokarzinome aggressiver sind und ihr molekulares Verhalten wohl weniger Wachstums suppressiven Faktoren durch direkte Mutationen unterworfen ist wie das für eine schrittweise Mutation bei einer Entstehung aus einem pleomorphen Adenom gegeben ist. 4.3.13 Karzinosarkome Mit einem Anteil von 1,7 % am Gesamtkollektiv konnten fünf Karzinosarkome diagnostiziert werden. Die Altersverteilung lag zwischen dem 50. und 88. Lebensjahr, wobei keine Geschlechtsdisposition −identisch mit Literaturangaben− zu finden war [57]. Vorwiegend die Gl. parotis (80 %), gefolgt von der Gl. submandibularis (20 %), waren immer auf der rechten Seite betroffen. Es ergab sich eine Rezidivbildung mit sekundärer Fernmetastasierung in Lymphknoten 84 und Lunge, wobei drei Patienten Tumor abhängig verstarben, die anderen Patienten sind laut Einwohnermeldeamt zwölf bzw. zehn Jahre nach Diagnosestellung am Leben. Das pT3-Stadium (60 %) und das pT2 Stadium (40 %) wurden ausschließlich vergeben, die UICC-Stadien verteilten sich relativ ausgeglichen (2: 20 %, 3:40 %, 4: 40 %). Alle Tumoren waren jedoch hochgradig (G3) und undifferenziert, in zwei Fällen war eine Resektion im Gesunden nicht mehr möglich. β2-MG Cnx Crt LMP-2 (n) LMP-7 (n) TAP-2 Tps HC-10 p= p= p= p= p= p= p= p= Acini 0,2 0,049↑ 0,042↓ 0,01↑ 0,16 0,453 0,002↑ 0,029↑ Schst. 0,048↑ 0,33 <0,001↓ 0,038↑ 0,008↓ 0,007↓ 0,66 0,27 Stst. 0,007↓ 0,32 <0,001↓ 0,007↑ 0,009↓ 0,005↓ 0,88 0,15 AG 0,015↓ 0,34 0,051 0,017↑ 0,058 0,05↓ 0,96 0,8 0,83 0,003↓ 0,005↑ 0,023↓ 0,1 0,36 0,58 PMMT Gesamt 0,057 Tab. 18: Die t-Test Werte des Karzinosarkoms (=PMMT) mit Über- (↑) und Unterexpressionen (↓) des Tumors. 65 66 67 68 Abb. 65: Positive Tumorzellen für LMP-2. Abb. 66: Crt hingegen zeigt nur wenig positive Zellen mit mäßiger Intensität. Abb. 67: Auch β-MG führt nur selten zu einer Farbreaktion. Abb. 68: TAP-2 ist komplett negativ, die Zellen sind hier spindelförmig (=sarkomatoid). 85 4.3.14 Zystadenokarzinome Das seltene Zystadenokarzinom wurde bei zwei männlichen Patienten diagnostiziert, wobei einmal die Gl. parotis bzw. submandibularis betroffen war. Zum Diagnosezeitpunkt waren sie 41 und 70 Jahre alt, keiner bildete Rezidive oder Metastasen. Laut Einwohnermeldeamt verstarb keiner, wobei die chirurgische Therapie mit der kompletten Drüsenentfernung (Gl. parotis bzw. submandibularis) und einer kompletten zervikalen Lymphknotenentfernung einen wesentlichen Beitrag leistete. Die sehr gute Überlebensrate entspricht auch einer anderen Studie, die jedoch insgesamt aus 57 Fällen besteht [90]. Während einmal ein UICC-Stadium 2 diagnostiziert wurde, war bei der Beteiligung der Gl. parotis Stadium 4 erreicht. Daher wurde postoperativ eine Strahlentherapie angewendet. Aufgrund des kleinen Fallkollektivs und der hohen Überlebenswahrscheinlichkeit kann auf prognostische Faktoren an dieser Stelle nicht eingegangen werden. 4.3.15 Undifferenzierte Karzinome Bei sieben Patienten wurde ein undifferenziertes Karzinom diagostiziert, wobei in zwei Fällen die Subtypisierung eines kleinzelligen Karzinoms erfolgte. Das hoch aggressive Verhalten spiegelte sich sowohl in den hohen UICC-Stadien wieder (fünfmal Stadium 4, zweimal Statium drei) als auch in der Mortalität von 71,4 %. Trotz kompletter Drüsen- und zervikaler Lymphknotenentfernung, Bestrahlung und Chemotherapie starben diese drei betroffenen Personen innerhalb eines Jahres. Ein Patient ist jedoch vier Jahre nach Erkrankungsbeginn noch am Leben. 4.4 Unterschiedliche immunhistochemische Expressionen zwischen Normal- und Tumorgewebe des gesamten Kollektivs Um Veränderungen der Proteine hinsichtlich des MHC-I-Transportweges zu analysieren, wurden mithilfe des t-Tests für unabhängige Variablen (Signifikanz bei p<0,05) die verschiedenen Entitäten entsprechend ihres histogenetischen Ursprungs eingeteilt. Es ergaben sich 40 Azinuszellkarzinome, 99 Karzinome mit Enstehung aus dem Schaltstück, 4 onkozytäre Karzinome aus dem Streifenstück und 137 Tumore aus dem Ausführungsgang. Die übrigen 14 Fälle hin- 86 gegen, bestehend aus primären malignen Mischtumor, den undifferenzierten Karzinomen, den groß- sowie kleinzelligen Karzinomen konnten keinem histogenetischen Ursprung zugeordnet werden. LMP-7 wurde mäßig im Zytoplasma (Mittelwert bei 145 %-Punkten) und nukleär (Mittelwert bei 158 %-Punkten) im azinären Normalgewebe exprimiert. In Geweben der Schaltstücke, Streifenstücke sowie der Ausführungsgänge kam es zu einer Überexpression (Mittelwerte bei 232,2 %-Punkten/231,2 %-Punkten/ 198,5 %-Punkten), in der nukleären Auswertung lagen diese ebenfalls hoch bei 209,6 %-Punkten/207,0 %-Punkten/185,5 %-Punkten. Färbungen für TAP-1 zeigten sich im Normalgewebe negativ, β2-Microglobulin wurde moderat im Azinusgewebe exprimiert (Mittelwert 117,7%-Punkte) und zeigte niedrige Expressionwerte in den Schalt-, Streifenstücken und den Ausführungsgängen (Mittelwerte bei 68,6/45,2/54,0). Tapasin wurde stark exprimiert in den Schalt-, Streifenstücken sowie den Ausführungsgängen (Mittelwerte bei 157,5/141,4 und 153,7). In den Azini waren die Färbungen hingegen negativ (Mittelwert bei 33,0). HLA-A wurde in allen 4 Strukturen stark exprimiert (Mittelwert der Azini bei 200,3/ der Schaltstücke bei 214,7/der Streifenstücke bei 231,0/der Ausführungsgänge bei 197,0). Entitäten, deren Fallzahlen unter 8 lagen, wurden −mit Ausnahme der onkozytären Karzinome− ausgeschlossen. β-MG Cnx Crt = + ACC = MYEC ERp57 HLA-A LMP-2n LMP-2z LMP-7n LMP-7z TAP-1 TAP-2 Tps HC-10 = = = + + = - + + + = = - = - = = - - = - - - = = - = - = = - - + - = - BCC = = - = - - = - - + - = - PLGC = - = = = = = = - = - - - + = = = = + + - - = - = = MEC + = = = = + + = = + - = = SDC + = = = = + + - - + - = = ADCNOS = = = = = = = - - + - = = PEC + = = = = + + - - + - = = ACCC Schstu.: Ststtu.: OCC AG-Tu.: Tab. 19: Überexpressionen des Tumors + und Unterexpressionen - des Tumors Vergleich zum histogenetisch relevanten Speicheldrüsennormalgewebe. Wie Tabelle 19 veranschaulicht, zeigten die Azinuszellcarcinome signifikante Überexpressionen im Vergleich zum Normalgewebe bei Calnexin, LMP-2, 87 TAP-1, TAP-2 und Tapasin. Für die zytoplasmatische Auswertung bei LMP-7 (Mittelwert bei 116,8) waren Unterexpressionen in den Carcinomen (Mittelwert bei 158,0) charakteristisch. Tumore mit Enstehung aus den Schaltstücken zeigten eine Herunterregulierung von Calreticulin (Mittelwert bei 172,9), HLA-A (Mittelwert bei 140,5), LMP-7 (mittlerer Wert der zytoplasmatischen Auswertung bei 140,8 und nukleär bei 129,9), TAP-2 (Mittelwert bei 159,6) und HC-10 (Mittelwert bei 111,4). TAP-1 fiel hingegen durch seine Überexpressionen im myoepithelialen Carcinomen (im t-Test für unabhängige Variablen bei p=0,012) und in den Basalzellkarzinomen (p=0,03) auf. Tapasin zeigte ein verringertes Färbe-/Intensitätsverhalten in adenoidzsytischen Carcinomen (p<0,001) und polymorphen low-grade Adenokarzinomen (p=0,03). Bei den 4 onkozytären Karzinomen, von denen eine Enstehung aus den Schaltstücken angenommen wird, zeigte sich ein ähnliches Expressionsmuster wie bei Ausführungsgangtumoren. Das Adenokarzinom NOS ausgenommen, waren Überexpressionen bei Karzinomen des Ausführungsganges von β2-Mikroglobulin (Mukoepidermoidkarzinom bei p<0,001, Plattenepithelkarzinom bei p<0,001, Speicheldrüsengangkarzinom bei p<0,001) und LMP-2 (Mukoepidermoidkarzinom bei p<0,01, Plattenepithelkarzinom bei p<0,001, das Speicheldrüsengangkarzinom bei p<0,05) auffällig. Alle Tumore des Ausführungsganges zusammengenommen, zeigten ein erhöhtes Expressionsprofil bei TAP-1 (p<0,001) und ein erniedrigtes bei TAP-2 (p<0.001). Das onkozytäre Karzinom und das Adenokarzinom NOS hatten leicht erniedrigte Expressionen (zytoplasmatisch und nukleär) für LMP-7 (onkozytäre Carcinome mit Mittelwerten von 185,0 und 152,0; das Adenokarzinom NOS Mittelwerte von 167,5 und 187,9). Bei den Speicheldrüsengangcarcinomen und den Plattenepithelkarzinomen ließen sich ebenfalls nur schwache Färbungen für LMP-7 (Mittelwerte bei 85,4 bzw. 79,5) detektieren. Für alle 288 Speicheldrüsenkarzinome (siehe Tab. 20) waren starke Expressionen für β2-Mikroglobulin (t-Test für unabhängige Variablen bei p<0,001), Calnexin (p<0,001), LMP-2 (nukleär und zytoplasmatisch p<0,001) und TAP-1 (p<0,001) charakteristisch. Wohingegen HLA-A (p=0.001), LMP-7 (nukleär und zytoplasmatisch p<0,001), TAP-2 (p<0,001) und HC-10 (p=0,01) mit Downregulationen auffielen. Expressionen von Calreticulin, ERp-57 und Tapasin waren bezogen auf die gesamte Fallserie nicht signifikant abweichend. 88 Lässt man die Kenntnis um die Histogenese der Tumoren außer Acht und vergleicht die Punktwerte aller Normalgewebslokalisationen (Azinus, Schalt-, Streifenstück, Ausführungsgang) mit den einzelnen Punktwerten der verschiedenen Tumorentitäten, ergibt sich ein ungeordneteres Bild, wie Tabelle 20 zeigt. Das Azinuszellkarzinom weist nun stärkere Unterexpressionen auf (ERp57, LMP-7 n, TAP-2) und β2-MG wird sogar überexprimiert, ein Charakteristikum v.a. der Ausführungsgangtumore. Eine Unterexpression von Cnx kommt nun neben dem polymorphen low-grade Adenokarzinom (siehe auch Tabelle 19) beim adenoidzystischen Karzinom vor, während das vorher noch gemeinβ-MG Cnx Crt + + ACC = MYEC ERp57 HLA-A LMP-2n LMP-2z LMP-7n LMP-7z TAP-1 TAP-2 Tps HC-10 = - = + + - - + - + = - = - - = = - - = - - - = = - = - + + - - + + = - BCC = = = = - - = - - = = = = PLGC = - = = = = = = = = = = - = = = = = = = = = = = = = MEC + + = = = + + = = + = + = SDC + + = = = + + = = + = + = ADCNOS = + - = - + + - - + = = - PEC + = = = = + + - - + = + = PMMT = = - = = - = - = = = = = ALLE + + = = - + + - - + - = - ACCC Schstu.: Ststu.: OCC AG-Tu.: Tab. 20: Expressionsmuster zwischen Tumorgewebe und allen Normalgewebslokalisationen (=Gesamt) mithilfe des t-Tests für unabhängige Variablen. ALLE steht für die gesamte Fallserie (n=288). same Muster bei Tps verschwunden ist. Crt hingegen wird nur noch beim myoepithelialen Karzinom weniger gebildet, während die Unterexpressionen von LMP-7 und HC-10 beinahe vollständig bestehen bleiben. Das onkozytäre Karzinom zeigt zum Normalgewebe keine Abweichung mehr. Die Überexpressionsäulen der Ausführungsgangtumoren, bestehend aus β2-MG, LMP-2 und TAP-1 bleiben zum größten Teil vorhanden, dazu kommen noch Cnx und Tps. Die Unterexpressionen bei dem Marker LMP-7 bleiben im Wesentlichen gleich. Das klinisch unterschiedlich verlaufende Mukoepidermoidkarzinom und 89 das Speichelgangkarzinom weisen jetzt ein identisches Muster aller Marker auf. Auch die Unterexpressionen zwischen dem Adenokarzinom NOS und dem myoepithelialen Karzinom sind ähnlich. Der primäre maligne Mischtumor (Synonym: Karzinosarkom), dessen Histogenese unbekannt ist und daher nicht in Tabelle 19 aufgeführt wurde, zeigt ein Mischbild aus dem myoepithelialen Karzinom, dem Adenokarzinom NOS sowie dem Basalzelladenokarzinom (vgl. β2 MG, Cnx, Crt, ERp57, LMP-2, LMP-7 n). Weiterhin nähert sich das polymorphe low-grade Adenokarzinom dem onkozytären Karzinom an und auch die Gemeinsamkeiten zwischen dem Azinuszellkarzinom und den Ausführungsgangtumoren bleiben im Wesentlichen bestehen. Fasst man beide Tabellen noch einmal zusammen, ergibt sich meist ein individuelles Entitätenmuster, wobei hoch aggressive Tumoren wie das primäre Plattenepithelkarzinom und das Speichelgangkarzinom (Tabelle 19), aber auch das Mukoepidermoidkarzinom und das Speichelgangkarzinom (Tabelle 20) je nach Normalgewebsreferenzwerten identische immunhistochemische Eigenschaften besitzen. Darüber hinaus zeigt sich auch eine Verflechtung der Tumorarten untereinander, so dass hinsichtlich seiner Überexpressionen das Azinuszellkarzinom Gemeinsamkeiten mit den Ausführungsgangtumoren aufweist, ebenso auch Streifenstücktumore Parallelen mit Ausführungsgangtumoren. Als Zeichen eines „Immunescapes“ ist die Unterexpression zu werten, die bei mittelgradig malignem Tumoren des Schaltstückes und hoch malignen Tumoren des Ausführungsganges vorkommt und auch auf Ähnlichkeiten hindeutet. Darüber hinaus gibt es Marker, die unabhängig von der Entität Dysregulationen zeigen. LMP-7 wird in Tabelle 19 (außer beim MEC) unterexprimiert, in Tabelle 20 ist dies für mehrere Entitäten der Fall (polymorphes low-grade Adenokarzinom, onkozytäres Karzinom, Mukoepidermoidkarzinom und Speichelgangkarzinom). Unter histogenetischer Berücksichtigung kann man von einem Universalmarker sprechen, der Entitätenunabhängig unterexprimiert wird. Auch TAP-2 neigt in Tabelle 19 zu einem Verhalten der Unterexpression, währenddessen LMP-2 besonders beim Azinuszellkarzinom, dem onkozytärem Karinom und den Ausführungsgangtumoren zur Überexpression tendiert. Vergleicht man alle Tumoren zusammen gegen alle Normalgewebslokalisationen, setzt sich das Muster von TAP-2, LMP-2 und -7 fort, wobei insgesamt ein quantitativ ausgeglichenes Bild an Über- und Unterexpressionen hinsichtlich aller 90 Marker entsteht. Statistisch unbeeinflusst zumindest in Tabelle 20 sind das onkozytäre Karzinom und das polymorphe low-grade Adenokarzinom. 4.5 Prognose und Überleben aller Speicheldrüsenkarzinome Bei prognostischen Faktoren spielen sowohl einige der untersuchten immunzytochemische Marker als auch klinischen Parameter eine Rolle. 4.5.1 Überlebensanalyse anhand immunhistochemischer Eigenschaften Im Folgenden werden die aus der Kaplan-Meier-Analyse gewonnenen log-rankMantel-Cox-Werte hinsichtlich ihres immuhistochemischen Verhaltens zusammengestellt (Tab. 21), wobei entweder Unterexpressionen (↓: Werte von 0 bis 150) oder Überexpressionen (↑: Werte zwischen 151 und 300) signifikant bei p<0,05 mit einer schlechteren Prognose assoziiert sind. Dabei sind die Marker Crt, LMP-2 (n), TAP-2, ERp57 aufgrund fehlender prognostischer Relevanz nicht aufgelistet. Bei den Speichelgang-, Plattenepithelkarzinomen und den primär malignen Mischtumoren ergaben sich ebenfalls keine überlebensβ2-MG Cnx HLA-A LMP-2 z LMP-7 n LMP-7 z TAP-1 Tps HC-10 ACCC 0,024↓ 0,07 0,22 0,46 0,94 0,11 - 0,48 0,61 ACC <0,001↑ 0,29 0,15 - 0,08 0,61 - 0,003↑ 0,1 0,51 0,048↓ 0,12 0,002 ↑ 0,32 0,46 - 0,06 0,53 0,001↑ 0,16 0,007↑ <0,001↑ 0,015↓ 0,12 - 0,004↑ 0,56 OCC 0,78 0,89 0,89 0,37 0,6 - - 0,14 0,2 MEC 0,92 0,012↑ 0,014↑ 0,88 0,04↓ 0,31 0,22 0,018↑ 0,29 SDC 0,62 0,69 0,24 0,37 0,59 0,47 0,72 0,71 0,69 ADCNOS 0,21 0,16 0,002↑ 0,16 0,95 0,004↑ 0,66 0,012↑ 0,048↑ PEC 0,65 0,41 0,12 0,56 0,19 0,66 0,41 0,19 0,78 AG-Tu. 0,26 0,004↑ 0,002↑ 0,19 0,016↓ 0,71 0,11 0,01↑ 0,14 PMMT 0,86 0,22 0,22 - 0,28 0,26 - 0,86 0,54 0,024↓ 0,46 <0,001↑ 0,18 0,005↓ 0,89 0,01↑ <0,001↑ 0,07 MYEC Schs-Tu. Alle Tab. 21: Über-(↑) und Unterexpressionen (↓) gehen in der Kaplan-Meier-Analyse bei einem log-rank Wert (Mantel-Cox) von p<0,05 mit einem prognostisch signifikanten kürzerem Überlerleben einher. abhängigen Parameter. Wenn in einer Kaplan-Meier-Analyse eine Berechnung nicht möglich war, weil alle Fälle aufgrund ihrer Punktwerte in einer Gruppe la- 91 gen, ist dies entsprechend mit „ − “ markiert. Dies zeigte sich beim polymorphen low-grade Adenokarzinom, so dass auf eine Ausführung verzichtet wird. Bei der Fallserie des Basalzelladenokarzinoms konnte keine Berechnung durchgeführt werden, weil kein Patient innerhalb des Beobachtungszeitraumes verstarb. Die Azinuszellkarzinome gehen trotz nur zwei unzensierte Ereignisse bei einer Unterexpression von β2-Mikroglobulin (p=0,024) mit einer schlechteren Prognose einher. Gegensätzlich zeigen dies die adenoidzystischen Karzinome bei einer Unterexpression (p<0,001), ebenso korreliert eine Überexpression von Tapasin (p=0.003) mit einer kürzeren Überlebenszeit. Das myoepitheliale Karzinom weist eine schlechtere Prognose bei einer Unterexpression von Calnexin (p=0,048) und einer Überexpression von LMP-2 (zytoplasmatische Auswertung p=0,002) auf. Betrachtet man alle Tumoren, die histogenetisch aus dem Schaltstück entstehen (adenoidzystische Karzinome, polymorphe low-grade Adenokarzinome, myoepitheliale Karzinome epithelialmyoepitheliale Karzinome, Basalzelladenokarzinome), ergeben sich Assoziationen mit einem schlechteren Überleben bei Überexpressionen von β2-Mikroglobulin (p<0,001), HLA-A (p=0,007), LMP-2 zytoplasmatisch (p<0,001), Tapasin (p<0,004) und Unterexpressionen von LMP-7 in der nukleären Auswertung (p=0,015). Die Streifenstücktumoren, bestehend aus den onkozytären Karzinomen, stehen in keinem Zusammenhang mit immunhistochemischen Prognosefaktoren, hierfür wäre die Fallzahl auch zu gering. Beim Mukoepidermoidkarzinom ist eine Überexpression von Calnexin (p=0.012), HLA-A (p=0.014) und Tapasin (p=0,018) und eine Unterexpression von LMP-7 nukleär (p=0,04) mit einer geringeren Überlebenswahrscheinlichkeit assoziiert. Beim Adenokarzinom NOS besteht neben den prognostisch relevanten Expressionen (HLA-A, HC-10, LMP-7 z und Tps) eine Parallele zwischen den Tumoren des Schaltstückes hinsichtlich HLA-A und Tapasin. Bei den Ausführungsgangtumoren ergeben sich somit signifikante Überlebensunterschiede hinsichtlich Calnexin (p=0,004), HLA-A (p=0,002), LMP-7 nukleär (p=0,016) und Tapasin (p=0,01). Betrachtet man alle Tumoren gemeinsam, so gehen Unterexpressionen von LMP-7 nukleär (p=0,005) sowie von β2-Mikroglobulin (p=0,024) und Überexpressionen von HLA-A (p<0,001), TAP-1 (p=0,01) und Tapasin (p<0,001) mit prognostisch signifikanten Ergebnissen einher. Dies wird in den folgenden Grafiken verdeutlicht. 92 β2-Mikroglobulin TAP-1 Unterexpression (n=179) Unterexpression (n=272) Überexpression (n=106) p=0,024 HLA-A Überexpression (n=13) p=0,01 Tapasin Unterexpression (n=110) Unterexpression (n=158) Überexpression (n=124) Überexpression (n=174) p<0,001 LMP-7 (nukleär) Überexpression (n=86) Unterexpression (n=198) p=0,005 p<0,001 93 4.5.2 Einbeziehen klinischer Parameter Tabelle 22 fasst klinische Parameter unter Berücksichtigung der einzelnen Tumorentitäten unter prognostischen Aspekten zusammen (Kaplan-MeierAnalyse, signifikante Werte ergeben sich bei einem Mantel-Cox-Wert von p<0,05). Abschließend werden auch die Tumoren (ALLE) gemeinsam aufgeführt. Typ ACCC ACC MEC SDA ADC NOS PEC MYEC PLGAC PMMT OCC ALLE Alter p= 0,54 0,023 a <0,001 Geschlecht Lokalisation p= p= 0,022 0,66 0,52 0,81 0,21 0,22 c 0,003 0,66 c 0,027 0,17 0,46 0,18 0,53 0,32 0,11 0,39 0,86 0,22 0,58 0,09 0,29 a 0,015 0,27 0,49 0,68 0,54 0,11 <0,001 a 0,002 b 0,005 c Seite p= 0,34 d 0,058 0,57 0,88 0,99 d 0,032 0,24 0,53 0,45 0,038 d pT-Stadium p= 0,19 0,81 e 0,001 0,91 0,67 0,46 0,07 0,48 0,22 e 0,02 e 0,001 pN-Stadium p= 0,62 f <0,001 0,049 0,69 f 0,006 f 0,025 0,28 0,56 0,16 0,25 f <0,001 UICC-Stadium p= 0,32 0,086 0,17 0,68 g 0,046 0,17 0,21 0,13 g 0,05 g <0,001 a) Alter ≤60 Jahre versus Alter >60 Jahre: Alter >60 Jahre zeigt eine schlechtere Prognose. b) Männer versus Frauen: Männer haben eine schlechtere Prognose als Frauen. c) Bessere Prognose> schlechtere Prognose : Kleine SD > Gl. submandibularis > Gl. Parotis d) Rechte Seite hat eine schlechtere Prognose als die linke Seite (bezogen auf die großen SD). e) pT1/2 versus pT3/4: pT3/4- Stadien haben eine schlechtere Prognose. f) pN0 versus pN2/3: pN2/3- Stadien haben eine schlechtere Prognose. g) Stadium1/2 versus 3/4: Stadien 3/4 haben eine schlechtere Prognose. Typ ACCC ACC MEC SDA ADC NOS PEC MYEC PLGAC PMMT OCC ALLE Grading p= 0,45 0,1 h <0,001 0,57 0,17 0,26 h 0,006 0,69 h <0,001 Metastase p= 0,54 i <0,001 0,71 0,081 i 0,014 0,12 i 0,008 i 0,014 0,93 i <0,001 Residuum p= 0,61 0,132 <0,001 0,16 <0,001 0,047 <0,001 0,68 0,17 0,41 <0,001 j h) Grad 1 versus Grad 2/3: Grade 2/3 haben eine schlechtere Prognose. i) Eingetretenes Ereignis geht mit einer schlechteren Prognose einher. j) R0 verus R1/2: R1/2 geht mit einer schlechteren Prognose einher. Tab. 22: p-Werte (Mantel-Cox) aus der Kaplan-Meier-Analyse hinsichtlich klinischer Daten. Hinsichtlich des Alters wurden zwei Gruppen gebildet, zum einen die bis zu 60 Jahren und zum anderen eine Gruppe der über 60-jährigen. Patienten, die zu der zweiten Gruppe gehören, zeigen erwartungsgemäß eine geringere Überlebenswahrscheinlichkeit beim Mukoepidermoidkarzinom, beim Adenokarzinom 94 95 NOS und auch bei allen Tumorentitäten zusammengerechnet. In anderen Analysen mit follow-up Daten von 127 und 565 Patienten ist das Alter ebenfalls ein prognostischer Überlebensfaktor [34, 285], da perse höheres Lebensalter an einer stärkere Sterbewahrscheinlichkeit gekoppelt ist, muss dieser Parameter jedoch in einer Überlebensanalyse kritisch gesehen werden. Während das Geschlecht innerhalb der einzelnen Entitäten (außer beim ACCC) keine signifikante Disposition offenbart, liegt diese bei den 288 Fällen insgesamt vor: Männer haben dabei eine niedrigere Lebenserwartung als Frauen [vgl. 34, 285]. Bei der Lokalisation des Tumors besteht bei den Speichelgangkarzinomen, den Adenokarzinomen NOS und auch allen Entitäten zusammen die kürzeste Überlebenszeit, wenn das Malignom in der Gl. parotis lokalisiert ist. Weiterhin bedingt statistisch die rechte Seite beim primären Plattenepithelkarzinom, dem adenoidzystischen Karzinom sowie allen Tumorentitäten eine schlechtere Prognose bei einer Lokalisation in den großen Speicheldrüsen. Das pT-Stadium (MEC, OCC zusammen mit RC) und das pN-Stadium (ACC, ADC NOS, PEC, alle Tumorentitäten) sowie das UICC-Stadium (ADC NOS, alle Tumorarten) sind signifikante prognostische Größen, wobei ein höheres pT-/pN-/UICC-Stadium mit einem schnelleren Todeseintritt vergesellschaftet ist. Der Tumorgrad ist ebenfalls ein signifikanter Faktor bei den Mukoepidermoid- sowie myoepithelialen Karzinomen und allen Tumorentitäten zusammen, so dass ein G2- und G3-Status eine niedrigere Überlebenswahrscheinlichkeit bedingt. Metastasenbildungen (ACC, ADC NOS, MYEC, PLGC, alle Tumorfälle) brachten ebenfalls signifikante Ergebnisse: Ein Vorkommen zeigte eine niedrigere Überlebenswahrscheinlichkeit. Eine Resektion im Gesunden im Vergleich zu einem R1- oder R2-Status resultierte in einem längeren Überleben (p<0.001). Hingegen konnte eine durchgeführte Strahlentherapie bei allen Tumoren eine prognostische Verbesserung nicht zeigen. Sie ist sogar Indikator für eine schlechtere Prognose, was an einem Confoundingeffekt liegen könnte, da diese Therapieform bei Tumoren aggressiveren Verhaltens zur Anwendung kommt und auch Patienten mit einem R1-, N1-, oder M1-Status bestrahlt werden, ist dieses Ergebnis nicht zu verwerten. Daneben ist auch die pathologisch diagnostizierte Karzinomart von entscheidender Bedeutung, so dass Tumoren wie das Plattenepithelkarzinom, das Speichelgangkarzinom und das Adenokarzinom NOS eine ungünstige Prognose bedeuten. Daran schließen sich das myoepitheliale, das adenoidzystische und das Adenokarzinom NOS an. Die beste Prognose hat das 96 Azinuszellkarzinom, gefolgt vom Mukoepidermoidkarzinom. Das polymorphe low-grade Adenokarzinom und auch das myoepitheliale Karzinom wurden in nachfolgender Grafik trotz statistisch signifikanter Fallzahl nicht aufgeführt, da die Beobachtungszeitspanne zu kurz war. 4.5.3 Immunhistochemische und klinische Faktoren als gemeinsame Parameter der Überlebenszeit Während unter 4.5.1 und 4.5.2 einzelne Variablen hinsichtlich eines Prognoseunterschieds betrachtet wurden, soll nun mit einem rückwärts bedingten CoxRegressionsmodell (Ausschluss des am wenigsten signifikanten Faktors mit p<0,10, Signifikanzniveau p≤0,05) auf mehrere Variablen hinsichtlich ihres gemeinsamen Überlebenseinflusses eingegangen werden. Ebenso wird die Wirkung auf das relative Risiko (Hazard-Ratio) bezüglich einer erhöhten Sterblichkeit analysiert. Univariat a Grad b pT pN pM b2-MG c HLA-A d Lmp7 n Lmp 7 c Tap-1 c Tapasin HC-10 <0.001 <0.001 <0.001 <0.001 0.038 <0.001 <0.001 0.89 0.018 <0.001 0.07 Multivariat step 1 step 2 <0.001 <0.001 0.088 0.088 0.295 0.015 0.07 0.96 0.02 0.02 0.038 0.036 0.81 0.82 0.308 0.045 0.041 0.60 0.60 step 3 <0.001 0.08 0.015 0.02 0.035 0.32 0.60 step 4 <0.001 0.06 0.015 0.02 0.033 0.024 - Hazard 4.1 1.5 1.3 2.0 1.0 2.0 0.6 0.9 1.5 1.7 0.9 95% KI 1.94-8.70 0.95-2.26 0.81-1.98 1.14-3.33 0.56-1.53 1.08-3.52 0.35-0.97 0.55-1.59 0.68-3.33 1.01-2.86 0.54-1.43 a) Grad 3/4 korreliert mit einem schlechteren Überleben. b) pT3/4 korreliert mit einem schlechteren Überleben. c) Eine hohe Expression zeigt ein schlechteres Überleben. d) Eine niedrigere Expression zeigt ein schlechteres Überleben. Tab. 23: Univariate und multivariate Analyse klinischer und immunhistochemischer Parameter. Die p-Werte der univariaten Analyse entsprechen denen der Kaplan-MeierBerechnung (siehe Tab. 21, 22). Die multivariate Cox-Regression hingegen verdeutlicht, dass Tumorgrad 2/3 (RR 4,1), eine Metastasenbildung (RR 2,0) sowie eine Überexpression von HLA-A (RR 2,0) und Tapasin (RR 1,7) negativ prognostische Faktoren darstellen, eine Überexpression von LMP-7 nukleär betrachet ist als prädiktiver Überlebensfaktor zu werten (RR 0.6). 97 5. Diskussion 5.1 Methodik und Material Die verschiedenen Subtypisierungen der Speicheldrüsenkarzinome und auch die niedrigen Inzidenzwerte (0,4-2,6 pro 100.000) haben zur Folge, dass statistische Auswertungen entweder bei einem geringen Fallkollektiv nur bedingte Aussagekraft besitzen oder dass große Gesamtkollektive sich in ihren Ergebnissen auf eine inhomogene Tumorgruppe beziehen [75]. Daher wurde in dieser Arbeit versucht, zunächst die einzelnen Entitäten darzustellen und auszuwerten, um im Anschluss auf das Gesamtkollektiv (288 Fälle) bezüglich klinischer, immunhistochemischer und prognostischer Aspekte einzugehen. Es wurde weiterhin bei einzelnen Tumoren mit nur geringer Fallzahl (undifferenziertes Karzinom, epithelial-myoepitheliales Karzinom, Zystadenokarzinom, kleinzelliges Karzinom) auf eine statistische Analyse verzichtet, wobei in der Analyse des Gesamtkollektivs diese mitberücksichtigt wurden. Dadurch wird die statistische Aussagekraft in dieser Arbeit zwar gesteigert, lässt aber in dieser Betrachtung spezielle Eigenschaften einzelner Entitäten außer Acht. Um einen Vergleich zwischen Normal- und Tumorgewebe anhand der 11 untersuchten Marker vornehmen zu können, wurde der t-Test für unabhängige Variablen angewendet. Dies lässt sich dadurch begründen, dass bei einer im Histogramm beobachteten Normalverteilung, die sich auch in Tests nach Kolmogorow-Smirnow bestätigte, gesundes und tumorinfiltrative Gewebe auf Objektträgern ohne Probleme identifiziert werden konnten. Obwohl das Normalgewebe aus Fällen erkrankter Patienten gewonnen wurde, war dieses aus pathohistologischer Sicht als eindeutig tumorfrei und somit als statistisch unabhängig zu bezeichnen. Das große Spektrum der Speicheldrüsenkarzinome (derzeit 24) stellt daneben eine große Herausforderung für den Pathologen in der Befundung dar, so dass immunhistochemische Zusatzuntersuchungen den Entscheidungsprozess unterstützen und letztlich Basis einer prognostischen Einschätzung für den Patienten sind [77]. Diese Färbemethode ist zum einen relativ kostengünstig, kann an laborüblichen Lichtmikroskopen ausgewertet werden und hat in Pathologischen Instituten in der der Routinediagnostik schon längst Eingang gefunden. Nachteilig hingegen ist, dass in kleineren Häusern nur immunhistochemische Standardfärbungen 98 verfügbar sind und dass die unterschiedliche Sensitivität bzw. Spezifität auch zu falsch positiven oder negativen Werten führen kann, was durch standardisierte Verfahren und Mitführen von Positiv- sowie Negativkontrollen umgangen werden soll. Das subjektive Scoringsystem bei immunhistochemischen Auswertungen stellt weiterhin ein derzeit kaum lösbares Problem dar, wobei durch eine Doppeleinsicht mit Kontrolle der Punktewerte diese Fehlerquelle dezimiert werden sollte. Eine Verwendung von speziellen Computerprogrammen hätte in dieser Arbeit zu Problemen bei einer Identifikation von Tumorzellen geführt. Auch eine Bestimmung nach nukleären, membranösen oder zytoplasmatischen Aspekten kann von diesen Programmen derzeit nicht valide beurteilt werden. Bei der angewendeten Färbetechnik wurde in einer direkten Methode auf eine spezielle Peroxidase zurückgegriffen (Horseradish Peroxidase), die sich an einem mit Polymeren versehenen primären Antikörper befand. Dadurch werden Hintergrundfärbungen wie bei der Verwendung von Biotin vermieden und sind oft auch sensitiver und schneller als dies für die LSAB-Methode (=Labelled Strept-Avidin-Biotin) der Fall ist. Weiterhin enthalten die Polymere sehr viel Enzym, so dass eine verstärkte Anfärbung erreicht wird, wobei die Größe dieser Polymere aufgrund sterischer Behinderungen bedingt, dass diese ihren Bindungsort manchmal nicht erreichen können und dann zu falsch negativen Ergebnissen führen. Bei den verwendeten Antikörpern HC-10, β2-Mikroglobulin, LMP-2, LMP-7, TAP-1, TAP-2, Tapasin, Calnexin, Calreticulin, ERp-57, HLA-A handelte es sich um hochspezifische IgG1-Proteine, bei HC-10 um ein IgG2Molekül. Dabei wurden bewusst keine murinen Antikörper W6/32 wie in anderen Studien verwendet [37, 143, 176, 250, 251, 294], da diese den HC/β2Mikroglobulin-Komplex nur an gefrorenem Gewebe detektieren können. Somit ist ersichtlich, warum diese Studien vermehrt, möglicherweise von falsch negativen Unterexpressionen, hinsichtlich des Antigen präsentierenden MHCKlasse-I-Komplexes sprechen. Zu kritisieren an der immunhistochemischen Methode ist jedoch, das funktionelle Zusammenhänge außer Acht gelassen werden können, in dem Antikörper an teils mutierte Proteine trotzdem noch binden können, jedoch keine Auskunft über deren Intaktsein/Funktionieren geben. In der retrospektiven Datenerhebung konnten Daten durch pathologische Befunde oder durch Krankenhausakten sowie durch Mithilfe von Hausärzten, Tumorzentren, Einwohnermeldeämtern, Betroffenen oder deren Angehörige zusammengestellt werden. Eine Befragung der Patienten oder der Hinterbliebe- 99 nen kann jedoch zu einer Recall-Bias führen und letztlich zu einer falschen Datensammlung beitragen. Auch Confoundereffekte lassen sich in einer retrospektiven Analyse nur schwierig identifizieren. Kausalzusammenhänge sollten weiterhin nicht aus diesen Studien abgeleitet werden. Vorteilig ist jedoch, dass für diese Arbeit auf in Paraffin eingebettetes Gewebe nach operativer Therapie mit anschließender Diagnose und therapeutischer Konsequenz zurückgegriffen werden konnte. Dies hatte somit keinen negativen Einfluss auf den Patienten. 5.2 Deskriptive Analyse Das adenoidzystische Karzinom (17,3 %), das Mukoepidermoidkarzinom (14,9 %), das Azinuszellkarzinom (13,8 %), das Adenokarzinom NOS (12,5 %), das Speichelgangkarzinom (11,5 %) und das polymorphe low-grade Adenokarzinom (4,5 %) wiesen mit ihren Häufigkeiten in der eigenen Fallserie ähnliche Frequenzen, wie von der WHO (2005) und dem Armed Forced Institute of Pathology (=AFIP) beschrieben, auf [9, 10, 31, 64, 67, 71, 264]. Zwar wird das Mukoepidermoidkarzinom in der Literatur meist als häufigstes Speicheldrüsenkarzinom genannt, dicht gefolgt vom Adenokarzinom NOS, jedoch zählen das adenoidzystische sowie das Azinuszellkarzinom ebenfalls zu den vierthäufigsten [64, 264]. Das Plattenepithelkarzinom (8,6 %) befindet sich hingegen über den von der WHO angegebenen Werten mit 1-5 % [159]. Mit der Häufigkeit des Hamburger Speicheldrüsenregisters (6-14 %) ist der Wert konform [57]. Dies deutet insgesamt auf die weltweit unterschiedliche Verteilung und auf uneinheitliche Angaben hin, weiterhin werden auch neue Entitäten eingeführt und machen einen Vergleich zwischen älteren und neueren Registern bei ausbleibender Neubefundung schwierig. Auch das myoepitheliale Karzinom (6,3 %) ist zu den in der Literatur beschriebenen Häufigkeiten mit weniger als 2 % erhöht [260]. Größere und aktuellere Studien sprechen daher auch von einer stärkeren Beteiligung als bislang angenommen wurde [238, 258]. Im eigenen Kollektiv entsprechen die Werte der befallenen Gl. Parotis (69,9 %), der kleinen Speicheldrüsen (15,22 %), der Gl. submandibularis (14,5 %) und der Gl. sublingualis (0,35 %) den Angaben der WHO und des AFIP [78], die Gl. submandibularis soll etwas weniger mit 7-11 % beteiligt sein. Auch der Gipfel von Speicheldrüsenkarzinomen zwischen dem 6. und 7. Lebensdekade deckt sich mit Literaturangaben, lediglich der Mittelwert des Erkrankungsalters liegt mit 60,7 Jahren weit über diesem Wert (46,5) [77]. Dies 100 lässt sich durch den quantitativen Einfluss des Adenokarzinoms NOS, des Speichelgangkarzinoms, des Plattenepithelkarzinoms, des Azinuszellkarzinoms, des myoepithelialen Karzinoms und des polymorphen low-grade Adenokarzinoms erklären, da diese Entitäten einen höheren Mittelwert des Erkrankungsalters aufweisen [10, 31, 71, 159, 170, 258]. Auch eine leichte weibliche Disposition von 52,1 % deckt sich mit den in der Literatur beobachteten Angaben, so dass zusammenfassend hinsichtlich der Tumor-, der Lokalisations-, der Alters- und Geschlechtsverteilung in der vorliegenden Serie von einem repräsentativen Patientengut gesprochen werden kann [57]. 5.3 Pathologische Parameter Die UICC-Stadien waren wie folgt verteilt: Stadium 1 wurde in 23,3 % diagnostiziert, 28 % waren auf das Azinuszell- und 24 % davon auf das Mukoepidermoidkarzinom zurückzuführen. Dies mag dadurch begründet sein, dass das Azinuszellkarzinom und das klassische Mukoepidermoidkarzinom durch ein langsameres Tumorwachstum auffallen. Stadium 2 ergab sich in 21,5 %, dabei machte das Mukoepidermoidkarzinom immerhin noch 21 %, das adenoidzystische Karzinom 18 % aus. Stadium 3 (21,8 %) zeigte wie Stadium 4 (32,9 %) eine vorwiegende Beteiligung des Adenokarzinoms NOS (17,5 % bzw. 29 %) und des adenoidzystischen Karzinoms (16 %), hier v.a. der soliden Variante. Im höchsten Stadium (4) war mit 17 % auch das Speichelgangkarzinom stark beteiligt. Bei zwei (0,5 %) Fällen konnte trotz Lesen der pathologischen Befunde weder eine Stadiumeinteilung gefunden, noch wegen fehlender Informationen nachträglich vergeben werden. Die Verteilung auf die UICC-Stadien verdeutlicht das aggressive Wachstumsverhalten des Adenokarzinoms NOS, des Speichelgangkarzinoms, des Plattenepithelkarzinoms und des adenoidzystischen Karzinoms. Dabei scheint das UICC-Stadium laut WHO bei allen Speicheldrüsenkarzinomen der entscheidende prognostische Faktor zu sein [64]. Die cervikale Lymphknotenbeteiligung lag bei 29,9 % über anderen Literaturangaben (14-28 %) [57, 64, 78]. Davon machen das Adenokarzinom NOS mit 30 % und das Speichelgangkarzinom mit 28 % den größten Anteil aus und drücken somit das starke lymphogene Wachstumsverhalten aus, welches auch in anderen Arbeiten beschrieben wurde [57, 265]. Hinsichtlich der Fernmetastasierung (11,1 %) stellt wiederum das Adenokarzinom NOS den größten Anteil 101 (28 %), gefolgt vom Speichelgangkarzinom (16 %), was u.a. auch für ihr hämatogenes Metastasierungspotential spricht. Die Graduierung folgte dem von Jouzdani et al. [142] vorgeschlagenem Schema: Das Azinuszellkarzinom, das Basalzellkarzinom das Zystadenocarcinom, das polymorphe low-grade Karzinom erhielten G1, Ausnahme war die dedifferenzierten Variante, der Grad 3 zugeordnet wurde. Für die aggressiveren Tumore wie das Speichelgangkarzinom, das Adenokarzinom NOS, das Plattenepithelkarzinom, das onkozytäre Karzinom sowie das undifferenzierte Karzinom wurde G3 vergeben. Analog der WHO-Klassifikation (siehe Tabelle 1, S. 31) wurde das Mukoepidermoidkarzinom in 3 Grade eingeteilt. Das adenoidzystische Karzinom wurde seiner Morphologie entsprechend mit G2 (tubulärcribriform) bzw. G3 (solide Variante) versehen. 5.4 Klinische Parameter Zur Rezidivbildung kam es bei insgesamt 24,8 %. Dies liegt in dem Intervall von anderen Studien, die Werte zwischen 20-43 % angeben [122, 161]. Davon machten das adenoidzystische Karzinom und das Adenokarzinom NOS je 21 % aus. Dies zeigt, dass adenoidzystische Karzinome aufgrund ihrer perineuralen und Adenokarzinome NOS wegen ihres aggressiven, grenzenüberschreitenden Wachstumsverhaltens eine große Herausforderung für eine kurative Therapie darstellen. Die adjuvante Bestrahlung wurde, in Anbetracht möglicher lokaler Mikrometastasen bei 58,1 % der Patienten durchgeführt und kommt somit der Forderung einer größeren Studie von 498 Patienten nach, die bei dieser Therapie eine bessere lokale Tumorkontrolle beobachtete [285]. Mit einer Chemotherapie wurde −trotz einer bislang noch spärlich belegten Überlebensverbesserung− immerhin in 17,6 % therapiert, jedoch vorwiegend in einem palliativen Ansatz. 5.5 Immunexpressionsprofil Wie auch in anderen Studien untersucht wurde [37, 143, 176, 249, 250, 251, 294], spielt bei verschiedenen Tumoren die MHC-Klasse-I-Proteinmaschinerie eine wichtige Rolle. Dabei werden aberrante Expressionsmuster mit klinischen Parametern verglichen: Malignome wie z.B. das Mammakarzinom, das Cervixund Endometriumkarzinom, das Hodgkin-Lymphom, das maligne Melanom, das 102 Prostatakarzinomen, das Nierenzellkarzinom, das Urothelkarzinom der Blase sowie das Plattenepithelkarzinomen der Kopf und Halsregion [142, 176, 250, 251] weisen bei einem aberranten Expressionsverhalten eine Assoziation mit einem Fortschreiten der Erkrankung, einer Frührezidivbildung oder einem hohem Tumorgrad auf. In Abhängigkeit verschiedener Tumortypen wirken sich dabei Unter- und auch Überexpressionen unterschiedlich auf klinische Faktoren aus: Beobachten einige Autoren eine Unterexpression von HLA-A und anderen Antigen präsentierenden Komponenten bei invasiven Tumoren und hochgradigen intraepithelialen Neoplasien des Kolons [5], deuten Färbungen von HLA-A, -B, -C in Kolonkarzinomen sowie Normalgewebe auf eine Variabilität des Färbeverhaltens hin, das sich in Unter- aber auch Überexpressionen äußert. Diese Tumoren verhalten sich somit bezüglich dieses unterschiedlichen Expressionsverhaltens ähnlich wie ihre benignen Vorläufer, charakterisiert durch eine Aufund Abregulation der MHC-Klasse-I präsentierenden Moleküle. Eine Abweichung der Tumore vom Normalgewebe, sowohl bei Über- als auch bei Unterexpressionen von HLA-A, war mit einem schlechteren Gesamtüberleben assoziiert [20]. Atkins et al. [5] stellte eine Korrelation in Kolontumoren zwischen molekularen Abweichungen und K-RAS-Mutationen her, letzteres wird als bekannter negativer Prognosefaktor in Kolonkarzinomen gesehen. Menon et al. [178] stellt eine Korrelation zwischen unterexprimierten HLA-A und einem längeren Überleben bei Kolontumoren her, weiterhin ein kürzeres Überleben bei einer CD-8+ T-Zellinfiltration bei gleichzeitiger Expression von HLA-A/-B/-C (je p=0,04). Das Vorkommen von CD 57+ Natürlichen Killerzellen, die Tumorzellen unabhängig von ihrer Oberflächenpräsentation erkennen können, stellt er dagegen als positiven prognostischen Faktor dar. Eine Assoziation mit einem besseren Überleben bei HLA-Klasse-I downregulierten Proteinen an Tumorzellen, die durch Natürliche Killerzellen eliminiert werden, könnten somit eine geringere Aggressivität der Tumorzellen und dadurch einen Überlebensvorteil implizieren. In Ösophaguskarzinomen ist eine erniedrigte Expression von HC mit einem kürzeren Überleben vergesellschaftet, wohingegen starke Expressionen bei TAP-1 und β2-Mikroblobulin bei diesen Tumoren vermehrt festgestellt wurden [282]. TAP-1 wurde hier sogar als unabhängiger, negativ prognostischer Faktor dargestellt (p=0.015). 103 In Prostatakarzinomen wird eine Unterexpression der Antigen präsentierenden Maschinerie häufig beobachtet, Seliger et al. [251] sieht in einer Unterexpression von Calnexin eine Assoziation zwischen einem Krankheitsprogress sowie einer Metastasenbildung, eine andere Studie [132] konnte dies für eine Überexpression von β2-Mikroblobulin nachweisen. An den Beispielen des Prostata-, Ösophagus- und Kolonkarzinoms soll gezeigt werden, dass die Aggressivität und die Progression eines Tumors nicht zwangsläufig auf der Theorie des „immune escapes“ sowie dessen Herunterregulation der Antigen präsentierenden Maschinerie zurückzuführen ist. Andere immunologische und nicht immunologische Faktoren üben einen wesentlichen Einfluss auf den Krankheitsverlauf aus. Berücksichtigt werden muss bei der Betrachtung des abberranten Expressionsverhaltens letztlich auch, dass es einen Unterschied macht, ob eine MHCKlasse-I-Degradierung bereits bei der Peptidbildung stattfindet (Proteasomenuntereinheiten: LMP-2 und -7), während des Peptidtransports (TAP-1 und -2) bzw. während des Beladungsvorganges (Calnexin, Calreticulin, ERp-57) oder Stabilisatoren betrifft (Tapasin); Forschungen am Herpes simplex Virus, welches den Transporter TAP hemmen, zeigten, dass diese Blockierung zu einem kompletten Funktionsverlust der Oberflächenpräsentation führt, bei spätereren Fehlern des MHC-Klasse-I-Weges hingegen wurde nur eine verminderte Präsentation erreicht [37, 192, 215]. Eine komplett fehlende Expression ist somit von einer frühen Dysregulation abhängig. Da die Histogenese der Speicheldrüsenkarzinome der allgemein anerkannten bizellulären Theorie folgt [1,75], wurden die verschiedenen Entitäten entsprechend ihrer Entstehungslokalisation zugeordnet und hinsichtlich ihrer Antigen präsentierenden Moleküle ausgewertet. In der Gesamtbetrachtung (Tab. 19) ist auffällig, dass die Tumore, die aus Vorläuferzellen des Schaltstückes entstehen, zahlreiche Unterexpressionen (Cnx, Crt, HLA-A, LMP-2n, LMP-z und -n, TAP-2, Tapasin, HC-10) haben. Auch die Ausführungsgangtumore zeigen hinsichtlich LMP-7 und TAP-2 eine Unterexpression, ausgenommen hiervon ist das Mukoepidermoidkarzinom, das klinisch im Gegensatz zu seinen Gruppenpartnern milder verläuft. Vergleicht man hiermit das Azinuszellkarzinom, treten die genannten Unterexpression deutlich auf. Dabei könnte es sich um einen Immunescapemechanismus handeln, dazu würde auch der klinisch bessere Verlauf passen, Überexpression von Calnexin, TAP-2 und Tapasin charakteri- 104 sieren ein spezifisches Profil. Nach der modifizierten bizellulären Theorie ist anzumerken, dass man sich hinsichtlich des Ursprungs des Azinuszellkarzinoms uneinig ist, ob die Tumorvorläuferzellen einen Ursprung aus den Azini oder den Schaltstücken besitzen, dies ist vermutlich von den unterschiedlichen Subtypen abhängig [242], weswegen unter 5.3.1 beide Referenzpunkte aufgeführt sind. Daneben gibt es auch Marker wie LMP-7 und TAP-2, die besonders durch ihre Unterexpressionen gruppenüberschreitend auftreten. An dieser Stelle wäre ein Vergleich zu gutartigen Speicheldrüsentumoren als möglicher Malignitätsmarker interessant − dies muss weiteren Studien vorbehalten bleiben. Warum jedoch Schaltstücktumore mehr Unterexpressionen aufweisen als die klinisch meist aggressiveren Ausführungsgangtumore spricht gegen eine Korrelation zwischen Unterexpression und klinischem Verhalten. Wirft man einen Blick in die einzelnen Gruppen (Tumore der Azini, der Schalt-, Streifenstücke und der Ausführungsgänge) haben aggressive Tumore wie das Plattenepithelkarzinom und das Speichelgangkarzinom sogar dasselbe Expressionsmuster: Parallelen dieser beiden Entitäten zeigen sich schließlich auch im Überleben (Abb. 22). Hinsichtlich der Überexpressionen bestehen Verflechtungen zwischen den drei Tumorgruppen (LMP-2, TAP-1), trotzdem weist beinahe jede einzelne Entität ein spezifisches molekulares Expressionsprofil auf. 5.6 Überleben und Prognose 5.6.1 Kaplan-Meier-Analyse Das 5-Jahresüberleben aller Speicheldrüsenkarzinome liegt in der Fallserie bei 60 %, das 10-Jahresüberleben bei 50 %. Dies ist mit Ergebnissen anderer größerer Studien identisch [34, 122, 264, 285]. Dabei ist die Tumorentität jedoch entscheidend, da das 5-Jahresüberleben beim Azinuszellkarzinom 90 %, beim primären Plattenepithelkarzinom jedoch nur 35 % beträgt. Auch bei der Betrachtung des 10-Jahresüberlebens ändert sich dieser Wert hinsichtlich des Azinuszellkarzinoms nicht, während das Speichelgangkarzinom, das Plattenepithelkarzinom und das Adenokarzinom NOS Werte von 0 %/ 19 %/ 50 % haben. Dabei zeigt sich, dass das Speichelgangkarzinom eine schlechtere Prognose aufweist, als in der Literatur beschrieben wird, wohingegen der Wert des Plattenepithelkarzinoms mit anderen aus der Literatur übereinstimmt [111, 158]. Das Adenokarzinom NOS hat dagegen eine deutlich bessere Prognose, als 105 dies bislang in der Literatur beschrieben worden ist (zwischen 3-50 %) [8]. Eine gradabhängige Betrachtung wird jedoch aus diesem Grund von einigen Autoren empfohlen, da dieser neben der Tumorklassifizerung ausschlaggebend für das Überleben ist [34, 264, 285], da diese Entität meist mit einer undifferenzierten Graduierung assoziiert ist, kann dieser Forderung jedoch nur selten nachgekommen werden. Klinische Faktoren, die am stärksten mit dem Überleben negativ korrelieren, sind in der Auswertung v.a. hohes Alter, hohes pT-pN- und UICC-Stadium, hoher Malignitätsgrad, Metastasenbildung sowie ein Residualtumor R1/R2 (p≤0,001). Dies stimmt auch mit anderen Studien überein [34, 78, 285]. Von der WHO wird das Tumorstadium als stärkster prognostischer Faktor genannt, andere Studien dagegen postulieren Tumorgrad, pT-Stadium oder Alter [34, 78, 285]. Dies zeigt die bislang uneinheitliche Datenlage, was sicherlich an dem heterogenen Spektrum, der regional unterschiedlichen Häufigkeiten, aber auch an Studien mit nur kleinen Fallkollektiven liegt. In der eigenen Arbeit konnten darüber hinaus Assoziationen mit einem kürzeren Überleben bei einer Lokalisation in der Gl. parotis (p=0,005), bei männlichem Geschlecht (p=0,006) und bei Auftreten an der rechte Seiten (bezüglich der großen Speicheldrüsen mit p=0,03) beobachtet werden (Tab. 22). Diese prognostische Seitenabhängigkeit ist erstaunlicher Weise auch in anderen Studien beschrieben, ohne jedoch eine Ursache benennen zu können [34, 122, 264, 285]. Die Bestrahlung (p=0,028) führte zu einem signifikant geringeren Überleben, da diese jedoch ohnehin bei aggressiveren Tumoren angewendet wird, liegt hier wahrscheinlich ein sogenannter Confoundingeffekt vor. Auch die Expression immunhistochemischer Marker geht mit signifikanten Prognoseunterschieden einher. Unterexpressionen von nukleärem LMP-7 (p=0,005) und Überexpressionen von β2-Mikroglobulin (p=0,028), HLA-A, Tps (mit je p<0,001) und TAP-1 (p=0,016) zeigen eine Korrelation mit einem kürzeren Überleben. Ähnlichkeiten gibt es demnach bei Ösophaguskarzinomen in einer Studie [178], eine Überexpression von TAP-1 stellt einen negativ prognostischer Faktor (p=0.015) dar, auch Überregulationen von β2-Mikroglobulin sind mit einem kürzeren Überleben assoziiert. Weiterhin ging eine Minderexpression von Calnexin in Prostatakarzinomen mit einem aggressiveren Krankheitsverlauf und einer 106 verstärkte Metastasenbildung einher [251], zuselben Ergebnis kam eine andere Studie wiederum bei einer Überexpression von β2-Mikroglobulin [132]. In der eigenen Fallserie gibt es jedoch auch hoch aggressive Tumoren wie das Plattenepithel-, Speichelgangkarzinom oder der primäre maligne Mischtumor. Hinsichtlich des MHC-I-Weges besitzen diese keine immunhistochemischen Prognosefaktoren. Diese verlaufen demnach sowohl bei einer vermehrten oder erniedrigten Expression prognostisch gleich schlecht. 5.6.2 Cox-Regressionsanalyse Die multivariate Analyse zeigt, dass sowohl klinische als auch immunhistochemische Variablen das relative Risiko erhöhen, früher zu versterben. Die daraus resultierenden Variablen ergaben, dass den stärksten Einfluss ein hoher Tumorgrad G2/3 (Relative Risiko, RR 4,1) hat. Dieses relative Risiko liegt sogar in demselben Konfidenzintervall (95 %) wie in einer anderen Arbeit, die veröffentlicht wurde und Prognosefaktoren bei Speicheldrüsenkarzinomen untersuchte [32]. Weitere Risikofaktor früh zu versterben, wurde in den Tumorstadien pT3/4 (RR 1,46) und einer Fernmetastasierung (RR 1,95) herausgearbeitet Daneben zeigten sich auch Überexpression von Tapasin (RR 1,7) und HLA-A (RR 1,95) als negative Überlebensfaktoren. Auch andere Arbeiten weisen daraufhin, dass Überexpressionen des MHC-Klasse-I-Weges das Überleben negativ beeinflussen können [132,178]. LMP-7 weist mit seinem RR von 0,58 (KI 0.349-0.970) bei einer Überexpression sogar einen prognostisch günstigen Überlebensfaktor auf und scheint ein unabhängiger Faktor zu sein. Dies wurde bereits in einer anderen Studie beschrieben, in der ebenfalls bei einer Überexpression von LMP-7 in Ovarialkarzinomen ein besseres krankheitsspezifisches Überleben beobachtet wurde [156]. Eine funktionelle Erklärung ist, dass die Proteasomenuntereinheit LMP-7 bei einer verstärkten Expression auch eine höhere proteolytische Aktivität beinhaltet und somit zu einer vermehrte Produktion von Tumorpeptiden führt. Dies ist wiederum Voraussetzung für eine verstärkte Oberflächenpräsentation. Die Peptidbildung scheint somit im Gegensatz zum Peptidtransport, -zusammenbau bzw. –stabilisierung bei Speicheldrüsenkarzinomen der wesentliche Einflussfaktor zu sein und vor allem unabhängig von den späteren Schritten zu sein. Nach der Peptidbildung durch die Proteasomenuntereinheiten folgt die Einschleusung in das endoplasmatische 107 Reticulum mithilfe der Transporter TAP-1 und -2: Studien am Zellmodell konnten zeigen [192, 215], dass Defekte im TAP-Transporter zu einem völligen Verlust der Oberflächenpräsentation führen, während andere Defekte späterer Schritte meist noch kompensiert werden können. In der eigenen Arbeit war jedoch eine Unterexpression von TAP-1 bei Speicheldrüsenkarzinomen mit einem besseren Überleben assoziiert (p=0,016), in der multivariaten Analyse ließ sich kein Zusammenhang mit anderen immunhistochemischen oder klinischen Parametern herstellen. Zusammenfassend lässt sich festhalten, dass Speicheldrüsenkarzinome nichtvollständig in das Modell des „immune escapes“ bzw. einer Unterexpression der Antigen präsentierenden Maschinere passen, wie dies auch schon beim malignen Melanom, dem Nierenzellkarzinom und dem kolorektalen Karzinom gezeigt wurde [5, 42, 143, 178]. Die Speicheldrüsenkarzinome ähneln hinsichtlich ihrer Unter- und Überexpressionen der heterogenen Gruppe der Kolonkarzinome [5, 178], die anhängig von ihrer Mikrosatellitenstabilität bzw. –instabilität und ihrer muzinösen/medullären Typisierung eine heterogene Gruppe darstellen. 108 7 Literaturverzeichnis 1 Akrish S., Peled M., Ben-Izhak O., Nagler R.-M.: Malignant salivary gland tumors and cyclooxygenase-2: A histopathological and immunhistochemical analysis with implications on histogenesis. Oral Oncol 45 (12), 2009, S. 1044-1050. 2 Alos L., Cardesa A., Bombi J.A., Mallofre C., Cuchi A., Traserra J.: Myoepithelial tumors of salivary glands: a clinicopathologic, immunohistochemical, ultrastructural, and flow-cytometric study. Semin Diagn Pathol 13, 1996, S. 138-147. 3 Alos L., Carrillo R., Ramos J., Baez J.M., Mallofre C., Fernandez P.L., Cardesa A.: High-grade carcinoma component in epithelial-myoepithelial carcinoma of salivary glands clinicopathological, immunohistochemical and flow-cytometric study of three cases. Virchows Arch 434, 1999, S. 291-299. 4 Alvarez-Canas C., Rodilla I.G.: True malignant mixed tumor (carcinosarcoma) of the parotid gland. Report of a case with immunohistochemical study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 81, 1996, S. 454-458. 5 Atkins D., Breuckmann A., Schmahl G.E. : MHC class I antigen processing pathway defects, ras mutations and disease stage in colorectal carcinoma.Int J Cancer 2004; 109; 265-273. 6 Attar A., Scheffer P., Roucayrol A.M., Blanchard P.: Le cystadénocarcinome papillaire de la glande sous-maxillaire. Un diagnostic rare. Rev Stomatol Chir Maillofac 90, 1989, S. 330-333. 7 Auclair P.L.: Cystadenocarcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S.332. 8 Auclair P.L., Ellis G.L.: Adenocarcinoma, not otherwise specified. In: Ellis G.L., Auclair P.L., Gnepp D.R. (Herg.) Surgical pathology of the salivary glands. Saunders, Philadelphia London Toronto Montreal Sydney Tokyo, 1991, S. 318-332. 9 Auclair P.L., Ellis G.L.: Mukoepidermoid Carcinoma. In: Ellis G.L., Auclair P.L., Gnepp D.R. (Herg.) Surgical pathology of the salivary glands. Saunders, Philadelphia London Toronto Montreal Sydney Tokyo, 1991, S. 269-298. 109 10 Auclair P, Van der Waal J.E.: Adenocarcinoma, not otherwise specified. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, 2005, S. 238-239. 11 Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P (2005).: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 210. 12 Barnes L., Rao U., Krause J., Contis L., Schwartz A., Scalamogna P.: Salivary duct carcinoma. Part I. A clinicopathologic evaluation and DNA image analysis of 13 cases with review of the literature. Oral Surg Oral Med Oral Pathol 78, 1994, S. 64-73. 13 Batskis J.G., Pinkston G.R., Luna M.A., Byers R.M., Sciubba J.J., Tillery G.W.: Adenocarcinomas of the oral cavity: a clinicopathological study of terminal duct carcinomas. J Laryngol Otol 97, 1989, S. 655-664. 14 Batsakis J.G., Regezi J.A., Luna M.A., El-Nagger A. (1989): Histogenesis of the salivary gland neoplasm: a postulate with prognostic implications. Laryngol Otol 103, S. 939-944, 1989. 15 Beahrs O.H., Woolner L.B., Kirklin J.W., Devine K.D.: Carcinomatous transformation of mixed tumors of the parotid gland. Arch. Surg 75, 1957, S. 605-614. 16 Becker W.: Anatomie, Entwicklungsgeschichte und Missbildungen der Ohrspeicheldrüse. In: Fortschritte der Kiefer und Gesichtschirurgie.Stuttgart, Thieme,1960, S.194-200. 17 Becker W., Haubrich J., Seifert G.: Krankheiten der Kopfspeicheldrüsen. In: Hals-, Nasen-, Ohrenheilkunde in Praxis und Klinik. Band 3, Thieme, Stuttgart, 1978, 12.1-12.55. 18 Belicha-Villanueva A., Blickwedehl J., McEvoy S., Golding M., Gollnick S., Bangia N.: What ist the role of alternative splicing by major histocompatibility complex class I molecules?. Immunul Res 46 (1-3), 1999, S. 32-44. 19 Belsky J.L., Tachikawa K., Cihak R.W., Yamamoto T.: Salivary gland tumors in atomic bomb survivors, Hiroshima-Nagasaki, 1957 to 1970. JAMA 219, 1972, S. 864-886. 110 20 Benevolo M., Mottolese M., Piperno G.: HLA-A, -B, -C expression in colon carcinoma mimics that of the normal colonic mucosa and is prognostically relevant. Am J Surg Pathol 2007; 31; 76-84. 21 Bero J.W., Lone F., Stearns M.W.: Mucoepidermoid anal cancer. Cancer 13, 1960, S. 914-916. 22 Billroth T.: Beobachtungen über Geschwülste der Speicheldrüse. Virchows Arch A Pathol Anatom 17, 1859, S. 357-375. 23 Bishop Pitman M.: Mucoepidermoid carcinoma ex pleomorphic adenoma of the parotid gland. Acta Cytol 39,1995, S. 604-606. 24 Bonnin J.M.: The association of embryonal tumors originating in the kidney and the brain: a report of seven cases. Cancer 54, 1984, S. 2137-2146. 25 Borg M.F., Benjamin C.S., Morton R.P., Llewellyn H.R.: Malignant lymphoepithelial lesion of the salivary gland: a case report and review of the literature. Australas Radiol 37, 1993, S. 288-291. 26 Bosch A., Brandenburg J.H., Gilchrist K.W.: Lymph node metastases in adenoid cystic carcinoma of the submaxillary gland. Cancer 45, 1980, S. 2872-2877. 27 Brandwein M.S., Huvos A.G.: Oncocytic tumors of major salivary glands. A study of 68 cases with follow-up of 44 patients. Am J Surg Pathol 15(6), 1991, S. 514-528. 28 Brandwein M.S., Huvos A.G., Dardick I., Thomas M.J., Theise N.D.: Noninvasive and minimally invasive carcinoma ex mixed tumor: a clinopathologic anoploidy study of 12 patients with major salivary gland tumors of low (or no?) malignant potential. Oral Surg oral med oral Pathol Oral Radiol Endod 81, 1996, S. 655-664. 29 Brandwein M., Huvos A.G., Dardick I., Thomas M.J., Thiese N.O., Huo W.: Malignant mixed tumor (MMT) of the major salivary glands with encapsulation or minimal invasion. Lab Invest 68, 1993, 79A/454. 111 30 Brandwein M.S., Jagirdar J., Patil J., Biller H., Kaneko M.: Salivary duct carcinoma (cribriform salivary carcinoma of excretory ducts). A clinicopathologic and immunohistochemical study of 12 cases. Cancer 65, 1990, S. 2307-2314. 31 Brandwein M.S., Skálová A., Nagao T.: Salivary duct carcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 236-237. 32 Brannon R.B., Fowler C.B., Hartman K.S.: Necrotizing sialometaplasia. A clinicopathologic study of sixty-nine cases and review of the literature. Oral Surg Oral Med Oral Pathol 72, 1991, S. 317-325. 33 Briggs J., Evans J.N.G.: Malignant oxyphilic granular-cell tumor (oncocytoma) of the palate: Review of the recent literature and report of a case. Oral Surg Oral med Oral Pathol 23, 1967, S. 796-802. 34 Carillo J.F., Vázquez R., Ramírez-Ortega M.C., Cano A., Ochoa-Carillo F., Oñate-Ocaña L.F.: Multivariate Prediction of the Probability of Recurrence in Patients With Carcinoma of the Parotid Gland. Wiley Interscience 4, 2007, S. 2043-2051. 35 Castle J.T., Thompson L.D., Frommelt R.A., Wenig B.M., Kessler H.P.: Polymorphous low grade adenocarcinoma: a clinicopathologic study of 164 cases. Cancer 86, 1999, S. 207-219. 36 Cerilli L.A., Swartzbaugh J.R., Saadut R., Marshall C.E., Rumpel C.A., Moskaluk C.A., Frierson H.F.Jr.: Analysis of chromosome 9p21 deletion and p16 gene mutation in salivary gland carcinomas. Hum Pathol 30, 1999, S. 1242-1246. 37 Chapman D.-C., Williams D.B.: ER quality control in the biogenesis of MHC class I molecules. Semin Cell Dev Biol 21, 1999, S. 512-519. 38 Chen K.T.K.: Carcinoma arising in monomorphic adenoma of the salivary gland. Am J Otolaryngol 6, 1985, S. 39-41. 39 Chevet E., Smirley J., Cameron P.-H., Thomas D.-Y., Bergeron J.-J.-M.: Calnexin phosphorylation: Linking cytoplasmatic signalling to endoplasmatic reticulum lumenal functions. Seminars in Cell & Developmental Biology 21, 2009, S. 486-490. 112 40 Cho K.J., El Naggar A.K., Ordonez N.G., Luna M.A., Austin J., Batsakis J.G.: Epithelial-myoepithelial carcinoma of salivary glands. A clinicopathologic, DNA flow cytometric, and immunohistochemical study of Ki-67 and HER-2/neu oncogene. Am J Clin Pathol 103, 1995, S. 432-437. 41 Choi H.R., Batsakis J.G., Callender D.L., Prieto V.G., Luna M.A., El Naggar A.K.: Molecular analysis of chromosome 16q regions in dermal analogue tumors of salivary glands: a genetic link to dermal cylindroma? Am J Surg Pathol 26, 2002, S. 778-783. 42 Clark W.H. Jr., Elder D.E., Guerry D. 4th, Braitman L.E., Trock B.J., Schultz D., Synnestvedt M., Halpern A.C.: Model predicting survival in stage I melanoma based on tumor progression.J Natl Cancer Inst. 81(24), 1981, S. 1893-1904. 43 Cleary K.R., Batsakis J.G.: Undifferentiated carcinoma with lymphoid stroma of the major salivary glands. Ann Otol Rhinol Laryngol 99, 1990, S. 236-238. 44 Clemente C.G., Mihm M.C. Jr., Bufalino R., Zurrida S., Collini P., Cascinelli N.: Prognostic value of tumor infiltrating lymphocytes in the vertical growth phase of primary cutaneous melanoma. Cancer 77, 1996, S. 1303-1310. 45 Coli A., Bigotti G., Bartolazzi A.: Malignant oncocytoma of major salivary glands. Report of a post-irradiation case. J Exp Clin Cancer Res 17, 1998, S. 65-70. 46 Colmenero C., Patron M., Sierra I.: Acinic cell carcinoma of the salivary glands. A review of 20 new cases. J Craniomaxillofac Surg 19, 1991, S. 260-266. 47 Crawford J.-M., Taubmann M.-A., Smith D.-J.: Minor salivary glands as a major source of secretory immunoglobulin in the human oral cavity. Science 190, 1975, S. 1206-1209. 48 Crissman J.D., Rosenblatt A.: Acinous cell carcinoma of the larynx. Arch Path Lab Med 102, 1978, S. 233-236. 49 Dardick I., Burford-Mason A.P.: Current status of histogenetic and morphogenetic concepts of salivary gland tumorgenesis. Crit Rev Oral Biol Med 4, 1993, S. 639-677. 113 50 Dardick I., Daya D., Hardie J., Nostrand A.W.P. Van: Mucoepidermoid carcinoma: ultrastructural and histogenetic aspects. J Ora pathol 13, 1984, S. 342-358. 51 Dardick I., Naiberg J., Leung R.: Ultrastructural study of acinar and intercalated duct organization of submandibular and parotid salivary gland. Lab Invest 63, 1990, S. 394-404. 52 Dardick I., Nostrand A.-W.-P. Van: Morphogenesis of salivary gland tumors. A prerequisite to improving classification. Pathology Annual 22, 1987, S. 1-53. 53 Darling M.-R., Schneider J.-W., Philipps V.-M.: Polymorphous low-grade adenocarcinoma and adenoid cystic carcinoma: a review and comparison of immunhistochemical markers. Oral Oncology 38, 2002, S. 641-645. 54 Di Palma S., Guzzo M.: Malignant myoepithelioma of salivary glands: clinicopathological features of ten cases. Virchows Arch A Pathol Anat Histopathol 423, 1993, S. 389-396. 55 Dithmar S., Crowder J., Jager M.-J., Vigniswaran N., Grossniklaus H.E.: HLA-I-Antigenexpression korreliert mit dem histologischen Zelltyp uvealer Melanome. Der Ophthalmologe 99, 2002, S. 625-628. 56 Dodge O.G.: Gastroesophageal carcinoma of mixed histologic types. J Pathol Bacteriol 81, 1961, S. 459-471. 57 Doerr W., Seifert G., Uehlinger E.: Oralpathologie I- Pathologie der Speicheldrüsen. Band I, 2. Auflage, Springer, Heidelberg und Hamburg, 1996, S.1-53, 308-710. 58 Donath K.: Die Sialadenose der Parotis. Ultrastrukturelle, klinische und experimentelle Befunde zur Sekretionspathologie. Fischer, Stuttgart New York, 1975, S.10-50 59 Donath K., Seifert G., Schmitz R.: Diagnosis and ultrastructure of the tubular carcinoma of salivary gland ducts. Epithelialmyoepithelial carcinoma of the intercalated ducts. Virchows Arch A Pathol Pathol Anat 356, 1972, S. 16-31. 114 60 Doughtery C.M., Cotton N.: Mixed squamous cell and adenocarcinoma of the cervix. Combined, adenosquamous, and mucoepidermiod type. Cancer 17, 1964, S. 1132-1143. 61 Dunn G.P., Bruce A.T., Ikeda H., Old L.J., Schreiber R.D.: Cancer immunoediting: from immunosurveillance to tumor escape. Nat Immunol. 11, 2002, S. 991-998. 62 Ellis G.: Basal cell adenocarcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 229-230. 63 Ellis G.L., Auclair P.L.: Acinic cell adenocarcinoma. In: Ellis G.L., Auclair P.L., Gnepp D.R.: Surgical pathology of the salivary glands. Saunders, Philadelphia London Toronto Montreal Sydney Tokyo, 1991, S. 299317. 64 Ellis G.L., Auclair P.L.: Tumours of the salivary glands. 3rd ed. Armed Forces Institute of Pathology: Washington, 1996, S. 296-369. 65 Ellis G.L., Auclair P.L., Gnepp D.R.: Surgical Pathology of the Salivary Glands. WB Saunders, Philadelphia, 1991. 66 Ellis G.L., Corio R.L.: Acinic cell adenocarcinoma. A clinicopathological Analysis of 294 cases. Cancer 52, 1983, S. 542-549. 67 Ellis G., Simpson R.H.W.: Acinic cell tumor. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 216-218. 68 Ellis G.L., Wiscovitsch J.G.: Basal cell adenocarcinoma of the major salivary glands. Oral Surg Oral Med Oral Pathol 69, 1990, S. 461-469. 69 El-Mofty S.K., O’Leary T.R., Swanson P.E.: Malignant myoepithelioma of salivary glands: clinicopathologic and immunophenotypic features. Review of literature and report of two cases. Int J Surg Pathol 2, 1994, S. 133-140. 115 70 El Naggar A.K., Abdul-Karim F.W., Hurr K., Callender D., Luna M.A., Batsakis J.G.: Genetic alterations in acinic cell carcinoma of the parotid gland determined by microsatellite analysis. Cancer Genet Cytogenet 102, 1998, S. 19-24. 71 El-Naggar A.K., Huvos A.G.: Adenoid cystic carcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 221-222. 72 El Naggar A.K., Lovell M., Callender D.L., Ordonez N.G., Killary A.M.: Concurrent cytogenetic, interphase fluorescence in situ hybridization and DNA flow cytometric analyses of a carcinoma ex-pleomorphic adenoma of parotid gland. Cancer Genet Cytogenet 107, 1998, S. 132-136. 73 Ernster J.A., Franquemont D.W., Sweeney J.P.: Initial report of a case of carcinosarcoma of the supraglottis. Ear Nose Throat J 79, 2000, S. 384-387. 74 Evans H.L., Luna M.A.: Polymorphous low-grade adenocarcinoma: a study of 40 cases with long-term follow up and an evaluation of the importance of papillary areas. Am J Surg Pathol 24, 2000, S. 1319-1328. 75 Eversole L.H.: Histogenetic classification of the salivary gland tumors. Arch Pathology 92, 1971, S. 433-443. 76 Eversole L.R., Gnepp D.R., Eversole G.M.: Undiffentiated Carcinoma. In: Ellis G.L., Auclair P.L., Gnepp D.R. (Herg.). Surgical pathology of the salivary glands. Saunders, Philadelphia London Toronto Montreal Sydney Tokyo, 1991, S. 422-440. 77 Eveson J.W., P. Auclair, Gnepp D.R., El-Naggar A.K.: Tumors of the salivary glands, Introduction. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Head and Neck tumors, WHO OMS, Lyon, 2005, S. 210-252. 78 Eveson J.W., Cawson R.A.: Salivary gland tumours. A review of 2410 cases with particular reference to histological types, site, age and sex distribution. J Pathol 146, 1985, S. 51-55. 79 Eveson J.W., Cawson R.A.: Tumours of the minor (oropharyngeal) salivary glands: a demographic study of 336 cases. J Oral Patholology 14, 1985, S. 500-509. 116 80 Eveson J.W., Yeudal A.: What is the evidence for the progression from benign to malignant pleomorphic adenoma?. In: McGurk M., Renehan A. (Herg.) Controversies in the management of salivary gland diseases. Oxf Univ Press 78, 2001, S. 105-113. 81 Fayemi A.O., Toker C.: Salivary duct carcinoma. Arch Otolaryngol 99, 1974, S. 366-368. 82 Fechner R.E., Bentinck B.R., Askew J.B. jr.: Acinic cell tumor of the lung. A histological and ultrastructural study. Cancer 29, 1972, S. 501508. 83 Ferensic Z., Frkovic-Grazio S., Petric V.: Multicentric malignant myoepithelioma of parotid gland: a case report. Path Research Pract 191, 1995, S. 663. 84 Ferlito A.: Acinic cell carcinoma of minor salivary glands. Histopathol 4, 1980, S. 331-343. 85 Ferlito A., Donati L.F.: Malignant lymphoepithelial lesions. Undifferentiated ductal carcinomas of the parotid gland. J Laryngol 91, 1977, S. 869-885. 86 Ferlito A., Gale N., Hvala H.: Laryngeal salivary duct carcinoma: a light and electron microscopic study. J Laryngol Otol 95, 1981, S. 731-738. 87 Först A.: Analyse der von 1963-1989 an der Klinik und Poliklinik für Mund-Kiefer und Gesichtchirurgie der Friedrich Alexander Universität Erlangen-Nürnberg stationär behandelten Patienten mit Erkrankungen der Kopfspeicheldrüsen. Medizinische Dissertation, Erlangen, 1992, S.1. 88 Fonseca I., Soares J.: Epithelial-myoepithelial carcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 225-226. 89 Foote F.W., Frazell E.L.: Tumors of the major salivary glands. Cancer 6, 1953, S. 1065-1133. 117 90 Foss R.D., Ellis G.L., Auclair P.L.: Salivary gland cystadenocarcinomas. A clinicopathologic study of 57 cases. Am J Surg Pathol 20, 2006, S. 1440-1447. 91 Freedman P.D., Lumerman H.: Lobular carcinoma of intraoral minor salivary gland origin. Report of 112 cases. Oral Surg Oral Med Oral Path 56, 1993, S. 157-166. 92 Frühwald M.C., Graf N.: Rhabdoide Tumoren im Kindesalter. Klinik und Forschung 4, 2006, S. 22-25. 93 Gallenger H.S., Miler G.V., Grampa G.: Primary mucoepidermoid carcinoma of the skin. Report of a case. Cancer 12, 1959, S. 286-288. 94 Gamel J.W., Font R.L.: Adenoid cystic carcinoma of the lacrimal gland: The clinical significance of a basaloid histological pattern. Hum Pathol 13, 1982, S. 219- 225. 95 Garrido F., Ruit-Cabello F., Cabrera T., Perz-Villar J.-J., Lopez-Botet M., Duggan-Keen M. : Implications for immunosurveillance of altered HLA class I phenotypes in human tumors. Immunol Today 18, 1997, S. 89-95. 96 Geissinger K.R., Reynolds G.D., Vance R.P., McGuirt W.F.: Adenoid cystic carcinoma arising in a pleomorphic adenoma of the parotid gland. An aspiration cytology and ultrastructural study. Acta Cytol 29, 1985, S. 522-526. 97 Gerughty R.M., Scofield H.H., Brown F.M., Hennigar G.R.: Malignant mixed tumors of salivary gland origin. Cancer 24, 1969, S. 471-486. 98 Gnepp D.R.: Carcinosarkoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 244. 99 Gnepp D.R.: Diagnostic Surgical Pathology of the Head and Neck. W.B. Saunders, Philadelphia., 2001, S.141-238. 100 Gnepp D.R., Wenig B.M.: Malignant mixed tumors. In: Ellis G.L., Auclair P.L., Gnepp D.R. (Herg.) Surgical pathology of the salivary glands. Saunders, Philadelphia London Toronto Montreal Sydney Tokyo, 1991, S. 35-368. 118 101 Gnepp D.R., Brandwein-Gensler M.S., El Naggar A.K., Nagao T.: Carcinoma ex pleomorphic adenoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 242-243. 102 Gnepp D.R., Corio R.L., Brannon R.B.: Small cell carcinoma of the major salivary glands. Cancer 58, 1986, S. 705-714. 103 Gnepp D.R., Wenig B.M.: Malignant mixed tumors. In: Ellis G.L., Auclair P.L., Gnepp D.R. (Herg.) surgical pathology of the salivary glands. Saunders, Philadelphia London Toronto Montreal Sydney Tokyo, 1991, S. 350-368. 104 Gnepp D.R., Wick M.R.: Small cell carcinoma of the major salivary glands. An immunohistochemical study. Cancer 66, 1990, S. 185-192. 105 Gogas J., Markopoulos C., Karydakis V., Gogas G., Delladetsima J.: Carcinosarcoma of the submandibular salivary gland. Eur J Surg Oncol 25, 1999, S. 333-335. 106 Goode R.K., Auclair P.L., Ellis G.L: Mucoepidermoid carcinoma of the major salivary glands: clinical and histopathologic analysis of 234 cases with evaluation of grading criteria. Cancer 82, 1998, S. 1217-1224. 107 Goode R.K., Corio R.L.: Oncocytic adenocarcinoma of salivary glands. Oral Surg Oral Med Oral Pathol 65, 1988, S. 6166. 108 Goode R.K., El-Naggar A.K.: Mucoepidermoid carcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 219-220. 109 Gosa G. de, Zeppa P., Transfa F., Bonavolontá G.: Acinic cell carcinoma arising in a lacrimal gland. First case report. Cancer 57, 1986, S. 19881991. 110 Gotte K., Riedel F., Coy J.F., Spahn V., Hormann K.: Salivary gland carcinosarcoma: immunohistochemical, molecular genetic and electron microscopic findings. Oral Oncol 36, 2000, S. 360-364. 119 111 Grenko R.T., Gemryd P., Tytor M., Lundquist P.G., Boeryd B.: Salivary duct carcinoma. Histopathology 26, 1995, S. 261-266. 112 Guérin R., Beauregard P.-B., Leroux A., Rokeach L.-A.: Calnexin Regulates Apoptosis Induced by Inositol Starvation in Fission Yeast. PloSOne 4, 2009, S. 120-127. 113 Guimaraes D.S., Amaral A.P., Prado L.F., Nascimento A.G.: Acinic cell carcinoma of salivary glands: 16 cases with clinicopathologic correlation. J Oral Pathol Med 18, 1989, S. 396-399. 114 Habermann R.S., Rogers W.A., Habermann P.H.: Malignant oncocytic adenocarcinoma of the parotid gland with metastasis to bone. Surg Pathol 3, 1990, S. 221-226. 115 Hamilton-Dutoit S.J., Therkildsen M.H., Neilsen N.H., Jensen H., Hansen J.P., Pallesen G.: Undifferentiated carcinoma of the salivary gland in Greenlandic Eskimos: demonstration of Epstein-Barr virus DNA by in situ nucleic acid hybridization. Hum Pathol 22, 1991, S. 811-815. 116 Hammond C., Helenius A.: Quality control in the secretory pathway. Curr. Opin. Cell Biology 7, 1995, S. 523-529. 117 Hamper K., Schmitz-Watjen W., Mausch H.E., Caselitz J., Seifert G.: Multiple expression of tissue markers in mucoepidermoid carcinomas and acinic cell carcinomas of the salivary glands. Virchows Arch A Pathol Anat Histopathol 414, 1989, S. 407-413. 118 Handra-Luca A., lamas G., Bertrand J.-C., Fouret P.: MUC1, MUC2, MUC4, and MUC5AC Expression in Salivary Gland Mukoepidermoid CarcinomaDiagnostic and Prognostic Implications. Am J Surg Pathol Vol 29, 7, 2005, S. 881-889. 119 Hanna W., Kahn H.J.: Ultrastructural and immunhistochemical characteristics of mucoepidermoid carcinoma of the breast. Hum Pathol 16, 1985, S. 941-946. 120 Hanson T.A.S.: Acinic cell carcinoma of the parotid salivary gland presenting as a cyst. Report of two cases. Cancer 36, 1978, S. 570-575. 121 Harada H.: Histomorphological investigation regarding to malignant transformation of pleomorphic adenoma (so-called malignant mixed tumor) of the salivary gland origin: special reference to carcinosarcoma. Kurume Med J 47, 2000, S. 307-323. 120 122 Harbo G., Bundgaard T., Pedersen D., Sogaard H., Overgaard J.: Prognostic indicators for malignant tumours of the parotid gland. Clin Otolaryngol Allied Sci 27, 2002, S. 512-516. 123 Hayashi Y., Nagamine S., Yanagawa T., Yoshida H., Yura Y., Azuma M., Sato M.: Small cell undifferentiated carcinoma of the minor salivary gland containing exocrine, neuroendocrine, and squamous cells. Cancer 60, 1987, S. 1583-1588. 124 Hellquist H.B., Sundelin K., Di Bacco A., Tytor M., Manzotti M., Viale G.: Tumour growth fraction and apoptosis in salivary gland acinic cell carcinomas. Prognostic implications of Ki-67 and bcl-2 expression and of in situ end labeling (TUNEL). J Pathol 181, 1987, 323-329. 125 Hemmi A., Hiraoka H., Mori Y.: Malignant pleomorphic adenoma (malignant mixed tumor) of the trachea. Report of a case. Acta Pathol Jpn 38, 1988, S. 1215-1226. 126 Herold G.: Innere Medizin. Herold Innere Medizin Verlag, Köln, 2009, S. 371-374. 127 Hoang M.P., Callender D.L., Sola Gallego J.J., Huang Z., Sneige N., Luna M.A., Batsakis J.G., El Naggar A.K.: Molecular and biomarker analyses of salivary duct carcinomas: comparison with mammary duct carcinoma. Int J Oncol 19, 2001, S. 865-871. 128 Hoffman D.A., McConahey W.M., Fraumeni J.F.Jr., Kurland L.T.: Cancer incidence following treatment of hyperthyroidism. Int J Epidemiol 11, 1982, S. 218-224. 129 Horinouchi H., Ishihara T., Kawamura M., Kato R., Kikuchi K., Kobayashi K., Maenaka Y., Torikata C.: Epithelial myoepithelial tumour of the tracheal gland. J Clin Pathol 46, 1993, S. 185-187. 130 Horn-Ross P.L., Ljung B.M., Morrow M.: Environmental factors and the risk of salivary gland cancer. Epidemiol B, 1994, S. 414-419. 131 Horsman D.E., Berean K., Durham J.S.: Translocation (11;19)(q21;p13.1) in mucoepidermoid carcinoma of salivary gland. Cancer Genet Cytogenet 80, 1995, S. 165-166. 121 132 Huang W.C., Wu D., Xie Z., Zhau H.E., Nomura T., Zayzafoon M., Pohl J., Hsieh C.L., Weitzmann M.N., Farach-Carson M.C., Chung L.W.: Beta2-microglobulin is a signaling and growth-promoting factor for human prostate cancer bone metastasis. Cancer Res. 66, 2006, S. 9108-9116. 133 Hui K.K., Luna M.A., Batsakis J.G., Ordónez N.G., Weber R.: Undifferentiated carcinomas of the major salivary glands. Oral Surg Oral Med Oral Pathol 69, 1991, S. 76-83. 134 Hungermann D., Roeser K., Buerger H., Jakel T., Loning T., Herbst H.: Relative paucity of gross genetic alterations in myoepitheliomas and myoepithelial carcinomas of salivary glands. J Pathol 198, 2001, S. 487-494. 135 Huntrakoon M.: Neuroendocrinic carcinoma of the parotid gland: A report of two cases with ultrastructural and immunhistochemical studies. Hum Pathol 18, 1987, S. 1212-1217. 136 Iezzoni J.C., Gaffey M.J., Weiss L.M.: The role of Epstein-Barr virus in lymphoepithelioma- like carcinomas. Am J Clin Pathol 103, 1995, S. 308-315. 137 Ito K., Tsukuda M., Kawabe R., Nakagawa C., Matsushita K., Kubota A., Furukawa M., Kameda Y., Ito T.: Benign and malignant oncocytoma of the salivary glands with an immunohistochemical evaluation of Ki-67. ORL J Otorhinolaryngol Relat Spec 62, 2000, S. 338-341. 138 Iwsaki K., Ono I., Ebihara S.: Clinopathological study of salivary gland adenocarcinomas. Nippon Jibiinkoka Gakkai Kaiho 92, 1989, S. 2047-2054. 139 Jeannon J.P., Soames J.V., Bell H., Wilson J.A.: Immunohistochemical detection of oestrogen and progesterone receptors in salivary tumours. Clin Otolaryngol 24, 1999, S. 52-54. 140 Jeng Y.M., Lin C.Y., Hsu H.C.: Expression of the c-kit protein is associated with certain subtypes of salivary gland carcinoma. Cancer Lett 154, 2000, S. 107-111. 141 Jin Y., Mertens F., Mandahl N., Wennerberg J., Dictor M., Heim S., Mitelman F.: Tetraploidization and progressive loss of 6q in a squamous cell carcinoma of the parotid gland. Cancer Genet Cytogenet 79, 1995, S. 157-159. 122 142 Jouzdani E., Yachouh J., Costes V., Faillie J.L., Cartier C., Poizat F., Pierre G., Burcia V., Makeieff M., Crampette L., Guerrier B., Garrel R.: Prognostic value of a three-grade classification in primary epithelial parotid carcinoma: result of a histological review from a 20-year experience of total parotidectomy with neck dissection in a single institution. Eur J Cancer. 2010 Jan;46(2):323-31. doi: 10.1016/j.ejca.2009.10.012. 143 Kageshita T., Hirai S., Ono T., Hicklin D.J., Ferrone S.: Down-regulation of HLA class I antigen-processing molecules in malignant melanoma: association with disease progression. Am J Pathol. 154, 1999, S. 745-754. 144 Katz D.R., Bubis J.J.: Acinic cell tumor of the bronchus. Cancer 38, 1977, S. 830-832. 145 Kessler A., Handler S.D.: Salivary gland neoplasms in children: a 10-year survey at the Children’s Hospital of Philadelphia. Int J Pediatr Otorhinolaryngol 29, 1994, S. 195-202. 146 Kim T., Yoon G.S., Kim O., Gong G.: Fine needle aspiration diagnosis of malignant mixed tumor (carcinosarcoma) arising in pleomorphic adenoma of the salivary gland. A case report. Acta Cytol 42, 1998, S. 1027-1031. 147 Kleinsasser O.: Azinuszelltumoren der Schleimdrüsen. Muköse Azinuszellkarzinome der Nase. Arch Klein Exp Ohr-Nasen-Kehlkopfheilkd 195, 1970, S.815-837. 148 Klöppel G., Morohoshi T., John H.D.: Solid and cystic acinar cell tumour of the pancreas. A tumour in young women with favourable prognosis.Virchows Archiv A Path Anat 392, 1981, S. 171-183. 149 Knapp I., Mann W., Qachter W.: Stellenwert der ultraschallgesteuerten Feinnadelbiopsie in der Diagnostik unklarer Halstumoren. L aryngorhinootologie 68, 1989, S. 683-689. 150 Kumar M., Stivaros N., Barrett A.W., Thomas G.J., Bounds G., Newman L.: Polymorphous low-grade adenocarcinoma-a rare and aggressive entity in adolescence. B J of oral and maxillofac Surg 42, 2004, S. 195-199. 151 Kuo T., Hsueh C.: Lymphoepithelioma-like salivary gland carcinoma in Taiwan: a clinicopathological study of nine cases demonstrating a strong association with Epstein-Barr virus. Histopathol 31, 1997, S. 7582. 123 152 Kuster L.C. von, Cohen C.: Malignant mixed tumor of the gallbladder. Report of two cases and a review of the literature. Cancer 50, 1982, S. 1166-1170. 153 Kwon M.Y., Gu M.: True malignant mixed tumor (carcinosarcoma) of parotid gland with unusual mesenchymal component: a case report and review of the literature. Arch Pathol Lab Med 125, 2001, S. 812815. 154 Lack E.E., Upton M.P.: Histopathologic review of salivary gland tumors in childhood. Arch Otolaryngol Head Neck Surg 114, 1988, S. 898-906. 155 Lawrence J.B., Mazur M.T.: Adenoid cystic carcinoma: A comparative pathologic study of tumors in salivary gland, breast, lung and cervix. Hum Pathol 13, 1982, S. 916-924. 156 Leffers N., Gooden M.J., Mokhova A.A.: Down-regulation of proteasomal subunit MB1 is an independent predictor of improved survival in ovarian cancer. Gynecol Oncol 2009; 113; 256-263. 157 Leivo I.: Insights into a complex group of neoplastic disease: Advances in histopathological classification and molecular pathology of salivary gland cancer. Acta Oncologia 45, 2006, S. 662-668. 158 Lewis J.E., McKinney B.C., Weiland L.H., Ferreiro J.A., Olsen K.D.: Salivary duct carcinoma. Clinicopathologic and immunohistochemical review of 26 cases. Cancer 77, 1996, S. 223-230. 159 Lewis J.E., Olsen K.D.: Squamous cell carcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 345-346. 160 Lewis J.E., Olsen K.D., Sebo T.J.: Carcinoma ex pleomorphic adenoma: pathologic analysis of 73 cases. Hum Pathol 32, S. 596604, 2001. 161 Lima R.A., Tavares M.R., Dias F.L., Kligerman J., Nascimento M.F., Barbosa M.M., Cernea C.R., Soares J.R., Santos I.C., Salviano S.: Clinical prognostic factors in malignant parotid gland tumors. Otolaryngol Head Neck Surg 133, 2005, S. 702-708. 124 162 LiVolsi V.A., Perzin K.H.: Malignant mixed tumors arising in salivary glands. I. Carcinomas arising in benign mixed tumors: a clinicopathologic study. Cancer 39, 1971, S. 2209-2230. 163 Llucia A., Lujan B. Castillo M., Nadal A., Carreras M., Caballero M., Bolos C. de, Cardesa A.: Expression of Membrane-Bound Mucins (MUC1 and MUC4) and secreted Mucins (MUC”, MUC5AC, MUC5AC, MUC5B, MUC6 and MUC7) in Mucoepidermoid Carcinomas of salivary Glands. Am J Surg Pathol 29, 2005, S. 806-812. 164 Loening T.: Immunpathologie der Mundschleimhaut. Orales Immunsystem Entzündungsreaktionen- TumorMarker-Virusnachweis. Fisher, Stuttgart, 1984, S. 143-187. 165 Loke Y.W.: Salivary gland tumours in Malaya. Br J Cancer 21, 1967, S. 665-674. 166 Lopes M.A., Kowalski L.P., Da Cunha Santos G., Paes de Almeida O.: A clinicopathologic study of 196 intraoral minor salivary gland tumours. J Oral Pathol Med 28, 1999, S. 264-267. 167 Ludwig M.E., LiVolsi V.A., McMahon R.T.: Malignant mixed tumor of the lacrimal gland. Am J Surg Pathol 3, 1979, S. 457-462. 168 Luna M.A., El Naggar A., Batsakis J.G., Weber R.S., Garnsey L.A., Goepfert H.: Flow cytometric DNA content of adenoid cystic carcinoma of submandibular gland. Correlation of histologic features and prognosis. Arch Otolaryngol Head Neck Surg 116, 1990, S. 12911299. 169 Luna M.A., Ordonez N.G., Mackay B., Batsakis J.G., Guillamondegui O.: Salivary epithelial myoepithelial carcinomas of the intercalated ducts: A clinical, electron microscopic, and immunhistochemical study. Oral Surg Oral med Oral Pathol 59, 1985, S. 482-490. 170 Luna M.A., Wenig B.M.: Polymorphous low-grade adenocarcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 223-224. 171 Mahmoud N.: Malignant oncocytoma of the nasal cavity. J Laryngol Otol 93, 1979, S. 729-734. 125 172 Manrique j.J., Albores-Saavedra J., Orantes A., Brandt H.: Malignant mixed tumor of the salivary-gland type, primary in prostate. Am J Clin pathol 70, 1978, S. 932-937. 173 Martins C., Fonseca I., Roque L., Ribeiro C., Soares J.: Cytogenetic similarities between two types of salivary gland carcinomas: adenoid cystic carcinoma and polymorphous low-grade adenocarcinoma. Cancer Genet Cytogenet 128, 2001, S. 130-136. 174 Maruya S., Kurotaki H., Shimoyama N., Kaimori M., Shinkawa H., Yagihashi S.: Expression of p16 protein and hypermethylation status of its promoter gene in adenoid cystic carcinoma of the head and neck. ORL J Otorhinolaryngol Relat Spec 65, 2003, S. 26-32. 175 Meijer S., Hoitsma H.: Malignant intrathoracical oncocytoma. Cancer 49, 1982, S. 97-100. 176 Meissner M., Reichter T.-E., Kunkel M., Gooding W., Whiteside T.-L., Soldano F.: Defects in the Human Leucocyte Antigen Class I Antigen-Processing Machinery in Head and Neck Squamous Cell Carcinoma: Association with Clinical Outcome. Imaging, Diagnosis, Clinical cancer research 11, 2005, S. 2552-2560. 177 Menck H.R., Henderson B.E.: Cancer incidence patterns in the Pacific Basin. Natl Cancer Inst Monogr 62, 1982, S. 101-109. 178 Menon A.G., Morreau H., Tollenaar R.A.: Down-regulation of HLA-A expression correlates with a better prognosis in colorectal cancer patients. Lab Invest 2002; 82; 1725-1733. 179 Michal M., Skalova A., Simpson R.H., Leivo I., Ryska A., Starek I.: Well-differentiated acinic cell carcinoma of salivary glands associated with lymphoid stroma. Hum Pathol 28, 1997, S. 595-600. 180 Michal M., Skalova A., Simpson R.H., Rychterova V., Leivo I.: Clear cell malignant myoepithelioma of the salivary glands. Histopathol 28, 1996, S. 309-315. 181 Mihailescu D., Shore-Freedman E., Mukani S., Lubin J., Ron E., Schneider A.B.: Multiple neoplasms in an irradiated cohort: pattern of occurrence and relationship to thyroid cancer outcome. J Clin Endocrinol Metab 87, 2002, S. 3236-3241. 182 Milford C.A., Mugliston T.A., O`Flyn P., McCarthy K.: Carcinoma arising in a pleomorphic adenoma of the epiglottis. J Laryngol Otol 103, 1989, S. 324-327. 126 183 Milham S.Jr.: Cancer mortality pattern associated with exposure to metals. Ann N Y Acad Sci 271, 1976, S. 243-249. 184 Miller A.S., Hartmann G.G., Chen S.-Y., Edmonds P.R., Brightman S.A., Harwick R.D.: Estrogen receptor assay in polymorphous low-grade adenocarcinoma and adenoid cystic carcinoma of salivary gland origin. An immunhistochemical study. Oral Surg Oral Med Oral Pathol 77, 1994, S. 36-40. 185 Mineta H., Miura K., Takebayashi S., Araki K., Ueda Y., Harada H., Misawa K.: Immunohistochemical analysis of small cell carcinoma of the head and neck: a report of four patients and a review of sixteen patients in the literature with ectopic hormone production. Ann Otol Rhinol Laryngol 110, 2001, S. 76-82. 186 Moberger J.G., Eneroth C.-M.: Malignant mixed tumor of the major salivary glands. Spezial reference to the histological structure in metastases. Cancer 21, 1968, S. 1198-1211. 187 Momburg F., Hämmerling H.G.: Generation and TAP-mediated transport of peptides for major histocompatibility complex class I molecules. Adv. Immunol 68, 1998, S. 191-256. 188 Momburg F., Tan P.: Tapasin- the keystone of the loading complex optimizing peptide binding by MHC class I molecules in the endoplasmatic reticulum. Moleculare Immunol 39, 2002, S. 401-408. 189 Monk J.S.Jr., Church J.S.: Warthin’s tumor. A high incidence and no sex predominance in central Pennsylvania. Arch Otolaryngol Head Neck Surg 118, 1992, S. 477-478. 190 Moore J.G., Bocklage T.: Fineneedle aspiration biopsy of large-cell undifferentiated carcinoma of the salivary glands: presentation of two cases, literature review, and differential cytodiagnosis of high-grade salivary gland malignancies. Diagn Cytopathol 19, 1998, S. 44-50. 191 Moran C.A., Suster S.: Mucoepidermoid carcinomas of the thymus. A clinopathological study of six cases. Am J Surg Pathol 19, 1995, S. 826-831. 192 Morel S.: Processing of somes antigens by the standard proteasome but not by the immunproteasome results in poor presentation by dendritic cells. Immunity 12, 2000, S. 107-117. 127 193 Mores H.P. de, Herrera G.A., Mendonca A.M.N., Estrela R.R.: Metastatic malignant mixed tumor of the skin. Ultrastructural and immuncytochemical characterization, histogenetic consideration and comparison with benign mixed tumors of skin and salivary glands. Appl Pathol 4, 1986, S. 119-208. 194 Morgan M.N., Mackenzie D.H.: Tumours of salivary glands. A review of 204 cases with 5-year follow-up. Br J Surg 55, 1968, S.284-288. 195 Mori M., Takay J., Kunikata M.: Salivary gland tumors: a possible origin of modified myoepithelial cells is ductal basal cells. Cancer Journal 5, 1985, S. 316-320. 196 Morinaga S., Hashimoto S., Tezuka F.: Epithelial-myoepithelial carcinoma of the parotid gland in a child. Acta Pathol Jpn 42, 1992, S. 358-363. 197 Muller S., Barnes L.: Basal cell adenocarcinoma of the salivary glands. Report of seven cases and review of the literature. Cancer 78, 1996, S. 2471-2477. 198 Mutoh H., Nagata H., Ohno K., Numata T., Nagao T., Nagao K., Konno A.: Analysis of the p53 gene in parotid gland cancers: a relatively high frequency of mutations in low-grade mucoepidermoid carcinomas. Int J Oncol 18, 2001, S. 781-786. 199 Nabili V., Tan J.W., Bhuta S., Sercarz J.A., Head C.S.: Salivary Duct Carcinoma: A Clinical And Histological Review With Implications For Trastuzumab Therapy. Head and Neck, 2007, S. 907-912. 200 Nacopoulou L., Azaris P., Papacharalampous N., Davaris P.: Prognostic significance of histologic host response in cancer of the large bowel. Cancer.47, 1991, S. 930-936. 201 Nagao T.: Large cell carcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 349-350. 202 Nagao T.: Small cell carcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 247-248. 128 203 Nagao T., Gaffey T.A., Olsen K.D., Serizawa H., Lewis J.E.: Small cell carcinoma of the major salivary glands: clinicopathologic study with emphasis on cytokeratin 20 immunoreactivity and clinical outcome. Am J Surg Pathol 28, 2004, S. 762-770. 204 Nagao T., Gaffey T.A., Serizawa H., Iwaya K., Watanabe A., Yoshida T., Yamazaki K., Sageshima M., Lewis J.E.: Sarcomatoid variant of salivary duct carcinoma: clinicopathologic and immunohistochemical study of eight cases with review of the literature. Am J Clin Pathol 122, 2004, S. 222-231. 205 Nagao T., Gaffey T.A., Visscher D.W., Kay P.A., Minato H., Serizawa H., Lewis J.E.: Invasive micropapillary salivary duct carcinoma: a distinct histologic variant with biologic significance. Am J Surg Pathol 28, 2004, S. 319-326. 206 Nagao T., Ishida Y., Sugano I., Tajima Y., Matsuzaki O., Hino T., Konno A., Kondo Y., Nagao K.: Epstein-Barr virus-associated undifferentiated carcinoma with lymphoid stroma of the salivary gland in Japanese patients. Comparison with benign lymphoepithelial lesion. Cancer 78, 1996, S. 695-703. 207 Nagao K., Matsuzaki O., Saiga H.: Histopathological studies on adenocarcinoma of the parotid gland. Acta Pathol Jpn 36, 1986, S. 337-347. 208 Nagao K., Matsuzaki O., Saiga H., Sugano I., Shigematsu H., Kaneko T., Katoh T., Kitamura T.: Histopathologic studies of undifferentiated carcinoma of the parotid gland. Cancer 50, 1982, S. 1572-1579. 209 Nagao T., Sugano I., Ishida Y., Tajima Y., Matsuzaki O., Konno A., Kondo Y., Nagao K.: Salivary gland malignant myoepithelioma: a clinicopathologic and immunohistochemical study of ten cases. Cancer 83, 1998, S. 1292-1299. 210 Nagao T., Sugano I., Ishida Y., Tajima Y., Munakata S., Asoh A., Yamazaki K., Muto H., Konno A., Kondo Y., Nagao K.: Primary large-cell neuroendocrine carcinoma of the parotid gland: immunohistochemical and molecular analysis of two cases. Mod Pathol 13, 2000, S. 554-561. 211 Nascimento A.G., Amaral A.L., Prado L.A., Kligerman J., Silveira T.R.: Adenoid cystic carcinoma of salivary glands. A study of 61 cases with clinicopathologic correlation. Cancer 57, 1986, S. 312-319. 129 212 Nishimura M., Hori Y.: Adamantinoid basal cell carcinoma. An ultrastructural study. Arch Pathol Lab Med 115, 1991, S. 624-626. 213 Nordkvist A., Gustafsson H., Juberg- Ode M., Stenman G.: Recurrent rearrangements of 11q14-22 in mucoepidermoid carcinoma. Cancer Genet Cytogenet 74, 1994, S. 77-83. 214 Oliviere P., Fonseca I., Soares J.: Acinic cell tumors of the salivary glands. A review of 13 cases. Path Res Pract 185, 1989, S. 116. 215 Peaper D.R., Cresswell P.: the redox activity of ERp57 is not essential for its functions in MHC class I peptide loading. Proc. Natl. Acad. Sci USA 105, 1998, S. 10477-10482. 216 Penner C.-R., Folpe L., Budnick S.-D.: C-kit Expression Distinguishes Salivary Gland Adenoid Cystic Carcinoma from Polymorphous Low-Grade Adenocarcinoma. Mod Path 15, 2002, S. 687-691. 217 Perez-Ordonez B., Linkov I., Huvos A.G.: Polymorphous low-grade adenocarcinoma of minor salivary glands: a study of 17 cases with emphasis on cell differentiation. Histopathology 32, 1998, S. 521-529. 218 Perosa F., Luccarelli G., Prete M., Favoino. E, Ferrone S,, Dammacco F.: Beta 2-microglobulin-free HLA class I heavy chain epitope mimicry by monoclonal antibody HC10-specific peptide. J Immunol 171, 2003, S. 1918-1926. 219 Perzin K.H., Gullane P., Clairmont A.C.: Adenoid cystic carcinomas arising in salivary glands: a correlation of histologic features and clinical course. Cancer 42, 1978, S. 265-282. 220 Perzin K.-H., Gullane O., Conley J.: Adenoid cystic carcinoma involving the external auditory canal. A clinopathological study of 16 cases. Cancer 42, 1982, S. 265-282. 221 Pezzuto A., Ulrichs T., Burmester G.-R.: Taschenatlas der Immunologie. 2. Auflage, Thieme, Stuttgart New York, 2007, S.166. 222 Pfaltz M., Jundt G.: Mund, Zähne und Speicheldrüsen. In: Denk H., Heitz P.U., Böcker W., Pathologie, 3. Auflage, Urban und Fischer, München Jena, 2004, S. 656-661. 130 223 Pieters J.: MHC class II restricted antigen presentation. Curr. Biol. Immunology 9, 1997, S. 89-96. 224 Poulsen P., Jorgensen K., Grontved A.: Benign and malignant neoplasms of the parotid gland: incidence and histology in the Danish County of Funen. Laryngoscope 97, 1987, S. 102-104. 225 Prasad M.-L., Barbacioru C., Rawal Y. B., Husein O., Wen P.: Hierarchical cluster analysis of myoepithelial/basal cell markers in adenoid cystic carcinoma and polymorphous low-grade adenocarcinoma. Modern Pathology 21, 2008, S. 105-114. 226 Quddus M.R., Henley J.D., Affify A.M., Dardick I., Gnepp D.R.: Basal cell adenocarcinoma of the salivary gland: an ultrastructural and immunohistochemical study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 87, 1999, S. 485-492. 227 Queimado L., Reis A., Fonseca I., Martins C., Lovett M., Soares J, Parreira L.: A refined localization of two deleted regions in chromosome 6q associated with salivary gland carcinomas. Oncogene 16, 1996, S. 83-88. 228 Rainwater L.M., Farrow G.M., Hay I.D., Lieber M.M.: Oncocytic tumors of the salivary gland, kidney and thyroid. Nuclear DNA patterns studied by flow cytometry. Br J Cancer 53, 1986, S. 799-804. 229 Rao P.H., Murty V.V., Louie D.C., Chaganti R.S.: Nonsyntenic amplification of MYC with CDK4 and MDM2 in a malignant mixed tumor of salivary gland. Cancer Genet Cytogenet 105, 1998, S. 160-163. 230 Rees R.C., Mian S.: Selective MCH expression in tumors modulates adaptive and innate antitumor responses. Cancer Immunol Immunth 48, 1999, S. 374-381. 231 Regezi J.A., Zarbo R.J., Batsakis J.G.: Immunoprofile of mucoepidermoid carcinomas of the minor salivary glands. Oral Surg Oral med Oral pathol 71, 1991, S. 189-192. 232 Reinhold E.: Immunhämatologie und Transfusionsmedizin. Urban&Fischer/Elsevier, München, 2004, S. 5872. 131 233 Rettinger G.: Physiologie der Speicheldrüsen. In: Naumann H.H., Helms J., Herberhold C., Kastenbauer (Hrsg.) Oto-Rhino-Laryngologie in Klinik und Praxis, Band 2, Thieme, Stuttgart New York, 1992, S.693-698. 234 Rizvi S. M., Raghavan M.: Mechanism of Function of tapasin, a Critical Major Histocompatibility Complex Class I assembly Factor. Interscience 11, 2009, S. 332-347. 235 Roijer E., Kas K., Behrendt M., Van de Ven W., Stenman G.: Fluorescence in situ hybridization mapping of breakpoints in pleomorphic adenomas with 8q1213 abnormalities identifies a subgroup of tumors without PLAG1 involvement. Genes Chromosomes Cancer 24, 1999, S. 78-82. 236 Sandros J., Mark J., Happonen R.P., Stenman G.: Specificity of 6q- markers and other recurrent deviations in human malignant salivary gland tumors. Anticancer Res 8, 1988, S. 637-643. 237 Sartoris S., Valle M.T., Barbaro A.L., Tosi G., Cestari T., D´Agostino A., Megiovanni A.M., Manca F., Acolla R.-S.: HLA class II expression in uninducible hepatocarcinoma cells after transfection of IR-gene product CIITA: acquisition of antigen processing and presentation capacity. J Immunol 161, 1998, S. 814-820. 238 Savera A.T., Sloman A., Huvos A.G., Klimstra D.S.: Myoepithelial carcinoma of the salivary glands: a clinicopathologic study of 25 patients. Am J Surg Pathol 24, 2000, S. 761-774. 239 Saw D., Lau W.H., Ho J.H., Chan J.K., Ng C.S.: Malignant lymphoepithelial lesion of the salivary gland. Hum Pathol 17, 1986, S. 914-923. 240 Schwarz S., Clemens S., Müller M., Ettl T., Brockhoff G., Zenk J., Agaimy A.: Salivary Gland Mucoepidermoid Carcinoma is a Clinically, Morphologically and Genetically Heterogeneous Entity. A Clinicopathologic Study of 40 Cases with Emphasis on Grading and Histological Variants. Histopathology, 2011/3, 58 (4), S. 557-570. 241 Schwarz S., Stiegler C., Zenk J., Iro H., Agaimy A.: Mukoepidermoidkarzinom der Speicheldrüse-Ungewöhnliche Varianten mit Nachweis der Translokation t(11,19)(q21;p13). Pathol 6, 2009, S. 472-477. 132 242 Schwarz S, Zenk J, Müller M, Ettl T, Wünsch PH, Hartmann A, Agaimy A. The many faces of acinic cell carcinomas of the salivary glands: a study of 40 cases relating histological and immunohistological subtypes to clinical parameters and prognosis. Histopathology. 2012 Sep;61(3):395-408. 243 Sciubba J.J., Shimano M.: Oncocytic carcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 235. 244 Seifert G.: Mucoepidermoid carcinoma in a salivary duct cyst of the parotid gland. Contribution to the development of tumours in salivary gland cysts. Pathol Res Pract 192, 1996, S. 1211-1217. 245 Seifert G., Miehlke A., Haubrich J., Chilla R.: Speicheldrüsenkrankheiten. Pathologie-Klinik-Therapie-Fazialischirurgie. Thieme, Stuttgart New York, 1984. 246 Seifert G., Okabe H., Caselitz J.: Epithelial salivary gland tumors in children and adolescents. Analysis of 80 cases (Salivary Gland Register 1965-1984). ORL J Otorhinolaryngol Relat Spec 48, S. 137-149. 247 Seifert G., Schulz J.P.: Das Adenoakarzinom der Speicheldrüsen. Pathohistologie und Suklassifikation von 77 Fällen. HNO 33, S. 433- 442. 248 Seifert G., Sobin L.H.: Histological Typing of Salivary Gland Tumours. 2. Auflage Springer-Verlag: Berlin, 1991. 249 Seliger B., Maeurer J., Ferrone S.: TAP off- tumors on. Immunol Today 18, 1997, S. 292-299. 250 Seliger B., Markus J., Maeurer J., Soldano F.: Antigen-processing machinery breakdown and tumorgrowth. Immunol Today 9, 2000, S.455464. 251 Seliger B., Stoehr R., Handke D., Müller A., Soldano F., Wullich B., Tannapfel A., Hofstaedter F., Hartmann A.: Association of HLA class I antigen abnormalities with disease progression and early recurrence in prostate cancer. Cancer Immunol Immunther 59, 2010, S. 529-540. 252 Sheen T.S., Tsai C.C., Ko J.Y., Chang Y.L., Hsu M.M.: Undifferentiated carcinoma of the major salivary glands. Cancer 80, 1997, S. 357-363. 133 253 Shemen L.J., Huvos A.G., Spiro R.H.: Squamous cell carcinoma of salivary gland origin. Head Neck Surg 9, 1987, S. 235-240. 254 Shintaku M., Honda T.: Identification of oncocytic lesions of salivary glands by anti-mitochondrial immunohistochemistry. Histopathol 31, 1997, S. 408-411. 255 Sidhu G., Forrster E.: Acinic cell carcinoma: long-term survival after pulmonary metastases. Light and electron microscopic study. Cancer 40, 1977, S. 756-765. 256 Simpson R.H.W., Prasad A.R., Lewis J.E., Skalova A., David L.: Mucin-rich variant of salivary duct carcinoma: a clinicopathologic and immunohistochemical study of four cases. Am J Surg Pathol 27, 2003, S. 1070-1079. 257 Simpson R.H., Skalova A.: Metastatic carcinoma of the prostate presenting as parotid tumour. Histopathol 30, 1997, S. 7074. 258 Singh R., Cawson R.A.: Malignant myoepithelial carcinoma (myopithelioma) arising in a pleomorphic adenoma of the parotid glang. Oral Surg Oral Med Oral Pathol 66, 1988, S. 65-70. 259 Sironi M., Isimbaldi G., Claren R., Delpiano C., Di Nuovo F., Spinelli M.: Carcinosarcoma of the parotid gland: cytological, clinicopathological and immunohistochemical study of a case. Pathol Res Pract 196, 2000, S. 511-517. 260 Skálová A., Jäkel K.T.: Myoepithelial carcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 240-241. 261 Skalova A., Starek I., Kucerova V., Szepe P., Plank L.: Salivary duct carcinoma- a highly aggressive salivary gland tumor with HER-2/neu oncoprotein overexpression. Pathol Res Pract 197, 2001, S. 621-626. 262 Skalova A., Starek I., Vanecek T., Kucerova V., Plank L., Szepe P., DiPalma S., Leivo I.: Expression of HER-2/neu gene and protein in salivary duct carcinoma of parotid gland as revealed by fluorescence in situ hybridization and immunohistochemistry. Histopathol 42, 2003, S. 1-9. 134 263 Soini Y., Kamel D., Nuorva K., Lane D.P., Vahakangas K., Paakko P.: Low p53 protein expression in salivary gland tumours compared with lung carcinomas. Virchows Arch A Pathol Anat Histopathol 421, 1992, S.415-420. 264 Speight P.M., Barrett A.W.: Salivary gland tumors. Oral diseases 8, 2002, S. 229-240. 265 Spiro R.H., Huvos A.G., Strong E.W.: Adenocarcinoma of salivary origin. Clinicopathologic study of 204 patients. Am J Surg 144, 1982, S. 423-431. 266 Spiro R.H., Huvos A.G., Strong E.W.: Adenoid cystic carcinoma of salivary origin. A clinicopathologic study of 242 cases. Am J Surg 128, 1974, S. 512-520. 267 Squires J.E., Mills S.E., Cooper P.H., Innes D.J., McLeean W.C.: Acinic cell carcinoma. Its occurrence in the laryngotracheal junction after thyroid radiation. Arch Path lab Med 105, 1981, S. 266-268. 268 Stallmach I., Zenklusen P., Komminoth P., Schmid S., Perren A., Roos M., Jianming Z., Heitz P.U., Pfaltz M.: Loss of heterozygosity at chromosome 6q23-25 correlates with clinical and histologic parameters in salivary gland adenoid cystic carcinoma. Virchows Arch 440, 2002, S. 77-84. 269 Stanley M.W., Torsten L.: Mucin production by pleomorphic adenomas of the parotid gland. A cytological spectrum. Diagn Cytopathol 6, 1990, S. 49-52. 270 Stene T., Koppang H.S.: Intraoral adenocarcionoms. J Oral Pathol 10, 1981, S. 216-225. 271 Stephen J., Batsakis J.G., Luna M.A., Heyden U. van der, Byers R.M.: True malignant mixed tumor (carcinosarcoma) of salivary gland. Oral Surg Oral Med Oral Pathol 61, 1986, S. 597-602. 272 Sterman B.M., Kraus D.H., Sebek B.A.,Tucker H.M.: Primary squamous cell carcinoma of the parotid gland. Laryngoscope 100, 1990, S. 146-148. 273 Sun E.C., Curtis R., Melbye M., Goedert J.J.: Salivary gland cancer in the United States. Cancer Epidemiol Biomarkers Prev 8, 1999, S. 1095-1100. 135 274 Swanson G.M., Belle S.H.: Cancer morbidity among woodworkers in the U.S. automotive industry. J Occup Med 24, 1982, S. 315-319. 275 Swanson G.M., Burns P.B.: Cancer incidence among women in the workplace: a study of the association between occupation and industry and 11 cancer sites. J Occup Environ Med 37, 1995, S. 282-287. 276 Swanson G.M., Burns P.B.: Cancers of the salivary gland: workplace risks among women and men. Ann Epidemiol 7, 1987, S. 369-374. 277 Szanto P.A., Luna M.A., Tortoledo M.E.,White R.A.: Histologic grading of adenoid cystic carcinoma of the salivary glands. Cancer 54, 1984, S. 1062-1069. 278 Takahashi H., Fujita S., Okabe H., Tsuda N., Tezuka F.: Distribution of tissue markers in acinic cell carcinomas of salivary gland. Pathol Res Pract 188, 1992, S. 692-700. 279 Takata T., Nikai H., Ogawa I., Ijuhin N.: Ultrastructural and immunhistochemical observation of a true malignant mixed tumor (carcinosarcoma) of the tongue. J Oral Pathol Me 19, 1990, S. 261-265. 280 Takeda A., Matsuyama N., Sugimoto Y.: Oncocytic adenocarcinoma of the ovary. Virchows Arch A Pathol Anat 399, 1983, S. 345-353. 281 Takeichi N., Hirose F., Yamamoto H., Ezaki H, Fujikura T.: Salivary gland tumors in atomic bomb survivors, hiroshima, japan. II. Pathologic study and supplementary epidemiologic observations. Cancer 5, 1983, S. 377-385. 282 Tanaka K., Tsuchikawa T., Miyamoto M.: Down-regulation of human leukocyte antigen class I heavy chain in tumors cancer patients. Int. J. Oncol. 2011; 40; 965–974. 47. 283 Tazawa K., Kurihara Y., Kamoshida S., Tsukada K., Tsutsumi Y.: Localization of prostate-specific antigen-like immuno -reactivity in human salivary gland and salivary gland tumors. Pathol Int 49, 1999, S. 500-505. 136 284 Teo P., Yu P., Lee W.Y., Leung S.F.,Kwan W.H., Yu K.H., Choi P., Johnson P.J.: Significant prognosticators after primary radiotherapy in 903 nondisseminated nasopharyngeal carcinoma evaluated by computertomography. Int J Radiat Oncol Biol Phys 36, 1996, S. 291304. 285 Terhaard C.H.J., Lubsen H., Tweel van der I., Hilgers F.j.M., Eijkenboom W.M.H., Marres H.A.M., Tijho-Heslinga R.E., Jong de J.M.A., Roodenburg J.L.N.: Salivary Gland Carcinoma: Independent Prognostic Factors For Locoregional Control, Distant Metastases, And Overall Survival: Results of the Dutch Head And Neck Oncology Cooperative Group. Wiley Interscience 7, 2004, S. 681-693. 286 Thackray A.C., Lucas R.B.: Tumors of major salivary glands. Armed Forces Institute of Pathology, Washington DC, 1974. 287 Thompson L.D., Wenig B.M., Ellis G.L.: Oncocytomas of the submandibular gland. A series of 22 cases and a review of the literature. Cancer 78, 1996, S. 2281-2287. 288 Tilman B., Drüeke A., Ziad A.: Beta2-Microglobulin. Interscience 22, 2009, S. 378-380. 289 Toida M., Balazs M., Mori T., Ishimaru J.I., Ichihara H., Fujitsuka H., Hyodo I., Yokoyama K., Tatematsu N., Adany R.: Analysis of genetic alterations in salivary gland tumors by comparative genomic hybridization. Cancer Genet Cytogenet 127, 2001, S. 34-37. 290 Tomita T., Lotuaco L., Talbott L., Watanabe I.: Mucoepidermiod carcionoma of the subglottis. An ultrastructural study. Arch Pathol Lab Med 101, 1997, S. 145-148. 291 Tortoledo M.E., Luna M.A., Batsakis J.G.: Carcinomas ex pleomorphic adenoma and malignant mixed tumors. Histomorphologic indexes. Arch Otolaryngol 110, 1984, S. 172-176. 292 Tsai C.C., Chen C.L., Hsu H.C.: Expression of Epstein-Barr virus in carcinomas of major salivary glands: a strong association with lymphoepithelioma-like carcinoma. Hum Pathol 27, 1996, S. 258-262. 293 Tsang W.Y.W., Kuo T.T., Chan J.K.C.: Lymphoepithelial carcinoma. In: Barnes L. (Herg.), Eveson J.W. (Herg.), Reichert P. (Herg.), Sidransky P.: Pathology and Genetics of Head and Neck Tumors, WHO OMS, Lyon, 2005, S. 251-252. 137 294 Van Endert P.M.: Genes regulating MHC-class I processing of antigen. Curr. Immunol 11, 1999, S. 82-88. 295 Vargas P.A., Gerhard R., Araujo Filho V., de Castro I.V.: Salivary gland tumors in a Brazilian population: a retrospective study of 124 cases. Rev Hosp Clin Fac Med Sao Paulo 57, 2002, S. 271-276. 296 Vaupel P.: Funktion des Magen -Darm Traktes. In: Schmidt R.F. (Hers), Lang F. (Hers), Thews G. (Hers): Physiologie des Menschen mit Pathophysiologie. 29. Auflage, Springer-Verlag, S. 338-348. 297 Waldron C.A., El Mofty S.K., Gnepp D.R.: Tumors of the intraoral minor salivary glands: a demographic and histologic study of 426 cases. Oral Surg Oral Med Oral Pathol 66, 1988, S. 323-333. 298 Waßmuth R.: Einführung in das HLA-System. Ecomed-Verlag, Landberg/Lech, 2005, S. 31-37. 299 Weiler C., Zengel P., van der Wal J.E., Guntinas-Lichius O., Schwarz S., Harrison J.D., Kirchner T., Ihrler S.: Carcinoma ex pleomorphic adenoma with special reference to the prognostic significance of histological progression: a clinicopathological investigation of 41 cases. Histopathology. 2011 Oct;59(4):741-50. 300 Welsch U.: Lehrbuch Histologie. 2. Auflage, Urban und Fischer, München, 2006, S. 352-357. 301 Wenig B.M., Harpaz N., Del Bridge C.: Polymorphous low-grade adenocarcinoma of seromucous glands of the nasopharynx. A report of a case and a discussion of the morphologic and immunohistochemical features. Am J Clin Pathol 92, 1989, S. 104-109. 302 Whiteside T.-L., Stanson J., Shurin M.-R., Ferrone S.: Antigen-Processing Machinery in Human Dendritic Cells: Up-Regulation by Maturation and Down-Regulation by Tumor Cells. J of immunl 173, 2004, S. 1526-1534. 303 Williams S.B., Ellis G.L., Auclair P.L.: Immunohistochemical analysis of basal cell adenocarcinoma. Oral Surg Oral Med Oral Pathol 75, 1993, S. 64-69. 138 304 Williams M.D., Roberts D., Blumenschein G., Temam S., Kies M.S., Rosenthal D.I., Weber R.S., El-Naggar A.K.: Differential Expression of Hormonal and Growth Factor receptors in Salivary Duct Carcinomas. Am J Surg Pathol 11, 2007, S. 1645-1652. 305 Woodard B.H., Shelburne J.D., Vollmer R.T., Postlethwair R.W.: Mucoepidermoid carcinoma of the esophagus: A case report. Hum Pathol 9, 1978, S.352-354. 306 Wynder E.L., Covey L.S., Mabuchi K., Mushinski M.: Environmental factors in cancer of the larynx: a second look. Cancer 38, 1976, S. 1591-1601. 307 Xiao-Lin L., Dongqing Z., Yoshinobu O., Glass J., Mathis J.-M., Qian-Jin Z.: Priming of immune responses against transporter associated with antigen processing (TAP)deficient tumors: tumor direct priming. Immunol 128, 2009, S. 420-428. 308 Yaku Y., Kanda T., Yoshihara T., Kaneko T., Nagao K.: Undifferentiated carcinoma of the parotid gland. Case report with electron microscopic findings. Virchows Arch A Pathol Anat Histopathol 401, 1983, S. 89-97. 309 Yoo J., Robinson R.A.: H-ras gene mutations in salivary gland mucoepidermoid carcinomas. Cancer 88, 2000, S. 518523. 310 Yousem S., Hochholzer L.: Mukoepidermoid tumors of the lung. Cancer 60, 1987, S. 1346-1352. 311 Zeidler R., Elssner G., Meissner P., Uebel S., Tampé R., Lazis S., Hammerschmidt W.: Downregulation of Tap1 in B lymphocytes by cellular and Epstein-Barr-encoded interleukin-10. Blood 90, 1997, S. 2390-2397. 312 Zhang L., Conejo-Garcia J.R., Katsaros D., Gimotty P.A., Massobrio M., Regnani G., Makrigiannakis A., Gray H., Schlienger K., Liebman M.N., Rubin S.C., Coukos G.: Intratumoral T cells, recurrence, and survival in epithelial ovarian cancer. N Engl J Med. 348, 2003, S. 203-213. 313 Zohar Y., Shem-Tov Y., Gal R.: Salivary duct carcinoma in major and minor salivary glands. A clinicopathological analysis of four cases. J Craniomaxillofac Surg 16, 1988, S. 320-323. 139 8 Abkürzungsverzeichnis Abb. Abbildung OCC onkozytäres Karzinom ACC adenoidzystisches Karzinom p Protein ACCC Azinuszellkarzinom PAS Periodic-acid-Schiff ADC Adenokarzinom PEC Plattenepithelkarzinom ADH Antidiuretisches Hormon PLGA polymorphes low-grade AFIP Armed Forces Institute of Pathology AG Ausführungsgang BCC Basalzellkarzinom ß2-MG Adenokarzinom PMMT primärer maligner Mischtumor β2-Mikroglobulin PSA Prostata spezifisches Antigen bzw. beziehungsweise RC rhabdoides Karzinom ca. circa rER raues Endoplasmatisches CAC Zystadenokarzinom CEA Carcino-Embryonales-Antigen RR relatives Risiko CK Zytokeratin S Svedberg Cnx Calnexin SCC kleinzelliges Karzinom Crt Calreticulin Schs. Schaltstück EMA Epitheliales Membranantigen SDC Speichelgangkarzinom EMC Epithelial-myoepitheliales Karzinom SMA smooth muscle antibodies GCDFB-15 Gross-Cystic-Disease-Fluid- Retikulum Sog. sogenannt Protein 15 Stst. Streifenstück GFAP Gliäres-Fibrilläres-Azides Protein Tab. Tabelle Gl. Glandula Tps Tapasin Gll. Glandulae UC undifferenziertes Karzinom HE Hämatoxylin-Eosin v.a vor allem HLA Haupthistokompatibilitätsantigen WHO Weltgesundheitsorganisation IHC Immunhistochemie i.V.z im Vergleich zu IFN Interferon Ig Immunglobulin kD Kilo Dalton KI Konfidenzintervall kl. klassisch KL1 Pan-Zytokeratin LOH Verlust der Heterogenität MEC Mukoepidermoidkarzinom M. Musculus MHC Major-Histokompatibilitätsantigene 140 8. Danksagung und Lebenslauf PD Dr. Stephan Schwarz-Furlan für die fachliche Betreuung und das Erlernen wissenschaftlichen Arbeitens. Ohne seine Unterstützung wäre diese Arbeit niemals entstanden. Seine Freude an der Pathologie ist eine Inspiration. PD Dr. Agaimy für das Erklären besonderer morphologischer Merkmale der Speicheldrüsenkarzinome am Lichtmikroskop. Prof. Dr. Wünsch, Prof. Dr. Dr. Neukam, Prof. Dr. Iro und Prof. Dr. Dr. Farmand, die dazu beitrugen, dass die Fallserie sowohl anhand von pathologischen Befunden als auch anhand von klinischen Daten zusammengestellt werden konnte. Frau Dr. Petsch und Frau Dr. Klinkhammer-Schalke: Die Informationen über das Tumorzentrum Erlangen bzw. Regensburg waren wesentlich für das Sammeln klinischer Daten. Rudolf Jung für sein labortechnisches Geschick, Frau Zimmermann sowie Frau Landin-Stöber für ihr organisatorisches Engagement. Meinen Eltern und meinem Großvater für ihre Ratschläge und ihr Interesse. Persönliche Daten Name Maximilian Müller Geburtsdatum 21.10.1985 Geburtsort Fürth Familienstand ledig Schulausbildung 1993-1996 Grundschule Tennenlohe 1996-2005 Christian-Ernst-Gymnasium, Erlangen 141 Hochschulausbildung 2006-2008 Johannes Gutenberg Universität Mainz, vorklinischer Abschnitt 2008-2012 Friedrich Alexander Universität Erlangen-Nürnberg, klinischer Abschnitt und Erlangung der Approbation Wissenschaftliche Arbeiten Salivary gland mucoepidermoid carcinoma is a clinically, morphologically and genetically heterogeneous entity: a clinicopathological study of 40 cases with emphasis on grading, histological variants and presence of the t(11;19) translocation. Schwarz S, Stiegler C, Müller M, Ettl T, Brockhoff G, Zenk J, Agaimy A. Histopathology. 2011 Mar; 58(4):557-70. Morphological heterogeneity of oral salivary gland carcinomas: a clinicopathologic study of 41 cases with long term follow-up emphasizing the overlapping spectrum of adenoid cystic carcinoma and polymorphous low-grade adenocarcinoma. Schwarz S, Müller M, Ettl T, Stockmann P, Zenk J, Agaimy A. Int J Clin Exp Pathol. 2011 Apr; 4(4):336-48. Loss of PTEN is associated with elevated EGFR and HER2 expression and worse prognosis in salivary gland cancer. Ettl T, Baader K, Stiegler C, Müller M, Agaimy A, Zenk J, Kühnel T, Gosau M, Zeitler K, Schwarz S, Brockhoff G. Br J Cancer. 2012 Feb 14;106(4):719-26. The Prognostic Impact of Human Leucocyte Antigen (HLA) Class I Antigen Abnormalities in Salivary Gland Cancer. A Clinico-pathological Study of 288 Cases. Müller M, Agaimy A, Zenk J, Ettl T, Hartmann A, Seliger B, Schwarz S. J Histpathology, 2013 May;62(6):847-59. 142 Promotionsarbeit 07.2009-05.2013 Die Modulation immunologisch relevanter endogener Antigene und ihre prognostische Bedeutung in Speicheldrüsenkarzinomen. Famulaturen 09.2008 Prof. Dr. A. Hartmann, Pathologisches Institut, Erlangen 03.2009 Prof. Dr. G. Schuler, Dermatologie und Venerologie, Erlangen 09.2009 Prof. Dr. A. Junger, Anästhesie und Intensivmedizin, Nürnberg 03.2010 PD Dr. F.-M. Reinhardt, Neurologie und neurologische Rehabilitation, Erlangen 09.2010 Prof. Dr. H. Iro, Hals-Nasen-Ohrenheilkunde, Erlangen 09.2010 Prof. Dr. M. Wilhelm, Medizinische Klinik 5, Nürnberg Praktisches Jahr 02.2011-06.2011 Prof. Dr. M. Wilhelm, Medizinische Klinik 5, Nürnberg 06.2011-09.2011 Prof. Dr. H. Rupprecht, Chirurgische Klinik 1, Fürth 10.2011-01.2012 Prof. Dr. Dr. h.c. J. Schüttler, Anästhesiologische Universitätsklinik, Erlangen Zusätzliche berufliche Erfahrungen 07.2005-04.2006 Zivildienstleistender in der Neurochirurgie der Universität Erlangen 11.2008-01.2009 Studentische Hilfskraft, Zusammenarbeit des pathologisches Instituts Erlangen und des mittelfränkischen Tumorzentrums Seit 08.2012 Assistenzarzt in der Onkologie/ Hämatologie/ Knochenmarktransplantationen/ Palliativmedizin/ Infektiologie/ Hämostasiologie Klinikum Nürnberg 143 Besondere Kenntnisse Sprachen Latein (9 Jahre), Englisch (5 Jahre), Spanisch (2 Jahre) EDV Word, Excel, Power-Point, Soarian, SAP, PASWStatistics Fortbildung Absolvieren des Strahlengrundkurses, Wahlfach der Inneren Medizin. Sport Tennistrainer (Klasse C) und Jugendwart beim SV Tennenlohe Aktivitäten Erlangen, der 10.01.2015 Tennis und Ausdauerlauf 7