Grundwissen 8. Klasse (Lachenmayr)
Werbung

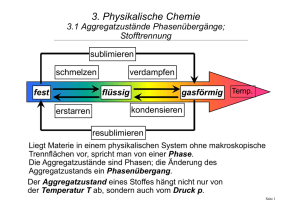
Ein löslicher Stoff (z.B. Salz) ist in einem Lösungsmittel (z.B. Wasser) gelöst. Lösung 8C1 Jede Lösung ist ein homogenes Stoffgemisch: Feststofflösung: Feststoff ist in Flüssigkeit gelöst (Zuckerwasser) Gaslösung: Lösung eines oder mehrerer Gase in einer Flüssigkeit z.B.: Lösung von Kohlenstoffdioxid in Wasser Flüssigkeitsgemisch: Lösung zweier Flüssigkeiten z.B. Alkohol in Wasser (Wein) Homogenes Stoffgemisch (gasförmig/gasförmig) Gasgemisch 8C2 Legierung 8C3 Mischung mehrerer Gase z.B.: Luft (Stickstoff, Sauerstoff, Kohlenstoffdioxid…) Homogenes Stoffgemisch aus Metallen (fest/fest) z.B. Messing aus Kupfer und Zink oder Bronze aus Kupfer und Zinn Heterogenes Stoffgemisch (fest/flüssig) Suspension 8C4 Aufschlämmung von Feststoffteilchen (mit Sand verschmutztes Wasser, Aufschlämmung von Kreide usw.) Heterogenes Stoffgemisch (flüssig/flüssig) Emulsion 8C5 Tröpfchenaufschwemmung zweier nicht mischbarer Flüssigkeiten (z.B. Milch: Fetttröpfchen – Wasser) Heterogenes Stoffgemisch (fest/gasförmig) Rauch 8C6 Gemisch aus Feststoffteilchen und Gas(en) Heterogenes Stoffgemisch (flüssig/gasförmig) Nebel 8C7 Stoffgemische 8C8 Gemisch aus Tröpfchen und Gas(en) Stoffgemische haben je nach dem Mischungsverhältnis der beteiligten Stoffe veränderliche Gemischeigenschaften. Sie sind durch physikalische Trennverfahren (Filtrieren, Destillieren, Sedimentieren, Extrahieren usw.) in Reinstoffe trennbar; homogene G. bestehen aus einer einzige Phase, d.h. haben ein einheitliches Aussehen, heterogene G. aus mehreren Phasen, d.h. haben ein uneinheitliches Aussehen. Reinstoffe 8C9 Jeder Reinstoff hat charakteristische, unveränderliche Kenneigenschaften wie z.B. Siedepunkt, Schmelzpunkt, Dichte, Aggregatszustand bei RT, Leitfähigkeit, Geruch, Farbe, Kristallform…. Reinstoffe sind durch physikalische Trennverfahren wie z.B. Destillieren oder Filtrieren nicht weiter trennbar. Alle Stoffe bestehen aus kleinsten Teilchen. Teilchenmodell 8C10 Teilchen können sein: Atome (atomos gr. = unteilbar) Moleküle (zusammengesetzte Teilchen) oder Ionen (geladene Teilchen) Aggregatszustände Fest, flüssig oder gasförmig Übergang von – nach: festflüssig = schmelzen, flüssiggasförmig = verdampfen, flüssigfest = erstarren, gasförmigflüssig = kondensieren, festgasförmig = sublimieren, gasförmigfest = resublimimieren 8C11 Verbindung 8C12 Stoffebene: ein Reinstoff, der aus zwei oder mehreren Elementen durch eine chemische Reaktion entstanden ist. Teilchenebene: ein Stoff, der die verschiedenen Teilchen zweier oder mehrerer Elemente in einem bestimmten Zahlenverhältnis enthält. Element 8C13 Stoffebene: Ein Stoff mit best. Kenneigenschaften, der (chemisch) nicht mehr weiter in andere Stoffe zerlegt werden kann; jedem Element ist ein Elementsymbol zugeordnet Teilchenebene: Verband aus Teilchen (Atomen, Molekülen) einer einzigen Art ,d.h. derselben Protonenzahl. Eine chemische Formel gibt das Zahlenverhältnis an, in dem die Atome in einer chemischen Verbindung vorkommen. Chemische Formel 8C14 Chemische Reaktion 8C15 Reaktionsgleichung 8C16 So gibt z.B. die Formel H2O an, dass in der Verbindung Wasser die Elemente Wasserstoff und Sauerstoff im Verhältnis 2:1 vorkommen. Der Index (tief gestellte Zahl) bezieht sich auf das links davor stehende Elementsymbol. Stoffebene: Vorgang, bei dem aus einem oder mehreren Reinstoffen ein oder mehrere neue Reinstoffe entstehen; Chemische Reaktionen sind Stoff- und Energieumwandlungen Teilchenebene: Chemische Reaktionen sind gekennzeichnet durch • Umordnung und Veränderung von Teilchen • Umbau von chemischen Bindungen Die Reaktionsgleichung gibt an, welche Teilchen in welchem kleinstmöglichem Zahlverhältnis miteinander reagieren bzw. entstehen. Beispiel: CH4 + 2 O2 CO2 + 2 H2O bedeutet: 1 Methanmolekül reagiert mit 2 Molekülen Sauerstoff zu 1 Molekül Kohlenstoffdioxid und 2 Molekülen Wasser. Innere Energie 8C17 Energie 8C18 die in einem Stoff oder in Stoffen gespeicherte Energie; Energievorrat im Inneren eines Systems (=Edukte oder Produkte) Fähigkeit eines Systems, Arbeit zu verrichten; Formen der Energie sind z.B.: Wärme-, Licht-, Lage-, Bewegungsenergie, elektrische, mechanische, chemische Energie Energie geht nicht verloren. Die verschiedenen Energieformen sind jedoch ineinander umwandelbar. Reaktion, bei der Wärme frei wird; Ei exotherme Reaktion E1 Aktivierungsenergie Edukte ∆Ei < 0 8C19 Produkte E2 Reaktionskoordinate Reaktion, bei der Wärme verbraucht wird (ständige Wärmezufuhr) Ei endotherme Reaktion 8C20 Aktivierungsenergie E1 Produkte ∆Ei > 0 E2 Edukte Reaktionskoordinate Aktivierungsenergie 8C21 Atom 8C22 Die zur Auslösung einer Reaktion erforderliche Energie. Die Edukte werden durch die Aktivierungsenergie in einen reaktiven Zustand versetzt. Bei exothermen Reaktionen sind die Edukte in einem metastabilen Zustand, d.h. sie reagieren unmessbar langsam, sie gehen nicht spontan in einen stabilen (energiearmen Zustand) über; instabil ist der Zustand nach Zuführung der EA. Das Atom ist das kleinste Teilchen eines Elements. In der Atomhülle befinden sich Elektronen, im Atomkern, die Protonen und Neutronen. Die Atome eines Elementes haben die gleiche Protonenzahl. Die Nukleonenzahl A ist die Summe aus Protonenzahl Z und Neutronenzahl N: A = Z + N Atome gleicher Protonenzahl, aber verschiedener Neutronenzahl und damit verschiedener Masse. Beispiel: Isotop 8C23 Teilchenmasse 8C24 Die Masse eines Teilchens (Atommasse mA, Molekülmasse mM) wird in der Regel in der atomaren Masseneinheit u angegeben, die als 1/12 der Masse des C-12 Atoms definiert ist. 1u entspricht in etwa der Masse eines H-Atoms. Molekül 8C25 Moleküle sind Verbände aus Nichtmetallatomen, die bei Elementen aus gleichartigen Atomen, bei Verbindungen aus verschiedenartigen Atomen bestehen. Die Molekülformel gibt an, wie viele Atome im Molekül vorhanden sind. Beispiele: H2: Element H2O: Verbindung NH3: Verbindung Wasserstoff (H2) Elemente, die als zweiatomige Moleküle vorkommen 8C26 Stickstoff (N2) Sauerstoff (O2) alle Elemente der 7. Hauptgruppe (Halogene) Fluor (F2) Chlor (Cl2) Brom (Br2) Iod (I2) Positiv geladener Kern: Protonen (p+) + Neutronen (n) = Nukleonen Negativ geladene Hülle (e-) Atombau 8C27 Energiestufenmodell der Atomhülle (Bohr`sches Atommodell) 8C28 Die Atomhülle ist in „Schalen“ (Energiestufen) K, L, M, .. Q bzw. Hauptquantenzahl (n = 1, 2 ..7) gegliedert und maximal mit 2 n 2 Elektronen besetzt. Der Raum mit der größten Aufenthaltswahrscheinlichkeit wird Orbital genannt, da weder Ort noch Bahn eines Elektrons exakt bestimmt werden können. Periodensystem der Elemente (PSE) 8C29 Metalle (links von der Diagonale) Halbmetalle (auf der Diagonale) Nichtmetalle (rechts von der Diagonale) Energie, die zur Abtrennung eines Elektrons aus einem Atom benötigt wird Ionisierungenergie 8C30 Salze 8C31 Ion Ionenbindung Ionengitter Bei der Synthese von Metallen und Nichtmetallen entstehen Salze (Ionenverbindungen) mit folgenden Eigenschaften: Kristallinität, Sprödigkeit, elektrische Leitfähigkeit in Lösungen und Schmelzen Nicht aber im festen Zustand ! (Leiter 2. Ordnung) Elektrisch geladene Atom (Atom-Ionen) oder Atomverbände (Molekül-Ionen) Anionen (negativ geladen) und Kationen (positiv geladen) ziehen sich gegenseitig an und bilden ein Ionengitter 8C32 Ionenverbindungen sind Salze Edelgas-Konfiguration Oktettregel 8C33 MetalleMetallbindung Besonders stabile Elektronenkonfiguration (e- Anordnung) gleich der eines Edelgase, in der Regel 8 Valenzelektronen = Außenelektronen (Elektronenoktett) [Ausnahme Helium (Elektronendublett)] Metallischer Glanz , gute Wärmeleitfähigkeit Elektrische Leitfähigkeit (Leiter 1. Ordnung) Elektronen als Ladungsträger (Elektronengas-Modell) Leichte Verformbarkeit (Metallgitter-Modell) 8C34 Valenzelektronen Valenzstrich-Schreibweise 8C35 Elektronen der äußersten Schale (Energiestufe)