AG Huntington - Institut für Medizinische Genetik und angewandte
Werbung
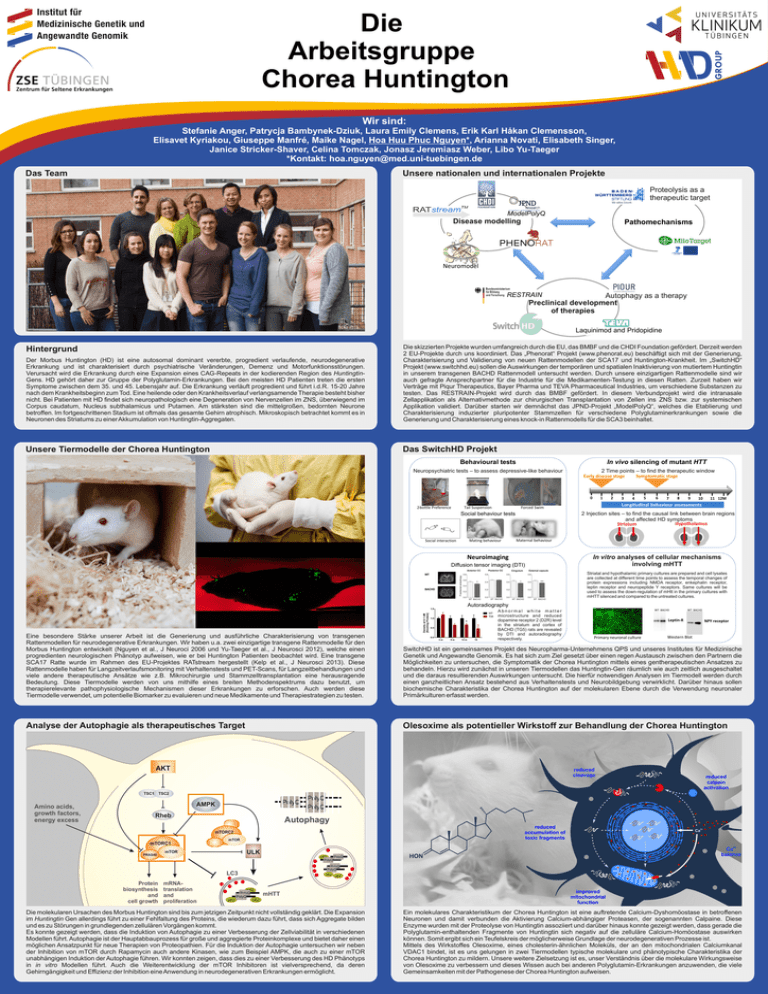
GROUP Die Arbeitsgruppe Chorea Huntington Wir sind: Stefanie Anger, Patrycja Bambynek-Dziuk, Laura Emily Clemens, Erik Karl Håkan Clemensson, Elisavet Kyriakou, Giuseppe Manfré, Maike Nagel, Hoa Huu Phuc Nguyen*, Arianna Novati, Elisabeth Singer, Janice Stricker-Shaver, Celina Tomczak, Jonasz Jeremiasz Weber, Libo Yu-Taeger *Kontakt: [email protected] Das Team Unsere nationalen und internationalen Projekte Proteolysis as a therapeutic target ModelPolyQ T Disease modelling pe ra he Pr ed ic oaches appr utic tive mod els Target id io Behav Pathomechanisms ent ific ati on lm ur a s er ark Neuromodel RESTRAIN Autophagy as a therapy Preclinical development of therapies Laquinimod and Pridopidine Der Morbus Huntington (HD) ist eine autosomal dominant vererbte, progredient verlaufende, neurodegenerative Erkrankung und ist charakterisiert durch psychiatrische Veränderungen, Demenz und Motorfunktionsstörungen. Verursacht wird die Erkrankung durch eine Expansion eines CAG-Repeats in der kodierenden Region des HuntingtinGens. HD gehört daher zur Gruppe der Polyglutamin-Erkrankungen. Bei den meisten HD Patienten treten die ersten Symptome zwischen dem 35. und 45. Lebensjahr auf. Die Erkrankung verläuft progredient und führt i.d.R. 15-20 Jahre nach dem Krankheitsbeginn zum Tod. Eine heilende oder den Krankheitsverlauf verlangsamende Therapie besteht bisher nicht. Bei Patienten mit HD findet sich neuropathologisch eine Degeneration von Nervenzellen im ZNS, überwiegend im Corpus caudatum, Nucleus subthalamicus und Putamen. Am stärksten sind die mittelgroßen, bedornten Neurone betroffen. Im fortgeschrittenen Stadium ist oftmals das gesamte Gehirn atrophisch. Mikroskopisch betrachtet kommt es in Neuronen des Striatums zu einer Akkumulation von Huntingtin-Aggregaten. Die skizzierten Projekte wurden umfangreich durch die EU, das BMBF und die CHDI Foundation gefördert. Derzeit werden 2 EU-Projekte durch uns koordiniert. Das „Phenorat“ Projekt (www.phenorat.eu) beschäftigt sich mit der Generierung, Charakterisierung und Validierung von neuen Rattenmodellen der SCA17 und Huntington-Krankheit. Im „SwitchHD“ Projekt (www.switchhd.eu) sollen die Auswirkungen der temporären und spatialen Inaktivierung von mutiertem Huntingtin in unserem transgenen BACHD Rattenmodell untersucht werden. Durch unsere einzigartigen Rattenmodelle sind wir auch gefragte Ansprechpartner für die Industrie für die Medikamenten-Testung in diesen Ratten. Zurzeit haben wir Verträge mit Piqur Therapeutics, Bayer Pharma und TEVA Pharmaceutical Industries, um verschiedene Substanzen zu testen. Das RESTRAIN-Projekt wird durch das BMBF gefördert. In diesem Verbundprojekt wird die intranasale Zellapplikation als Alternativmethode zur chirurgischen Transplantation von Zellen ins ZNS bzw. zur systemischen Applikation validiert. Darüber starten wir demnächst das JPND-Projekt „ModelPolyQ“, welches die Etablierung und Charakterisierung induzierter pluripotenter Stammzellen für verschiedene Polyglutaminerkrankungen sowie die Generierung und Charakterisierung eines knock-in Rattenmodells für die SCA3 beinhaltet. Unsere Tiermodelle der Chorea Huntington Das SwitchHD Projekt Hintergrund Behavioural tests In vivo silencing of mutant HTT Neuropsychiatric tests – to assess depressive-like behaviour 2 Time points – to find the therapeutic window Symptomatic stage Early disease stage 0 2-bottle Preference Tail Suspension Mating behaviour 2 3 4 5 6 7 8 9 10 11 12M Longitudinal behaviour assessments Forced Swim 2 Injection sites – to find the causal link between brain regions and affected HD symptoms Hypothalamus Striatum Social behaviour tests Social interaction 1 Maternal behaviour Neuroimaging Diffusion tensor imaging (DTI) In vitro analyses of cellular mechanisms involving mHTT Striatal and hypothalamic primary cultures are prepared and cell lysates are collected at different time points to assess the temporal changes of protein expressions including NMDA receptor, enkephalin receptor, leptin receptor and neuropeptide Y receptors. Same cultures will be used to assess the down-regulation of mHtt in the primary cultures with mHTT silenced and compared to the untreated cultures. Autoradiography * Abnormal white matter microstructure and reduced dopamine receptor 2 (D2R) level in the striatum and cortex of BACHD (TG5) rats are revealed by DTI and autoradiography respectively. WT BACHD WT BACHD Leptin-R NPY receptor Eine besondere Stärke unserer Arbeit ist die Generierung und ausführliche Charakterisierung von transgenen Rattenmodellen für neurodegenerative Erkrankungen. Wir haben u.a. zwei einzigartige transgene Rattenmodelle für den Morbus Huntington entwickelt (Nguyen et al., J Neuroci 2006 und Yu-Taeger et al., J Neurosci 2012), welche einen progredienten neurologischen Phänotyp aufweisen, wie er bei Huntington Patienten beobachtet wird. Eine transgene SCA17 Ratte wurde im Rahmen des EU-Projektes RATstream hergestellt (Kelp et al., J Neurosci 2013). Diese Rattenmodelle haben für Langzeitverlaufsmonitoring mit Verhaltenstests und PET-Scans, für Langzeitbehandlungen und viele andere therapeutische Ansätze wie z.B. Mikrochirurgie und Stammzelltransplantation eine herausragende Bedeutung. Diese Tiermodelle werden von uns mithilfe eines breiten Methodenspektrums dazu benutzt, um therapierelevante pathophysiologische Mechanismen dieser Erkrankungen zu erforschen. Auch werden diese Tiermodelle verwendet, um potentielle Biomarker zu evaluieren und neue Medikamente und Therapiestrategien zu testen. SwitchHD ist ein gemeinsames Projekt des Neuropharma-Unternehmens QPS und unseres Institutes für Medizinische Genetik und Angewandte Genomik. Es hat sich zum Ziel gesetzt über einen regen Austausch zwischen den Partnern die Möglichkeiten zu untersuchen, die Symptomatik der Chorea Huntington mittels eines gentherapeutischen Ansatzes zu behandeln. Hierzu wird zunächst in unseren Tiermodellen das Huntingtin-Gen räumlich wie auch zeitlich ausgeschaltet und die daraus resultierenden Auswirkungen untersucht. Die hierfür notwendigen Analysen im Tiermodell werden durch einen ganzheitlichen Ansatz bestehend aus Verhaltenstests und Neurobildgebung verwirklicht. Darüber hinaus sollen biochemische Charakteristika der Chorea Huntington auf der molekularen Ebene durch die Verwendung neuronaler Primärkulturen erfasst werden. Analyse der Autophagie als therapeutisches Target Olesoxime als potentieller Wirkstoff zur Behandlung der Chorea Huntington AKT TSC1 Amino acids, growth factors, energy excess Primary neuronal culture Western Blot reduced cleavage reduced calpain activation TSC2 PolyQ AMPK Rheb PolyQ PolyQ Autophagy reduced accumulation of toxic fragments mTORC2 mTORC1 PRAS40 mTOR ULK mTOR p62 Ca2+ Ca2+ balance PolyQ PolyQ PolyQ PolyQ LC3 Protein biosynthesis and cell growth mRNAtranslation and proliferation p62 p62 p62 p62 PolyQ PolyQ mHTT p62 Die molekularen Ursachen des Morbus Huntington sind bis zum jetzigen Zeitpunkt nicht vollständig geklärt. Die Expansion im Huntingtin Gen allerdings führt zu einer Fehlfaltung des Proteins, die wiederum dazu führt, dass sich Aggregate bilden und es zu Störungen in grundlegenden zellulären Vorgängen kommt. Es konnte gezeigt werden, dass die Induktion von Autophagie zu einer Verbesserung der Zellviabilität in verschiedenen Modellen führt. Autophagie ist der Hauptabbauprozess für große und aggregierte Proteinkomplexe und bietet daher einen möglichen Ansatzpunkt für neue Therapien von Proteopathien. Für die Induktion der Autophagie untersuchen wir neben der Inhibition von mTOR durch Rapamycin auch andere Kinasen, wie zum Beispiel AMPK, die auch zu einer mTOR unabhängigen Induktion der Autophagie führen. Wir konnten zeigen, dass dies zu einer Verbesserung des HD Phänotyps in in vitro Modellen führt. Auch die Weiterentwicklung der mTOR Inhibitoren ist vielversprechend, da deren Gehirngängigkeit und Effizienz der Inhibition eine Anwendung in neurodegenerativen Erkrankungen ermöglicht. improved mitochondrial function Ein molekulares Charakteristikum der Chorea Huntington ist eine auftretende Calcium-Dyshomöostase in betroffenen Neuronen und damit verbunden die Aktivierung Calcium-abhängiger Proteasen, der sogenannten Calpaine. Diese Enzyme wurden mit der Proteolyse von Huntingtin assoziiert und darüber hinaus konnte gezeigt werden, dass gerade die Polyglutamin-enthaltenden Fragmente von Huntingtin sich negativ auf die zelluläre Calcium-Homöostase auswirken können. Somit ergibt sich ein Teufelskreis der möglicherweise Grundlage der neurodegenerativen Prozesse ist. Mittels des Wirkstoffes Olesoxime, eines cholesterin-ähnlichen Moleküls, der an den mitochondrialen Calciumkanal VDAC1 bindet, ist es uns gelungen in zwei Tiermodellen typische molekulare und phänotypische Charakteristika der Chorea Huntington zu mildern. Unsere weitere Zielsetzung ist es, unser Verständnis über die molekulare Wirkungsweise von Olesoxime zu verbessern und dieses Wissen auch bei anderen Polyglutamin-Erkrankungen anzuwenden, die viele Gemeinsamkeiten mit der Pathogenese der Chorea Huntington aufweisen.