Quorum sensing in Pflanzen-assoziierten Bakterien
Werbung
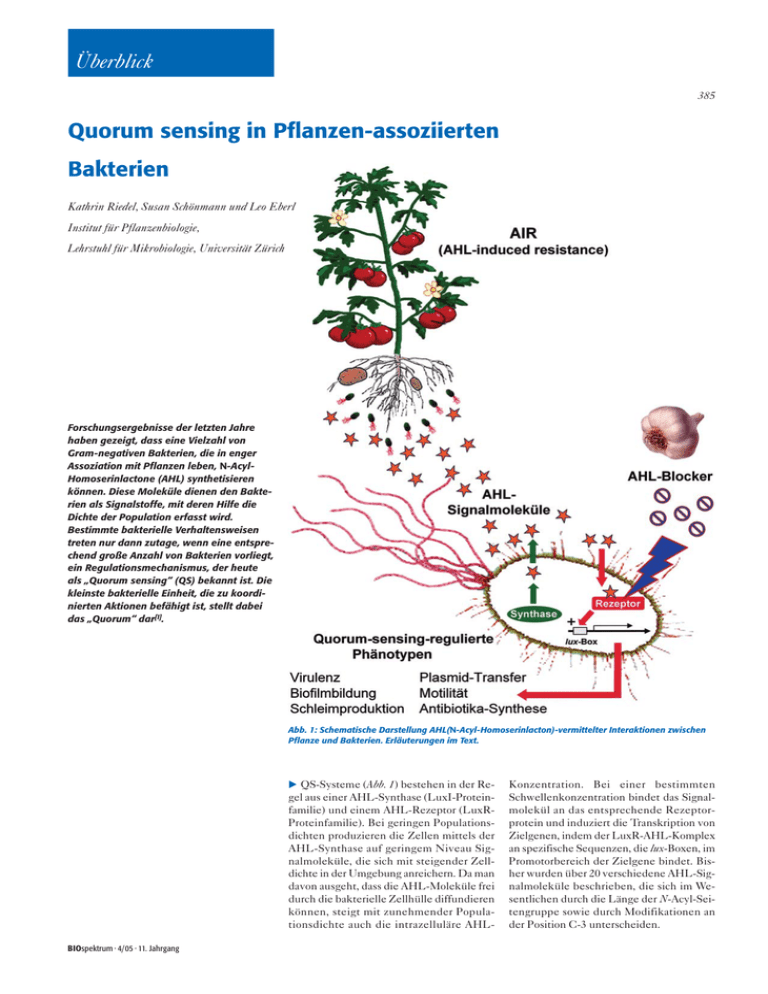
Überblick 385 Quorum sensing in Pflanzen-assoziierten Bakterien Kathrin Riedel, Susan Schönmann und Leo Eberl Institut für Pflanzenbiologie, Lehrstuhl für Mikrobiologie, Universität Zürich Forschungsergebnisse der letzten Jahre haben gezeigt, dass eine Vielzahl von Gram-negativen Bakterien, die in enger Assoziation mit Pflanzen leben, N-AcylHomoserinlactone (AHL) synthetisieren können. Diese Moleküle dienen den Bakterien als Signalstoffe, mit deren Hilfe die Dichte der Population erfasst wird. Bestimmte bakterielle Verhaltensweisen treten nur dann zutage, wenn eine entsprechend große Anzahl von Bakterien vorliegt, ein Regulationsmechanismus, der heute als „Quorum sensing“ (QS) bekannt ist. Die kleinste bakterielle Einheit, die zu koordinierten Aktionen befähigt ist, stellt dabei das „Quorum“ dar[1]. Abb. 1: Schematische Darstellung AHL(N-Acyl-Homoserinlacton)-vermittelter Interaktionen zwischen Pflanze und Bakterien. Erläuterungen im Text. QS-Systeme (Abb. 1) bestehen in der Regel aus einer AHL-Synthase (LuxI-Proteinfamilie) und einem AHL-Rezeptor (LuxRProteinfamilie). Bei geringen Populationsdichten produzieren die Zellen mittels der AHL-Synthase auf geringem Niveau Signalmoleküle, die sich mit steigender Zelldichte in der Umgebung anreichern. Da man davon ausgeht, dass die AHL-Moleküle frei durch die bakterielle Zellhülle diffundieren können, steigt mit zunehmender Populationsdichte auch die intrazelluläre AHLBIOspektrum · 4/05 · 11. Jahrgang Konzentration. Bei einer bestimmten Schwellenkonzentration bindet das Signalmolekül an das entsprechende Rezeptorprotein und induziert die Transkription von Zielgenen, indem der LuxR-AHL-Komplex an spezifische Sequenzen, die lux-Boxen, im Promotorbereich der Zielgene bindet. Bisher wurden über 20 verschiedene AHL-Signalmoleküle beschrieben, die sich im Wesentlichen durch die Länge der N-Acyl-Seitengruppe sowie durch Modifikationen an der Position C-3 unterscheiden. Überblick 386 Tab. 1: Beispiele für QS-Systeme in Pflanzen-assoziierten Bakterien Bakterium Signalmoleküle regulierte Funktionen Pflanzen-pathogene Bakterien Agrobacterium tumefaciens 3-oxo-C8-HSL Konjugativer Transfer Tumor-induzierender Plasmide Burkholderia glumae C8-HSL Virulenz (Produktion des Phytotoxins Toxoflavin) Erwinia sp. 3-oxo-C6-HSL Carbapenem-Biosynthese Produktion von Zellwand-zersetzenden Exoenzymen (z. B. Cellulasen und Pektinasen) Pantoea stewartii 3-oxo-C6-HSL Pathogenität (EPS-Synthese; Virulenzfaktoren) Bakterien mit förderlichen Eigenschaften Burkholderia sp. C8-HSL „Biocontrol“ (antifungale und nematozide Eigenschaften) Biofilmbildung Pseudomonas aureofaciens C6-HSL Antifungale Eigenschaften (Produktion von Phenazin) Rhizobium sp. Sinorhizobium sp. multiple AHL-Moleküle (Acylkette C6 – C18) Symbiose mit Pflanzen Knöllchenbildung zur Stickstofffixierung EPS II-Synthese, Plasmidtransfer Serratia liquefaciens C4-HSL Antibiotika-Produktion, Exoenzyme, Schwärmen Die Produktion von AHL-Signalmolekülen scheint bei Pflanzen-assoziierten Bakterien besonders weit verbreitet zu sein. So zeigten Cha et al.[2], dass fast alle untersuchten Isolate der Gattungen Agrobacterium, Pantoea, Rhizobium und mehr als die Hälfte aller Erwinien und Pseudomonaden AHLSignalmoleküle synthetisieren. Auch in den Rhizosphären von Weizen und Tomate sind AHL-Produzenten verschiedener Gattungen mit etwa zehn Prozent der Gesamtpopulation vertreten[3]. Die QS-regulierten Funktionen in den verschiedenen Pflanzenassoziierten Bakterien sind beispielhaft in Tabelle 1 zusammengefasst. Es fällt dabei auf, dass QS-Systeme häufig die pathogenen oder aber die für die Pflanzen förderlichen Eigenschaften der Bakterien kontrollieren. Dieses Phänomen ist bei den Burkholderien besonders stark ausgeprägt. gen Rezeptorprotein CepR[6]. Wir konnten zeigen, dass dieses QS-System die Ausbildung von Biofilmen, Schwärmermotilität, die Produktion extrazellulärer Proteasen, Siderophore, eines „Biosurfactants“ und weiterer Funktionen reguliert[7, 8] (Abb. 2). Besonders interessant ist die Tatsache, dass das cep-QS-System sowohl pathogene als auch nutzbringende Eigenschaften kontrolliert. So ist die Expression einer Polygalacturonase, die für die Zwiebelpathogenität verantwortlich ist, in B. cepacia ATTC 25416 AHL-reguliert[9]. Eine für die Pflanze vorteilhafte Eigenschaft einiger Burkholderien ist die Unterdrückung pathogener Pilze und Nematoden (Abb. 2). Zhou et al.[10] berichteten, dass die antifungale und nematozide Wirkung von B. ambifaria BC-F – eines Stammes, der zur Bekämpfung verschiede- ner bodenbürtiger Krankheiten von Gurke, Soja und Tomaten eingesetzt wird – QS-reguliert wird. Unsere Untersuchungen haben gezeigt, dass einige Burkholderien den Nematoden Caenorhabditis elegans nach Ingestion töten[11]. In diesem Infektionsprozess spielt das cep-QS-System eine zentrale Rolle, da es die Expression des AidA-Proteins reguliert, das für das Überleben des Bakteriums im Darm des Nematoden essenziell ist[12]. AHL-vermittelter „cross-talk“ in der Rhizosphäre von Tomatenpflanzen Nachdem eine Vielzahl der Rhizobakterien AHL-abhängige Kommunikationssysteme aufweisen, vermuteten wir, dass diese Signalmoleküle nicht nur als Kommunikationsmittel zwischen den Zellen einer Art fungieren, sondern auch artübergreifende Interaktionen zwischen den verschiedenen Populationen ermöglichen. Um diese Hypothese zu testen, wurden Biosensoren entwickelt, welche bei Anwesenheit der Signalstoffe das Grün-fluoreszierende Protein (GFP) exprimieren (Abb. 3A). Diese Biosensoren weisen eine translationale Fusion eines AHL-regulierten Gens mit gfp auf sowie ein luxR-homologes Gen, das konstitutiv exprimiert wird. Da weder das Plasmid noch der Wirtsstamm für eine AHL-Synthase kodieren, kommt es nur dann zur Expression von GFP, wenn AHL-Signalmoleküle von außen zugegeben werden. In einer Reihe Quorum sensing in der Gattung Burkholderia Vertreter der Gattung Burkholderia sind in der Natur weit verbreitet und kommen im Boden, Wasser und in der Rhizosphäre von Pflanzen vor[4]. Besonders häufig können sie aus den Rhizosphären verschiedener Gräser und Kulturpflanzen wie Mais, Weizen, Reis, Kaffee, Sonnenblumen und Erbsen isoliert werden. Ursprünglich wurde Burkholderia cepacia als Erreger der Zwiebelfäule beschrieben[5]. Ganz im Gegensatz zu den pathogenen Vertretern der Burkholderien, sind viele andere Arten in der Lage, die Wirtspflanze gegenüber Pathogenbefall zu schützen und das Pflanzenwachstum zu fördern. In fast allen bislang untersuchten Burkholderia-Arten konnte das cep-QS-System nachgewiesen werden. Dieses besteht aus der AHL-Synthase CepI, welche die Synthese von N-Octanoyl-L-Homoserinlacton (C8-HSL) katalysiert, sowie dem zugehöri- Abb. 2: Schematische Darstellung des cep-QS-Systems. Neben der Regulation der Produktion extrazellulärer hydrolytischer Enzyme kontrolliert der CepR/C8-HSL-Komplex auch die Expression fungizider und nematozider Eigenschaften sowie die Ausbildung von Biofilmen in Burkholderien. BIOspektrum · 4/05 · 11. Jahrgang Überblick Abb. 3: (A) Funktionsweise eines auf GFP basierenden AHL-Biosensors. (B) AHL-abhängige intergenerische Kommunikation in der Rhizosphäre. Tomatenwurzeln wurden mit dem AHL-Biosensor und dem AHL-produzierenden Rhizobakterium Rahnella aquatilis inokuliert. Nach zehntägiger Inkubation wurden die Wurzeln mittels konfokaler Laserscanning-Mikroskopie untersucht. Das Auftreten grün fluoreszierender Zellen weist auf einen AHL-vermittelten „cross-talk“ zwischen den beiden Stämmen hin. von Experimenten, in denen die verschiedenen Biosensoren zusammen mit ausgewählten AHL-produzierenden Rhizobakterien in den Wurzelraum axenisch gezogener Tomatenpflanzen inokuliert wurden, konnte eine deutliche Aktivierung der Sensoren beobachtet werden[3] (Abb. 3B). Unsere Experimente zeigten, dass AHL-Signalmoleküle nicht nur innerhalb einer Art, sondern auch über die Artgrenzen hinweg die Expression von Targetgenen regulieren können. Weiterführende Arbeiten lieferten zudem Hinweise, dass die natürliche mikrobielle Lebensgemeinschaft der Tomatenrhizosphäre AHL-Signalmoleküle in biologisch wirksamen Konzentrationen produziert. AHL-induzierte systemische Resistenz in Tomatenpflanzen Aber nicht nur die Bakterien der Rhizosphäre, sondern auch die Pflanze selbst kann AHL-Signalmoleküle wahrnehmen. So beeinflusst die Anwesenheit von AHL-Molekülen in der Rhizosphäre von Medicago sativa die Expression von über 200 Proteinen in den Wurzeln der Pflanze[13]. Um zu untersuchen, ob die Anwesenheit von AHL-Produzenten in der Rhizosphäre einen stimulierenden Effekt auf das Abwehrsystem der Pflanze hat, wurden Tomatenpflanzen, deren Wurzelraum entweder mit dem AHLproduzierenden Stamm Serratia liquefaciens MG1 oder einer isogenen AHL-Mutante besiedelt wurden, mit dem Pilz Alternaria alternata infiziert[14]. Dabei zeigte sich, dass es bei Anwesenheit des AHL-produzierenden Wildtyps, nicht jedoch bei der Mutante, zu einer Verminderung der Nekrosenbildung kam. Es ist seit geraumer Zeit bekannt, dass die Anwesenheit gewisser Bakterien in der Rhizosphäre die Resistenz der Pflanze gegenüber Pathogenbefall erhöht. Diese „induced systemic resistance (ISR)“ wird durch generelle Elicitoren, wie Lipopolysaccharide und Flagellin, stimuliert. Dabei wird ein Jasmonat- und Ethylen-abhängiger Signalweg in der Pflanze benutzt. Im Gegensatz dazu induzieren nekrotisierende, pathogene Bakterien und Pilze in den oberirdischen Organen eine „systemic acquired resistance (SAR)“, die einen Salicylsäure-abhängigen Signalweg auslöst. Eine Besiedelung der Tomatenwurzel mit dem Wildtyp MG1 führt sowohl zu einer systemischen Erhöhung der Ethylenbiosynthese in den Blättern als auch zu einem Anstieg der Salicylsäure-Konzentration. Makroarray-Analysen wiesen nach, dass AHL-Signalmoleküle die Expression von Abwehrgenen in der Tomatenpflanze stimulieren. Da Hexanoyl-Homoserinlacton als Reinsubstanz sowohl Salicylsäure-, als auch Ethylen- und Jasmonatabhängige Abwehrgene in der Tomatenpflanze induziert, wurde eine neue Form systemischer Resistenz, die „AHL-induced resistance (AIR)“, postuliert. Pflanzen als natürliche Quelle für QS-Inhibitoren Nicht nur bei Pflanzen-pathogenen Bakterien wird die Expression von Virulenzfakto BIOspektrum · 4/05 · 11. Jahrgang Überblick 388 Susan Schönmann Kathrin Riedel geboren 1968; Studium der Biologie in München; Promotion 1998 am Lehrstuhl für Mikro- Leo Eberl geboren 1964; Studium der Technischen Chemie an der TU Graz, Österreich; 1992 Promotion; 1992–1996 Postdoc am geboren 1973; 1997– 2003 Studium der Agronomie an der ETH Zürich; seit 2003 Doktorarbeit am Lehrstuhl für Mikrobiologie der Universität Zürich. biologie (Prof. Schleifer) der TU München; 1999– 2000 DFG-Stipendiatin am BioCentrum der DTU, Dänemark (Prof. Molin); 2001–2003 Wiss. Assistentin am Lehrstuhl für Mikrobiologie der TU München; seit 2004 Wiss. Oberassistentin und Leiterin der Proteomgruppe am Lehrstuhl für Mikrobiologie der Universität Zürich. Department of Microbiology der Technischen Universität Kopenhagen, Dänemark; 1996– 1997 EU-Stipendiat am Lehrstuhl für Mikrobiologie der TU München; 1998–2002 Wiss. Assistent an der TU München und Leiter der Arbeitsgruppe bakterielle ZellZell Kommunikation; 2001 Habilitation; seit 2003 Professor für Mikrobiologie an der Universität Zürich. ren häufig durch QS-Systeme kontrolliert, sondern auch bei humanpathogenen Keimen. Eine Unterbrechung der Kommunikationssysteme stellt somit ein attraktives Target für die Entwicklung neuer antibakterieller Wirkstoffe dar. Dieser Therapieansatz zielt nicht darauf ab, das Wachstum der Bakterien zu inhibieren, sondern vielmehr die Ausprägung von pathogenen Merkmalen zu verhindern, weshalb die Hoffnung besteht, dass es nicht zur Ausbildung bakterieller Resistenzen kommt. Aus der marinen Makroalge Delisea pulchra wurden verschiedene halogenierte Furanone isoliert, die spezifisch AHL-regulierte Funktionen und so- mit die Virulenz des opportunistisch pathogenen Bakteriums Pseudomonas aeruginosa unterdrücken[15]. Da jedoch die Furanone instabil sind und eine hohe Zytotoxizität aufweisen, ist ihr praktischer Nutzen stark einschränkt. Die Suche nach natürlich vorkommenden QS-Blockern, die keine toxischen Nebeneffekte aufweisen, stellt daher einen Schwerpunkt der aktuellen Forschung dar. Tatsächlich konnten in einigen Lebensmitteln, Gewürzen und traditionellen Heilpflanzen hochwirksame Substanzen nachgewiesen werden, die in der Lage sind, Infektionen mit P. aeruginosa im Tiermodell effektiv zu bekämpfen[16]. [11] Köthe, M., Antl, M., Huber, B., Stoecker, K., Ebrecht, D., Steinmetz, I., Eberl, L. (2003): Killing of Caenorhabditis elegans by Burkholderia cepacia is controlled by the cep quorum-sensing system. Cellular Microbiology 5: 343–351. [12] Huber, B., Feldmann, F., Köthe, M., Vandamme, P., Wopperer, J., Riedel, K., Eberl, L. (2004): Identification of a novel virulence factor in Burkholderia cenocepacia H111 required for efficient slow killing of Caenorhabditis elegans. Infect. Immun. 72: 7220–7230. [13] Mathesius, U., Mulders, S., Gao, M., Teplitski, M., Caetano-Anolles, G., Rolfe, B. G., Bauer, W. D. (2003): Extensive and specific responses of a eu- karyote to bacterial quorum-sensing signals. PNAS 100: 1444–1449. [14] Schuhegger, R., Ihring, A., Gantner, S., Bahn- Literatur [1] Eberl, L. (1999): N-acyl homoserinelactone-mediated gene regulation in Gram-negative bacteria. System. Appl. Microbiol. 22: 493–506. [2] Cha, C., Gao, P., Chen, Y., Shaw, P. D., Farrand, S. K. (1998): Production of acyl-homoserine lactone quorum-sensing signals by gram-negative plant-associated bacteria. Mol. Plant-Microbe Interact. 11: 1119–1129. [3] Steidle, A., Sigl, K., Schuhegger, R., Ihring, A., Schmid, M., Gantner, S., Stoffels, M., Riedel, K., Givskov, M., Hartmann, A., Langebartels, C., Eberl, L. (2001): Visualization of N-Acylhomoserine Lactone mediated cell-cell communication between bacteria colonizing the tomato rhizosphere. Appl. Environ. Microbiol. 67: 5761–5770. [4] Mahenthiralingam, E., Urban, T. A., Goldberg, J. B. (2005): The multifarious, multireplicon Burkholderia cepacia complex. Nat. Rev. Microbiol. 3: 144–156. [5] Burkholder, W. H. (1950): Sour skin, a bacterial rot of onion bulbs. Phytopathology 40: 115–117. [6] Huber, B., Riedel, K., Hentzer, M., Heydorn, A., Gotschlich, A., Givskov, M., Molin, S., Eberl, L. (2001): The cep quorum-sensing system of Burkholderia cepacia H111 controls biofilm formation and swarming motility. Microbiology 147: 2517–2528. [7] Huber, B., Riedel, K., Köthe, M., Givskov, M., Molin, S., Eberl, L. (2002): Genetic analysis of functions involved in the late stages of biofilm development in Burkholderia cepacia H111. Mol. Microbiol. 46: 411–426. [8] Riedel, K., Arevalo-Ferro, C., Reil, G., Görg, A., Lottspeich, F., Eberl, L. (2003): Analysis of the quorum-sensing regulon of the opportunistic pathogen Burkholderia cepacia H111 by proteomics. Electrophoresis 24: 740–750. [9] Aguilar, C., Bertani, I., Venturi, V. (2003): Quorum-sensing system and stationary-phase sigma factor (rpoS) of the onion pathogen Burkholderia cepacia genomovar I type strain, ATCC 25416. Appl. Environ. Microbiol. 69: 1739–1747. weg, G., Knappe, C., Vogg, G., Hutzler, P., Schmid, M., Van Breusegem, F., Eberl, L., Hartmann, A., Langebartels, C.: Induction of systemic plant resistance by N-acylhomoserine lactone – producing rhizosphere bacteria. Submitted. [15] Hentzer, M., Wu, H., Andersen, J. B., Riedel, K., Rasmussen, T. B., Bagge, N., Kumar, N., Schembri, M. A., Song, Z., Kristoffersen, P., Manefield, M., Costerton, J. W., Molin, S., Eberl, L., Steinberg, P., Kjelleberg, S., Hoiby, N., Givskov, M. (2003): Attenuation of Pseudomonas aeruginosa virulence by quorum sensing inhibitors. EMBO J. 22: 3803–3815. [16] Rasmussen, T. B., Bjarnsholt, T., Skindersoe, M. E., Hentzer, M., Kristoffersen, P., Köthe, M., Nielsen, J., Eberl, L., Givskov, M. (2005): Screening for quorum-sensing inhibitors (QSI) by use of a novel genetic system, the QSI selector. J. Bacteriol. 187: 1799– 1814. Danksagung: Unser Dank gilt allen MitarbeiterInnen, besonders jedoch B. Huber, A. Steidle, R. Schuhegger und S. Gantner, die an den Projekten mitgewirkt haben. Ein Teil der Arbeiten wurde in einem vom BMBF geförderten Projekt gemeinsam mit C. Langebartels und A. Hartmann, GSF-Forschungszentrum, Neuherberg/München, durchgeführt. Unsere Forschungsvorhaben wurden zudem durch die DFG, den DAAD und den Mukoviszidose e.V. unterstützt. Korrespondenzadresse: Prof. Dr. Leo Eberl Lehrstuhl für Mikrobiologie Universität Zürich Zollikerstraße 107 CH-8008 Zürich [email protected] [10] Zhou, H., Yao, F., Robert, D. P., Lessie, T. G. (2003): AHL-deficient mutants of Burkholderia ambifaria BC-F have decreased antifungal activity. Curr. Microbiol. 47: 174–179. BIOspektrum · 4/05 · 11. Jahrgang











