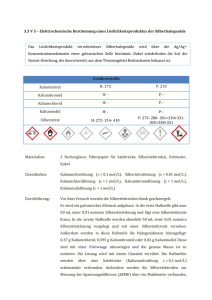
Löslichkeit von Silberchlorid = [Cl-] (a) nur AgCl in H2O: KL = [Ag+]
Werbung
![Löslichkeit von Silberchlorid = [Cl-] (a) nur AgCl in H2O: KL = [Ag+]](http://s1.studylibde.com/store/data/002963182_1-eb295693f18d34ca7e5e197987c802ea-768x994.png)
Löslichkeit von Silberchlorid = [Cl-] (a) nur AgCl in H2O: KL = [Ag+] [Cl-] = 1,96 · 10-10 mol2/l2 KL = [Cl-]2 und nachAuflösen mit [Ag+] = [Cl-] ergibt sich [Cl-] = Wurzel aus KL = 1,4 · 10-5 mol/l (b) jetzt Einstellung von [Ag+] auf 0,01 mol/l: KL = [Ag+] [Cl-] = 0,01 mol/l [Cl-] =1,96 · 10-10 mol2/l2 Damit [Cl-] = KL/0,01 = 1,96 · 10-8 mol/l Elektrisch leitfähig (sowohl im festen als auch im flüssigen Zustand, Wärmeleitfähig, metallisch glänzend, verformbar, aufgebaut aus Atomrümpfen und „Elektronengas“, ... Temporäre Polarisierung eines unpolaren Moleküls bei Annäherung eines zweiten Moleküls führt zu temporären Dipol-Dipol-Wechselwirkung, Bsp. Kohlenwasserstoffe oder Br2 Kovalente Bindung (H-O-H) Dipolwechselwirkungen (H ist delta+, O ist delta-) Wasserstoffbrücken (zwischen H eines H2O Moleküls und O eines zweiten H2O Moleküls) Koordinationsverbindung, Bindung zwischen einem Liganden und einem Metall Koordinative Beindung analog Bindung zwischen Lewis Säure (liefert freies Orbital) und Lewis Base (liefert Elektronenpaar) Verbindung mit freiem Elektronenpaar, die an ein Metall binden (koordinieren) kann. Ein Chelatligand hat zwei (oder mehr) koordinierende Gruppen Chelatkomplexe sind stabiler als Komplexe mit einzähnigen Liganden (EntropieEffekt und Statistik: 2 Bindungen öffnen sich selten gleichzeitig) Beispiel: Ethylendiamin bindet stärker als zwei Methylamine Al(OH)3 + OH- → [Al(OH)4](und vieles mehr ...) oder AgCl + 2 NH3 → [Ag(NH3)2]+ + 2 Cl- 5 8 5 4 (bitte über Teilgleichungen lösen) (bitte über Teilgleichungen lösen) 5 6 [I2]3 [H2O]3 K= ̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶ [IO3-] [I-]5 [H+]6 3 3 Zusätzliche Übungsaufgaben 5 8 1 2 Zusätzliche Übungsaufgaben Nehmen ab (zunehmende Kernladung zieht Elektronen näher zum Kern) Nimmt zu Nimmt ab Nehmen zu (Besetzung weiterer Schalen, die weiter vom Kern entfernt sind) Nimmt ab Nimmt zu Zusätzliche Übungsaufgaben Zusätzliche Übungsaufgaben Welche Reaktion findet beim Zünden des Gemischs statt? IdealesGas: 1 mol Gas nimmt (etwa) 24 l ein. → 4 mol Gas entspricht 96 l H2 + O2 → 2 H2O (+ H2) → 3 mol H3 und 1 mol O2 reagieren zu 2 mol H2O, 1 mol H2 bleibt übrig Unter Normalbedingungen: H2O ist flüssig, 2 mol H2O = 36 g = 36 ml (mit Dichte = 1 g/ml) H2 ist gasförmig, also 1 mol = 24 l Gesamtvolumen = 24 l (36 ml H2O ist vernachlässigbar) Zusätzliche Übungsaufgaben Aufgabe 7: Säuren / Basen / pH-Wert Berechnen Sie die pH-Werte der angegebenen Lösungen: Anmerkung: (a) 0,01 m KOH pKS(Essigsäure) = 4,75 Starke Base, [OH-] = 0,01 mol/l (b) 0,1 m Essigsäure (CH3-COOH) pOH = 2 pH = 14 – pOH = 12 Schwache Säure, s. nächste Seite In Wasser sind schon 10-7 mol//l H3O+ und 10-7 mol/l OH-, Zugabe von weiteren 10-9 mol/l H3O+ ist vernachlässigbar → pH = 7 (d) Eine Mischung von je 100 ml 0,1 m Essigsäure (CH3-COOH) und 0,1 m Natriumacetat (CH3COO-Na+) Puffergemisch mit [HAc] = [Ac-], damit pH = pKs = 4.75 (c) 10-9 m HCl (e) 0,01 m Natriumacetat (f) 0,05 m NaCl Schwache Base, s. nächste Seite Weder Na+ noch Cl- reagieren sauer oder basisch in Wasser (Na+ ist Salz eine starken Base, Cl- Salz einer starken Säure), pH = 7 (b) HAc + H2O → Ac- + H3O+ [Ac-] [H3O+] Ks = ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ [HAc] [H3O+]2 = ̶̶̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ [HAc] → [H3O+] = Wurzel aus (Ks [HAc]) = 10-2,875 pH = 2,875 (e) Ac- + H2O → HAc + OH- [HAc] [OH-] Kb = ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ [Ac-] [OH-]2 = ̶̶̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ ̶ [Ac-] pKb = 14 – pKs = 9,25 → [OH-] = Wurzel aus (Kb [Ac-]) = 10-5,625 POH = 5,625 → pH = 8.375