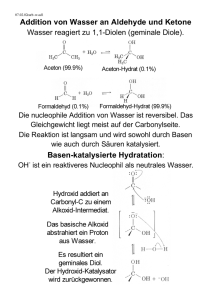
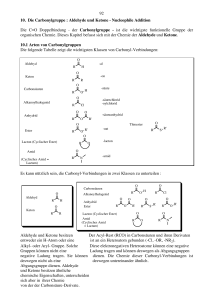
Carbonylverbindungen II
Werbung

Organic Chemistry 4th Edition Paula Yurkanis Bruice Chapter 18 Carbonylverbindungen II Irene Lee Case Western Reserve University Cleveland, OH ©2004, Prentice Hall Aldehyde - Nomenklatur Aldehydgruppe am Ring Wenn eine Verbindung zwei funktionelle Gruppen hat, erhält die Gruppe niedrigster Priorität den Präfix Nomenklatur Ketone Wenn ein Keton eine zweite Funktionalität höherer Priorität hat, wird die Vorsilbe -oxo verwendet Aldehyde sind reaktiver als Ketone Sterische Hinderung Typische Reaktion: Nucleophile Addition O- und N-Nucleophile: Eliminierung tritt auf (Triebkraft Bildung der C=N oder C=N Doppelbindung Wasser reagiert mit Aldehyden und Ketonen zu Hydraten Warum gibt es so große Unterschied in den Keq Werten? Stabilität von Carbonylverbindungen und Hydraten Addition eines Alkohols an ein Keton oder Aldehyd Aldehyde und Ketone reagieren mit primären Aminen zu Iminen (Schiff’sche Basen) Nucleophile Additions-Eliminierungsreaktion pH der Reaktion muß kontrolliert werden Aceton + Hydroxylamin: pH-Abhängigkeit Aldehyde und Ketone reagieren mit sekundären Aminen zu Enaminen Imin Derivative Grignard Reagenzien Grignard Reagenzien reagieren mit Aldehyden, Ketonen und Carbonsäuren Reaktionen mit Acetyliden Unter basischen Bedingungen erfolgt die Rückreaktion des Cyanhydrins zum Keton Verwendung von Cyanhydrinen Reduktion durch Hyrdid Reduktion von Carbonsäuren mit LiAlH4 führt zu Alkoholen Säurechloride werden ebenfalls von LiAlH4 zum Alkohol reduziert Amide werden von LiAlH4 zu Aminen reduziert Desoxygenierung von benzylische Carbonylgruppen Schutzgruppen LiAlH4 reduziert sowohl die Erster- wie auch die Ketogruppe zum Alkohol Schutzgruppe für Ketone: die Ketale Der reaktivere Aldehyd wird geschützt bevor die Grignard-Verbindung zugegeben wird. Schwefelnucleophile Entschefelung ersetzt C-S für C-H Bindungen Bildung von Alkenen Die Wittig Reaktion Darstellung der Phosphonium Ylide Nucleophile Addition an α,β-ungesättigte Carbonsäurederivate