Kohlenwasserstoffe
Werbung

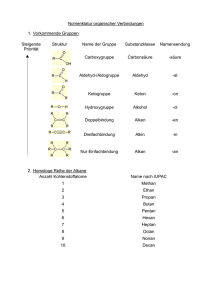
ORGANISCHE CHEMIE Prof. Manfred SUSSITZ über(be)arbeitet und zusammengestellt nach Internetvorlagen: Medizinische Fakultät, Universität Erlangen http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-mediziner-neu/start.html http://www.chemgapedia.de/index.html http://de.wikipedia.org/wiki/chemie http://www.chemienet.info/ub8.html u.a. ... http://www.bioc.unizh.ch/bipweb/lexikon/ (bewegte Moleküle- Biochemie) 1 Kohlenwasserstoffe Homologe Reihe der Alkane Die Alkane bestehen aus (geraden oder verzweigten) Ketten von sp3 -hybridisierten Kohlenstoffatomen, die mit Wasserstoffatomen abgesättigt sind. Zwischen den Atomen liegen nur Einfachbindungen (-Bindungen) vor. Die Tabelle zeigt die ersten fünf unverzweigten Alkane in verschiedenen Schreibweisen. Name Summenformel Strukturformel Methan CH4 Ethan C2 H6 Propan C3 H8 Butan C4H10 Pentan C5H12 Hexan C6H14 H3C-(CH2)4-CH3 Heptan C7H16 H3C-(CH2)5-CH3 Octan C8H18 H3C-(CH2)6-CH3 Nonan C9H20 H3C-(CH2)7-CH3 Decan C10H22 H3C-(CH2)8-CH3 Kurzschreibweise Kugel-Stab-Modell 3D-Moleküle: www.zum.de/Faecher/Materialien/beck/chemkurs/ckurse10.htm# 2 Isomerie von Butan Kohlenwasserstoffe mit mehr als 3 Kohlenstoffatomen können verzweigte Ketten bilden. Daraus folgt, dass es ab Butan mehrere Isomere mit der gleichen Summenformel gibt. Von Butan (C 4H10) gibt es zwei und vom Pentan (C 5H12) drei Isomere, von Hexan (C6 H14) bereits fünf. Decan (C10H22) besitzt 75 und Eicosen (C 20H42) über 300.000 (!) Isomere. ! iso-Butan n-Butan Summenformel: 2-Methyl-propan C4 H10 C4H10 Strukturformel: 3D-Struktur http://www.oci.unizh.ch/edu/lectures/material/AC_BII/Kap2/alkane_3D.html Physikalische Eigenschaften der Alkane Die Bindungen in den Kohlenwasserstoffen sind nahezu unpolar. Die Moleküle der Alkane können daher keine Dipol-Wechselwirkungen oder Wasserstoffbrücken ausbilden. Sie sind lipophil, mit Wasser also praktisch nicht mischbar (= hydrophob), und besitzen verhältnismäßig kleine Siedepunkte. Auch ihre Dichte ist gering (leichter als Wasser). Methan Ethan Propan Butan 16 30 44 58 Molare Masse Siedepunkt –180°C –88,6°C –42,2°C –0,5°C Ölteppich Kohlenwasserstoffe sind lipophil und daher mit Wasser nicht mischbar. Da sie stets leichter als Wasser sind, schwimmen sie auf der Wasseroberfläche. zum Vergleich: Ammoniak Wasser 17 18 –33,4°C +100°C 3 Zum Problem wird diese Eigenschaft bei Unfällen von Tankern. Das Erdöl läuft aus und bildet einen auf dem Meer schwimmenden Ölteppich. Die flüchtigen, kurzkettigen Kohlenwasserstoffe verdunsten und es bleibt eine zähe, klebrige Masse zurück. Diese verklebt das Gefieder von Seevögeln, unterbricht die Sauerstoffzufuhr aus der Luft und schirmt das Sonnenlicht ab. Methan in der Atmosphäre Kohlenwasserstoffe zählen in der Atmosphäre zu den "Treibhaus-Gasen", d.h. sie absorbieren infrarotes Licht und führen damit zu einer Erwärmung der Atmosphäre. Sie reagieren aber auch mit Ozon, das dabei zersetzt wird. 95% der Kohlenwasserstoff-Emissionen sind Methan. Etwa ein Drittel der Methan-Emission stammt aus natürlichen Quellen. Ein weiteres Drittel stammt aus dem Bergbau, der Kohle-, Gas- und Ölförderung und Mülldeponien. Wiederkäuer nutzen bei der Verdauung methanproduzierende Bakterien. Riesige Mengen Methan sind in den Eismassen der Arktis und Antarktis eingeschlossen. Reaktionsträgheit von Alkanen Die Alkane besitzen nur C-C- und H-C-Einfachbindungen. Diese Bindungen sind chemisch sehr stabil (reaktionsträge) und unpolar. Erst bei hohen Temperaturen oder unter energiereicher Strahlung gehen die Alkane mit starken Oxidationsmitteln Reaktionen ein (z.B. beim Verbrennen mit Sauerstoff, bzw. Reaktionen mit Halogenen). Diese Reaktionsträgheit wurde schon im 19.Jhd. erkannt und trug den Alkanen den Namen Paraffine ein. (lat. parum = wenig + affinis = verwandt, beteiligt). WUNDBENZIN: Zur Entferung öliger oder fettiger Verschmutzungen kann beim Arzt Wundbenzin verwendet werden. Dabei handelt es sich um ein AlkanGemisch mit einem Siedebereich von ca. 40-60°C. Wegen seiner lipophilen / fettlösenden Eigenschaften können damit Ölreste (z.B. nach Unfällen in Werkstätten), aber auch Rückstände von Heftpflastern entfernt werden. Vorsicht: Wundbenzin ist leichtentzündlich! 4 Nomenklatur organischer Verbindungen Damit chemische Verbindungen weltweit einheitliche Namen erhalten, wurden von der IUPAC (International Union of Pure and Applied Chemistry) eindeutige Regeln aufgestellt. Daneben bleiben für viele Stoffe die alten Namen (die sogenannten Trivialnamen) weiterhin im Gebrauch. Die Benennung geht zunächst von der längsten unverzweigten C-Kette aus. Der Name des entsprechenden Kohlenwasserstoffs bildet den Basisnamen. Die Endung gibt an, ob in der Kette nur Einfachbindungen -an, Doppelbindungen -en oder Dreifachbindungen -in vorhanden sind. Besitzt die Grundkette 4 C-Atome, die nur mit Einfachbindungen verknüpft sind, heißt sie Butan, ist Bindung 1 eine Doppelbindung lautet der Name 1-Buten (But-1-en). Es wird hierbei so gezählt, dass die Doppelbindung eine möglichst kleine Zahl erhält: - also 1-Buten und nicht 3-Buten. Eine Verzweigung wird als Substituent betrachtet, er bekommt die Endung -yl: Name des Substituenten Strukturformel Methyl- -CH3 EthylEthenyl- (Vinyl-) -CH2-CH3 -CH=CH2 Propyl- -CH2 -CH2 -CH3 IsopropylButyl- -CH(CH 3)-CH3 -CH2-CH2-CH2 -CH3 Die Stellung des Substituenten wird wieder durch eine vorgestellte Zahl angegeben. Hier wird die Nummerierung so gewählt, dass der Substituent (bzw. die Substituenten) eine möglichst kleine Stellungsnummer erhalten. Wurde jedoch bereits aufgrund von Mehrfachbindungen nummeriert, hat diese Reihenfolge Vorrang (Doppelbindung hat VORRANG)! Sind mehrere gleichartige Substituenten ® vorhanden, kommt eine entsprechende Vorsilbe dazu: Zahl der Substituenten Vorsilbe 2 3 ditri- 4 tetra- 5 penta- 6 hexa- 5 Bei verschiedenen Substituenten richtet sich die Reihenfolge der Nennung im Namen nach dem Alphabet, wobei die Vorsilben (di, tri, ...) nicht berücksichtigt werden. Also butyl- kommt vor ethyl- und dieses vor methyl-. Alphabetische Ordnung der Substituenzen! 1. Längste Kohlenstoffkette suchen. Auf die richtige Endung achten. 2. Die C-Atome der Kette so durchnummerieren, dass die Substitutenten möglichst kleine Stellungsnummern erhalten. 3. Substitutenten in alphabetischer Reihenfolge ordnen. Benennen Sie die abgebildete Verbindung! 1. Längste Kohlenstoffkette suchen. 2. Substituenten mit der kleinsten Stellungsnummer suchen. 3. Welcher Substituent wird als erster genannt? 4. Substanznamen vervollständigen. Benennen Sie die abgebildete Verbindung! 1. Längste Kohlenstoffkette suchen. Auf die richtige Endung achten. 2. Substituenten mit der kleinsten Stellungsnummer suchen. 3. Wie heißt der längste Substituent? 4. Substanznamen vervollständigen. 6 Cycloalkane Die Moleküle der Cycloalkane werden oftmals als ebene Ringe gezeichnet. Dies entspricht jedoch nicht der Realität. Wären die Cycloalkane eben gebaut, besäßen sie sehr hohe Ringspannungen. Bei Cyclopropan, das zwangsläufig (da aus drei Atomen bestehend) eben sein muss, ist dies auch der Fall: Die Bindungswinkel betragen 60°, der spannungsfreie Tetraederwinkel, den die sp 3hybridisierten Kohlenstoffatome anstreben, dagegen 109,5°. Auch Cyclobutan besitzt eine hohe Ringspannung. Cyclopentan und Cyclohexan kann durch einen gewinkelten Bau der hohen Ringspannung ausweichen. Zwar wäre bei einem eben gebauten Cyclopentan der Bindungswinkel mit 108° nahe dem Tetraederwinkel, durch eine Faltung des Moleküls kann aber der ideale 109,5°-Winkel erreicht werden. Das gleiche gilt für Cyclohexan. Planar mit 120° wäre die Ringspannung relativ groß, durch den gewinkelten Bau wird aber auch hier ein spannungsfreier Zustand mit 109,5°Winkeln erreicht (idealer Winkel bei Einfachbindungen). Sesselform von Cyclohexan Wannenform von Cyclohexan a e e a a: axial; e: äquatoriel cist und trans-Stellung der Substituenten 3 D-Modelle: http://www.egbeck.de/chemkurs/skripten/cmol1.htm http://dc2.uni-bielefeld.de/dc2/facharbeit/molalkane.html http://www.uni-saarland.de/fak8/mediziner/Vorlesungen/Organik_1.pdf 7 Alkylhalogenide (Halogenalkane) Bei Kohlenwasserstoffen können Wasserstoffatome durch Halogenatome (Fluor, Chlor, Brom, Iod) ersetzt sein. Es handelt sich dann um Alkylhalogenide (Halogenalkane). Bei Methan können beispielsweise 1-4 H-Atome durch Chlor substituiert werden: Methylchlorid Chlormethan Methylenchlorid Dichlormethan Chloroform Trichlormethan Tetrachlorkohlenstoff Tetrachlormethan Die halogenierten Kohlenwasserstoffe sind sehr reaktionsträge und wurden daher früher als Treibmittel in Spraydosen verwendet. Da diese Substanzen aber die Ozonschicht schädigen, werden sie heute nur noch in besonderen Fällen eingesetzt. Auch einige Pflanzenschutzmittel, z.B. DDT, enthalten Halogenatome. Halothan 2-Brom-2-chlor-1,1,1-trifluorethan (Narkosemittel) Frigen Dichlor-difluormethan (FREONE) DDT Dichlor-diphenyl-trichlorethan Homolyse / Heterolyse - Spaltung von Bindungen Alkylhalogenide entstehen durch eine radikalische Substitution. Eingeleitet wird diese durch eine homolytische Spaltung der X-X-Bindung. Dabei entstehen zwei Radikale. Bei einer heterolytischen Spaltung verbleiben dagegen beide Bindungselektronen an einem Bindungspartner, es entstehen somit je ein Kation und ein Anion. Homolyse: Heterolyse: Halogenierung Beispiel: Die Chlorierung von Methan wird durch eine homolytische Spaltung des Cl2 -Moleküls eingeleitet. Diese Reaktion erfolgt in der Regel photochemisch, d.h. durch Bestrahlung mit 8 energiereichem (ultraviolettem) Licht. Dabei entstehen zwei Chlor-Radikale. Ein solches Radikal kann nun mit dem Alkan reagieren, wobei es ein H-Atom abspaltet und HCl bildet. Zurück bleibt ein Methyl-Radikal. Dieses kann nun ein Cl2 -Molekül spalten, zu Methylchlorid reagieren und dabei wieder ein neues Cl-Radikal bilden. Es kommt eine Kettenreaktion in Gang. Bruttogleichung: Stabilität von Radikalen - Selektivität der Halogenierung Je mehr Kohlenstoffatome an das C-Atom mit dem ungepaarten Elektron (also der Radikalfunktion) gebunden sind, desto stabiler ist dieses Radikal. Ein tertiäres Radikal ist daher stabiler als ein sekundäres und dieses wiederum stabiler als ein primäres Radikal. Bei den sehr reaktionsfähigen Halogenen (Fluor, Chlor) spielt bei der Halogenierungsreaktion die unterschiedliche Stabilität der verschiedenen Radikale kaum eine geringe Rolle und hat daher auch nur einen geringen Einfluss auf entstehenden Produkte. Brom zeigt dagegen eine deutlich geringere Reaktivität: Bei der Bromierung von Isobutan entsteht praktisch ausschließlich 2-Brom-isobutan, das primäre Radikal (obwohl es statistisch 9mal so oft gebildet werden kann) entsteht nicht. 9 Alkene (Olefine) Die Moleküle der Alkene besitzen C=C-Doppelbindungen. Zwischen den Kohlenstoffatomen ist eine -Bindung und eine -Bindung ausgebildet. Die C-H-Bindungen liegen auf einer Ebene. Die Ebene der -Bindung steht senkrecht auf der C-H-Bindungsebene. Die -Bindung ist somit von außen leicht zugänglich und lässt dadurch Reaktionen zu, die Alkane nicht eingehen können. Das Vorhandensein einer C=C-Doppelbindung wird im Verbindungsnamen durch die Endung -en kenntlich gemacht. 3-Hepten 5-Ethyl-3,6-dimethyl-3-hepten cis-trans-Isomerie (geometrische Isomerie) Um die C=C-Doppelbindung ist keine freie Drehbarkeit möglich. Die Bindungspartner an den beiden C-Atomen können daher zwei verschiedene relative Anordnungen (= Isomere) zueinander annehmen: Diese Isomere unterscheiden sich in der relativen Lage der Substituenten zueinander. Man bezeichnet solche Moleküle auch als geometrische Isomere und unterscheidet die Verbindungen durch die Vorsilben cis- bzw. trans-. Eliminierung Alkene können aus substituierten Alkanen durch Abspaltung je eines Bindungspartners an zwei benachbarten C-Atomen entstehen. Eine solche Reaktion nennt man Eliminierung. Besonders leicht lassen sich Halogen-Atome (Chlor, Brom, Iod) abspalten. Am benachbarten CAtom wird noch ein Wasserstoffatom abgespalten und es entsteht ein Alken und Halogenwasserstoff. Die Reaktionsgleichung zeigt die Eliminierung von HBr aus 1-Brom-butan, 10 wobei 1-Buten entsteht. Diese Reaktionen sind Basen-katalysiert, laufen also in alkalischer Lösung ab. Dehydrierung - Dehydratisierung Die Abspaltung von zwei Wasserstoffatomen unter Ausbildung einer C=C-Doppelbindung wird als Dehydrierung bezeichnet. (ENZYME: Dehydrogenasen) Bei einer Dehydratisierung wird Wasser abgespalten. (ENZYME: Dehydratasen) Addition Die Addition stellt die Umkehrung einer Eliminierung dar. Ein Molekül wird an ein Alken gebunden, wobei die Doppelbindung aufgebrochen wird. Besonders leicht können Halogene und Halogenwasserstoffe (im Beispiel Iodwasserstoff) addiert werden. 11 Hydrierung - Hydratisierung Die Umkehrung der Dehydrierung, also die Addition von Wasserstoff an eine Doppelbindung, heißt Hydrierung. Bei der Hydratisierung wird Wasser an eine Doppelbindung addiert. Die Addition von Brom an eine Doppelbindung nennt man Bromierung. Entsprechend heißt eine Addition von Chlor Chlorierung und die Addition von Iod Iodierung (allgemein: Halogenierung). Mechanismus der Addition Die Reaktionsablauf einer Addition von Brom an ein Alken soll nun genauer betrachtet werden: Zunächst lagert sich das Brommolekül an das -System der Doppelbindung an. Da die Elektronenwolke negativ geladen ist, werden die Bindungselektronen im Br2 -Molekül zum äußeren Atom hin verschoben. ----- Nun erfolgt eine heterolytische Spaltung der Br–Br-Bindung. Ein Br–Ion (Bromid-Ion) wird abgespalten, das Br +-Ion (Bromonium-Ion) bleibt am -System gebunden. Es liegt der -Komplex vor. Zwischen dem Br +-Ion und einem C-Atom bildet sich eine -Bindung aus, die positive Ladung befindet sich nun am zweiten C-Atom. (-Komplex) An das positiv geladene C-Atom (Carbenium-Ion) kann sich nun das Bromidion binden. Die Addition ist abgeschlossen. Da das Bromidion von der entgegengesetzten Seite aus gebunden wird, handelt es sich bei diesem Mechanismus um eine anti-Addition. 12 Diene und Polyene In einem Molekül können auch mehrere Doppelbindungen auftreten. Sind zwei Doppelbindungen durch eine Einfachbindung getrennt, wie im 1,3-Butadien, sind die Doppelbindungen konjugiert. Die mit je einem Elektron besetzten p-Orbitale an allen vier sp 2-hybridisierten C-Atomen bilden ein gemeinsames -System, das sich auf das gesamte Molekül erstreckt. Liegen mehr als eine Einfachbindung zwischen den Doppelbindungen, sind sie also durch ein oder mehrere sp 3hybridisierte C-Atome getrennt, sind die Doppelbindungen isoliert und nicht konjugiert. Moleküle mit mehreren konjugierten Doppelbindungen sind oft farbig, z.B. der orange-rote Farbstoff -Carotin in Möhren und vielen anderen Pflanzenteilen und das rote Lycopin in den Tomaten. -Carotin Lycopin 13 Aromaten Benzol (Benzen) besteht aus sechs sp2-hybridisierten Kohlenstoffatomen. Auch hier bilden die mit je einem Elektron besetzten p-Orbitale ein ringförmiges -System aus. Formal liegen in diesem Molekül abwechselnd je drei Doppel- und Einfachbindungen vor: die Doppelbindungen sind konjugiert. Bei diesem Molekül gibt es für die Lage der Doppelbindungen zwei äquivalente Möglichkeiten. Tatsächlich sind alle C-C-Bindungen im Benzol gleichwertig. Eine derartige Elektronenanordnung, bei der die Doppelbindungen "verschoben" werden können, bezeichnet man als mesomer. Oft wird dies durch die rechte Schreibweise angedeutet: Der Kreis soll anzeigen, dass es keine isolierten Doppelbindungen gibt, sondern ein geschlossenes System. Geschlossene, ringförmige -Systeme mit (4n+2) -Elektronen nennt man aromatisch. Zu den Aromaten gehören neben Benzol (mit 6 -Elektronen) auch Naphthalin (10 -Elektronen) und Anthracen (14 -Elektronen). Naphthalin Anthracen Elektrophile Substitution am Aromaten Das aromatische System des Benzols ist sehr stabil. Benzol reagiert daher ohne Katalysator nicht mit Halogenen. Mit einem geeigneten Katalysator geht Benzol mit Brom eine Reaktion ein. Dabei erfolgt aber - im Gegensatz zu den Alkenen - keine Addition sondern eine Substitution. Das folgende Schema zeigt den Mechanismus dieser Substitutionsreaktion. Br2 bildet mit dem Katalysator FeBr3 einen Komplex. Dieser kann sich an das -System des Benzols anlagern. Nun erfolgt - analog zur Addition - eine heterolytische Spaltung der Br–Br-Bindung. Der hierbei gebildete -Komplex geht in einen -Komplex über, bei dem das Bromatom an einem C-Atom lokalisiert ist. Die positive Ladung ist über das mesomere System delokalisiert. Nun wird ein Proton abgespalten, wobei das aromatische System wieder zurückgebildet wird. Das abgespaltene Proton – kann mit [FeBr4 ] zu HBr und dem Katalysator FeBr3 reagieren. 14 Da diese Reaktion durch einen Angriff am elektronenreichen -System eingeleitet wird, bezeichnet man diesen Reaktionstyp als elektrophile Substitution. Substituenten am Benzol Sind zwei Substituenten an Benzol gebunden, können sie drei verschiedene relative Positionen einnehmen. Man bezeichnet diese mit den Vorsilben ortho- (o-), meta- (m-) und para- (p-). Zweitsubstitution am Aromaten Ist bereits ein Substituent an einen Benzolring gebunden, erfolg eine zweite Substitution meist an bestimmten Positionen. Hydroxy-Gruppen (-OH) dirigieren z. B. den zweiten Substituenten in ortho- und para-Stellung. Wird beispielsweise Phenol mit Brom umgesetzt, entsteht ein Gemisch aus ound p-Bromphenol, aber kein m-Bromphenol.