Nichtmetalle
Werbung
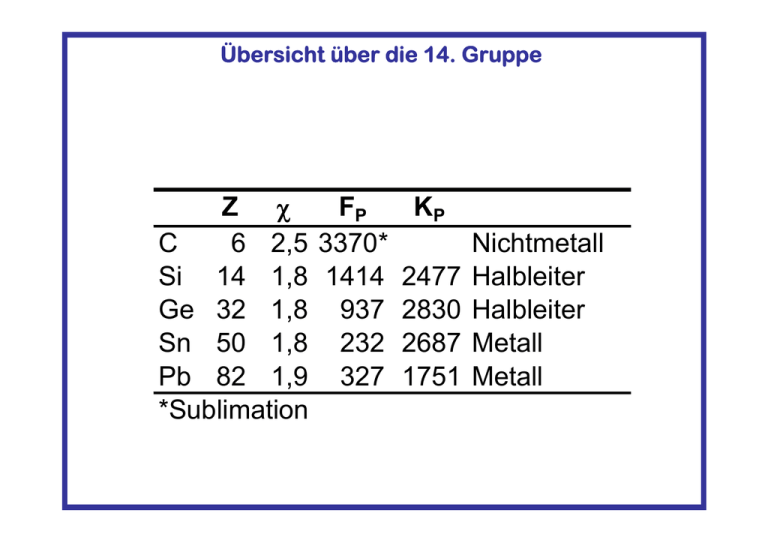
Übersicht über die 14. Gruppe Z FP KP C 6 2,5 3370* Nichtmetall Si 14 1,8 1414 2477 Halbleiter Ge 32 1,8 937 2830 Halbleiter Sn 50 1,8 232 2687 Metall Pb 82 1,9 327 1751 Metall *Sublimation Übersicht über die 14. Gruppe C Si Ge Sn Metallcharakter nimmt zu Affinität zu elektropositiven Elementen nimmt ab Affinität zu elektronegativen Elementen nimmt zu Saurer Charakter der Hydroxide nimmt ab Salzcharakter der Halogenide nimmt zu Beständigkeit der H-Verbindungen nimmt ab Stabilität der max. Ox-Stufe nimmt ab Höchste Wertigkeit gegen O, F ohne Vorzeichen 4 Höchste Wertigkeit gegen H, I ohne Vorzeichen 4 Pb Einteilung der Minerale • • • • • • I Elemente II Sulfide III Halide IV Oxide, Hydroxide V Borate VI Nitrate, Carbonate • VII Sulfate, Chromate Molybdate, Wolframate • VIII Phosphate, Arsenate, Vanadate • IX Silikate Calcit: CaCO3 www.calcit.de/ Calcit: CaCO3 Quelle: Wikipedia stalaktitischer Calcit aus Mexiko Malachit: Cu2(CO3)(OH)2 www.edelstei.ch/galerie/photo-galerien/edelsteine/galerie-steine/Bilder/malachit-1_jpg.jpg p / GPa Zustandsdiagramm von Kohlenstoff T2 Tripelpunkt von Graphit/Diamant/Schmelze T2 Diamantbildung: Thermodynamik: p hoch ! –3 ρ (Diamant) = 3,5 g·cm T1 Tripelpunkt von T1 Graphit/Dampf/Schmelze » ρ 1.5 (Graphit) Kinetik: T hoch ! T / 1000 K Erdmantel 150 – 200 km Tiefe Formen des Kohlenstoffs Diamant Fulleren Graphit Nano- Röhren Graphit A B A B A hexagonal 335 pm d(C-C) = 142 pm Einfachbindung: 154 pm Doppelbindung: 134 pm Vom Benzol zum Graphit C6H6: 92,26%C, 7,74%H C26H16: 95,09% C, 4,91% H Graphit: 100% C C96H26: 97,78% C, 2,22% H Struktur des kubischen Diamanten A C B A Vorkommen der Diamanten Alte Vulkanschlote als primäre Lagerstätten des Diamanten Fullerene C540 C60 (Buckminsterfulleren) C70 Leonardo da Vinci (1452-1519) “Biosphere of Man” Pavillion der USA auf der Expo ‘67 entworfen von Richard Buckminster Fuller Fulleren C60 800 pm Kohlendioxid CO2 Kreislauf des CO2 Anstieg des CO2-Gehalts der Erdatmosphäre CO2- Kerzentreppe CO2 Zustandsdiagramm des CO2 krit. Punkt 74 p / bar flüssig fest 5 Tripelpunkt gasförmig 1 –78 –57 T / °C 31 Versuche mit Trockeneis 1. Sublimation von TE in Wasser 2. Reaktion mit verschiedenen Indikatoren Lackmus Phenolrot Thymolblau blau → rot rot → gelb blau → gelb Phenolphthalein violett →farblos Boudouard-Gleichgewicht (1) C + 1/2 O2 (2) CO + 1/2 O2 (3) C 2(1) –(3) + O2 2 C + O2 CO2 C + CO2 CO ΔHR = ΔHB = -111 kJ/mol exotherm CO2 ΔHR = -283 kJ/mol exotherm ΔHR = ΔHB = -394 kJ/mol stark exotherm CO2 2 CO ΔHR = -222 kJ/mol C + O2 ∆HR = +394 kJ/mol 2 CO ΔHR = +172 kJ/mol Boudouard-Gleichgewicht endotherm Temperatur- Abhängigkeit des Boudouard- Gleichgewichts 60 40 CO metastabil 100 Vol.-% CO 80 CO2 CO 20 0 200 400 600 800 1000 T / °C Gewinnung von Metallen durch Reduktion mit Kohlenstoff ~ 30m, V ~ 500-1100m3 Beschickung Gichtgas Gicht 250°C Schacht 400-1200°C Vorwärmzone Indirekte Reduktion: 2Fe2O3 +2CO → 4FeO + 2CO2 Reduktionszone CO2 + C ⇌ 2CO ΔH° = +173 kJ/mol FeO + CO → Fe + CO2 ΔH° = - 17 kJ/mol Direkte Reduktion: 2FeO + C → 2Fe + CO2 Wind Eisen Kohlensack Rast 1600°C Gestell Kohlungszone Schmelzzone Wind Schlacke ΔH° = +138 kJ/mol 2C +O2 → 2CO ΔH0 = -221 kJ/mol Hochofenanlage im Ruhrgebiet Quelle: Wikipedia Hüttenwerk in Duisburg-Meiderich Carbide Salzartig, CaC2 Darstellung von H2C2 Metallartig, Interstitiell, WC WC/CoHartmetall Kovalent, SiC Schleifmittel Cermets Kristallstruktur des Zementit: Fe3C Übersicht über die 14. Gruppe Z FP KP C 6 2,5 3370* Nichtmetall Si 14 1,8 1414 2477 Halbleiter Ge 32 1,8 937 2830 Halbleiter Sn 50 1,8 232 2687 Metall Pb 82 1,9 327 1751 Metall *Sublimation Einteilung der Gesteine • Magmatische Gesteine – Plutonite z.B. Granit – Vulkanite z.B. Basalt • Metamorphe Gesteine – Kontaktmetamorphe Gesteine z.B. Gneis – Regionalmetamorphe Gesteine z.B. Schiefer • Sedimentgesteine – Rückstandsgesteine z.B. Bauxit – Trümmergesteine z.B. Sandstein – Chemische oder biogene Gesteine z.B. Kalkstein Zustandsdiagramm des Si Kristallzucht von Si Einkristallen Silicium Siliziumdarstellung 1. Herstellung von Rohsilicium durch Reduktion von SiO2 (Quarzsand) mit Koks gewonnen: SiO2 + 2 C Si + 2 CO 2. Herstellung von Trichlorsilan und destillative Aufreinigung: 2000°C Si + 3 HCl 300°C HSiCl3 + H2 HSiCl3 Wirbelschichtreaktor ~35°C Si Destillationskolonne 300°C HCl HSiCl3 H2 1100°C Dünnstab aus Silicium 3.Reduktion von hochreinem HSiCl3 zu Reinstsilicium mit H2: HSiCl3 + H2 300°C Si + 3 HCl Wasserstoff Trichlorsilan Quarzglocke + - Czochalski- Verfahren zur Einkristallzucht Reinstsilizium Zonenschmelzen Schneiden Siliziumscheiben SiO2 Bergkristall www.spiritvisions.com/ gfx/images/amethyst.jpg Amethyst Opal http://payopal.eu/jet_black_opal_1.60_a_ct_kopie.jpg (Halb-) Edelsteine auf SiO2-Basis Quarz Rauchquarz Rosenquarz Citrin Amethyst Tigerauge Opal Ausdehnungskoeffizient von Quarzgegenständen Rasotherm - Glas Quarz- Glas Der Ausdehnungskoeffizient von Quarzglas beträgt nur ~ 1/18 desjenigen von gewöhnlichem Glas Anhydrid der Kieselsäure SiO2 + H2O HO OH HO Si OH H4SiO4 Intramolekulare Kondensation Orthokieselsäure OH HO Si + HO OH HO Si O Si + OH HO OH Si Si n -H 2O Si HO OH -H 2O O OH OH H 6Si 2O 7 OH Si O O OH Si Si O Dikieselsäure OH Si OH OH OH OH H 8Si 3O 10 H2SiO3 Trikieselsäure Si O O Metakieselsäure -H2O OH OH O Si OH O Si OH OH OH HO HO OH OH O OH OH H 4SiO 4 OH Si OH OH OH OH H 6Si 2O 7 HO Si OH OH Si HO OH OH H 4SiO 4 OH H 4SiO 4 -H2O Metakieselsäure OH OH O O Si O O OH OH OH einbindige Endeinheit zweibindige Mitteleinheit dreibindige Mitteleinheit O Si O O vierbindige Doppelverzweigungseinheit Systematik der Silicate H4SiO4 SiO2·2H2O [SiO44-] Inselsilicate H2nSinO3n SiO2 ·H2O [SinO3n2n- ] Ringsilicate H2SiO3 SiO2 ·H2O [SiO32-] Kettensilicate H6Si4O11 4SiO2 ·3H2O [Si4O116-] Bandsilicate H2Si2O5 2SiO2 ·H2O [Si2O52-] Schichtsilicate SiO2 SiO2 SiO2 Siliciumdioxid [AlySi1-yO2y-] Gerüstsilicat Inselsilikate: Olivine (Fe,Mg)2[SiO4] MgO6 -Oktaeder SiO4 - Tetraeder Forsterit Mg2[SiO4] Copyright: Rob Lavinsky Inselsilikate: Zirkon Zr[SiO4] ZrO8 - Polyeder SiO4 - Tetraeder Zirkon Zr[SiO4] Inselsilikate: Granate X3Y2[SiO4]3 www. minerals.gps.caltech.edu/. ../garnets/index.htm Alamandin: Fe3Al2[SiO4]3 www. minerals.gps.caltech.edu/. ../garnets/index.htm Grossular: Ca3Al2[SiO4]3 Spessartin: Mn3Al2[SiO4]3 www.heilsteine.info/ granat-spessartin-t1034.html Gruppen-, Ringsilikate www.mineralienatlas.de Beryll Al2Be3[Si6O18] Schichtsilikate: Talk SiO4 - Tetraeder AlO6 - Oktaeder Quelle: Wikipedia Mg3[Si4O10](OH)2 Kristallstruktur des Quarz SiO2 d(Si-O) =159.8 pm Kristallstruktur des β-Tridymit A B b A a Si+4 c O-2 Alumosilicate Faujasit: Na2Ca[Al4Si10O28] 20H2O Alumosilicate Quelle: Wikipedia Sodalith: Na8[Al6Si6O24]Cl2 Übersicht 15. Gruppe Z FP KP N 7 2,5 -210 -196 Nichtmetall P 15 2,1 41 281 Nichtmetall As 33 2 616* Metall Sb 51 1,9 631 1635 Metall Bi 83 1,9 271 1580 Metall *Sublimation Übersicht über die 15. Gruppe N P As Sb Metallcharakter nimmt zu Affinität zu elektropositiven Elementen nimmt ab Affinität zu elektronegativen Elementen nimmt zu Saurer Charakter der Hydroxide nimmt ab Salzcharakter der Halogenide nimmt zu Beständigkeit der H-Verbindungen nimmt ab Stabilität der max. Ox-Stufe nimmt ab Höchste Wertigkeit gegen O, F ohne Vorzeichen 5 Höchste Wertigkeit gegen H, I ohne Vorzeichen 3 Bi Der Stickstoff- Kreislauf (stark vereinfacht) N2 in der Luft Assimilation Nahrungskette NH 3-Synthese pflanzliches Kunstdünger Eiweiß – N2 NH3 NO3 –NH2 tierisches Eiweiß NO 2 Humus Naturdünger Nitrifikation Knöllchenbakterien N2 NH3 Nitrosomonas Nitrobakter NH4+ NO2– NO2– NO3– NH4-Salze Nitrate Ammonifikation –NH2 NH 3 Denitrifikation NO3– N2 Blaualgen N2 NH3 Ammoniak-Synthese nach dem HABER-BOSCH- Verfahren 3H2 + N2 ⇄ 2NH3 Fritz Haber (1868-1934) Nobelpreis 1918 ΔHB = - 46kJ/mol Carl Nobelpreis 1931 (1874 Bosch – 1940) Ausbeute NH3/% → 10 0 80 1000 bar Nobelpreis- Urkunde 60 40 300 bar 100 bar 20 30 bar 1 bar 0 200 300 400 500 600 700 Temperatur/°C → Technische Reaktionsführung: Temperatur: 400-500°C Druck: ca. 300 bar Katalysator: Fe3O4, Al2O3 Ausbeute: ca. 17% Reaktionsführung im Kreislauf Ammoniaksynthese Katalysator: Fe3O4, Al2O3, CaO, K2O Aufbau einer Anlage bei der BASF, 1950 Wärmetausch Synthesegas 3 H2 + N2 Entgasungslöcher Methan Weicheisenauskleidung Dampf N2, H2,CO2 Vorwärmer Wasser Komp. H2O N2, H2,NH3 Luft H2O H2O N2 H2 Katalysator 450-500°C 200-300 bar Kompressor N2, H2 H2O CO2 Kompressor Kühler Amide und Nitride 2Na 3Mg + + 2NH 3 → 2NaNH 2 N2 → Mg 3 N 2 + H2 Salzartige Nitride Li 3 N Si 3 N 4 , BN kovalente Nitride Fe 4 N metallische Nitride Instabilität der Azide Anwendung: Airbag im PKW NaN3 + Schwarzpulver 2 NaN3 300°C 2 Na + 3 N2 2 AgN3 → 2 Ag + 3 N2 Anwendung: Initialsprengstoff Stickstoffoxide Name Ox-Stufe Farbe N2O +1 farblos NO +2 farblos N2O3 +3 blaugrün NO2 +4 braun N2O5 +5 braun NO3 +5 - Dimer Farbe N2O2 farblos N2O4 farblos N2O6 - OSTWALD-Verfahren NH3 O2 NO 4 NH3 + 5 O2 4 NO + 6 H2O 2 NO + O2 2 NO2 600°C 30°C ∆HR = -900 kJ/mol Verweilzeit ca. 1 ms, 800-950°C, Pt/Rh Kat. 2 NO2 N 2 O4 bei 20°C ca. 80 % Dimer OSTWALD-Verfahren AbsorptionsN2O4 + H2O HNO3 + HNO2 Salpetersäure 3 HNO2 kolonne salpetrige Säure (instabil) Wasser HNO3 + 2 NO + H2O 2 NO + O2 N2O4 Gesamtreaktion: N2O4 + H2O + ½ O2 2 HNO3 N2O4 Das OSTWALD-Verfahren liefert eine 68%-ige „konzentrierte“ Salpetersäure (azeotropes Gemisch), die zur Düngemittelherstellung verwendbar ist. 98%-ige Salpetersäure durch Einpressen (50 bar) von NOx/O2 in wässrige HNO3. Wasserfreie, „rote, rauchende“ HNO3 kann durch Vakuumdestillation in Anwesenheit wasserentziehender Mittel (H2SO4, P2O5) erhalten werden. Ostwaldverfahren zur Darstellung von Salpetersäure NOx Pt/Rh-Netz NH3 / Luft Modifikationen des Phosphors Pweiß 180-400°C Prot 550°C Pviolett 200°C, 12 kbar 380°C, Hg 550°C Pschwarz 83 kbar Prhomboedrisch isotyp mit Asgrau 111 kbar Pkubisch 620°C P4, Dampf Weißer Phosphor Kristallstruktur von P (weiß) b a c Quelle: Wikipedia Wachsweich Flammpunkt 60°C Chemolumineszenz triklines Kristallsystem P4-Tetraeder Schwarzer Phosphor b c a grauschwarz metallisch glänzend leitet Strom und Wärme Violetter Phosphor P2 P8 P2 P9 P2 P8 P2 P9 P2 P8 Rot-violett nicht selbstentzündlich c a b P2 Darstellung von Phosphor Ca3(PO4)2 + 3 SiO2 + 5 C → 3 CaSiO3 + 5 CO(g) + P2(g) 1400°C, Lichtbogenofen www.mineralienatlas.de Apatit: Ca5(PO4)3(F,Cl,OH) Phosphor(V)-Oxid: P4O10 P O P 4 O 10 + 6H 2 O → 4H 3 PO 4 Orthophosporsäure P 4 + 5O 2 → P 4 O 10 Düngemittel Der Effekt von Dünger auf das Pflanzenwachstum Düngemittel Minimumregel nach Liebig Übersicht über die 16. Gruppe Z O 8 S 16 Se 34 Te 52 Po 84 FP KP 3,5 -219 -183 Nichtmetall 2,6 120 445 Nichtmetall 2,6 217 685 Nichtmetall 2,1 450 1390 Metall 2 254 962 Metall Übersicht über die 16. Gruppe O S Se Te Metallcharakter nimmt zu Affinität zu elektropositiven Elementen nimmt ab Affinität zu elektronegativen Elementen nimmt zu Saurer Charakter der Hydroxide nimmt ab Salzcharakter der Halogenide nimmt zu Beständigkeit der H-Verbindungen nimmt ab Stabilität der max. Ox-Stufe nimmt ab Höchste Wertigkeit gegen O, F ohne Vorzeichen 6 Höchste Wertigkeit gegen H, I ohne Vorzeichen 2 Po Vergleich der Wasserstoff-Verbindungen H2E O, x = 2 S, x = 8 Se, x = 1 Te, x = 1 Standardbildungsenthalpie Reaktionswärme nimmt ab H2 +1/x Ex =H2E, Ho/kJ mol-1 -286 Normalpotential: o(0/-II)/V Reduzierende Wirkung von H2E nimmt zu H2E = 1/x Ex + 2H+ + 2e- -1,23 Säurestärke: pKS Säurestärke von H2E nimmt zu H2E +H2O = H3O+ + EH- 15,74 -21 -0,14 6,99 +30 +0,40 3,73 +100 +0,74 2,64 Chemische Eigenschaften ungiftig, geruch- und geschmacklos gelber, reaktionsträger Stoff S + O2 → SO2 ΔH0 = -297 kJ/mol plastischer Schwefel: Abschrecken der Schmelze (~400°C) bildet Ketten und Ringe → S8 S S S S S S S S Modifikationen des Schwefels © Thomas Seilnacht Abschrecken plastischer Schwefel Zustandsformen des Schwefels 95,6°C α-S gelb rhombischer S β-S 119,6°C Smp. gelb monokliner S kristalliner Schwefel λ-S >120°C π-S 444,6°C Sn μ-S Sdp. niedermolekulare Ringe n = 6...26 (außer S8) dunkelbraun dunkelrotzähflüssig braun Sx- Ketten n = 1...8 (x = 103-106) flüssiger Schwefel temperaturabhängige Gleichgewichte zwischen λ-, π-, μ-S gasförmiger Schwefel temperaturabhängige Gleichgewichte, oberhalb 2200°C überwiegen S-Atome gelb leichtflüssig S8- Ringe Gewinnung von Schwefel Plattformsystem mit 600 000 t/a Kapazität Prinzip des FrashVerfahrens Gewinnung von Schwefel Hochdruck-Heißdampf, ~200°C 1. Frash-Verfahren Schwefel Erdoberfläche Gesteinsdeckschicht S-haltiges Gestein 2. aus S-haltigen Abprodukten Entschwefelung von Erdöl und –gas/ Claus-Verfahren Co, Mo schwefelhaltiges + H2 H2S + schwefelfreies Erdöl, -gas Erdöl, -gas → 2SO2 + 2H2O 2H2S + 3O2 SO2 + 2H2S → 3S + 2H2O Abrösten sulfidischer Erze CuFeS2 + 3/2O2 → CuS + FeO + SO2 elementar (Sizilien, Mexiko) Sulfate: CaSO4·2H2O (Gips) CaSO4 (Anhydrit) MgSO4·7H2O (Bittersalz) Na2SO4 ·10H2O (Glaubersalz) Sulfide: Kiese: FeS2 Pyrit (Katzengold) Glanze: PbS (Bleiglanz) Blenden: ZnS organische Materie: Erdöl und -gas Kohle Lebewesen Schwefel Vorkommen Galenit: PbS www.mineralienatlas.de Pyrit: FeS2 www.fossilien.de/ Wichtige Schwefel-Verbindungen I Schwefelwasserstoff H2S farbloses, stark giftiges, übelriechendes Gas brennbar H2 + S → H2S FeS + 2HCl → H2S + FeCl2 Fäulnisprozesse (anaerober Abbau organischer S-Verbindungen) Schwefeldioxid SO2 farbloses, giftiges, stechend riechendes Gas nicht brennbar gut in Wasser löslich Umweltgift → Rauchgasentschwefelung (↗) Wipfelschaden Lametta-Syndrom Auslichtung Tod Schwefel- Verbindungen: FeS S - Pulver ve Fe - Pulver hen c s i rm chem. Reaktion heterogenes Stoffgemisch chemische Verbindung + HCl H2S + Pb2+ → PbS + 2 H+ FeS + 2HCl → H2S + FeCl2 Wichtige Schwefel-Verbindungen II Schwefeltrioxid SO3 2 SO2 + O2 ⇌ 2 SO3 ∆HR= -198 kJ/mol ~ 140 pm 143 pm 163 pm Kristalle von asbestartigem Schwefeltrioxid Mit Spuren von Wasser bilden sich hingegen asbestartig Nadeln: - polymere (SO3)n–Kette: - unverzweigt b-SO3, verzweigt a-SO3 - bzw. genauer Polyschwefelsäuren H(OSO2)nOH = H2SnO3n+1 mit n 105 Wichtige Schwefel-Verbindungen III Schwefelsäure H2SO4 (konz.) farblose, wasserklare, ölige Flüssigkeit Produkt Rohstoffbasis M io. t,/a USA H 2 SO 4 Schwefel, H 2 S 37 NH 3 Luft, Erdöl, Erdgas, W asser 17 N2 Luft 17 CaCO 3 Kalkstein 16 O2 Luft 16 NaOH Kochsalz 10 Cl 2 Kochsalz 10 H 3 PO 4 Apatit 9 HNO 3 Luft, Erdöl, Erdgas, W asser 8 NH 4 NO 3 Luft, Erdöl, Erdgas, W asser 8 Na 2 CO 3 Kalk+Kochsalz, Trona 7 CO(NH 2 ) 2 Luft, Erdöl, Erdgas, W asser 7 CO 2 Luft, Erdöl, Kohle 4 Schwefelsäureherstellung: SO3 + H2SO4 → H2S2O7 H2S2O7 + H2O → 2H2SO4 Schwefelsäure-Produktion nach dem Kontaktverfahren ΔHR = -297 kJ/mol S + O2 SO2 SO3 + H2SO4 H2S2O7 H2S2O7 + H2O 2 H2SO4 Wärmetauscher V2O5-Kat. SO2 + O2 1. Horde (60 % Umsatz) 620°C 450°C 2. Horde 510°C (90 % Umsatz) 450°C 3. Horde 475°C (95 % Umsatz) 430°C 4. Horde 450°C (98 % Umsatz) SO3 SO2 + V2O5 SO3+ V2O4 V2O4 + ½ O2 V2O5 ΔHR = -99 kJ/mol Eigenschaften von H2SO4 hohe Verdünnungswärme ΔHR= -95,4 kJ/mol Reihenfolge beim Verdünnen: 1. Wasser 2. Säure Erst das Wasser, dann die Säure, sonst geschieht das Ungeheure! Ausgangstemperatur 21,3 °C wirkt stark wasserentziehend (z. B. Zucker) stark oxidierend Verwendung: Düngemittel, Batteriesäure, Seifen, Waschmittel, Faserherstellung, Gipsherstellung Endtemperatur 125.3 °C Übersicht 17. Gruppe F Cl Br I At Z FP KP 9 4 -219 -188 gasförmig 17 3,2 -101 -34 gasförmig 35 3 -7 60 flüssig 53 2,7 114 185 fest 85 575 610 fest Übersicht 17. Gruppe Fluor Chlor Brom Iod Symbol F Cl Br I Ordnungszahl 9 17 35 53 e--Konfiguration [He]2s22p5 [Ne]3s23p5 [Ar]3d104s24p5 [Kr]4d105s25p5 Aussehen im schwach gelbes Gas schwach grüngelbes Gas rotbraune schwarz-violette Flüssigkeit metallisch mit hohem glänzende Dampfdruck Kristalle Normzustand Schmelzpunkt in °C -219 -101 -7 113 Siedepunkt in °C -188 -34 59 185 (subl.) Dichte in g/l 1,69 3,21 3,14 4,94 Elektronegativität 4,0 3,0 2,8 2,5 Übersicht 17. Gruppe F Cl Br I Metallcharakter nimmt zu Affinität zu elektropositiven Elementen Affinität zu elektronegativen Elementen nimmt ab Beständigkeit der H-Verbindungen nimmt ab Stabilität der max. Ox-Stufe nimmt ab nimmt zu Höchste Wertigkeit ohne F ohne Vorzeichen 7 Höchste Wertigkeit gegen H 1 At Vorkommen der Halogene Große Reaktionsfähigkeit Fluor (fluor) (lat.: fließend) CaF2 Na3AlF6 Ca5(PO4)3F (Al2(OH,F)2)(SiO4) Halogene kommen nicht elementar vor Flussspat Kryolith Fluor-Apatit Topas Chlor (chloros) (griech.: gelbgrün) Meerwasser 18.1 kg Cl-/m3 NaCl Steinsalz KCl Sylvin KMgCl3·6H2O Carnallit Brom (bromos) (griech.: Gestank) AgBr Bromargyrit Meerwasser 68 g Br -/m3 Totes Meer 4 - 5 kg Br -/m3 Iod (iodos) (griech.: veilchenfarbig) Iodid im Meerwasser, Meeresalgen Ca(IO3)2 Lautarit als Beimengung im Chilesalpeter Chlorgewinnung durch Elektrolyse H2 Chlor-Alkali-Elektrolyse Membran (nur für Kationen durchlässig) - NaOH e- 2 H2O + 2 H2 + 2 OH- Cl2 Kohlenstoffanode Stahlkathode Nebenprodukt: chloridfreie Natronlauge + 2 Na+ 2 NaCl 2 Cl- Cl2 + 2 e- gesamt: 2 NaCl + 2 H2O Cl2 + 2 NaOH klassische HCl-Elektrolyse SVK- Technik (Bayer) NaCl Chlorknallgas Cl2 + H2 ⇄ 2 HCl Quelle:https://lp.uni-goettingen.de/get/text/1951 Antimon- Sprühregen Cl2 gefüllter Standzylinder, Antimon hineingeben erkennbar heftige, exotherme Reaktion Sb + 3/2 Cl2 SbCl3 allgemein: M + n/2 X2 MXn M = Metall, X = Halogen Bleichwirkung von Chlor wird gebleicht durch oxidative Zerstörung des Farbstoffs Wichtige Halogen-Verbindungen I Halogen: „Salzbildner“ s2p5 + e- → s2p6 Na• + Cl → Na+ + Cl ⎯ Halogenide mit Edelgaskonfiguration mit Wasserstoff: Chlorwasserstoff HCl farbloses, stechend riechendes Gas sehr gute Löslichkeit in Wasser → Salzsäure Metall + HCl → Salze (Chloride), z. B. NaCl, KCl, MgCl2 Nachweis von Chlorid analytischer Cl --Nachweis Cl- + Ag+ → AgCl↓ weißer käsiger Niederschlag Bromwasserstoff HBr sehr gute Wasserlöslichkeit, Salze: Bromide AgBr: lichtempfindliche Substanz in S/W-Filmen AgBr Licht Ag + Br Wichtige Halogen-Verbindungen II mit Sauerstoff: Chloroxide, Chlorsäuren und deren Salze ClO2 gelbgrünes, explosives Gas ClO2 → ½Cl2 + O2 ΔH° = -103 kJ/mol Perchlorsäure HClO4 stärkste bekannte Säure konz. HClO4 starkes Oxidationsmittel, reagiert heftig mit allen organischen Substanzen (!) Chlorate MeClO3 starke Oxidationsmittel in Zündhölzern, Sprengstoffen, Leuchtsätzen, Pflanzenvernichtungsmitteln typische Reaktion: Disproportionierung ±0 -1 Cl2 + H2O Cl- + ClO- + 2 H+ +1 3 Cl O - +5 +1 - -1 Cl O 3 + 2 Cl - Versuche mit Kaliumchlorat ⅜ S8 + 2 KClO3 3 SO2 + 2 KCl Chlorat- Knall P4 + 5O2 → P4 O10 KClO3 → KCl + 3/2 O2 Sauerstoffsäuren des Chlors Summenformel Valenzstrichformel Name HClO H O Hypochlorige Säure Ox.zahl (Cl) Anionen Salze Cl +1 - Cl O Hypochlorit HClO2 H HClO3 Cl O H O Cl O HClO4 O Chlorsäure +3 +5 Cl Chlorit O - Cl O H Cl O O Chlorige Säure -O O O O Perchlorsäure +7 O O Chlorat O -O Cl O O Perchlorat











