Nomenclature AllgCh
Werbung

Nomenklatur der Anorganische Chemie,
eine (sehr) kurze Einführung
Prof. W. H. Koppenol, Sekretär 1994-1997, IUPAC Kommission der
anorganisch-chemischen Nomenklatur
International Union of Pure and Applied Chemistry (www.iupac.org,
sehe auch: www.chem.qmw.ac.uk/iupac/bibliog/inorg.html)
8 Untereinheiten:
I.
II.
III.
IV.
V.
VI.
VII.
VIII.
PHYSICAL AND BIOPHYSICAL CHEMISTRY
INORGANIC CHEMISTRY
ORGANIC AND BIOMOLECULAR CHEMISTRY
MACROMOLECULAR
ANALYTICAL CHEMISTRY
CHEMISTRY AND THE ENVIRONMENT
CHEMISTRY AND HUMAN HEALTH
CHEMICAL NOMENCLATURE AND STRUCTURE
REPRESENTATION
IUPAC Nomenclature of Inorganic Chemistry - Recommendations
1990, G. J. Leigh, ed., Blackwell, Oxford, 1990, oder „Red Book I“.
Wird überarbeitet, sollte mehr oder weniger fertig sein.
IUPAC Nomenklatur der Anorganischen Chemie, W. Liebscher und J.
Neels, VCH, Weinheim, 1994.
1782
L.B. Guyton de Morveau:"...il exige une méthode constante
de dénominations qui aide l'intelligence et soulage la memoire."
Übersetzung: Regeln, keine willkürliche Namen
Neues Projekt: Chemical indentifier
1
Nomenklatur ist eine Sprache - es gibt eine Grammatik
Exponent, Index
Klammern
+ und −,
Strich
[Fe(C5H5)2]
[Al(HO)(H2O)5]2+
Ca[AgF4]2
[Co(en)3]3+
[{()}]
neutral
geladen
komplex Ion
Abkürzung
Reihefolge, wenn [ und (
nicht reichen
[15N]H3
Isotopen
Ladung: Fe2+, nicht Fe+2, nicht Ferro, sondern
Eisen(II)
Optische Aktivität
[Mn2(CO)10], bis(pentacarbonylmangan)(Mn−Mn)
Punkt
O2•−
Komma
Trennung von Lokanten: 2,2‘-bpy
bpy = Bipyridin
Koordination: cis-Bis(glycinato-N,O)platin
Festkörperchemie: (Mo,W) nO3n-1
Ladung: Fe3O4, Trieisen(II,III)tetraoxid
(Magnetit)
Isotopen: [18O,32P]H3PO4
Kursiv
cis, (Mn−Mn), cyclo, catena, usw., auch
Kappa-Konvention, sehe unten..
Superoxid oder Dioxid(•1−)
Multiplikative Präfixe Unterschied zwischen di und bis, tri und tris,
tetra und tetrakis usw.: tetrachloro.., aber tetrakis(ethanolato)...
2
Elemente
Periodensystem: Elementen 1-109, eingeteilt in 18 Gruppen, haben
Namen (Element 109 ist Meitnerium), 110 und höher noch nicht.
Isotop: gleicher Name wie das Element, Ausnahme Wasserstoff: 1H,
Protium; 2H, Deuterium, D; 3H, Tritium, T (H+, Proton; D+ oder 2H+,
Deuteron; T+ oder 3H+, Triton). Das natürliche Gemisch von H+, D+
und T+: Hydron
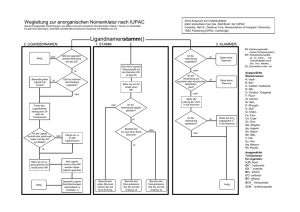
Nomenklatursysteme: 3 + a
Binärnomenklatur
Natriumchlorid
Magnesium-chlorid-hydroxid
Uranyldifluorid
Kohlenstofftetrachlorid
Koordinationsnomenklatur
Triammintrinitrocobalt
Tetrakalium-hexacyanoferrat
(Kalium-hexacyanoferrat?, Ladung?)
Tetrachlorokohlenstoff
Substitutionsnomenklatur (Organische Chemie)
geeignet für Gruppen 14, 15 und 16, und für Bor (Hydridnamen)
Methan (CH4)
Azan (NH3),
Oxidan (H2O)
Silan (SiH4)
Phosphan (usw.)
Sulfan
German
Arsan
Selan
Stannan
Stiban
Tellan
Plumban
Bismutan
Polan
Beispiele:
Difluorsilan
Tetrachlormethan
SiF2H2
CCl4
Bemerkung: Hydrogen statt Wasserstof ist erlaubt.
3
Drei Namen für CCl4!
Spezielle Nomenklatur
Oxosäure
Dichromsäure, H2Cr2O7, halbsystematisch, undeutlich.
„a“ Nomenklatur ("replacement" nomenclature)
1,4,7-triazacyclononan (NH ersetzt CH2)
Borverbindungen – Namen abgeleitet von Boran, BH3
Oxosäure, systematisch
Ion
Cl–
ClO–
ClO2–
ClO3–
ClO4–
alt
Chlorid
Hypochlorid
Chlorit
Chlorat
Perchlorat
neu (K-Nomenklatur)
bleibt!
Oxochlorat(1–)
Dioxochlorat(1–)
Trioxochlorat(1–)
Tetraoxochlorat(1–)
Hypo-, Per-, -it, -at: Relative Oxidationszustände: vergleiche Chlorit
und Chlorat mit Sulfit und Sulfat, nicht systematisch.
Schwefelsäure ist jetzt: Dihydrogen-tetraoxosulfat(2–)
Griechische Buchstaben:
µ
Brücke, verknüpft Koordinationszentren:
[{Co(CN)5}{Fe(CN)5}(µ-CN)], Pentacyanocobaltat(III)-µcyano-pentacyanoferrat(III). Was ist hier noch unklar?
κ
Kappa-Konvention um Ligandatomen an zu geben:
[O=N–O–Co(NH3)5]2+, Pentaamminnitrito-κO-cobalt(III).
η
hapto-Symbol: gibt die Anzahl der koordinierenden Atomen im
Liganden an: [PtCl2(C2H4)NH3], Ammindichloro(η2ethen)platin.
4
Trivialnamen
Viele sind noch erlaubt:
H2O
H2O2
NO+
UO22+
HO–
CN–
NCS–
NCO–
PO43–
Wasser
Wasserstoffperoxid
Nitrosyl (oder Nitrosyl-Kation)
Uranyl(2+)
Hydroxid oder Hydroxid-Ion, nicht Hydroxyl
Cyanid
Thiocyanat
Cyanat
Phosphat, oder (besser), Tetraoxophosphat(3–)-Ion
Sehr nützlich ist die Tabelle VIII am Ende des „roten“ Buches
5
Übungen
Gefragt: Namen oder Formeln
H2O2, HOO•, abgeleitet von Oxidan, Wasser
N2O, NO•, NO2•, NO3•
Pentaaz-2-en
[CoCl(NH3)5]2+
[Fe(CO)4]2–
Pentaamminnitrito-κN-cobalt(III)
AsO43–, SeO32–, S42–
µ-Oxo-hexaoxodisilicat(7–)
NaTl(NO3)2
2
AlK(SO4)•12H2O
H– oder D–
Silanol
_________________________
Fragen und Bemerkungen: Prof. W. H. Koppenol, CHI H211.
6