+ Kompendium 8.2.1. Modellverstellung vom Atom - + X + e-
Werbung
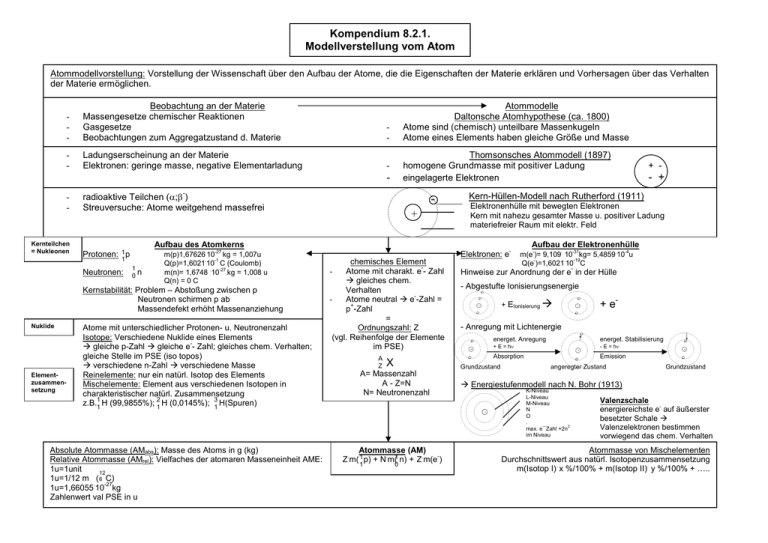
Kompendium 8.2.1. Modellverstellung vom Atom Atommodellvorstellung: Vorstellung der Wissenschaft über den Aufbau der Atome, die die Eigenschaften der Materie erklären und Vorhersagen über das Verhalten der Materie ermöglichen. - Beobachtung an der Materie Massengesetze chemischer Reaktionen Gasgesetze Beobachtungen zum Aggregatzustand d. Materie - - Ladungserscheinung an der Materie Elektronen: geringe masse, negative Elementarladung - Atommodelle Daltonsche Atomhypothese (ca. 1800) Atome sind (chemisch) unteilbare Massenkugeln Atome eines Elements haben gleiche Größe und Masse Thomsonsches Atommodell (1897) homogene Grundmasse mit positiver Ladung eingelagerte Elektronen - Kernteilchen = Nukleonen - radioaktive Teilchen (α;β ) Streuversuche: Atome weitgehend massefrei Neutronen: 1 0n m(p)1,67626.10-27 kg = 1,007u Q(p)=1,6021.10-1 C (Coulomb) m(n)= 1,6748 .10-27 kg = 1,008 u Q(n) = 0 C Kernstabilität: Problem – Abstoßung zwischen p Neutronen schirmen p ab Massendefekt erhöht Massenanziehung Elementzusammensetzung Elektronenhülle mit bewegten Elektronen Kern mit nahezu gesamter Masse u. positiver Ladung materiefreier Raum mit elektr. Feld + Atome mit unterschiedlicher Protonen- u. Neutronenzahl Isotope: Verschiedene Nuklide eines Elements gleiche p-Zahl gleiche e - Zahl; gleiches chem. Verhalten; gleiche Stelle im PSE (iso topos) verschiedene n-Zahl verschiedene Masse Reinelemente: nur ein natürl. Isotop des Elements Mischelemente: Element aus verschiedenen Isotopen in charakteristischer natürl. Zusammensetzung z.B.11 H (99,9855%); 21 H (0,0145%); 31 H(Spuren) chemisches Element Atome mit charakt. e - Zahl gleiches chem. Verhalten Atome neutral e -Zahl = + p -Zahl = Ordnungszahl: Z (vgl. Reihenfolge der Elemente im PSE) - A Z Elektronen: e X - Abgestufte Ionisierungsenergie - - 1 0 + e- - + EIonisierung + + - - Anregung mit Lichtenergie - energet. Anregung - + E = hν + energet. Stabilisierung - - E = hν + + Absorption Grundzustand Atommasse (AM) . . . Z m( 1 p) + N m(1 n) + Z m(e ) Aufbau der Elektronenhülle m(e-)= 9,109. 10-31kg= 5,4859.10-4u Q(e-)=1,6021.10-19C - - Emission angeregter Zustand - Grundzustand Energiestufenmodell nach N. Bohr (1913) + Absolute Atommasse (AMabs): Masse des Atoms in g (kg) Relative Atommasse (AMrel): Vielfaches der atomaren Masseneinheit AME: 1u=1unit 12 1u=1/12 m ( 6 C) . -27 1u=1,66055 10 kg Zahlenwert val PSE in u - Hinweise zur Anordnung der e in der Hülle - A= Massenzahl A - Z=N N= Neutronenzahl - + Kern-Hüllen-Modell nach Rutherford (1911) Aufbau des Atomkerns Protonen: 1 p 1 Nuklide - + - K-Niveau L-Niveau M-Niveau N O . max. e—Zahl +2n2 im Niveau Valenzschale energiereichste e- auf äußerster besetzter Schale Valenzelektronen bestimmen vorwiegend das chem. Verhalten Atommasse von Mischelementen Durchschnittswert aus natürl. Isotopenzusammensetzung . . m(Isotop I) x %/100% + m(Isotop II) y %/100% + K..