2 Aufbau der Materie
Werbung

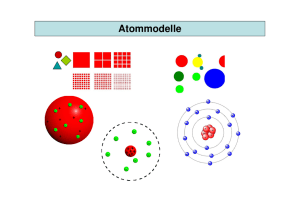
Hofer 2Aufbau der Materie 2 Aufbau der Materie 2.1 Die Bestandteile der Materie 1 Chemische Versuche und hoch auflösende Spezialmikroskope zeigen, dass alle Stoffe aus den chemischen Grundstoffen oder Elementen (elemento, el) aufgebaut sind. A1: Nenne einige chemische Elemente! Die kleinsten Teilchen eines Elements heißen Atome (átomo, el). Die Idee des Atoms geht auf Demokrit von Abdera und Leukipp von Milet zurück. (5. Jhdt. v. Chr.) atomos (griech.) = unteilbar Heute gilt das nicht mehr, denn man weiß, dass das Atom aus Kern und Hülle besteht. Das Elektron(electrón, el) wurde 1895 von Joseph John Thomson experimentell nachgewiesen. 1911 entdeckte Ernest Rutherford den Atomkern(núcleo (el) atómico). Im Atomkern ist fast die ganze Masse des Atoms enthalten. In der Umgebung des Atomkerns halten sich die Elektronen auf. Diesen Bereich nennt man Elektronenhülle(capa electrónica, la; envoltura electrónica, la). Die elektrisch negativen Elektronen und der elektrisch positive Kern ziehen einander an! Atom Atomkern Elektron Hülle Masse kg 10-26 10-26 10-30 10-29 Durchmesser m 10-10 10-14 10-19 10-10 elektrische Ladung neutral positiv negativ negativ Der Betrag der Ladung eines Elektrons heißt Elementarladung e (carga (la) elemental). Die Ladung der Elektronen gleicht die Ladung des Atomkerns aus. Wird die Anzahl der Elektronen eines Atoms verändert, dann erhält man ein geladenes Atom. Das Teilchen heißt dann Ion (ión, el). Verbinden sich Atome, so heißen sie Molekül (molécula, la). Zwei Wasserstoffatome und ein Sauerstoffatom bilden ein Wassermolekül H2O. Hofer 2Aufbau der Materie 2 Die Größe von Atomen anzugeben ist problematisch, weil die Elektronenhülle eines Atoms nach außen keine feste Grenzen hat. Man kann sich aber helfen, indem bei einem Element im festen Zustand den Abstand der Atomkerne zweier benachbarter Atome bestimmt. Abb.1: Relative Größe von Atomen Java Applet: Powers of Ten System Milchstraße Sonne Erde Mensch 1 Liter Wasser 1 cm3 Luft Wassermolekül Anzahl der Atome 1068 1057 1050 1028 1026 1019 3 A2: Was versteht man unter einem Atom? Was versteht man unter einem Molekül? Gib typische Größenordungen für die Größe und Masse von Atomen an! A3: Suche nach einem passenden Vergleich für den Größenunterschied zwischen Kern und Atomdurchmesser! Hofer 2Aufbau der Materie A4: Verschaffe dir Information über Demokrit, Leukipp, J.J. Thompson und E. Rutherford aus einem Lexikon oder aus dem Internet. 2.2 Die Elektronenhülle (capa electrónica, la; envoltura electrónica, la) 3 Die Anzahl der Elektronen im neutralen Atom heißt Ordnungszahl Z (atomic number; número (el) atómico). Aufgrund ihrer Ordnungszahl lassen sich alle Elemente im Periodensystem der chemischen Elemente (periodic table; sistema (el) periódico de los elementos). Java Applet: Periodensystem Elemente mit gleicher Eigenschaft stehen in einer Gruppe. Diese Elemente besitzen die gleiche Anzahl von äußeren Elektronen (Valenzelekronen). Die Aufstellung des Periodensystems gelang D. Mendelejew und J. Meyer 1869 unabhängig von einander. Heute sind über 100 Elemente bekannt. Unter normalen Bedingungen sind 11 Elemente gasförmig und nur zwei Elemente sind flüssig und alle anderen sind fest. Die Elemente Technetium Tc (Z = 43), Promethium Pm (Z = 61) und alle Elemente mit Z > 83 haben instabile Kerne. A1: Suche die gasförmigen und flüssigen Elemente im Periodensystem! Zwischen den elektrisch geladenen Atomkern und den Elektronen in der Hülle herrschen elektrische Kräfte(fuerza (la) eléctrica). Die Atome können in zwei Formen vorliegen: 1) Atomare Form 2) Chemische Verbindung (compound; combinación (la) química) Chemische Verbindungen Jede chemische Verbindung beruht auf elektrischen Kräften. 2Aufbau der Materie Hofer 4 Bindungsarten: Metallbindung Ionenbindung Atombindung Metall-Metall Metall – Nichtmetall Nichtmetall-Nichtmetall A2: Überlege den Zusammenhang zwischen der Stabilität einer chemischen Bindung und der Temperatur! A3: Vergleiche die Eigenschaften der einzelnen Bindungstypen! A4: Nenne den Bindungstyp von NH3 und Natriumoxid Na2O! Hofer 2Aufbau der Materie 1.3 5 Der Atomkern(núcleo (el) atómico) Jeder Atomkern enthält mindestens ein Proton(protón, el). A1: Erarbeite mit dem Lehrer oder anhand von Unterlagen die Eigenschaften des Protons! A2: Was bedeutet Kernladungszahl Z(número (el) atómico) bzw. Ordnungszahl. A3: Erarbeite mit dem Lehrer oder anhand von Unterlagen die Eigenschaften des Neutrons(neutrón, el)! Die Bestandteile des Kerns nennt man Nukleonen. A4: Wie berechnet sich die Massenzahl (número (el) de masa) A eines Atoms? Wenn es von einem Element verschiedene Kernarten gibt spricht man von Isotopen(isótopo, el)! Die Isotope eines Elements haben gleiche Kernladungszahl aber verschiedene Neutronenzahl. Die chemischen Eigenschaften sind gleich, weil sie die gleiche Elektronenhülle haben. Die Isotope des Wasserstoffs: Name Wasserstoff Deuterium Tritium A5: Kurzform Nukleonenanzahl Kernladungszahl Z Neutronenanzahl N 1 1 2 1 3 1 H 1 1 0 H 2 1 1 H 3 1 2 Gib Z, N und A des leichtesten und schwersten Kohlenstoffisotops an! Bemerkung: Protonen und Neutronen bestehen aus noch kleineren Teilchen, den Quarks. Hofer 2Aufbau der Materie 1.4 6 Die Atommasse (masa (la) atómica) Die Masse eines einzelnen Atoms ist sehr klein. Man hat daher eine Maßeinheit für die Masse von Atomen eingeführt. Atomare Masseneinheit (unidad (la) de masa atómica) 1 u = 1,6605 . 10-27 kg 1 u ist genau ein 1 der Masse eines 12 12 6 C Atoms. Die relative Atommasse gibt an wie oft die atomare Masseneinheit u in der Masse eines Atoms enthalten ist. Ernest Rutherford entdeckte 1911 experimentell, dass die Masse jedes Atoms praktisch vollständig im Atomkern befindet. A1: Warum stimmt die relative Massenzahl fast mit Anzahl der Protonen und Neutronen überein? A2: Berechne die Summe der Massen der Bestandteile eines A3: Versuche den Begriff relative Molekularmasse zu erklären! A4: Berechne die relative Molekularmasse von H 2 O und des CO 2 ! 16 8 O Atoms! 2Aufbau der Materie Hofer 7 1.5 Stoffmenge(cantidad (la) de materia) und Mol A1: Berechne die Anzahl der Atome in a) 1kg 12 6 C 12 6 b) 12g C c) 20,179g Ne Da bei Körpern des Alltags die Teilchenanzahlen sehr groß sind führt man eine neue physikalische Größe ein. Stoffmenge(cantidad (la) de materia) / Mol Die Einheit der Stoffmenge n heißt Mol Einheit: [n] = mol 1 mol eines Stoffes enthält soviel Gramm des Stoffes, wie die relative Atommasse angibt. 1 mol besteht aus 6 . 1023 Teilchen. (Loschmidtzahl oder Avogadrozahl NA) Die erste experimentelle Bestimmung der Teilchenzahl einer Stoffmenge führte der Österreicher Josef Loschmidt durch. kg/m3) A2: Berechne das Volumen von einem Mol Wasserstoff H2! A3: Berechne die Masse von 1 mol Sauerstoff O2, Methan CH4 und Cl2. Hofer 2Aufbau der Materie 1.6 8 Stabile und instabile Kerne Radioaktive Erscheinungen wurden 1896 erstmal von Antoine Henri Becquerel bei Uran entdeckt! Marie Curie und Pierre Curie waren Pioniere der Erforschung der Radioaktivität. 1903 wurden alle drei mit dem Nobelpreis ausgezeichnet! Natürliche Radioaktivität(radi(o)actividad, la) bedeutet, dass einzelne Atomkerne spontan Teilchen aussenden! Diese Teilchen können dann Atome treffen und sie zu Ionen machen. Man nennt diese Strahlung daher ionisierende Strahlung(radiación ionizado, la)! Für Zellen von Lebewesen kann diese Strahlung tödlich sein! Ionisierende Strahlung ist für Menschen gefährlich! Daher ist beim Umgang mit radioaktiven Stoffen Vorsicht geboten! A1: Vervollständige die Tabelle! Ionisierende Strahlung(radiación ionizado, la) Strahlung - Strahlung + - Strahlung - Strahlung Strahlung Ausgesandte Strahlung Masse/Ladung (masa, la/carga, la) Ort der Entstehung und Ursache Beispiel Reichweite (alcance, el) in Luft/Wasser Relative Schädlichkeit 10-1m/10-4m 10-20 100m/10-3m 100m/10-3m 1 103m/100m 1 Die Anzahl der Zerfälle pro Sekunde, die in einem radioaktiven Stoff stattfinden, heißt Aktivität A. Aktivität/Bequerel 1 Bequerel bedeutet ein Kernzerfall pro Sekunde. 1Bq = 1s-1 A1: Das Körpergewebe des Menschen besteht zu etwa 80% aus Wasser. Wie weit dringen die verschiedenen ionisierenden Strahlungen in den Körper des Menschen ein? 5-10