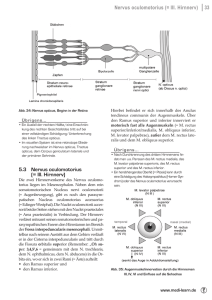
Der transmaxilläre endoskopische Zugang zur Orbita
Werbung

Ruhr-Universität Bochum Prof. Dr. med. Martin Scholz Dienstort: Klinikum Duisburg Klinik für Neurochirurgie Der transmaxilläre endoskopische Zugang zur Orbita -Eine anatomisch-experimentelle Studie- Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum Vorgelegt von Saskia Schultheiß aus Bonn 2010 Dekan: Prof. Dr. med. G. Muhr Referent: Prof. Dr. med. Martin Scholz Koreferent: Prof. Dr. med. Stefan Dazert Tag der Mündlichen Prüfung: 27. Januar 2011 Meinen Eltern in Liebe und Dankbarkeit Inhaltsverzeichnis 1. Einleitung 6 1.1. Ziel der Arbeit 6 1.2. Anatomie des Sinus maxillaris und der inferioren Orbita 6 1.3. Raumforderungen in der Orbita 11 1.4. Mikroskopische Orbitachirurgie 16 1.5. Endoskopische Orbitachirurgie 17 1.6. Blow-out-Frakturen des Orbitabodens 20 1.7. Der Caldwell-Luc-Zugang zur Kieferhöhle 21 2. Methodik 23 2.1. Material und Geräte 23 2.2. Durchführung des Zugangs 24 3. Ergebnisse 27 3.1. Zugang zur Kieferhöhle 27 3.2. Inspektion der Kieferhöhle 29 3.3. Eröffnung des Orbitabodens 31 3.4. Präparation des Intrakonalraumes 37 3.5. Medialer Zugangsweg 38 3.6. Lateraler Zugangsweg 43 3.7. Fazit 47 4. Diskussion 50 4.1. Durchführbarkeit des Zugangs, Vorteile und Risiken 50 4.2. Möglichkeiten der plastischen Deckung 53 4 4.3. Vergleich zu anderen operativen Zugängen zur Orbita 60 4.4. Fazit 62 5. Zusammenfassung 64 6. Literaturverzeichnis 66 5 1. Einleitung 1.1. Ziel der Arbeit Ziel dieser Arbeit ist die Überprüfung der Durchführbarkeit eines endoskopischen transmaxillären Zugangs zur Orbita anhand von formalinfixierten Kopfpräparaten mittels eines Hypophysenendoskopes. Folgende Fragen sollen durch diese Arbeit geklärt werden: - Ist der transmaxilläre Zugang zur Orbita endoskopisch durchführbar? - Welche Vor- und Nachteile bringt die Verwendung eines Endoskopes über diesen Zugang? - Welche Bereiche der Orbita können über diesen Zugang erreicht werden? 1.2. Anatomie des Sinus maxillaris und der Orbita Der im Os maxillare paarig angelegte Sinus maxillaris ist die größte Nasennebenhöhle des Menschen. Er ist, in der Frontalebene gesehen, dreieckig aufgebaut, wobei die mediale, in der Sagittalebene annähernd quadratische Wand an die Nasenhaupthöhle grenzt, die superiore Wand den Orbitaboden bildet und die laterale Wand die Schädelkontur zwischen Os zygomaticum und der oberen Zahnreihe bildet. So höhlt die Kieferhöhle fast den gesamten Oberkieferkörper aus und bildet annähernd eine Pyramide, deren Basis medial liegt. In der superioren Wand des Sinus verlaufen im Canalis infraorbitalis der N. infraorbitalis und seine begleitenden Gefäße; in etwa 15% der Fälle finden sich Dehiszenzen im Knochenkanal, in denen der Nerv nur durch Schleimhaut bedeckt ist (Lang, 1981). Kurz vor seinem Austritt aus dem Foramen infraorbitale gibt der Nerv Äste zum Plexus dentalis superior ab, der die Oberkieferzähne sensibel versorgt (Schünke et al., 2006). Durch den N. infraorbitalis und seine begleitenden Gefäße wird die nahezu dreieckige superiore Wand in ein kleines laterales Dreieck und ein mediales Trapez geteilt. 6 Die superiore Kieferhöhlenwand ist im Mittel 37,6 mm lang und 26,86 mm breit (Lang, 1981). Durch die Pneumatisation ist der Knochen in diesem Bereich sehr dünn- im Mittel 0,52(0,05-4,0) mm (Lang, 1981). Dorsal wölbt der Sinus maxillaris den Knochen zum Tuber maxillae aus, in der fazialen Wand befinden sich das Foramen infraorbitaleder Austrittspunkt des N. infraorbitalis- und der Bereich der Fossa canina. Die faziale Wand ist von außen von Wangenweichteilgewebe und Gingiva bedeckt, direkt unterhalb des Foramen infraorbitale setzt der M. levator anguli oris am Knochen an. Nach dem Austritt aus dem Foramen infraorbitale versorgt der N. infraorbitalis die Haut zwischen Unterlid und Oberlippe sensibel. Der Abfluss und die Belüftung des Sinus maxillaris erfolgen über das Ostium maxillare, das sich am oberen Ende der mittleren Sinuswand befindet, in den mittleren Nasengang. Oberhalb des Ausführungsganges liegen, durch einen dünnen Knochensteg abgetrennt, die Cellulae ethmoidales, welche die mediale Orbitawand bilden. Der tiefste Punkt der Kieferhöhle liegt oberhalb der Wurzeln der Molaren (Schünke et al, 2006). Oft sind Ausbuchtungen der Zähne im Schleimhautrelief des Sinus zu erkennen. Bei großer Kieferhöhle ragen die Wurzeln der Molaren und Prämolaren auch oft frei in die Kieferhöhle, so dass bei Zahnextraktionen die Gefahr der Eröffnung der Kieferhöhle besteht. Die Pneumatisation des Sinus maxillaris beginnt erst in der späten Fetalzeit, etwa um das 25. Lebensjahr ist die vollständige Größe erreicht (Lippert, 2003). Der Sinus maxillaris ist von der Orbita durch seine dünne superiore Wand getrennt. Der Orbitaboden wird zum größten Teil von der Facies orbitalis maxillae gebildet, den vorderen lateralen Teil bildet jedoch das Os zygomaticum und den hintersten Teil der Processus orbitalis des Os palatinae. Medial geht der Orbitaboden ohne sichtbare Grenze in die mediale Orbitawand über. Lateral wird der Orbitaboden in den hinteren zwei Dritteln durch die Fissura orbitalis inferior von der lateralen Orbitawand getrennt und geht im vorderen Drittel nach oben direkt in die laterale Orbitawand über. Weitere Knochen, die an der Bildung der knöchernen Orbita beteiligt sind, sind das Os sphenoidale, das Os ethmoidale, das Os lacrimale und das Os frontale. Der Orbitaboden verläuft nicht horizontal, sondern steigt konvex an, so dass der posteromediale Anteil weiter superior liegt als der flache anterolaterale Anteil. 7 Metzger et al. unterscheiden in einer Studie an 279 CT-Scans kaukasischer Patienten zwölf Variationen in der Anatomie des Orbitabodens: drei Variationen des rechten und drei des linken Orbitabodens, an denen außerdem geschlechtsspezifische Unterschiede feststellbar sind ( Metzger et al., 2007). Intraorbital, dem Orbitaknochen anliegend, findet sich die Periorbita, eine bindegewebige Hülle, die den gesamten Orbitainhalt umschließt. Sie ist leicht vom Orbitaboden zu lösen, an den Fissuren und am Apex haftet sie fester. Die Periorbita geht an den Fissurae orbitales in die Dura mater sowie in das äußere Periost des Schädels über (Lang, 1981). Im Bereich der Fissura orbitalis inferior finden sich als Rudimente glatte Muskelzellen, auch M. orbitalis genannt (Lippert, 2003). Über dem Orbitaboden und der anliegenden Periorbita befindet sich, hinter einer dünnen Fettschicht, der M. rectus inferior. Dieser senkt bei Anspannung den Blick nach unten und wird von einem Ast des Ramus inferior des N. oculomotorius versorgt, der von intrakonal in den Muskel eintritt. Der M. rectus inferior bildet gemeinsam mit dem M. rectus medialis, dem M. rectus superior, dem M. rectus lateralis und einem Anteil des M. obliquus superior einen Muskelkonus, der vom Bulbus zum Anulus tendineus communis am Apex der Orbita läuft, so dass sich ein Intra-und Extrakonalraum der Orbita unterscheiden lassen. Der M. obliquus superior setzt hierbei nicht direkt am Bulbus an, sondern wird zuvor über die Trochlea an der medialen oberen Orbitawand umgelenkt, bevor er von oben am lateralen Bulbus ansetzt. Der M. obliquus inferior entspringt nicht wie die übrigen Augenmuskeln dem Anulus tendineus communis, sondern dem medialen Orbitarand, er setzt dann am lateralen Bulbus an und umschließt diesen so von unten. Zentral im Muskelkonus verläuft der N. opticus, dessen intraorbitaler Abschnitt beim Erwachsenen etwa 28 mm lang ist (Lang, 1981). Durch den Anulus tendineus communis in der Fissura orbitalis superior treten neben dem N. opticus auch der Ramus superior und inferior des N. oculomotorius, der N. nasociliaris und der N. abducens in die Orbita ein, außerdem die A. ophthalmica. Der N. trochlearis, der N. frontalis und der N. lacrimalis treten gemeinsam mit der V. ophthalmica superior oberhalb des Anulus tendineus communis durch die Fissura 8 orbitalis superior ein, die V. ophthalmica inferior unterhalb des Anulus tendineus (Schünke et al., 2006). Der Ramus inferior des N. oculomotorius versorgt auch den M. rectus medialis, dessen versorgender Ast als erster abzweigt und unter dem N. opticus nach medial zieht, bevor der übrige Nerv sich in zwei Äste zum M. obliquus inferior und zum M. rectus inferior aufteilt. Nach dieser Gabelung gibt der Ast zum M. obliquus inferior eine motorische Wurzel mit parasympathischen Fasern zum Ganglion ciliare ab und verläuft dann lateral des M. rectus inferior, während der Ast zum M. rectus inferior von superior in den Muskel eintritt. Der Ramus superior des N. oculomotorius innerviert den M. rectus superior, er tritt von lateral in diesen ein. Der M. rectus lateralis wird vom N. abducens innerviert, dieser tritt von intrakonal und eher von superior in den Muskel ein. Der N. trochlearis versorgt den M. obliquus superior und tritt rasch nach dem Durchlaufen der Fissura orbitalis superior von oben in ihn ein. Das etwa 2 mm große Ganglion ciliare befindet sich in der inferioren Orbita, lateral des N. opticus und inferior des Hauptstammes der A. ophthalmica, etwa 2 cm vom Bulbus entfernt (Schünke et al., 2006). Es enthält neben der oben genannten motorischen Wurzel aus dem N. oculomotorius eine sensorische Wurzel zum N. nasociliaris, die sensorische Fasern von Bulbus und Kornea nach zentral und vermutlich sympathische Fasern von der A. carotis interna zum Bulbus und zum M. dilatator pupillae führt. Die Verbindung zwischen Ganglion ciliare und Bulbus bilden die kurzen Ciliarnerven, die um den N. opticus in die Sklera eintreten. Die langen Ciliarnerven führen ebenfalls sympathische Fasern zu Bulbus und M. dilatator pupillae, sie haben ihren Ursprung im intraorbitalen Teil des N. nasociliaris, laufen aber nicht über das Ganglion ciliare (Rhoton and Natori, 1996). Der N. nasociliaris verläuft zwischen M. rectus superior und N. opticus nach medial zwischen den M. rectus medialis und den M. obliquus superior und teilt sich dort in seine Endäste, den N. ethmoidalis anterior und den N. infratrochlearis, auf (Rhoton and Natori, 1996). 9 Die A. ophthalmica, die der A. carotis interna entspringt, verläuft nach dem Eintritt in die Orbita durch den Canalis opticus zunächst lateral des N. opticus und kreuzt dann in 85% der Fälle den N. opticus superior, in 15% inferior (Rhoton and Natori, 1996). Sie versorgt die gesamte Augenhöhle, außerdem den Nasenrücken (A. dorsalis nasi), die Stirn (A. supratrochlearis) und über die Aa. ethmoidales die Siebbeinzellen, die Dura mater der vorderen Schädelgrube, die Stirnhöhle und den oberen Teil der Nasenhöhle. Über die A. facialis, die A. temporalis superficialis und die A. maxillaris anastomosiert sie mit der A. carotis externa (Lippert, 2003). Nach dem Durchtritt des Apex gibt die A. ophthalmica während ihres Verlaufes neben dem N. opticus meist als ersten Ast die A. centralis retinae ab, meist an der Umbiegezone der A. ophthalmica nach medial. Es kommt selten vor, dass die A. centralis retinae aus anderen Ästen der A. ophthalmica, wie Aa ciliares oder anderen kleineren Ästen entspringt. Die A. centralis retinae verläuft korkenzieherartig gewunden nach medial und tritt etwa 9-10 mm vom Bulbus entfernt meist in die untere oder mediale Seite des N. opticus ein, in diesem verläuft sie dann zentral bis zur Retina. Außer der A. centralis retinae treten meist kleinere akzessorische Arterien in den Sehnerv ein (Lang, 1981). Weitere Äste der weit verzweigten A. ophthalmica sind A. lacrimalis, Aa. ciliares, Aa. conjunctivales, Aa. musculares und Aa. palpebrales. Die Ciliararterien verlaufen mit den Ciliarnerven zum Bulbus; die A. lacrimalis verläuft gemeinsam mit dem N. lacrimalis über dem M. rectus lateralis zur Tränendrüse, die unter dem oberen lateralen Orbitarand liegt. Der venöse Abfluss der Orbita erfolgt über die V. ophthalmica superior und inferior. Beide Venen verlaufen auf Höhe des Apex lateral des N. opticus und kreuzen in der anterioren Orbita nach medial. Die V. ophthalmica inferior drainiert den unteren und lateralen Teil der Orbita, den M. rectus inferior und M. obliquus inferior, Tränensack und Augenlider; durch die Fissura orbitalis inferior bestehen Verbindungen zum Plexus pterygoideus. Die V. ophthalmica superior drainiert den oberen medialen Teil der Orbita. Beide Venen münden in den Sinus cavernosus (Rhoton and Natori, 1996). 10 1.3. Raumforderungen in der Orbita Die Orbita stellt ein Grenzgebiet verschiedener Fachrichtungen dar, daher werden Orbitaprozesse oft interdisziplinär versorgt. Da Raumforderungen in der Orbita selten vorkommen, ist eine Versorgung in spezialisierten Zentren und die Operation durch einen in diesem Gebiet erfahrenen Chirurgen sinnvoll. Charakteristische Symptome intraorbitaler Raumforderungen können je nach Lokalisation Doppelbilder oder Visusminderung sein, aber auch Schmerzen, vor allem bei entzündlichen und malignen Prozessen. Bei fast allen Prozessen entsteht eine Protrusio bulbi (Hassler et al., 2007). Zur Diagnostik bei Verdacht auf intraorbitale Raumforderungen ist eine Magnetresonanztomografie mit Kontrastmittelgabe Mittel der Wahl, eine zusätzliche Computertomographie ist, besonders bei Tumoren die sich über die Orbita hinaus ausdehnen, zur Abgrenzung der knöchernen Strukturen sinnvoll. Orbitatumoren lassen sich auf verschiedene Arten einteilen. Nach ihrem Ursprung lassen sich primäre Läsionen, die direkt in der Orbita entstehen, sekundäre Läsionen, die in die Orbita hineinwachsen, und Metastasen unterscheiden. Außerdem unterscheidet man nach der Lokalisation intra- und extrakonale Tumoren (Darsault et al., 2001). Zwei Drittel der intraorbitalen Tumoren sind benigne, ein Drittel maligne, wobei sich im Kindesalter hauptsächlich gutartige Raumforderungen finden, der Anteil bösartiger Prozesse nimmt im Alter deutlich zu (Hassler et al., 2007). Die häufigste Tumorart sind gutartige, langsam wachsende Meningeome, an zweiter Stelle stehen vaskuläre Prozesse (Hassler et al., 2007). Intraorbitale Meningeome können entweder in der Orbita selbst entstehen oder sich in die Orbita ausdehnen (Darsaut et al., 2001). Als vaskuläre Malformationen sind im Kindesalter hauptsächlich kapilläre Hämangiome zu finden, die sich in einem hohen Prozentsatz spontan im Kleinkindalter zurückbilden, außerdem kavernöse Hämangiome, die auch im jungen Erwachsenenalter auftreten. Eine seltene Läsion im Kindes- und jungen Erwachsenenalter sind Lymphangiome, die intraorbital trotz der fehlenden lymphatischen Versorgung der 11 Orbita auftreten können. Hämorrhagien können beim Lymphangiom zu Komplikationen durch eine rasche Größenzunahme führen. Beim Erwachsenen finden sich vor allem Kavernome und arteriovenöse Malformationen, außerdem Hämangioperizytome, die komplett exzidiert werden müssen, um eine Metastasierung zu vermeiden (Hassler et al., 2007; Darsaut et al., 2001). Am N. opticus finden sich am häufigsten Optikusscheidenmeningeome, Lymphome und besonders bei Kindern Optikusgliome (Hassler et al., 2007). Optikusgliome sind die häufigsten intraorbitalen Tumoren bei der Neurofibromatose Typ 1 (Darsaut et al., 2001). Da der N. opticus nicht durch Schwann-Zellen umhüllt wird, sind Neurofibrome, Schwannome und maligne periphere Nervenscheidentumoren an ihm nicht zu finden; intraorbital entstehen diese an den motorischen Nerven zur Augenmuskulatur, aus dem N. ophthalmicus und N. maxillaris aus dem N. trigeminus und aus sympathischen und parasympathischen Fasern. Am Ganglion ciliare können sich selten Paragangliome bilden, obwohl die klassische Lokalisation hierfür eher die Ganglien des N. vagus sind (Darsaut et al., 2001). Intraorbitale Neurinome manifestieren sich eher im Erwachsenenalter, während Neurofibrome eher im Kindesalter vorkommmen (Hassler et al., 2007). Neurofibrome lassen sich in drei Gruppen einteilen: solitäre Tumoren, die aufgrund ihrer Umkapselung gut resektabel sind und nicht mit Neurofibromatose assoziiert sind, diffuse Tumoren, welche weiteres orbitales Gewebe einschließen und mit Neurofibromatose assoziiert werden können, und plexiforme Tumoren, die pathognomonisch für Neurofibromatose Typ 1 sind und aufgrund der starken Ausbreitung in umliegende Gewebe und Nerven nicht reseziert werden können (Darsaut et al., 2001). Dermoidzysten kommen bei Kindern und jüngeren Erwachenen als gutartige, aber zu Rezidiven neigende Raumforderung vor, sie liegen meist extrakonal; die häufigste Lokalisation ist die frontozygomatische Sutur (Darsaut et al., 2001). 12 Der häufigste maligne intraorbitale Tumor in der ersten Lebensdekade ist das Rhabdomyosarkom (Darsaut et al, 2001; Hassler et al., 2007). Das fibröse Histiozytom ist ein häufiger orbitale Tumor beim Erwachsenen und kann lokal infiltrierend wachsen. Das maligne fibröse Histiozytom kann auch metastasieren. Tumoren der Augenmuskeln wie Fibrome, Fibrosarkome, Leiomyome oder Leiomyosarkome sind extrem selten. Intraorbitale Lipome können Beschwerden verursachen, sind aber klinisch und histologisch schwierig von normalem Fettgewebe zu differenzieren (Darsaut et al., 2001). Im Bereich der Tränendrüse finden sich das benigne pleomorphe Adenom und das maligne adenoidzystische Karzinom (Hassler et al, 2007). Beim älteren Menschen können auch extra- und intrakonal Lymphome entstehen, insbesondere bei Non-Hodgkin-Lymphomen ist die Orbita häufiger befallen (Hassler et al., 2007). Im Bereich der knöchernen Orbita finden sich subperiostal Mukozelen, am Knochen selbst Osteome, Malignome, ossifizierende Fibrome, die fibröse Dysplasie, aneurysmatische Knochenzysten, osteogene Sarkome und Keilbeinflügelmeningeome (Hassler et al., 2007; Darsaut et al., 2001). Chondrome oder Chondrosarkome, die von der einzigen intraorbitalen knorpeligen Struktur, der Trochlea, ausgehen, sind extrem selten (Darsaut, 2001). Metastasen in der Orbita stammen beim Kind meist von Neuroblastomen, EwingTumoren, Chloromen und Langerhanszellhistiozytosen ab, bei Erwachsenen meist von Primärtumoren der Brust, Lunge, Prostata, Niere, Haut und des Gastrointestinaltraktes (Hassler et al., 2007; Darsaut et al., 2001). Das Vorliegen intraorbitaler Metastasen spricht für eine weit fortgeschrittene Erkrankung. Die Therapie erfolgt daher nach bioptischer Diagnostik meist palliativ, wobei kein zusätzlicher iatrogener Schaden entstehen sollte. Meist lässt sich durch eine Bestrahlung eine symptomatische Besserung erreichen (Hassler et al, 2007). Eine durch Schilddrüsenstörungen hervorgerufene endokrine Orbitopathie kann im schwersten Fall durch eine Sehnervenkompression zum Visusverlust führen (Ponto et al., 2009) und somit eine Indikation zur Orbitachirurgie darstellen, wenn sich bei einer 13 Visusverschlechterung medikamentös keine Besserung einstellt (Kennedy et al, 1990; Metson et al, 1994; Pletcher et al. 2006) Die Behandlung orbitaler Raumforderungen ist abhängig von deren Herkunft und Lokalisation. Bei infektiösen Prozessen oder dysthyroiden Orbitopathien kann zunächst eine medikamentöse Therapie, bei Hämangiomen ohne spontane Rückbildungstendenz im Kleinkindalter eine Kortikosteroidtherapie versucht werden (Darsaut et al., 2001). Bei der Mehrzahl orbitaler Tumoren bleibt die Chirurgie jedoch Mittel der Wahl, wobei der operative Zugang unter Beachtung der Lokalisation, der betroffenen anatomischen Strukturen und der Ausdehnung gewählt wird. Eine systematische Zusammenfassung der Zugangsmöglichkeiten zur Orbita wurde von Hassler et al. publiziert, die tabellarische Auflistung ist in modifizierter, gekürzter Form in Tabelle 1 dargestellt. Tabelle 1: Zugangsmöglichkeiten zur Orbita (nach Hassler et al., 2007) Extrakraniale Indikation Kontraindikation Gut umschriebene periorbitale Prozesse medial oder und intrakonale Tumoren, dorsal, mediobasal des N. opticus; basal und lateral des N. opticus; Zugang zum Apex Tumore der Tränendrüse beschränkt Extrakonale Tumoren medial des Superiore,basale und N. opticus; traumat. Schädigung laterale Tumoren; des Canalis opticus intrakonale Prozesse Tumore oder Trauma des Sinus Extensive frontobasale frontalis; Retentionszysten mit Schädigung; intrakonale Orbitabeteiligung; Extrakonale Tumoren Zugänge: Laterale Orbitotomie Transethmoidal Frontal transsinusoidal Prozesse mit Ausbreitung in den Sinus frontalis Transmaxillär Basale Läsionen mit Kontakt zum Läsionen oberhalb des N. Sinus maxillaris, extra-und opticus intrakonal 14 Transkonjunktival Basale, mediale intra- und Sehr kleine Läsionen; extrakonale Tumoren; Biopsien Apextumoren; laterale, intrakonaler Prozesse superiore und extrakonale Tumoren. Kombiniert Extra- Indikation Kontraindikation Supraorbital via Gut umschriebene intra-und Prozesse unterhalb des N. Augenbrauenschnitt extrakonale Prozesse oberhalb opticus und Intrakranialer Zugang: des N. opticus Transkraniale Indikation Kontraindikation Intraorbitales Gliom des N. Apextumoren; Tumoren opticus mit kranialer unterhalb des N. opticus; Ausbreitung; laterale Tumoren komplexe Tumoren mit des N. opticus Knocheninfiltration Zugänge: Subfrontal Frontolateral, pterional Ideal für Tumoren der Fissura Tumoren medial und basal orbitalis superior, Canalis opticus, des N. opticus; Tumore der Apex, N. opticus intraorbital; Tränendrüse Tumoren dorsal des N. opticus; laterale intra-und extrakonale Tumoren. Pterional extradural Dekompression des N. opticus im Prozesse im anterioren Canalis opticus; periorbitale Anteil der Orbita Tumoren; Tumoren an der Fissura orbitalis superior und inferior und des Sinus cavernosus Pterional kontralateral Tumoren des medialen Apex; Nicht anwendbar für Aneurysmen der A. ophthalmica andere Prozesse. 15 1.4. Mikroskopische Orbitachirurgie In der mikroskopischen Orbitachirurgie lassen sich grundsätzlich transkraniale und transorbitale Zugangswege unterscheiden. Transkraniale Zugänge eignen sich besonders für Läsionen im posterioren Orbitadrittel, während sich Läsionen in den zwei anterioren Dritteln durch transorbitale Zugänge erreichen lassen (Bejjani et al., 2001). Der frontotemporale Zugang und die posterioinferiore Orbitotomie zählen zu den transkranialen Zugängswegen zur Orbita. Die posterioinferiore Orbitotomie wird über einen transmaxillären Zugang unter mikroskopischer Sicht durchgeführt; der Orbitaboden wird über einen Caldwell-LucZugang im posterioren Bereich entfernt, so dass sich sich Läsionen unter dem N. opticus im Bereich des Apex entfernen lassen (Bejjani et al., 2001). Über den frontotemporalen Zugang lassen sich Raumforderungen im Bereich des Apex superior und lateral des N. opticus und an der Fissura orbitalis superior erreichen. Der Zugang erfolgt über eine frontotemporale Craniotomie, eine Rektraktion der zerebralen Hemisphere und Entfernung der lateralen oder superioren Orbitawand. Inwieweit die Osteotomie ausgedehnt wird, hängt von der intraorbitalen Lokalisation der Raumforderung ab (Bejjani et al., 2001). Hassler et al. berichten außerdem noch von einer weiteren Zugangsmöglichkeit, dem kontralateralen pterionalen Zugang mit transsphenoidal-transethmoidaler Route. Dieser Zugang eignet sich besonders für Läsionen im hinteren Intrakonalraum medial und inferior des N. opticus, welche schwierig über andere Zugangswege zu erreichen sind (Hassler et al., 1994). Zu den transorbitalen Zugängen, die man auch als extrakranial bezeichnen kann, da bei Ihnen die Schädelhöhle ungeöffnet bleibt, zählen die anteriore Orbitotomie ohne Osteotomie, die laterale Orbitotomie, die mediale Orbitotomie und die kombiniert laterale und mediale Orbitotomie (Cockerham et al., 2001). Die anteriore Orbitotomie erfolgt entweder über einen Schnitt in der oberen Lidfalte, einen Augenbrauenschnitt oder einen supraorbitalen Schnitt, über den auch eine Osteotomie des oberen Orbitarandes durchgeführt werden kann. Über diese Zugänge 16 lassen sich Läsionen in den anterioren superioren zwei Dritteln der Orbita erreichen, beispielsweise Läsionen im Bereich der Glandula lacrimalis. Über die laterale Orbitotomie können retrobulbäre Läsionen in den vorderen zwei Dritteln der lateralen, superolateralen und inferolateralen Orbita erreicht werden. Hierfür wird die laterale Orbitawand temporär über einen S-förmigen Schnitt zwischen Orbita und Temporalisfaszie entfernt. Die mediale Orbitotomie erfolgt transkonjunktival, der M. rectus inferior wird an seiner Insertionsstelle am Bulbus durchtrennt und an Fäden nach medial gezogen, so dass zwischen Bulbus und M. rectus medialis ein Zugang zum retrobulbären Raum geschaffen wird. Über den kombinierten lateralen und medialen Zugang wird der retrobulbäre Raum von medial noch besser erreicht, so dass auch größere Läsionen entfernt werden können. Der laterale Orbitarand wird hierbei über einen vom lateralen Augenwinkel ausgehenden Schnitt entfernt, so dass der Bulbus nach lateral mobilisiert werden kann und sich ein größerer Arbeitskanal zwischen M. rectus medialis und Bulbus bietet (Cockerham et al., 2001). 1.5. Endoskopische Orbitachirurgie Die Endoskopie bietet eine verbesserte Darstellung sowie eine bessere Ausleuchtung der Strukturen als konventionelle chirurgische Techniken, ausserdem macht sie kleinere Zugangswege und somit oft ein besseres kosmetisches Ergebnis möglich (Chen and Chen, 2003). Durch die Entwicklung von Kameras mit HD-Auflösung wird eine immer bessere Bildqualität erreicht. Der Einsatz von verschiedenen Winkeloptiken schafft Einblick in anatomische Bereiche, die durch den starren Winkel des Mikroskops nicht erreicht werden können. Daher wird in vielen neurochirurgischen Kliniken beispielsweise auch bei mikrochirurgischen transsphenoidalen Hypophysenresektionen abschließend endoskopisch kontrolliert, ob die Sella tumorfrei ist. Ein weiterer Vorteil der Arbeit mit dem Endoskop ist die Beweglichkeit des Operateurs. Dieser ist nicht an die starre Haltung, die zur Sicht durch das Okular des 17 Operationsmikroskopes nötig ist, gebunden und kann so bei längeren Operationen durch einen Wechsel seiner Position eine bequemere Sitzhaltung einnehmen. Die Geschichte der Neuroendoskopie begann im Jahr 1910, als Victor Lespinasse, ein Urologe aus Chicago, die erste neuroendoskopische Operation der Geschichte durchführte. Mithilfe eines pädiatrischen Endoskops inspizierte er bei zwei Kindern, die an Hydrocephali litten, die Ventrikel und koagulierte den Plexus choroideus, um die Liquorproduktion zu verringern. Obwohl seine Patienten nach dem Engriff fünf Jahre überlebten, was als Therapieerfolg zu werten war, wandte Lespinasse sich in seiner wissenschaftlichen Arbeit anderen Themen zu; erst acht Jahre später führte der amerikanische Neurochirurg Walter Dandy die Erforschung der Neuroendoskopie weiter (Chrastina et al., 2008). Im Laufe des Jahrhunderts wurden die Endoskopie des Ventrikelsystems erweitert und spezielle Gerätschaften für diese Eingriffe entwickelt (Chrastina et al., 2008; Schroeder and Gaab, 1999). In den 70er Jahren beschrieb Fukushima die Ergebnisse verschiedener endoskopischer Studien; neben Berichten über die klinische Verwendung flexibler Endoskope zur Ventrikuloskopie und weiteren Eingriffen am Ventrikelsystem (Fukushima et al., 1973) beschrieb er die Verwendung eines starren Endoskops für diagnostische Eingriffe am Spinalkanal, welche er gemeinsam mit Schramm an Hunden und sechs Patienten durchführte (Fukushima and Schramm, 1975). 1978 beschrieb er außerdem die Verwendung eines starren Endoskops zur Exploration von Cisterna magna, Cavum Meckeli und Kleinhirnbrückenwinkel in einer Kadaverstudie (Fukushima, 1978). Verschiedene wissenschaftliche Artikel belegen eine starke Zunahme der endoskopischen Hypophysenchirurgie Ende der 90er Jahre und zeigen gleichzeitig die Effektivität und Sicherheit dieses Verfahrens (Tabaee et al., 2007; Cappabianca et al., 2002; Jho, 2001; Shen et al., 2000). Hellwig und Bauer haben seit den 90er Jahren zahlreiche Artikel zu Möglichkeiten der neurochirurgischen Endoskopie publiziert, ein Schwerpunkt ihrer Arbeit lag hierbei in der Kombination von Endoskopie und Stereotaxie, beispielsweise zur Biopsie von Zysten, Abszessen, Hämatomen und unklaren Prozessen oder zur Anlage von Shunts (Hellwig and Bauer, 1991; Hellwig et al., 1991; Hellwig and Bauer, 1992). Bereits 1994 berichten sie in einem Überblick über die verschiedenen Verfahren von über 300 18 durchgeführten minimal invasiven endoskopischen Interventionen (Hellwig and Bauer, 1994). Auch endoskopische Zugangswege zu anderen Bereichen des Schädels, wie zum Beispiel zum Clivus, zur Sella, zum Sinus cavernosus oder zu verschiedenen weiteren Strukturen in der vorderen und mittleren Schädelgrube, wurden von verschiedenen Arbeitsgruppen entwickelt und teils in anatomischen, teils in klinischen Studien durchgeführt (Cavallo et al., 2005; Couldwell et al., 1997; Kassam et al., 2008; Kassam et al., 2009; Ong et al., 2008; Rabadan and Conesa, 1992; Alexander et al., 2010; Greenfield et al., 2010; Wang et al., 2010). Der mikroskopisch assistierte transmaxilläre Zugang zur Orbita wurde zwar vor einigen Jahren in einer Kadaverstudie untersucht (Gönül et al., 2003), der transmaxilläre endoskopischen Zugang zur Orbita wurde in der Literatur bisher jedoch nicht beschrieben. Verschiedene Autoren zeigen jedoch durch ihre Artikel, dass die Verwendung eines Endoskopes in der Orbitachirurgie möglich ist und verschiedene Vorteile hat. Pillai untersuchte einen endoskopischen transkonjunktivalen Zugang zum medialen Intrakonalraum und zum N. opticus in einer Kadaverstudie (Pillai et al., 2008). Ein kombinierter transmaxillärer-transnasaler endoskopischer Zugang wurde für die erfolgreiche Entfernung eines Lymphoms und eines Pseudotumors am orbitalen Apex bzw. der inferioren Orbitalfissur in zwei klinischen Fällen verwendet (Har-El, 2005). Die endoskopische orbitale Dekompression bei endokriner Orbitopathie über einen transnasalen Zugang ist von mehreren Arbeitsgruppen durchgeführt worden und in der Literatur beschrieben (Kennedy et al, 1990; Metson et al, 1994; Pletcher et al. 2006). Auch die Dekompression des Nervus opticus ist über einen endoskopischen transnasalen Zugang möglich (Luxenberger et al., 1998). Horiguchi et al. führten einen endonasalen transsphenoidalen Zugang zur Optikusdekompression nach Trauma in drei klinischen Fällen durch (Horiguchi et al., 2010). Saetti und Miman beschreiben die transnasale endoskopische Entfernung von Ethmoidosteomen mit Ausbreitung in die Orbita (Saetti et al., 2005; Miman et al., 19 2009); auch die Biopsie von verschiedenen anderen Orbitatumoren wurde unter Verwendung dieses Zugangsweges beschrieben (Sieskiewicz et al., 2008). Karaki et al. entfernten ein Hämangiom im Bereich des orbitalen Apex über einen endonasalen, transethmoidalen Zugang (Karaki et al., 2006). Läsionen des Orbitadaches können über einen Hautschnitt in der oberen Lidfalte endoskopisch assistiert versorgt werden (Prabhakaran et al., 2007). Auch Frakturen der medialen Orbitawand können erfolgreich endoskopisch über einen transkarunkulären Zugang oder einen intranasalen Zugang repariert werden (Rhee and Chen, 2006). Die Versorgung orbitaler Läsionen im Kindesalter stellt eine besondere Herausforderung dar, da das Schädelskelett beim Kind noch nicht ausgereift und die Nebenhöhlen noch nicht vollständig pneumatisiert sind. Burson et al. beschreiben die Drainage von Orbitaabszessen und periorbitalen Tumoren über einen endoskopischen transnasalen Zugang bei 11 Kindern. Alle beschriebenen Eingriffe waren erfolgreich, jedoch waren diese auf den periorbitalen Bereich beschränkt, das orbitale Fett blieb unberührt (Burson et al., 1995). Verschiedene Arbeiten zeigen, dass auch die Deckung von Orbitabodendefekten unter endoskopischer Sicht erfolgen kann (Persons and Wong, 2002; Chen and Chen, 2001; Jeon et al., 2007; Wallace et al., 2006; Farwell and Strong, 2006). 1.6. Blow-out-Frakturen des Orbitabodens Unter dem Begriff Blowout-Fraktur versteht man eine isolierte Fraktur des Orbitabodens, welche durch eine stumpfe Gewalteinwirkung auf den Bulbus entsteht. Der in dieser Arbeit beschriebene Zugang kann bei insuffizienter postoperativer plastischer Deckung wie eine Orbitabodenfraktur imponieren, weshalb ein kurzer Überblick hier deren wichtigste Merkmale aufzeigen soll: Symptome einer Orbitabodenfraktur können Diplopie und Augenmotilitätsstörungen sein, von außen ist häufig ein Monokelhämatom, bei Herniation von Orbitainhalt in die Kieferhöhle auch ein Enophthalmus sichtbar. Die Sensibilität im Versorgungsgebiet des N. infraorbitalis kann gestört sein. 20 Die häufigsten Frakturen der knöchernen Orbita sind Orbitabodenfrakturen im Bereich medial des Canalis infraorbitalis. Diese treten häufig in Kombination mit Frakturen der medialen Orbitawand auf, da hier nur eine dünne Knochenschicht Orbita und Ethmoidalzellen trennt (Manolidis et al., 2002; Nolasco and Mathog, 1995). In einer okzipitomentalen Schädelaufnahme und im CT kann sich das typische Bild des „hängenden Tropfens“, welches durch ein Absinken von Orbitainhalt in den Sinus maxillaris entsteht, zeigen (Henne-Bruns et al, 2003). Anhand einer konventionellen Röntgenaufnahme ist nicht immer eine genaue Diagnose möglich, in vielen Kliniken ist die CCT daher das Mittel der Wahl zur Diagnostik bei Orbitatraumen (Grove et al., 1978; Ploder et al., 2002). Größe und Form der Fraktur und das Volumen des gegebenenfalls hernierten Orbiatinhalts können mit verschiedener Software anhand von 2D- oder 3D- Computertomographien genau berechnet werden (Ploder et al., 2002). Eine Studie von Sandler et al. vergleicht die Ergebnisse von CT Scans mit den Ergebnissen einer diagnostischen Bedside-Kieferhöhlenendoskopie zur Diagnostik von Orbitabodenfrakturen und zeigt, dass beide Untersuchungen gleiche Ergebnisse bringen und zur Indikationsstellung zur Operation genutzt werden können. Sollte also eine CT Untersuchung nicht möglich sein, bietet die Endoskopie über einen eingebrachten Trokar eine Alternative (Sandler et al., 1999). Als Orientierungspunkt zur Beschreibung der Lokalisation von Orbitabodenfrakturen kann das Ostium maxillare dienen, das durchschnittlich 12 mm von der medialen anterioren Kieferhöhlenwand entfernt liegt und mit dem Endoskop deutlich erkennbar ist (Moore et al., 2008). Anhand des N.infraorbitalis kann der Orbitaboden außerdem in drei Zonen unterteilt werden: Zone 1 umfasst den am weitesten anterior gelegenen Aspekt des Orbitadaches, wo der Nerv in den dicken kortikalen Knochen des Orbitarandes läuft, Zone 2 umfasst den Bereich posterior davon bis zum Eintritt des N. infraorbitalis in die Kieferhöhle über die Fissura orbitalis inferior und Zone 3 erstreckt sich posterior von Zone 2 bis zum superioren posterioren Ende des Sinus maxillaris (Saunders et al., 1997). Neben Nerv und Ostium finden sich außerdem verschiedene Septen und Knochenverdickungen, die interindividuell jedoch deutliche Unterschiede aufweisen können. 21 1.7. Der Caldwell-Luc Zugang zur Kieferhöhle Der Caldwell-Luc Zugang ist nach George-Walter Calwell und Henri Luc benannt, die unabhängig voneinander 1893 und 1895 eine Methode zur Behandlung von chronischen Sinusitiden entwickelten. Die klassische Caldwell-Luc-Operation besteht aus einem Zugang zum Sinus maxillaris durch die Fossa canina, der Ausräumung der Sinusschleimhaut und einer Drainage zur Nase. Auch vor Caldwell und Luc wurden Versuche zu Behandlung chronischer Sinustiden durch frontale Kieferhöhleneröffnungen unternommen, 1889 durch Heath (London) und 1892 durch Robertson (Newcastle-on-Tyne); da diese aber auf die Drainage zur Nase verzichteten, waren die Ergebnisse wenig erfolgreich (Macbeth, 1971). Heute wird auch die Eröffnung des Sinus maxillaris durch die Fossa canina ohne radikale Ausräumung und Drainage als Caldwell-Luc-Antrostomie bezeichnet. Dieser gegenüberzustellen ist eine Methode, die 1974 von Lindorf entwickelt wurde; hierbei wird die faziale Kieferhöhlenwand durch die Replantation eines freien Knochendeckels wiederhergestellt, während beim Caldwell-Luc-Zugang nur der Weichteilmantel über dem entstandenen Defekt wieder verschlossen wird (Portugall et al., 1989). 22 2. Methodik 2.1. Material und Geräte Der transmaxilläre endoskopische Zugang wurde an neun formalinfixierten PräparatenKöpfe von Körperspendern- beidseitig durchgeführt- insgesamt also achtzehn mal. Zur besseren Differenzierung der Strukturen wurde durch das anatomische Institut bei sechs Köpfen rot und blau gefärbtes Latex in die Arterien und Venen injiziert. Vor Beginn der Präparation wurde ein Ethikantrag an die Ethik-Kommission der Medizinischen Fakultät der Ruhr Universität Bochum gestellt und bewilligt. Die Präparation erfolgte mithilfe von in der Klinik vorhandenen Operationsbestecken und starren Hopkins II- Neuroendoskopen (Karl Storz GmbH & Co. KG, Tuttlingen) mit 0° und 30° Winkeloptik. Über einen am Endoskop aufgesetzten Spül-Saugschaft wurden eine Absaugpumpe und ein Infusionssystem angeschlossen, mit dem das Endoskop bei Bedarf per Knopfdruck saubergespült werden konnte. Das verwendete Hopkins II- Neuroendoskop (Karl Storz GmbH & Co. KG, Tuttlingen) ist 18 cm lang und hat mit aufgesetztem Spül-Saugschaft einen Durchmesser von 5,5 mm. Als Lichtquelle wurde vorwiegend eine Wolf 5131AutoLP (Richard Wolf GmbH, Knittlingen), als Kamera eine Wolf 5520 1CCD-Endocam (Richard Wolf GmbH, Knittlingen) verwendet. Für den ersten Zugang wurde auch teilweise eine Wolf 4200LP-Lichtquelle (Richard Wolf GmbH, Knittlingen) genutzt. Kurzzeitig wurde auch mit einer SCB Image 1hub-Kamera und eine SCB-Xenon300 Lichtquelle (Karl Storz GmbH & Co. KG, Tuttlingen) gefilmt. Die in dieser Arbeit gezeigten endoskopischen Bilder entstanden aber alle mit der oben genannten Kamera der Firma Wolf. Auf ein Haltesystem wurde während der gesamten Präparation verzichtet; das Endoskop wurde in einer Hand gehalten, während mit der anderen präpariert wurde. Die gesamte Präparation wurde mithilfe eines DVD-HR753 DVD-Recorders (Samsung Electronics, Schwalbach) aufgezeichnet. 23 Nach einer Auswertung der Filme wurden am Computer einzelne Bilder digital mithilfe der Hypersnap-Software (Hyperionics Technology, Murrysville PA) extrahiert. 2.2. Durchführung des Zugangs Zur Durchführung des Zugangs wurde der Kopf stabil auf den Hinterkopf positioniert, die Präparation erfolgte von kaudal, um die Verhältnisse im Operationssaal möglichst realistisch nachzubilden. Für den Zugang wurde zunächst die Oberlippe mithilfe eines Wundspreizers nach kranial aufgespannt, so dass der gingivobuccale Sulcus sichtbar wurde. Dann wurde die Kieferhöhle sublabial durch einen Cadwell-Luc-Zugang eröffnet. Hierfür wurde zunächst die Mukosa mit einem Skalpell im gingivobuccalen Sulcus inzidiert, danach wurde über diesen Schnitt das Gewebe über der Fossa canina stumpf mit einem Dissektor abgeschoben. Die Präparation der Wangenweichteile vom Maxillaknochen erfolgte unter Sicht durch das Hypophysenendoskop mit 0°-Optik, um eine Beschädigung des N. infraorbitalis an seinem Austrittspunkt aus dem Foramen infraorbitale zu vermeiden. Die Präparationsschritte am Sinus wurden beim ersten Präparat von PD Dr. Maurer, dem leitenden Oberarzt aus der Mund-, Kiefer- und Gesichtschirurgie des Knappschaftskrankenhauses Bochum, begleitet. Die nach Abschieben der Wangenweichteile blank liegende faziale Kieferhöhlenwand wurde mit einer Stichinzision vorsichtig im Bereich der Fossa canina durchstoßen, und ein Loch- groß genug um Endoskop und ein Operationsbesteck zu fassen- wurde ausgestanzt. Nach der Eröffnung wurde die Kieferhöhle endoskopisch inspiziert. Der N. infraorbitalis wurde oft bereits durch die Mukosa dezent sichtbar, bei den gefäßinjizierten Präparaten auch die A. infraorbitalis, die parallel zum Nerv verläuft. Auch das Ostium maxillare, durch das die Kieferhöhle drainiert wird, wurde identifiziert. Auffälligkeiten im Schleimhautrelief wie Polypen oder Verdickungen wurden entfernt, um bessere Orientierung für die richtige Zugangsroute zu bekommen. Zwischen dem Nervus infraorbitalis und dem Ostium maxillare wurde die Mukosa mithilfe des Dissektors, eines Skalpells und der Mikrostanze abgetragen, so dass der Orbitaboden frei lag. Dieser wurde dann durch einen vorsichtigen Stich mit dem Dissektor durchbrochen, um einen Angriffspunkt für eine feine Stanze zu schaffen. 24 Danach wurde der Orbitaboden mit der Mikrostanze zwischen dem N. infraorbitalis und dem Hiatus semilunaris entfernt, wobei ein Knochensteg zwischen dem Ostium und der Öffnung im Orbitaboden erhalten wurde. Der N. infraorbitalis wurde bei einigen Zugängen freigelegt, bei anderen in der knochigen Umhüllung belassen. Abbildung 1: Route des Endoskops durch die Kieferhöhle. Die Millimeterfolie zeigt Ein- und Austritt sowie die durchschnittlich benötigte Öffnungsgröße. Die Periorbita wurde mit einem kleinen Schnitt eröffnet und mit der Mikrostanze entfernt, so dass das periorbitale Fett sichtbar wurde. Der M. rectus inferior wurde freipräpariert und mobilisiert, um einen medialen und einen lateralen Weg in die Orbita für Operationsbesteck und Endoskop zu ermöglichen. Auf einen zentralen Zugangsweg, wie für den transmaxillären mikrochirurgischen Zugangsweg beschrieben (Gönül et al., 2003), wurde verzichtet, da dieser eine komplette Durchtrennung des M. rectus inferior erfordert. 25 Das orbitale Fett wurde über die zwei verschiedenen Zugangswege lateral und medial des M. rectus inferior entfernt; möglichst viele retrobulbäre Strukturen wurden dargestellt. Die erreichten Strukturen wurden für die einzelnen Präparate dokumentiert. Abschließend wurden verschiedene Strukturen sowie die Maße des Caldwell-LucZuganges und der Öffnung im Orbitaboden mit 1mm-Folie in situ vermessen. 26 3. Ergebnisse 3.1. Zugang zur Kieferhöhle Der Zugang zur Kieferhöhle durch die faziale Wand gelang bei allen neun Köpfen beidseitig problemlos. Das Hypophysenendoskop in 0°-Optik war hierbei hilfreich zur Identifikation des N. infraorbitalis an seinem Austrittspunkt am Foramen infraorbitale. Durch die Formalinfixierung war das Gewebe deutlich fester als vitales Gewebe, so dass das Aufspannen der Oberlippe nach kranial mühsam war. Der Knochen im Bereich der Fossa canina war hier bei allen vorhandenen Präparaten so dünn, dass er durch eine vorsichtige Stichinzision durchbrochen werden konnte, um einen Ansatzpunkt für die feinen Knochenstanzen zu schaffen. Die Knochendicke ist interindividuell jedoch variabel, die Verwendung einer Fräse könnte daher in einigen Fällen sinnvoll sein. Beim ersten Zugangsversuch wurden ein großer Bereich der fazialen Kieferhöhlenwand und ein Randstück des Foramen infraorbitale entfernt. Die Aufzweigung des N. infraorbitalis nach dem Austritt aus dem Foramen wurde so deutlich sichtbar. Abbildung 2: Aufzweigung des N. infraorbitalis nach Austritt aus dem Foramen infraorbitale. Der kaudale Rand des Foramen wurde entfernt. . 27 Bei allen folgenden Zugängen wurde allerdings, um den Zugangsweg und entstehenden Schaden möglichst klein zu halten, weniger Knochen entfernt, und das Foramen infraorbitale blieb erhalten. Der Zugang wurde dann gerade so groß gewählt, dass Endoskop und ein Operationsbesteck hindurchgingen ohne sich durch Reibung zu behindern. Um nicht zuviel Knochen zu entfernen, wurde das Loch nach und nach mithilfe einer feinen Knochenstanze erweitert. Abbildung 3: Zugang zur Kieferhöhle über die Fossa canina. Die Schleimhaut des Vestibulum oris wurde durchtrennt und das Gewebe über dem Knochen abgeschoben. Der Knochen wurde durchbrochen und eine Öffnung ausgestanzt. Die Öffnungsgröße der Zugänge, die für die Präparation der inferioren Orbita an den Präparaten im Bereich der Fossa canina nötig waren, finden sich in Tabelle 2. Beim ersten Zugang wurde die faziale Kieferhöhlenwand sehr großzügig entfernt, bei Zugang Nr. 13 war die Kieferhöhle teilweise vorpräpariert, daher findet sich bei diesen Zugängen eine außergewöhnlich große Öffnungsfläche. 28 Tabelle.2: Größe der Fensterungen in der Fossa canina Zugang Nr. Breite (mm) Höhe (mm) Fläche (cm²) 1 25 13 3,25 2 17 10 1,7 3 12 9 1,08 4 13 10 1,3 5 13 11 1,43 6 14 9 1,26 7 15 8 1,2 8 12 9 1,08 9 14 9 1,26 10 11 9 0,99 11 16 10 1,6 12 12 10 1,2 13 25 12 3 14 13 8 1,04 15 13 10 1,3 16 11 11 1,21 17 12 10 1,2 18 13 8 1,04 Durchschnitt 14,5 9,8 1,45 3.2. Inspektion der Kieferhöhle Nach der Eröffnung wurde die Kieferhöhle zunächst inspiziert. Die verschiedenen Kieferhöhlen stellten sich interindividuell sehr unterschiedlich dar, das Schleimhautrelief war bei einigen Präparaten sehr glatt, bei anderen durch Cristae und Septen aufgeworfen. In einer Kieferhöhle fanden sich polypöse Veränderungen, an einem Kopf beidseits grauschwarze, den gesamten Sinus auskleidende Schleimhautveränderungen unklarer Genese, vermutlich Pilz- oder Teerauflagerungen. 29 Der N. infraorbitalis war bei 16 von 18 Präparaten in Richtung Foramen infraorbitale unter der Mukosa zumindest leicht abgehoben sichtbar, so dass der Verlauf im Sinus zu ahnen war, bei einigen Präparaten hob er sich auf gesamter Länge des Sinus deutlich ab. Bei den gefäßinjizierten Präparaten schien teilweise auch die A. infraorbitalis durch die Mukosa. Das Ostium maxillare war als Orientierungspunkt bei allen Präparaten sichtbar. Abbildung 4: Interindividuelle Unterschiede vier verschiedener linksseitiger Kieferhöhlendächer. Der Knochenkanal des N. infraorbitalis ist in den Bildern links kaum, rechts deutlich unter der Mukosa abgezeichnet. 30 Abbildung 5: Blick auf das Kieferhöhlendach vor Präparation 3.3. Eröffnung des Orbitabodens Nach Inspektion wurde die Mukosa lateral des Ostium maxillare bis lateral des N. infraorbitalis entfernt. Dazu wurde sie zunächst mit einem feinen Skalpell inzidiert, mit einem Dissektor abgeschoben und mit Mikrostanze und-schere entfernt. Der Knochen des Orbitabodens wurde so sichtbar, der N. infraorbitalis stellte sich noch deutlicher dar. Die Eröffnung des Orbitabodens erfolgte bei zehn Zugängen medial und lateral des N. infraorbitalis, wobei der N. infraorbitalis aus seiner knochigen Umhüllung befreit wurde. Dies hat den Vorteil, dass der N. infraorbitalis etwas verschoben werden kann und dass lateral und medial des Nerven ein Zugangsweg entsteht, andererseits birgt dieses Vorgehen das Risiko einer Verletzung des N infraorbitalis und der begleitenden Gefäße bei der Präparation. 31 Abbildung 6: Der N. infraorbitalis wurde komplett aus seiner Knochenhülle gelöst, der Orbitaboden medial und lateral davon entfernt. Bei acht Präparaten wurde der Nerv lateral teilweise in seiner Umhüllung belassen und nicht mobilisiert. Die Präparation erfolgte hier nur medial des N. infraorbitalis. Durch beide Verfahren war ein Erreichen des retrobulbären Raumes möglich. Abbildung 7: Der N. infraorbitalis wurde nicht mobilisiert, der Orbitaboden, die Periorbita und orbitales Fett wurden nur medial davon entfernt. 32 Welches Vorgehen der richtige Weg ist, hängt von der Anatomie des Individuums ab bzw. davon, wieviel Platz sich zwischen Hiatus maxillaris und N. infraorbitalis bietet. Liegt der Nerv sehr nah am Ostium, ist eine Mobilisation eher sinnvoll, um den Zugangsweg auf ein nötiges Maß zu vergrößern. Bei breitem Knochensteg zwischen Nerv und Hiatus und damit breiter medialer Zugangsmöglichkeit bringt eine Öffnung lateral des N. infraorbitalis keine nennenswerten Vorteile, da alle Bereiche der inferioren Orbita über den medialen Weg erreicht werden können. Der Orbitaboden war bei allen vorhandenen Präparaten so dünn, dass durch ein vorsichtiges Eindrücken mit dem Dissektor ein Ansatzpunkt für die Knochenstanze geschaffen werden konnte. Bei der Präparation habe ich mich am N. infraorbitalis orientiert und zunächst den Knochen medial davon entfernt. Die Entfernung des Knochens sollte zunächst eher sparsam erfolgen, eine spätere Erweiterung ist möglich, und eine sparsame Resektion bietet bessere Voraussetzungen für eine plastische Deckung am Ende der Operation. Abbildung 8: Gegenüberstellung der Möglichkeiten zur Eröffnung des Kieferhöhlendaches: links ohne, rechts mit Freilegung des N. infraorbitalis 33 Abbildung 9: Mit einer feinen Knochenstanze wird der Orbitaboden medial des N. infraorbitalis entfernt Da das Ziel des Zugangs der retrobulbäre Raum ist, erfolgte der Zugang durch den mittleren bis okzipitalen Teil des Kieferhöhlendaches. Erfolgt der Zugang zu nah an der Vorderwand der Kieferhöhle, kann der retrobulbäre Raum nicht erreicht werden, da die Richtung des Zugangs eher zum Bulbus läuft. Eine Erweiterung des Zuganges nach okzipital wird dann erforderlich. Bei der Entfernung des medialen Orbitabodens besteht die Gefahr der Eröffnung der Cellulae ethmoidales, welche sich dem dünnen Orbitaboden nach medial anschließen. Dies passierte bei den beschriebenen Zugängen viermal. Vermutlich ließe sich das Risiko dieser Komplikation durch eine präoperative Bildgebung oder durch intraoperative Navigation minimieren. Die zur Präparation des Situs benötigten Größen der Fensterung im Orbitaboden zeigt Tabelle 3. 34 Tabelle.3: Größe der Fensterungen im Orbitaboden Zugang Nr. Breite (mm) Höhe (mm) Fläche (cm²) 1 15 20 3 2 9 20 1,8 3 13 17 2,21 4 10 20 2 5 8 15 1,2 6 13 14 1,82 7 10 18 1,8 8 10 20 2 9 12 14 1,68 10 11 16 1,76 11 12 17 2,04 12 10 20 2 13 10 14 1,4 14 10 12 1,2 15 10 17 1,7 16 11 20 2,2 17 10 17 1,7 18 10 17 1,7 Durchschnitt 10,7 17,1 1,845 Nach der Entfernung des Orbitabodens wird die Periorbita als weiße, bindegewebige Hülle der Orbita sichtbar. Diese wird mit einer Schere oder einem feinen Sichelmesser inzidiert und mit der Knochenstanze entfernt. 35 Abbildung 10: Entfernung der Periorbita Bei der Entfernung der Periorbita waren meist schon Anteile des direkt dahinter liegenden M. rectus inferior zu sehen, oft durch eine dünne Fettschicht bedeckt. Bei einigen Präparaten war diese Schicht dicker und verdeckte den Muskel zunächst, ließ sich aber stets leicht entfernen. Abbildung 11: Nach Entfernung der Periorbita wird der M. rectus inferior, im orbitalen Fett eingelagert, sichtbar. Bei zwei Zugängen erfolgte die Entfernung des Orbitabodens zu weit anterior, dies war nach der Entfernung der Periorbita daran zu erkennen, dass nicht wie erwünscht der rötliche Muskelbauch des M. rectus inferior, sondern dessen weißlicher Muskelansatz am Bulbus sichtbar wurde. In diesen Fällen wurde der Zugang nach okzipital erweitert, bis die rötlichen Muskelanteile des M. rectus inferior sichtbar wurden. Bei allen 36 Präparaten konnte so die richtige Höhe des Muskels für den Weg zum retrobulbären Raum gefunden werden. Abbildung 12: Wird der Orbitaboden zu weit anterior eröffnet, wird der weiße Muskelansatz zum Bulbus sichtbar. 3.4. Präparation des Intrakonalraumes Nach der Entfernung der dünnen Fettschicht über dem M. rectus inferior wurde dieser mit dem Dissektor mobilisiert, der Muskel wurde im Wechsel nach lateral und medial verschoben und zum Vorschein kommendes Fettgewebe entfernt. 37 Abbildung 13: Orbitales Fettgewebe wird entfernt und der M. rectus inferior so mobilisiert. Nach und nach bot sich so immer mehr Platz neben dem Muskel, so dass ein lateraler und ein medialer Weg zum weiteren Intrakonalraum präpariert werden konnte. Zur Präparation der retrobulbären Strukturen wurde das Gewebe vorsichtig mit dem Dissektor aufgelockert und das so mobilisierte, zwischen den Strukturen liegende Fettgewebe mit Hilfe von Ringküretten und verschiedenen Zangen entfernt. Dieses Vorgehen hat sich als sinnvoll erwiesen, da bei der Verwendung von spitzen Geräten wie Scheren eine größere Gefahr der Verletzung beispielsweise von Arterienästen besteht. Bei den gefäßinjizierten Köpfen stellten sich die Arterien deutlich sichtbar dar, die dünnen Ciliarnerven waren jedoch oft im Fettgewebe leicht zu übersehen. 3.5. Medialer Zugangsweg Bei der Mobilisaton des M. rectus inferior nach lateral ist zu beachten, dass auf der medialen Seite feine Arterienäste der A. ophthalmica in den Muskel eintreten, die nicht verletzt werden sollten. 38 Abbildung 14: Feine Äste der A. ophthalmica ziehen von medial in den M. rectus inferior Diese feinen Arterienäste lassen sich mithilfe des Dissektors und einer feinen Zange aus dem Fettgewebe freilegen und zu ihren dickeren Ursprungsarterien weiterverfolgen. Abbildung 15: Freilegen der Muskeläste der A. ophthalmica Das umgebende Fettgewebe konnte apfelsinenfruchtfleischartig herausgelöst werden, so dass eine gute Darstellung des inferioren medialen Anteils der A. ophthalmica möglich war. 39 Meist wurde bei der Präparation der medialen Arterienäste schon ein Teil des M. rectus medialis sichtbar, sonst stets nach der Entfernung weiteren Fettgewebes nach medial. Abbildung 16: A. ophthalmica, Bulbus, M. rectus medialis werden sichtbar Der Eintritt des den Muskel innervierenden Astes des N. oculomotorius konnte an allen Präparaten dargestellt werden. Abbildung 17: Eintritt des N. oculomotorius in den M. rectus medialis 40 Durch Präparation nach anterior konnte der Bulbus bei 14 Zugängen dargestellt werden. Der N. opticus konnte bei allen 18 Zugängen von medial durch weitere Entfernung von Fettgewebe zwischen den Arterienästen freipräpariert werden, durchschnittlich über eine Länge von 13,7 mm. Der Eintritt der A. centralis retinae in den N. opticus war an sieben Nerven klar erkennbar. Abbildung 18: Eintritt der A. centralis retinae in den N. opticus Dass die A. centralis retinae nicht bei allen Präparaten sichtbar war, hatte verschiedene Gründe: bei den nicht-gefäßinjizierten Präparaten waren alle Arterien schwer abzugrenzen von nervalen Strukturen, bei den gefäßinjizierten Präparaten war die Farbe teilweise nicht in die kleinsten Gefäße vorgedrungen. Außerdem war eine Freilegung des Optikus teilweise schwierig, da die Arterien und das Fettgewebe nicht immer gleich gut trennbar waren und daher den Weg verlegten. Bei zwei Präparaten war einfach nicht zweifelsfrei sicher zu sagen, ob es sich um die A. centralis retinae oder um einen anderen Ast der A. ophthalmica handelte. Bei einer Orbita war die Entfernung des Fettgewebes sehr weit nach superior möglich, so dass sogar der N. nasociliaris und seine Aufteilung in N. infratrochlearis und N. 41 ethmoidalis anterior dargestellt werden konnte. Allerdings wurde hierbei ein kleinerer Muskelast der A. ophthalmica zum M. rectus medialis durchtrennt. Abbildung 19: In der Tiefe ist der N. nasociliaris sichtbar Nach vollständiger Darstellung der gut erreichbaren Strukturen war der Raum zwischen N. opticus, M. rectus medialis und M. rectus inferior, also die mediale inferiore Orbita, frei einsehbar und bis auf die Äste der A. ophthalmica praktisch leer. Abbildung 20: Mediale inferiore Orbita nach Präparation 42 3.6. Lateraler Zugangsweg Lateral des M. rectus inferior verläuft der Ast des N. oculomotorius zum M. obliquus inferior. Dieser Nervenast war bei allen 18 Zugängen leicht zu finden, da er mit 1 mm recht dick ist und wenig variabel verläuft. Meist kam er schon zum Vorschein, wenn der M. rectus inferior nach medial geschoben wurde, sonst nach Entfernung von wenig Fettgewebe lateral des Muskels. Abbildung 21: Der N. oculomotorius verläuft lateral des M. rectus inferior zum M. obliquus inferior Nach der Mobilisation des M. rectus inferior nach medial war bei den vorhandenen Präparaten neben dem Nervenast hauptsächlich Fettgewebe zu sehen, vereinzelt kleine Arterienäste. Auch hier wurde das Fettgewebe vorsichtig entfernt, bis Strukturen erkennbar wurden. 43 Abbildung 22: Durch Mobilisation des M. rectus inferior nach medial entsteht ein lateraler Zugangsweg Auch im lateralen inferioren Raum waren Äste der A. ophthalmica deutlich zu erkennen, bei den farbinjizierten Präparaten waren die Arterienäste gut von den Ciliarnerven zu unterscheiden, bei den farblosen Präparaten war dies nur teilweise und anhand des Durchmessers möglich. Die Präparation der Ciliarnerven war anfangs schwierig, da sie aufgrund ihres geringen Durchmessers leicht zerreißen und sie sich farblich kaum vom Fettgewebe unterscheiden- man übersieht sie leicht. Ein zeitaufwändiges vorsichtiges Vortasten mit dem Dissektor war daher nötig, um die Nervenäste zwischen den Fettkompartimenten aufzufinden und zu schonen. Bei späteren Präparaten konnten die Ciliarnerven aufgrund der Übung im Umgang und durch die bessere Kenntnis von Anatomie und Konsistenz der Strukturen größtenteils erhalten werden. 44 . Abbildung 23: Die Ciliarnerven sind im orbitalen Fettgewebe leicht zu übersehen Eine Darstellung des N. opticus von lateral war bei 17 von 18 Präparaten möglich, bei einem Präparat wurde der Nerv von den hier sehr schlecht aus dem Fettgewebe lösbaren Ciliarnerven und -arterien verlegt. Bei einigen Orbitae war der N. opticus von lateral nicht so frei präparierbar wie von medial, da der Nerv hier von Ciliarnerven und -arterien überlagert wurde, so dass nur ein Stück des N. opticus dargestellt werden konnte. Ein Verschieben dieser feinen Strukturen war zwar möglich, so dass der N. opticus erreicht werden konnte, ein Freilegen auf gesamter Länge war ohne eine Beschädigung der Ciliarnerven und arterien jedoch trotzdem nicht immer möglich. Im weiter okzipital liegenden Abschnitt war die Freilegung des N. opticus ohne Verletzung anderer Strukturen nicht mehr möglich, da die Ciliarnerven und –arterien sich hier stärker verzweigen und den Weg verlegen. Durch die konusartig spitz zulaufende Form des Muskeltrichters liegt hier zwischen den Nerven und Gefäßen deutlich weniger Fettgewebe, was die Präparation zusätzlich erschwert. Das Ganglion ciliare konnte ich bei der Präparation nicht klar erkennen. Im lateralen inferioren Quadranten der Orbita verläuft die V. ophthalmica inferior, welche das Blut aus dem unteren und lateralen Teil der Orbita , dem M. rectus inferior, dem M. obliquus inferior, dem Tränensack und den Augenlidern zum Sinus cavernosus 45 führt. Die V. ophthalmica inferior konnte bei 7 Zugängen an den gefärbten Präparaten dargestellt werden, bei den ungefärbten Präparaten nicht. Abbildung 24: V.ophthalmica inferior und Ciliarnerven im inferioren lateralen Raum Der M. rectus lateralis war bei allen Präparaten sichtbar, der N. abducens konnte jedoch nicht klar gesehen werden. Anatomische Abbildungen zeigen, dass der N. abducens superior des N. opticus in den M. rectus lateralis eintritt, der Nervenast des N. oculomotorius zum M. rectus medialis aber inferior des N. opticus (Rhoton and Natori, 1996). Damit ist zu erklären, weshalb bei dem transmaxillären Zugang , der hauptsächlich die inferiore Orbita darstellt, der Eintritt des Nerven in den M. rectus medialis gut, in den M. rectus lateralis aber nicht darzustellen ist. Nach Präparation der Strukturen waren diese verschieblich und der Bereich zwischen N. opticus, M. rectus lateralis und M. rectus inferior, also die laterale inferiore Orbita, frei und gut zugänglich. Die im Situs verbleibenden anatomischen Strukturen, also die Äste der A. ophthalmica, die Ciliarnerven und -arterien und ggf. die Venen waren meist voneinander lösbar, so dass bei 17 von 18 Präparationen eine gute Verschieblichkeit zum Ende der Präparation vorlag. 46 Abbildung 25: Vollständig präparierter lateraler Situs 3.7. Fazit Der transmaxilläre endoskopische Zugang ermöglicht eine Darstellung der inferioren intrakonalen Strukturen ohne eine Verletzung des infraorbitalen Nerves und der begleitenden Gefäße und ohne eine Durchtrennung des M. rectus inferior. Der Zugang zur Orbita durch die Kieferhöhle gelang in allen 18 Fällen. Sowohl beim lateralen als auch beim medialen Zugangsweg wurden immer wieder kleinste Arterienäste, die teilweise blind als Endäste im Fettgewebe endeten und teilweise als kleinste Abzweigungen zu verschiedenen Muskeln zogen, verletzt. Eine Verletzung dieser winzigen Gefäße lässt sich vermutlich auch mit mehr operativer Erfahrung nicht ganz verhindern. Die Blutungsgefahr ist daher ein wichtiger, zu beachtender Faktor. Auch bei Blutungen aus kleineren Gefäßästen besteht die Gefahr, dass die Übersicht rasch eingeschränkt wird und die Blutstillung nicht ganz zielgerichtet ablaufen kann. Dies birgt die Gefahr der Verletzung wichtiger Strukturen, wie größerer Gefäße und Nerven. Der Situs kann nicht wie an anderen Körperregionen freigesaugt oder abgetupft werden, um eine gute Sicht zur Blutstillung zu erhalten, da dies wieder kleinere Strukturen gefährden würde. Eine Spülung und ein sehr schwacher Sauger wären bei einer Operation in vivo sicher nötig. 47 Ein Spülsystem wird auch für die Reinigung des Endoskopes zwischen den verschiedenen Arbeitsschritten benötigt. Besonders durch das zerkleinerte Fettgewebe wurde die Sicht schnell verschwommen, und die Zwischenreinigung der Optik ohne Spülaufsatz bei den ersten Präparationen war zu zeitaufwändig. Das Endoskop mit 30°-Winkeloptik war für den Zugang durch den Orbitaboden und die Präparation der inferioren Orbita gut geeignet, während das Endoskop mit 0°Winkeloptik nur teilweise zur Präparation des Wangenweichteilgewebes von der Fossa canina und zur Identifikation des N. infraorbitalis am Austrittspunkt aus dem Foramen infraorbitale verwendet wurde. Zur intraorbitalen Präparation wurde die 0°-Optik nicht verwendet da die Blickrichtung zu weit nach posterior zeigte (siehe Abbildung…). Abbildung 26: Die Blickrichtung des Endoskops in 0°-Optik reicht zu weit nach posterior, während die der 30° abgewinkelten Optik den retrobulbären Raum erreicht. Der N. opticus ließ sich grundsätzlich über den medialen Zugangsweg einfacher darstellen als über den lateralen, da hier die fragilen Cilirnerven die Präparation erschweren. Die Darstellung des N. opticus war über durchschnittlich 13,7 mm möglich. 48 Bei der Präparation zeigte sich eine Zunahme der Geschicklichkeit im Umgang mit dem Endoskop und den Geräten. Die Koordination von Endoskop und Operationsbesteck verbesserte sich deutlich, und durch die zunehmende Kenntnis der Konsistenz des intraorbitalen Gewebes und der Lage der einzelnen Strukturen zueinander konnte bei den letzten Zugängen ein besseres Präparationsergebnis als anfangs erreicht werden. 49 4. Diskussion 4.1. Durchführbarkeit des Zugangs- zu erwartende Komplikationen Die beschriebene Studie zeigt, dass der endoskopische transmaxilläre Zugang zur Orbita am anatomischen Präparat durchführbar ist. Das mit Spül-Saugschaft im Durchmesser 5,5 mm breite und 18 cm lange Hypophysenendoskop hat sich hierbei als sinnvolles Instrumentarium herausgestellt, ähnliche Endoskope sind heute in den meisten neurochirurgischen Kliniken vorhanden. Da es sich bei den durchgeführten Experimenten um eine Kadaverstudie handelt, ist jedoch zu beachten, dass sich das Gewebe unter Formalinfixation verändert. Das fixierte Gewebe ist zäher und fester, aber auch brüchiger als vitales Gewebe Der Turgor des Augapfels war am formalinfixierten Präparat deutlich vermindert, an einigen Präparaten waren Eindellungen des Bulbus, beispielsweise am Eintritt des N. opticus zu erkennen. Für die Durchführung des Zugangs am Lebenden lässt dies vermuten, dass etwas weniger Platz zur Präparation hinter dem prallen Bulbus zur Verfügung stände als unter Formalinfixation. Durch einen prallen Bulbus werden außerdem die Augenmuskeln stärker gespannt. Vermutlich ist auch die Spannung der Augenmuskulatur selbst beim Lebenden höher; es ist fraglich, ob sich der M. rectus inferior am Lebenden, wenn auch unter Muskelrelaxation, ebenso verschieben lässt wie an den vorliegenden Präparaten. Ein weniger elastischer M. rectus inferior würde durch die geringere Verschieblichkeit einen anderen Arbeits- und Sichtwinkel verursachen. Möglicherweise wäre ein stärker abgewinkeltes Endoskop am Lebenden von Nutzen, um den nötigen Sichtwinkel zu erreichen. Inwieweit ein geänderter Arbeitswinkel die Präparation behindern würde, ist anhand einer Kadaverstudie an formalinfixierten Köpfen schwierig abzuschätzen. Eine Kadaverstudie an frischen menschlichen Köpfen wäre daher der nächste logische Schritt zur weiteren Erforschung des Zugangsweges. Die Blutungsgefahr lässt sich anhand des formalinfixierten Präparates ebenfalls schlecht abschätzen. Anhand der gefärbten Köpfe zeigte sich, dass bei der Präparation keine größeren Äste der A. ophthalmica verletzt wurden, es lässt sich jedoch schwer sagen, wie fragil die Gefäße am Lebenden sind. Durch die Einspritzung von Farbe gewinnen die Arterien und Venen eine zusätzliche Stabilität, dennoch wurden bei der Präparation 50 öfter kleinste Gefäße durchtrennt. Vor allem Arterienäste, die in die Augenmuskulatur ziehen, waren durch ihre Lage im Präparationsweg gefährdet; die Durchtrennung von kleinsten arteriellen Endästen, die im Fettgewebe endeten, war nicht zu vermeiden. Blutungen in der Kieferhöhle lassen sich über einen Caldwell-Luc-Zugang noch gut mittels Elektrokoagulation beherrschen, in der Orbita liegen die Strukturen jedoch so nah beieinander, dass auch immer eine Gefahr der Verletzung von anderen Strukturen besteht. Dies könnte erhebliche Folgen für den Patienten haben; würde beispielsweise der den M. rectus medialis versorgende Oculomotoriusast, der in direkter Nachbarschaft zu dickere Ästen der A. ophthamica liegt, versehentlich koaguliert, würde hieraus ein Auswärtsschielen mit Diplopie entstehen. Bei einer stärkeren Blutung und daraus folgender schlechter Sicht sind auch noch schwerere Komplikationen denkbar, beispielsweise eine Verletzung oder eine versehentliche Koagulation der den N. opticus hauptsächlich versorgenden A. centralis retinae oder gar des N. opticus selbst. Ein wirksames und zielgenaues System zur Blutungsstillung wäre also bei einer Operation am Lebenden unbedingt notwendig. Die Kombination eines Navigationssystems mit präoperativ gewonnenen CT- und MRBildern mit einem bildgesteuerten Kontrollsystem, das sich an den endoskopisch gewonnenen Bildern orientiert, kann helfen, auch bei Orientierungsverlust bei stärkerer Blutung oder bei Zwischenfällen wie dem Ausfall der Lichtquelle oder Kamera den Überblick zu behalten (Scholz et al., 1999). Zur digitalen Bildverarbeitung ist hier eine spezielle Software nötig (Scholz et al., 1999), es ist zu erwarten, dass in den nächsten Jahren die Entwicklungen in diesem Bereich zunehmen werden und sich so auch ein System bieten wird, das für die Orbitachirurgie kompatibel wäre. Neue feine Instrumente, die speziell für die Blutstillung in der Endoskopie entwickelt wurden, z.B. feinste bipolare Zangen, bieten außerdem die Möglichkeit, immer zielgenauer zu koagulieren. Die Ciliarnerven sind aufgrund ihrer im Fettgewebe unauffälligen Farbe und ihrer fragilen Struktur ebenfalls gefährdet. Sie lassen sich bei der Präparation nur durch vorsichtiges Vortasten und durch ihren Verlauf finden, oft verlaufen sie mit den Ciliararterien, so dass sich durch die aufgrund der Blutfüllung besseren Sichtbarkeit dieser eine Orientierungshilfe bietet. Eine versehentliche Durchtrennung eines oder mehrerer Ciliarneven passierte bei fast allen Präparaten; dies wäre bei einem geübten 51 Operateur wohl seltener, aber vermutlich auch nicht komplett zu vermeiden. Auch die Ciliararterien sind aufgrund ihres feinen Durchmessers gefährdet. Der durchschnittliche Durchmesser der medialen, superioren und lateralen posterioren Ciliararterien beträgt nur 0,65, 0,48 und 0,68 mm (Erdogmus and Govsa, 2008). Aufgrund dieser geringen Größe sind Ursprung und Verlauf der Ciliararterien präoperativ nicht darzustellen, so dass das Blutungsrisiko nicht durch Bildgebung minimiert werden kann. Die posterioren Ciliararterien verlaufen in zwei Mustern: meistens gibt es einen medialen und lateralen Abzweig, im zweiten Muster werden diese durch einen superioren Abzweig ergänzt (Erdogmus and Govan, 2008); hieraus ergibt sich zwar, dass die Ciliararterien bei Arbeiten in der inferioren Orbita wenig gefährdet sind, beim Vorarbeiten in weiter superiore Orbitaanteile sind sie jedoch mit großer Vorsicht zu behandeln. Die posterioren Ciliararterien enspringen der A. ophthalmica, eine Blutung könnte daher schwer zu stillen sein. Bei vier Zugängen wurden die sich dem Sinus maxillaris medial anschließenden Ethmoidalzellen versehentlich eröffnet. Eine Deckung des Defektes im Orbitaboden, die ohnehin zum Abschluß einer Operation erfolgen müsste, könnte im klinischen Fall dann etwas nach medial erweitert werden, um eine Verbindung zwischen Ethmoidalzellen und Orbita zu beseitigen. Das Risiko für eine Eröffnung der Ethmoidalzellen ließe sich vermutlich durch ein präoperatives CT und ein Navigationssystem minimieren. Eine genaue präoperative Diagnostik mittels CT und MRT und die Verwendung des Navigationssystems können auch dazu beitragen, den Defekt im Orbitaboden durch eine genaue Planung des Eingriffs und die Wahl des Zugangs über einen speziellen Bereich im Orbitaboden möglichst klein zu halten. Karaki et al. definieren in ihrer Arbeit über computertomographische Studien der Orbitaanatomie die Knochenplatte zwischen Sinus maxillaris und Sinus ethmoidalis als Landmarke für einen Zugang zum Raum zwischen M. rectus medialis und M. rectus inferior (Karaki et al., 2008). Die Definition solcher Landmarken anhand von bildgebenden Verfahren und die Orientierung an diesen mittels Navigationssystem bieten dem Operateur mehr Zielgenauigkeit als die wenigen makroskopischen Landmarken. Bei dem transmaxillären Zugang waren makroskopisch nur das Ostium maxillare und der N. infraorbitalis regelmäßig aufzufinden, so dass der Zugang bei den dargestellten Studien teilweise zu weit anterior gewählt wurde. CT- gesteuerte Navigation könnte hier eine deutliche Verbesserung erzielen. 52 Ein Problem bei neuroendoskopischen Zugängen ist auch die Hitzeeinwirkung der Lichtquelle auf die empfindlichen und feinen Strukturen. Durch die Verwendung von modernen Xenon Lichtquellen sowie Spülsystemen und der Vermeidung des direkten Kontaktes zwischen Endoskop und Gewebe kann das Risiko einer Hitzeschädigung minimiert werden. Bei allen Komplikationen ist zu bemerken, dass die Orbitachirurgie aufgrund der komplexen und feinen Anatomie insgesamt eine eher schwierige Disziplin ist und auch bei den anderen Zugangswegen gewisse Strukturen, wie die Ciliarnerven und kleine, variabel verlaufende Arterien, gefährdet sind. Die aufgetretenen Komplikationen sind also weniger spezifisch für den transmaxillären endoskopischen Zugang als vielmehr Eingriffe in die inferiore Orbita insgesamt. Weitere postoperative Komplikationen können durch den Defekt in der fazialen Kieferhöhlenwand und die Ausräumung der Kieferhöhlenschleimhaut entstehen. Ein nach der klassischen Caldwell-Luc-Operation beobachteter Symptomkomplex ist das „Syndrom der radikal operierten Kieferhöhle“, das sich aus neurologischen Störungen im Versorgungsgebiet des N. maxillaris, postoperativer Sinusitis oder Rhinitis und Schmerzzuständen zusammensetzt (Petzel et al., 1980). Petzel beschreibt, dass nur 33% der untersuchten Patienten nach Radikaloperation der Kieferhöhle völlig beschwerdefrei waren. Bei erfolgreicher Rekonstruktion des Orbitabodens und korrekter Reposition des Bulbus in seine ursprüngliche Lage ist ein kosmetisch erfreuliches Ergebnis zu erwarten. Durch den sublabialen Zugangsweg sind von außen keine Narben zu sehen. 4.2. Möglichkeiten der plastischen Deckung Durch den transmaxillären Zugang zur Orbita entstehen mehrere Defekte, die zum Abschluß der Operation gedeckt werden müssten. Die plastische Deckung wurde bei den vorliegenden Präparaten nicht durchgeführt, es finden sich jedoch einige interessante Literaturstellen zu diesem Thema. Die entstehenden Defekte sind das Loch in der Fossa canina, das Loch im Orbitaboden und der Defekt, der intraorbital durch das entfernte Fettgewebe entsteht. 53 Das Loch in der Fossa canina, das durch den Zugang zur Kieferhöhle entsteht, lässt sich auf zwei Arten behandeln: bei der ersten Methode nach Caldwell-Luc wird ein Loch im Knochen belassen und nur der Weichteilmantel darüber verschlossen, bei der anderen Methode nach Lindorf wird die faziale Kieferhöhlenwand durch die Replantation eines freien Knochendeckels rekonstruiert. In einer Vergleichsstudie der Universität Münster wurden bei 154 Patienten verschiedene Befunde nach beiden Operationsmethoden erhoben, hierbei zeigte sich eine Überlegenheit des osteoplastischen Vorgehens mit Replantation eines Knochendeckels in verschiedenen Kriterien wie unauffälliger Lokalbefund, Zeitpunkt bis zum Erreichen eines stabilen, postoperativen Zustandes und unauffälliger Röntgenbefund. In anderen Merkmalen wie Wetterfühligkeit, Druckdolenz am Austrittspunkt des N. infraorbitalis, Sensibilitätsstörungen und Vorhandensein neuralgiformer Beschwerden konnte kein statistisch signifikanter Unterschied festgestellt werden, was die Autoren auf das schleimhautschonende Vorgehen bei allen in die Studie eingeschlossenen Patienten zurückführen. Prozentual zeigten jedoch auch in diesen Merkmalen die meisten Ergebnisse eine Überlegenheit des osteoplastischen Verfahrens mit Knochendeckel (Portugall et al, 1989). Der knöcherne Orbitaboden müsste am Ende der Operation in jedem Fall repariert werden, da er wichtig für die Lage des Auges ist. Eines der charakteristischen Zeichen einer Blowout-Fraktur ist die Diplopie, welche durch das Absinken von Orbitainhalt in die Kieferhöhle entsteht. Ohne eine stabile Reparation wäre dies natürlich auch nach einer iatrogenen Eröffnung des Orbitabodens zu erwarten. In einer Studie über Orbitateilresektionen bestätigen De Monte et al., dass die primäre Rekonstruktion der inferioren Orbitawand notwendig ist, besonders, wenn mehr als zwei Drittel des Orbitabodens entfernt wurden, da postoperative Komplikationen ohne Rekonstruktion sehr wahrscheinlich sind (DeMonte et al., 2001). Eine Orientierung an kieferchirurgischen Erfahrungen zur Rekonstruktion von BlowoutFrakturen des Orbitabodens ist hier sicher sinnvoll. Walter beschrieb bereits 1972 eine Reparation von Blow-out Frakturen über einen transantralen Zugang, er nutzte hierfür eine Kopflampe um die Fraktur über eine 54 Antrostomie zu sichten, reponierte die Fraktur dann blind und tamponierte die Kieferhöhle anschließend für 10-14 Tage aus (Walter, 1972). In der Literatur findet sich eine Vielzahl von endoskopischen Zugangswegen und Materialien zur Reparation von Blow-out Frakturen des Orbitabodens (Persons and Wong, 2002; Chen and Chen, 2001; Jeon et al., 2007; Wallace et al., 2006; Farwell and Strong, 2006). Wallace et al. zeigen anhand von CT Untersuchungen in einer Kadaverstudie, dass eine effiziente Deckung von Orbitabodenfrakturen durch einen endoskopischen transantralen wie durch einen offenen Zugang zumindest am anatomischen Präparat gleichermaßen möglich ist. Für die Studie wurden Frakturen von 18 bis 29mm² erzeugt und das Orbitavolumen in mm³ vor und nach Fraktur und nach Reparatur gemessen. Es zeigte sich hier kein statistisch signifikanter Unterschied in den Ergebnissen zwischen offenem und endoskopischem Zugang. Bei beiden Verfahren zeigte sich kein statistisch relevanter Unterschied zwischen dem Orbitavolumen vor Fraktur und nach Reparatur. Die benötigte Öffnungsgröße der Antrostomie bemaß bei dem endoskopischen Zugang 11,3 mm². Zur Deckung des Defektes verwendeten Wallace et al. ein Ethisorb-Patch, dieses wurde mit Bariumsulfat beschichtet, um es in der CT-Untersuchung deutlich sichtbar zu machen (Wallace et al., 2006). In einem Review beschreiben Farwell und Strong die Technik der transantralen endoskopischen Reparatur von Blow-out Frakturen. Mediale Blow-out Frakturen und Trap-door Frakturen sind besonders geeignet zur endoskopischen Reparatur. Der Zugang kann über eine 1 cm x 2 cm messende Antrostomie im Bereich der Fossa canina erfolgen, die Inspektion und endoskopische Assistenz werden mit Endoskopen in 0°und 30°- Optik durchgeführt. Farwell und Strong beschreiben in ihrem Review die Deckung mithilfe einer porösen Polyethylenfolie, die 1mm größer als der Defekt zugeschnitten wird, eingebracht wird und dann durch den Druck des Orbitainhaltes in Richtung Kieferhöhle stabilisiert wird. Gelegentlich muss eine mittelmeatale Antrostomie erfolgen, um eine adäquate Drainage der Kieferhöhle zu gewährleisten (Farwell and Strong, 2006). Chen und Chen stellen gute Ergebnisse in einer Studie über neun Patienten mit Orbitabodenfrakturen, die endoskopisch transantral versorgt wurden, vor. Bei sechs der Patienten wurde ein Titannetz zur Rekonstruktion verwendet, das mit vier Schrauben im 55 anterioren Bereich des Kieferhöhlendaches fixiert wurde. Bei den übrigen drei Patienten waren um den Defekt herum ausreichende Knochenränder vorhanden, die die Stabilisierung eines Medpor (Porex) Implantates im Knochendefekt ermöglichten. Ein postoperativer Enophthalmus war bei einem Patienten messbar, der jedoch zusätzlich eine mediale Orbitawandfraktur erlitten hatte, welche nicht versorgt wurde. Bei drei Patienten trat postoperativ eine Diplopie auf, diese verschwand jedoch bei zwei Patienten im Verlauf und besserte sich bei dem dritten Patienten. Ein Taubheitsgefühl im Dermatom des N. infraorbitalis hielt 2 bis 3 Monate an (Chen and Chen, 2001). In einer weiteren Studie stellt Farwell mit anderen Kollegen die Ergebnisse von 53 Patienten mit Orbitafrakturen ohne Beteiligung des Orbitarandes vor (Farwell et al., 2007). Bei 45 der 53 Patienten konnte eine transantrale Reparatur endoskopisch vollendet werden, als Material zur Deckung wurde bei 28 Patienten Medpor (Porex) verwendet, bei 10 Patienten war eine Stabilisierung durch Reposition der Knochenfragmente ohne weiteres Einbringen von Fremdmaterial möglich. Bei den übrigen Patienten wurde autologer Knorpel aus dem Nasenseptum oder Gelfilm verwendet. Bei acht Patienten musste die Endoskopie intraoperativ abgebrochen und auf einen offenen Zugangsweg gewechselt werden. 36 der Patienten hatten nach dem Eingriff keine orbitalen Beschwerden, bei 7 Patienten war eine Diplopie feststellbar, die jedoch eine Besserung im Vergleich zum präoperativen Befund zeigte. Bei 3 Patienten war ein Enophthalmus zu beobachten, 2 Sinusitiden traten auf, und 8 der Patienten beklagten eine Persistenz der präoperativen Hypästhesie im Versorgungsgebiet des N. infraorbitalis. Schwierigkeiten in der endoskopischen Reparatur entstanden besonders dann, wenn eine Präparation bis auf die Lamina papyracea oder lateral des N. infraorbitalis nötig war, um ausreichende Knochenränder für die Stabilisierung des Implantates zu erreichen. Auch große Herniationen von Orbitainhalt erschweren die endoskopische Versorgung von Blow-out-Frakturen (Farwell et al., 2007). Jeon et al. beschreiben die Reparatur von 11 Orbitabodenfrakturen über einen transnasalen Zugang, sie verzichteten dabei auf Fremdmaterial und verwendeten zur Stabilisierung einen mit Kochsalzlösung gefüllten Ballon, der in der Kieferhöhle befüllt wurde. Die Kieferhöhle wurde so austamponiert und der Orbitaboden nach oben 56 reponiert. Nach 4 Wochen wurde der Ballon dann entfernt. 9 der 11 Patienten erholten sich vollständig und zeigten nach Abheilung keine orbitalen Symptome mehr, 2 behielten eine geringgradige Diplopie beim Blick über 20 ° nach oben zurück ( Jeon et al., 2007). Zur Deckung von Orbitabodendefekten sind grundsätzlich autologe, allogene und alloplastische Materialien verwendbar. Als autologe, also körpereigene Materialien können beispielsweise Knochen aus der Rippe oder der Spina iliaca oder Knorpel aus dem Ohr verwendet werden (Chen and Cordeiro, 2008). Bei Hypophysenoperationen wird auch Bauchfett verwendet, um den Zugangsweg abzudichten. Als allogene, also spezieseigene Materialien sind lyophilisierte Dura oder lyophilisierter Tensor fasciae latae möglich. Als alloplastische, künstlich hergestellte Materialien stehen Medpor, Titan-Netze, Hydroxyapatit, Methylmethacrylat, Silastic, Polytetrafluorethylen, Gelfilm, Polyamid-Netze, Vitallium-Netze, Marlex-Netze, Vicryl-Netze, poröse Polyethylenfolien, bioaktives Glas und weitere zur Verfügung (Chen and Cordeiro, 2008). Die Spanne der verwendbaren Materialien ist also groß, und es gibt verschiedene Meinungen, welches Material am geeignetsten zur Rekonstruktion des Orbitabodens ist: Einige Autoren bevorzugen autologe Materialien wie Knochen und Knorpel aufgrund der Vaskularisation , der Stabilität und des Einbaus in das orbitale Skelett (Chen and Cordeiro, 2008; Johnson and Raftopolous, 1999; Chowdhoury and Krause, 1998). Der Nachteil von Knochentransplantaten sind aber der entstehende Hebedefekt an anderer Körperstelle und das unvorhersehbare Resorptionsmuster, woraus Spätkomplikationen wie ein Enophthalmus entstehen können. Die Durchblutung des Orbitabodens ist variabel und die Kieferhöhle ist nicht steril, was die Resorption autologer Materialien beschleunigt (Persons and Wong, 2002). Allogene Materialien wie lyophilisierte Dura eignen sich zwar zur Deckung kleinerer Defekte, bieten aber bei größeren Defekten keine ausreichende Stabilität und sind daher für die Defektdeckung nach transmaxillärem endoskopischen Zugang zur Orbita nicht geeignet. Alloplastische Materialien umgehen den Hebedefekt, der bei der Gewinnung von autologen Materialien entsteht, und die Resorption ist vorhersehbarer als bei autologen 57 Materialien, sie haben aber auch verschiedene Nachteile. Ein zu dünnes alloplastisches Material kann in die Kieferhöhle hernieren und einen Enophthalmus verursachen. Ein zu dickes alloplastisches Material dagegen ist schwerer in den Defekt einzupassen, es kann extrudieren oder den okulären Druck steigern (Canalis et al., 1977). Silastic-Implantate extrudieren häufig und verursachen Langzeitinfektionen (Wolfe, 1981; Morrison et al., 1995; Zingg et al.,1991; Lynham et al.,2004). Nach Verwendung von Teflon, Methylmetacrylat, Supramid und Marlex-Netz wurden Langzeitkomplikationen beschrieben, die eine Entfernung des eingebrachten Materials erforderten (Jordan et al., 1992). Methylmetacrylat ist außerdem exotherm und kann dadurch intraorbitale Strukturen schädigen (Chowdhoury and Krause, 1998). Chowdhoury und Krause schlagen als Alternative zu autologen Materialien poröse Polyethylenfolie vor, da diese eine geringe Infektionsrate zeigt und gut in das orbitale Skelet eingebaut wird (Chowdhoury and Krause, 1998). Allerdings verweisen sie auch auf einen Bericht über einen Brand in einem Operationssaal, der durch die Verwendung eines Elektrokauters in Verbindung mit poröser Polyethylenfolie verursacht wurde (Shorr and Steinsapir, 1994). Die Entflammbarkeit der Folie ist somit ein gefährlicher Nachteil. Metallnetze werden fest in das Gewebe eingebaut, eine Entfernung bei Spätkomplikationen kann daher problematisch werden. Es ist deshalb sinnvoll, bei der Verwendung von Metallnetzen zusätzlich eine abgrenzende Schicht aus einem anderen Material einzusetzen (Chowdhoury and Krause, 1998). Gönül et al. schlagen zur Rekonstruktion des Orbitabodens in ihrer Arbeit über den mikrochirurgischen transmaxillären Zugang zur Orbita das alloplastische MedporImplantat (Porex surgical, Newnan, Ga.) vor. Persons und Wong empfehlen in ihrer Studie eine alloplastische Deckung von Orbitabodendefekten mit PLLA/PGA-Folie (poly L-lactid acid/polyglycolic acid), da diese stabil, aber formbar ist und innerhalb von 9-15 Monaten resorbiert wird (Persons and Wong, 2002). In der Studie ist die erfolgreiche Deckung von über 2 cm² großen Defekten beschrieben (Persons and Wong, 2002); die benötigte Öffnungsgröße im 58 Orbitaboden für den transmaxillären endoskopischen Zugang zur Orbita betrug 1,845 cm². Es ist daher anzunehmen, dass eine Deckung mit alloplastischen Materialien auch beim beschriebenen transmaxillären Zugang möglich ist. Denkbar ist auch, die Öffnung zur Kieferhöhle in der Fossa canina auszusägen und das so entstehende Knochenstück zur Deckung des Orbitabodendefektes als autologes Transplantat zu verwenden. Das Loch in der Fossa canina könnte dann nur mit dem Weichteilmantel der Wange verschlossen werden. Als Ersatz für den Defekt in der Periorbita wurde in klinischen Fällen erfolgreich Temporalisfaszie verwendet, welche leicht zu entnehmen ist und nur einen geringen Hebedefekt verursacht (Mc Cary and Levine, 1995). Zur weiteren Bedeckung des Defektes im Kieferhöhlendach ist auch eine zusätzliche Deckung mit Spaltschleimhaut in Verbindung mit einer Ballontamponade der Kieferhöhle denkbar. Diese könnte das Risiko neuralgiformer Beschwerden im Bereich des N. infraorbitalis senken (Lindorf, 1980). Bei insuffizienter Deckung des Defektes im Orbitadach und der sekundären Entwicklung einer Diplopie als charakteristisches Symptom des Absinkens von Orbitainhalt in die Kieferhöhle kann ein zweiter Eingriff zur erneuten Deckung des Defektes notwendig werden. Fraglich ist, ob der durch die Entfernung von intrakonalem Fettgewebe entstehende Defekt hinter dem Bulbus zum erfolgreichen Abschluß der Operation repariert werden muss. Bei fast allen Raumforderungen der Orbita entsteht eine Protrusio bulbi (Hassler et al, 2007). Es wäre zu erwarten, dass sich diese durch die erfolgreiche Entfernung des verursachenden retrobulbären Prozesses wieder ausgleicht und der Bulbus in seine Normalstellung zurückkehrt. Wenn eine Läsion weit in der Orbita liegt, wird, alleine um zur Läsion zu gelangen, eine Entfernung von gesundem Fettgewebe nötig. Durch den fehlenden Widerstand dieses zusätzlich zur Läsion entfernten Gewebes würde dann vielleicht ein Enophthalmus entstehen. Margalit beschreibt in seiner Studie einen Enophthalmus bei einem Patienten nach Resektion eines orbitalen Osteosarkoms (Margalit et al., 2007). 59 Bei den durchgeführten Präparationen wurde sehr viel intraorbitales Fettgewebe entfernt, um alle erreichbaren Strukturen aufzuzeigen. Bei der Entfernung einer singulären Läsion am Lebenden wäre eine so gründliche Entfernung des Fettgewebes aber eher nicht nötig, beispielsweise könnte bei einer medial liegenden Raumforderung wahrscheinlich auf die Präparation lateral des M. rectus inferior verzichtet werden, und umgekehrt. Das Risiko eines postoperativen Enophthalmus ist von Tumorgröße und -lage abhängig und daher individuell zu bewerten; eine autologe Fetttransplantation, wie sie beispielsweise bei Hypophysenoperationen duchgeführt wird, sollte aber präoperativ bedacht werden. Das Gewebe um den Rand des Bulbus sowie M. obliquus superior und inferior blieben bei den durchgeführten Zugängen unverletzt, so dass eine gewisse Stabilität der intraorbitalen Strukturen zur knöchernen Orbita weiterhin gewährleistet war. Ein sauber rekonstruierter Orbitaboden würde durch seine trichterförmig nach hinten zulaufende Form zusätzlich die Lage des Bulbus unterstützen. 4.3. Vergleich zu anderen operativen Zugängen zur Orbita In den letzten Jahren haben mehrere Arbeitsgruppen parallel die verschiedenen endoskopischen Techniken zur Orbita evaluiert (Pillai et al., 2008; Har-El, 2005; Kennedy et al, 1990; Metson et al, 1994; Pletcher et al. 2006; Luxenberger et al., 1998; Saetti et al., 2005; Miman et al., 2009; Sieskiewicz et al., 2008; Karaki et al., 2006; Rhee and Chen, 2006; Prabhakaran et al., 2007; Burson et al., 1995; Chen and Chen, 2003; Düz et al., 2009). Die Zunahme der wissenschaftlichen Arbeiten zur Orbitachirurgie und die dort aufgeführten guten funktionellen Ergebnisse deuten an, dass die therapeutischen Möglichkeiten, Raumforderungen der Orbita in klinischen Fällen zu behandeln, sich ausweiten. Durch die Ausarbeitung neuer Zugangswege kann zunehmend auch Patienten mit Tumoren an seltenen Lokalisationen geholfen werden. Die Orbita ist ein komplexes und feines anatomisches System. In allen Quadranten liegen wichtige Strukturen, die bei einem operativen Eingriff geschont werden müssen. Daher ist es sinnvoll, über eine Vielzahl verschiedener Zugänge zu verfügen, damit 60 jeder Bereich der Orbita möglichst direkt und ohne Umweg durch feine andere Strukturen erreicht werden kann. Margalit et al. zeigen in ihrer Studie an 41 Patienten mit intraorbitalen Läsionen, die über eine frontale oder laterale Orbitotomie operiert wurden, dass in den meisten Fällen eine komplette Entfernung des Tumors möglich war und dass die postoperative visuelle Funktion der Patienten- mit Ausnahme der Patienten, bei denen aus onkologischen Gründen eine Orbitaausräumung durchgeführt wurde- sich nicht verschlechtert hat. Jedoch ist bei einem Patienten ein Liquorleck entstanden (Margalit et al., 2007), eine Komplikation, die ohne die Eröffnung der Dura mater entfällt. Hassler et al. berichten von einem klinischen Fall, in dem ein großes retrobulbär verdrängend wachsendes Kavernom der Orbita über einen transkonjunktivalen mikrochirurgischen Zugang ohne Osteotomie reseziert wurde. Der gesamte Tumor konnte bei exzellentem kosmetischem Ergebnis entfernt werden (Hassler et al., 1994). Auch Koerbel et al. beschreiben den transkonjunktivalen mikroskopisch assistierten Zugang, der die Entfernung von Läsionen im anterioren Bereich aller vier Quadranten der Orbita ermöglicht, je nach Lokalisation über einen Schnitt durch die Konjunktiva des unteren Lides oder über einen Augenbrauenschnitt und die Retraktion des Bulbus nach superior oder inferior (Koerbel et al., 2007). Da der Zugang ohne eine Osteotomie erfolgt, ist die Retraktion des Bulbus allerdings nur intraorbital begrenzt möglich. Der transmaxilläre endoskopische Zugang könnte ein weiterer Baustein in der Therapie orbitaler Läsionen werden, denn er erreicht direkt und ohne Umwege einen großen Bereich der inferioren Orbita. Der entstehende Defekt im Orbitaboden ist zwar bei anderen endoskopischen Zugängen nicht vorhanden, die Übersicht über den Operationssitus ist aber gerade durch diesen Defekt enorm. Im Vergleich zum transkonjunktivalen Zugang zur Orbita (Pillai et al., 2008) erreicht der transmaxilläre endoskopische Zugang einen weiteren Bereich der Orbita, nämlich den lateralen inferioren Teil. Der N. opticus konnte in der Studie von Pillai et al. von medial über eine Länge von 17,3 mm dargestellt werden, während über den transmaxillären endoskopischen Zugang eine Darstellung über 13,7 mm möglich war, eine Darstellung der lateralen Seite des Nerven war aber nur über den transmaxillären Zugang möglich. Die A. centralis retinae kann über beide Zugänge gut dargestellt werden. Die Übersicht ist über den transmaxillären Zugang besser, da hier ein Vor- und 61 Zurückschieben des Endoskopes durch den großen Verschieberaum Kieferhöhle möglich ist. Pillai et al. beschreiben, dass über den transkonjunktivalen Zugang der N. opticus in 10 bis 15 Minuten erreicht werden kann, das ist wesentlich schneller als beim transmaxillären Zugang, da hier zunächst der Caldwell-Luc-Zugang geschaffen und der Orbitaboden unter Schonung des N. infraorbitalis eröffnet werden muss, was bei den durchgeführten Präparationen mindestens 20 Minuten dauerte, bevor überhaupt die intraorbitale Präparation begann. Die verschiedenen orbitachirurgischen Verfahren ergänzen sich also; für welchen Zugang entschieden wird, ist abhängig von Lage und Art der Läsion, auch Vorerkrankungen sind zu bedenken. Eine chonische Sinusitis beispielsweise schließt den transmaxillären Zugang aus, während eine Läsion im lateralen inferioren Bereich der Orbita über einen transkonjunktivalen Zugang gar nicht erst erreicht werden kann. Sinnvoll ist also, über ein Armentarium verschiedener Zugangswege zu verfügen, um jedem Patienten gerecht zu werden und individuell die beste Lösung zu ermöglichen. 4.4. Fazit Der transmaxilläre Zugang ist in der Kadaverstudie durchführbar, und die Ergebnisse einer Reparation von Blowout-Frakturen des Orbitabodens sind gut. Daher lässt sich vermuten, dass dieser Zugang eine Alternative zu anderen Zugängen zur Entfernung von tumorösen Läsionen im inferioren Teil der Orbita darstellt. Der nächste Schritt in der Erforschung des transmaxillären endoskopischen Zugangs zur Orbita wäre die Durchführung an einer frischen Anatomieleiche, um einen realistischen Eindruck von der Konsistenz und Elastizität des Gewebes zu erhalten. Während der experimentellen Arbeit war eine deutliche Lernkurve im Umgang mit dem Endoskop und den feinen Instrumenten zu verzeichnen. Gerade die feinen anatomischen Strukturen der Orbita erfordern einen sicheren Umgang mit den Gerätschaften, da ein Abrutschen oder eine unvorsichtige Drehung wichtige Strukturen gefährden. Eine genaue Kenntnis der Anatomie und der Konsistenz der intraorbitalen Strukturen muss erlernt werden, um das Verletzungsrisiko für den Patienten zu minimieren. Ein vergleichbares Tiermodell gibt es für die Orbitachirurgie nicht, da sich die Spezies hier 62 zu stark unterscheiden. Die Arbeit am menschlichen anatomischen Präparat ist daher in der Vorbereitung zu orbitachirurgischen Eingriffen sehr wichtig. 63 5. Zusammenfassung Der transmaxilläre Zugang zur Orbita und eine Präparation der inferioren intrakonalen Strukturen waren bei allen 18 Zugängen dieser Kadaverstudie möglich. Mit den in der Klinik vorhandenen Hypophysenendoskopen und Operationsbestecken ließen sich die anatomischen Strukturen gut darstellen. Die 30° abgewinkelte Optik erwies sich als gut geeignet für diesen Zugang, während die 0° Optik nur teilweise für den Zugang zur Kieferhöhle genutzt wurde. Mit der Präparation durch den Sinus maxillaris bietet sich ein großer Verschieberaum für die Instrumente und eine gute Übersicht über den gesamten Orbitaboden. Der Zugangsweg bis zur Orbita gefährdet keine wichtigen anatomischen Strukturen, da der N. infraorbitalis und seine begleitenden Gefäße bei allen Präparaten zweifelsfrei identifiziert und geschont werden konnten. Der M. rectus inferior und der Ast des N. oculomotorius zum M. obliquus inferior konnten regelhaft dargestellt und mobilisiert werden, um einen medialen und lateralen Zugangsweg zu schaffen. Die benötigten Größen der Fensterungen betrugen 14,5x 9,8 mm in der fazialen Kieferhöhlenwand und 10,7x 17,1 mm im Orbitaboden. Über den Zugangsweg medial des M. rectus inferior konnten der M. rectus medialis und sein versorgender Nervenast aus dem N. oculomotorius, Bulbus oculi und N. opticus, teilweise mit A. centralis retinae, und die A. ophthalmica erreicht werden. In einer Orbita war der N. nasociliaris präparierbar. Über den Zugangsweg lateral des M. rectus inferior war die Darstellung von M. rectus lateralis, Bulbus und N. opticus und, in unterschiedlicher Ausdehnung, der V. ophthalmica inferior und der Ciliarnerven möglich. Intraorbital sind beim medialen Zugangsweg die Äste der A. ophthalmica, lateral besonders die Ciliarnerven und –arterien gefährdet. Eine Präparation der Strukturen war nur etwa bis auf Höhe des N. opticus möglich, dieser konnte bis durchschnittlich 13,7 mm vom Augapfel entfernt dargestellt werden. 64 Das orbitale Fett zwischen den inferioren intrakonalen Strukturen konnte entfernt werden, woraus sich vermuten läßt, dass eine Resektion von Läsionen wie Kavernomen oder Neurinomen in klinischen Fällen möglich wäre. Der nächste Schritt zur Erforschung des transmaxillären endoskopischen Zugangs zur Orbita ist die Durchführung am frischen, unfixierten Präparat. 65 6. Literaturverzeichnis Alexander, H., Robinson, S., Wickremesekera, A., Wormald, P.J. (2010). Endoscopic transsphenoidal resection of a mid-clival meningeoma. J Clin Neuroscience 17(3), 374376 Bejjani, G., Cockerham, K., Kennerdell, J., Maroon, J. (2001). A reappraisal of surgery for orbital tumours. Part I: extraorbital approaches. Neurosurg. Focus 10(5), Article 2 Burson, J.G., Gussack, G.S., Hudgins, P.S. (1995). Endoscopic approach to the pediatric orbit. Laryngoscope 105(7), 771-773 Canalis, R.F., Handler, S.D., Fee, W.E (1977). Complications of orbital floor implants. Trans. Pac. Coast Otoophthalmol. Soc. Annu. Meet. 58, 81 Cappabianca, P., Cavallo, L.M., Colao, A., de Divitiis, E. (2002). Surgical complications associated with the endoscopic endonasal transsphenoidal approach for pituitary adenomas. J Neurosurgery 97, 293-298 Cavallo, L., Mesina, A., Gardner, P., Esposito, F., Kassam, A., Cappabianca, P., De Divitiis, E., Tschabitscher, M. (2005). Extended endoscopic endonasal approach to the pterygopalatine fossa: anatomical study and clinical considerations. Neurosurg. Focus 19(1), E5, 1-7 Chen, C.M., Cordeiro, P.G. (2008). The tongue in groove technique for orbital floor reconstruction after maxillectomy. Plastic and Reconstructive Surgery 121(1), 225-232 Chen, C.T., Chen, Y.R. (2001). Endoscopically assisted repair of orbital floor fractures. Plastic and Reconstructive Surgery 108(7), 2011-2018 Chen, C.T., Chen, Y.R. (2003). Endoscopic orbital surgery. Atlas Oral Maxillofac Surg Clin North Am. 11(2), 179-208 Chowdhoury, K., Krause, G.E. (1998). Selection of materials for orbital floor reconstruction. Arch. Otolaryngol. Head Neck Surg. 124, 1398-1401 Chrastina, J., Novak, Z., Riha, I. (2008). Neuroendoscopy. Bratisl Lek Listy 109(5), 198-201 66 Cockerham, K., Bejjani, G., Kennerdell, J., Maroon, J. (2001). Surgery for orbital tumors. Part II: transorbital approaches. Neurosurg. Focus 10(5), Article 3 Couldwell, W.T., Sabit, I., Weiss, M.H., Giannotta, S.L., Rice, D. (1997). Transmaxillary approach to the anterior cavernous sinus: a microanatomic study. Neurosurgery 40(6), 1307-1311 Darsaut, T., Lanzino, G., Lopes, B., Newman, S. (2001). An introductory overview of orbital tumors. Neurosurg. Focus 10(5), Article 1 DeMonte, F., Tabrizi, P., Culpepper,S., Abi-Said, D., Soparkar, C., Patrinely, J. (2001). Ophthalmological outcome following orbital resection in anterior and anteriolateral skull base surgery. Neuosurg. Focus 10(5), Article 4 Düz, B., Secer, H.I., Gonul, E. (2009). Endoscopic approaches to the orbit: a cadaveric study. Minimally invasive Neurosurgery 52, 107-113 Erdogmus, S., Govsa, F. (2008). Anatomic characteristics of the ophthalmic and posterior ciliary arteries. Journal of Neuroophthalmology 28(4), 320-324 Farwell, D.G., Sires, B.S., Kriet, J.D., Stanley, R.B. Jr. (2007). Endoscopic repair of orbital blowout fractures: use or misuse of a new appproach?. Arch Facial Plastic Surgery 9(6), 427-433 Farwell, D.G., Strong, E.B. (2006). Endoscopic repair of orbital floor fractures. Facial Plast Surg Clin N Am 14, 11-16 Fukushima, T. (1978). Endoscopy of Meckels cave, cisterna magna and cerebellopontine angle. Technical note. Journal of Neurosurgery 48(2), 302-306 Fukushima, T., Ishijima, B., Hirakawa, K., Nakamura, N., Sano, K. (1973). Ventriculofiberoscope: a new technique for endoscopic diagnosis and operation. Journal of Neurosurgery 38(2), 251-256 Fukushima, T., Schramm, J. (1975). Klinischer Versuch der Endoskopie des Spinalkanals: Kurzmitteilung. Neurochirurgia 18, 199-203 Gönül, E., Erdogan, E., Düz, B., Timurkaynak, E. (2003). Transmaxillary approach to the orbit: an anatomic study. Neurosurgery 53, 935-942 67 Greenfield, J.P., Anand, V.K., Kacker, A., Seibert, M.J., Singh, A., Brown, S.M., Schwartz, T.H. (2010). Endoscopic endonasal transethmoidal transcribriform transfovea ethmoidalis approach to the anterior cranial fossa and skull base. Neurosurgery 66(5), 883-892 Grove, A.S., Tadmor, R., New, P.F., Momose, K.J. (1978). Orbital fracture evaluation by coronal computed tomography. American Journal of Ophthalmology 85, 679-685 Har-El, G. (2005). Combined endoscopic transmaxillary-transnasal approach to the pterygoid region, lateral sphenoid sinus , and retrobulbar orbit. Annals of Otology, Rhinology & Laryngology 114(6), 439-442 Hassler, W., Meyer, B., Rohde, V., Unsöld, R. (1994). Pterional Approach to the contralateral orbit. Neurosurgery 34, 552-554 Hassler, W., Schaller, C., Farghaly, F., Rohde, V. (1994). Transconjunctival approach to a large cavernoma of the orbit. Neurosurgery 34, 859-862 Hassler, W., Unsöld, R., Schick, U. (2007). Raumforderungen der Orbita: Diagnostik und präoperative Behandlung. Dtsch Ärzteblatt 104(8), A496-501 Hellwig, D., Bauer, B.L. (1991). Endoscopic procedures in stereotactic neurosurgery. Acta Neurochirurgica Suppl. 52, 30-32 Hellwig, D., Bauer, B.L., List-Hellwig, E., Mennel, H.D. (1991). Stereotacticendoscopic procedures on processes of the cranial midline. Acta Neurochirurgica Suppl. 53, 23-32 Hellwig, D., Bauer, B.L. (1992). Minimally invasive neurosurgery by means of ultrathin endoscopes. Acta Neurochirurgica Suppl. 54, 63-68 Hellwig, D., Bauer, B.L. (1994). Minimally invasive endoscopic neurosurgery-a survey. Acta Neurochirurgica Suppl. 61, 1-12 Henne-Bruns, D., Dürig, M., Kremer, B. (2003). Chirurgie. Georg Thieme Verlag, Stuttgart 68 Horiguchi, K., Murai, H., Hasegawa, Y., Mine, S., Yamakami, I., Saeki, N. (2010). Endoscopic endonasal trans-sphenoidal optic nerve decompression for traumatic optic neuropathy-technical note. Neurol Med Chir (Tokyo) 50(6), 518-522 Jeon, S.Y., Kwon, J.H., Kim, J.P., Ahn, S.K., Park, J.J., Hur, D.G., Seo, S.W. (2007). Endoscopic intranasal reduction of the orbit in isolated blowout fractures. Acta OtoLaryngologica Suppl. 558, 102-109 Jho, H.D. (2001). Endoscopic transsphenoidal surgery. J Neurooncology 54, 187-195 Johnson, P.E., Raftopolous, I. (1999). In situ splitting of a rib graft for reconstruction of the orbital floor. Plast Reconstr Surg 103, 1709-1711 Jordan, D.R., St Onge, P., Anderson, R.L., Patrinely, J.R., Nerad, J.A. (1992). Complications associated with alloplastic implants used in orbital fracture repair. Ophthalmology 99, 1600 Karaki, M., Kobyashi, R., Mori, N. (2006). Removal of an orbital apex hemangioma using an endoscopic transethmoidal approach: technical note. Neurosurgery 59, ONS159-ONS160 Karaki, M., Kobayashi, R., Kobayashi, E., Ishii, G., Kagawa, M., Tamiya, T. Mori, N. (2008). Computed tomographic evaluation of anatomic relationship between the paranasal structures and orbital contents for endoscopic endonasal transethmoidal approach to the orbit. Neurosurgery 63, ONS15-ONS20 Kassam, A., Prevedello, D., Carrau, R., Snyderman, C., Gardner, P., Osawa, S., Seker, A., Rhoton, A.L. jr. (2009). The front door to meckel´s cave: an anteromedial corridor via expanded endoscopic endonasal approach-technical considerations and clinical series. Neurosurgery 64, ONS71-ONS83 Kassam, A., Vescan, A., Carrau,R., Prevedello, D., Gardner, P., Mintz, A., Snyderman, C., Rhoton, A.L. jr. (2008). Expanded endonasal approach: vidian canal as a landmark to the petrous internal carotid artery. Journal of Neurosurgery 108, 177-183 Kennedy, D.W., Goodstein, M.L., Miller, N.R., Zinreich, S.J. (1990). Endoscopic transnasal orbital decompression. Arch Otolaryngol Head Neck Surg. 116(3), 275-282 69 Koerbel, A., Ferreira, V.,Kiss, A. (2007). Combined transconjunctival-eyebrow approach providing minimally invasive access to all orbital quadrants. Neurusurg. Focus 23(5), E10 Lang, J. (1981). Klinische Anatomie des Kopfes: Neurokranium, Orbita, kraniozervikaler Übergang. Springer Verlag, Berlin, Heidelberg, New York. Lindorf, H.H. (1980). Wiederauskleidung der nach Caldwell-Luc voroperierten Kieferhöhle mit Spaltschleimhaut oder Duratransplantaten. Deutsche Z Mund-KieferGesichtschirurgie 4, 151-154 Lippert, H. (2003). Lehrbuch Anatomie. Urban & Fischer Verlag, München, Jena Luxenberger, W., Stammberger, H., Jebeles, JA, Walch, L. (1998). Endoscopic optic nerve decompression: the Graz experience. Laryngoscope 108(6), 873-882 Lynham, A.J., Chapman, P.J., Monsour, F.N.(2004). Management of isolated orbital orbital floor blow-out fractures: A survey of Australian and New Zealand oral and maxillofacial surgeons. Clin. Exp. Ophthalmol. 32, 42 Macbeth, R. (1971). Caldwell, Luc and their operation. The Laryngoscope 81(10), 1652-1657 Manolidis, S., Weeks, B.H., Kirby, M., Scarlett, M., Hollier, L. (2002). Classification and surgical management of orbital fractures: experience with 111 orbital reconstructions. J Craniofacial Surg 13, 726-737 Margalit, N., Ezer, H., Fliss, D., Naftaliev, E., Nosek, E., Kesler, A. (2007). Orbital tumors treated using transcranial approaches: surgical technique and neuroophthalmological results in 41 patients. Neurosurg. Focus 23(3), E11 McCary, S.W., Levine, P.A. (1995). Management of the eye in the treatment of sinonasal cancers. Otolaryngol Clin North Am 28, 1231-1238 Metson, R., Dallow, R.L., Shore, J.W. (1994). Endoscopic orbital decompression. Laryngoscope 104(8 PT 1), 950-957 70 Metzger, M., Schön, R., Tetzlaf, R., Weyer, N., Rafii, A., Gellrich, N.-C.,Schmelzeisen, R. (2007). Topographical CT-data analysis of the human orbital floor. Int. J. Oral Maxillofacial Surgery 36, 45-53 Miman, M.C., Bayindir, T., Akarcay, M., Erdem, T., Selimoglu, E. (2009). Endoscopic removal of a huge ethmoido-orbital osteoma. Journal of Craniofacial Surgery 20, 14031406 Moore, C., Bromwich, M, Roth, K., Matic, D. (2008). Endoscopic anatomy of the orbital floor and maxillary sinus. Journal of Craniofacial Surgery 19, 271-276 Morrison, A.D., Sanderson, R.C., Moos, K.F. (1995). The use of silastic as an orbital implant for reconstruction of orbital wall defects: Review of 311 cases treated over 20 years. J. Oral Maxillofac. Surg. 53, 412 Nolasco, F.P., Mathog, R.H. (1995). Medial orbital wall fractures: classification and clinical profile. Otolaryngol Head Neck Surg 112, 549-556 Ong, B.C., Gore, P.A., Donnellan, M.B., Kertesz, T., Teo, C. (2008). Endoscopic sublabial transmaxillary approach to the rostral middle fossa. Neurosurgery 62, ONS30ONS37 Persons, B.L., Wong, G.B. (2002). Transantral endoscopic orbital floor repair using resorbable plate. Journal of Craniofacial Surgery 13(3), 483-488 Petzel, J.-R., Minderjahn, A., Kreidler, J. (1980). Das Syndrom der operierten Kieferhöhle. Deutsche Z Mund-Kiefer-Gesichtschirurgie 4, 144-150 Pillai, P., Lubow, M., Ortega, A., Ammirati, M. (2008). Endoscopic transconjunctival surgical approach to the optic nerve and medial intraconal space: a cadaver study. Neurosurgery 63, ONS204-ONS209 Pletcher, S.D., Sindwani, R., Metson, R. (2006). Endoscopic orbital and optic nerve decompression. Otolaryngol Clin North Am. 39(5), 943-958 Ploder, O., Klug, C., Backfrieder, W., Voracek, M., Czerny, C., Tschabitscher, M. (2002). 2D- and 3D-based measurements of orbital floor fractures from CT scans. Journal of Cranio-Maxillofacial Surgery 30, 153-159 71 Ponto, K., Pitz, S., Pfeiffer, N., Hommel, G., Weber, M., Kahaly, G. (2009). Endokrine Orbitopathie. Deutsches Ärzteblatt 106(17), 283-289 Portugall, J., Khoury, F., Becker, R., Habel, G. (1989). Kieferhöhlenoperation mit oder ohne plastischen Zugang? Eine retrospektive Vergleichsstudie. Deutsche Z MundKiefer-Gesichtschirurgie 13, 54-56 Prabhakaran, V.C., Hsuan, J., Selva, D. (2007). Endoscopic assisted removal of orbital roof lesions via a skin crease approach. Skull Base 17(5), 341-345 Rabadan, A., Conesa, H. (1992). Transmaxillary-transnasal approach to the anterior clivus: a microsurgical anatomical model. Neurosurgery 30(4), 473-481 Rhee, J.S., Chen, C.T. (2006). Endoscopic approach to medial orbital wall fractures. Facial Plast Surg Clin N Am 14, 17-23 Rhoton, A., Natori, Y. (1996). The orbit and sellar region- microsurgical anatomy and operative approaches. Thieme Verlag New York, Stuttgart Saetti, R., Silvestrini, M., Narne, S. (2005). Ethmoid osteoma with frontal and orbital extension: endoscopic removal and reconstruction. Acta Otolaryngol 125(10), 11221125 Sandler, N., Carrau, R., Ochs, M., Beatty, R. (1999). The use of maxillary sinus endoscopy in the diagnosis of orbital floor fractures. Journal of Oral Maxillofacial Surgery 57, 399-403 Saunders, C.J., Whetzel, T.P., Stokes, R.B., Wong, G.B., Stevenson, T.R. (1997). Transantral endoscopic orbital floor exploration: a cadaver and clinical study. Plastic and Reconstructive Surgery 100(3), 575-581 Scholz, M., Hardenack, M., Konen, W., Fricke, B., von Düring, M., Heuser, L., Harders, A.G. (1999). Navigation in neuroendoscopy. Min Invas Ther & Allied Technol 8(5), 309-316 Schroeder, H.W., Gaab, M.R. (1999). Intracranial endoscopy. Neurosurg. Focus 6(4), Article 1 72 Schünke, M., Schulte, E., Schumacher, U., Voll, M., Wesker, K. (2006). Prometheus Kopf und Neuroanatomie- Lernatlas der Anatomie. Georg Thieme Verlag, Stuttgart Shen, C.C., Wang, Y.C., Hua, W.S., Chang, C.S., Sun, M.H. (2000). Endoscopic endonasal transsphenoidal surgery for pituitary tumours. Chin Med J (Engl) 63, 301-310 Shorr, N., Steinsapir, K.D. (1994). Flammability of highdensity porous polyethylene: a potential intraoperative fire hazard (letter). Arch. Ophthalmol.112, 1276-1277 Sieskiewicz, A., Lyson, T., Mariak, Z., Rogowski, M. (2008). Endoscopic trans-nasal approach for biopsy of orbital tumours using image-guided neuro-navigation system. Acta Neurochir 150, 441-445 Tabaee, A., Anand, V.K., Barron, Y., Hiltzik, D.H., Brown, S.M., Kacker, A., Mazumdar, M., Schwartz, T.H. (2009). Endoscopic pituitary surgery: a systematic review and meta-analysis. Journal of neurosurgery, january 23 (published online), 1-10 Wallace, T., Moore, C., Bromwich, M., Matic, D. (2006). Endoscopic repair of orbital floor fractures: computed tomographic analysis using a cadaveric model. The Journal of Otolaryngology 35(1), 1-7 Walter, W.L. (1972). Early surgical repair of blowout fracture of the orbital floor by using the transantral approach. South Med Journal 65(10), 1229-1243 Wang, Q., Lan, Q., Lu, X.J. (2010). Extended endoscopic endonasal transsphenoidal approach to the suprasellar region: anatomic study and clinical considerations. J Clin Neuroscience 17(3), 342-346 Wolfe, S.A. (1981). Correction of a lower eyelid deformity caused by multiple extrusions of alloplastic orbital floor implants. Plast. Reconstr. Surg. 68, 429 Zingg,M., Chowdhoury, K., Ladrach, K.(1991). Treatment of 813 zygoma-lateral orbital complex fractures: New aspects. Arch. Otolarygol. Head Neck Surg. 117, 611 73 Danksagung Mein besonderer Dank gilt Prof. Dr. Martin Scholz für die freundliche Überlassung des Themas, die Betreuung und die wertvollen Hinweise bei der Fertigstellung dieser Arbeit. Die Lehre der endoskopischen Technik, seine Geduld und Unterstützung und die Einführung in die wissenschaftliche Arbeit machten ein Gelingen der Experimente überhaupt möglich. Ich danke ihm außerdem für die Möglichkeit, Teilergebnisse der Arbeit auf verschiedenen Kongressen vorzustellen. Prof. Dr. Harders danke ich sehr für die Möglichkeit, in seiner Klinik diese wissenschaftliche Arbeit durchzuführen. PD Dr. Maurer danke ich herzlich für die praktische Unterstützung bei der Präparation des ersten Situs und die Hinweise zu interessanten Literaturstellen. Prof. Dr. Hassler danke ich für die freundliche Durchsicht meiner Arbeit und seinen Expertenrat zur Orbitachirurgie. Dem Anatomischen Institut der Ruhr Universität Bochum gebührt mein Dank für die Vorbereitung und Überlassung der Präparate. Lebenslauf Am 23. September 1983 wurde ich als Tochter von Dr. Karin Varchmin-Schultheiß und PD Dr. Rolf Schultheiß in Bonn am Rhein geboren. Nach Besuch der Grundschule von 1989 bis 1993 und anschließend des LiebfrauenGymnasiums von 1993 bis 1997 zog ich mit meinen Eltern und meinem älteren Bruder Jan von Bonn nach Dortmund um. Hier besuchte ich von 1997 bis 2002 das Mallinckrodt- Gymnasium, wo ich 2002 mein Abitur abschloss. Nach einer Ausbildung zur Rettungssanitäterin beim Deutschen Roten Kreuz begann ich im Wintersemester 2003/2004 mein Studium der Humanmedizin an der Universität Ulm, wo ich im Sommer 2006 den Ersten Abschnitt der Ärztlichen Prüfung ablegte. Zum Wintersemester 2006/2007 wechselte ich an die Ruhr-Universität Bochum, hier begann ich im April 2008 meine Promotionsarbeit bei Prof. Dr. Martin Scholz in der Klinik für Neurochirurgie des Knappschaftskrankenhauses Bochum. Mein Praktisches Jahr absolvierte ich von September 2009 bis Juli 2010 im Universitätsklinikum Bergmannsheil Bochum in den Fächern Plastische Chirurgie, Chirurgie und Innere Medizin. Im Herbst 2010 werde ich den Zweiten Abschnitt der Ärztlichen Prüfung ablegen.