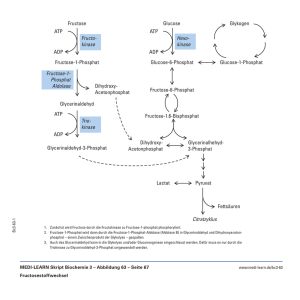
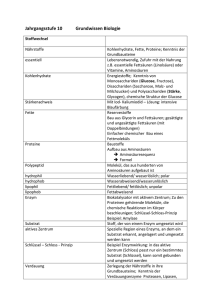
Musterlösung zum 2. Teil der Nachklausur
Werbung
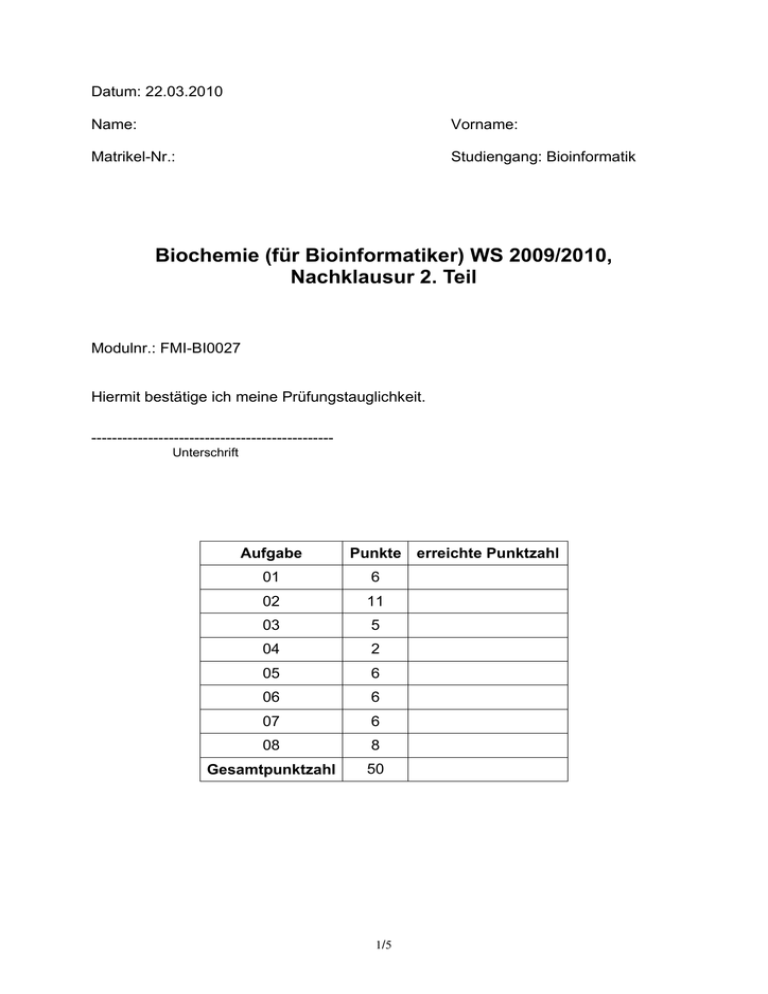
Datum: 22.03.2010 Name: Vorname: Matrikel-Nr.: Studiengang: Bioinformatik Biochemie (für Bioinformatiker) WS 2009/2010, Nachklausur 2. Teil Modulnr.: FMI-BI0027 Hiermit bestätige ich meine Prüfungstauglichkeit. ----------------------------------------------Unterschrift Aufgabe Punkte erreichte Punktzahl 01 6 02 11 03 5 04 2 05 6 06 6 07 6 08 8 Gesamtpunktzahl 50 1/5 01. (6 Punkte) Nennen Sie 3 Stoffwechselwege und deren subzelluläre Lokalisation. Beispiele: • Citratzyklus: Mitochondrium • Oxidative Phosphorylierung: Mitochondrium • Glykolyse: Cytosol • Glukoneogenese: erster Schritt in Mitochondrien, letzter Schritt im ER, dazwischen liegende Reaktionen im Cytosol • Pentosephosphatweg: Cytosol • Fettsäuresynthese: Cytosol 02. (11 Punkte) Bei welchen Reaktionen der Glykolyse wird ATP verbraucht, und in welchen Schritten wird ATP gebildet? Schreiben Sie die Reaktionsgleichungen auf (die ATP-bildenden mit Strukturformeln). Wie hoch ist die Nettoausbeute an ATP in der Glykolyse? ATP-verbrauchende Reaktionen: ATP ADP α-D-Glucose-6-phosphat α-D-Glucose Hexokinase Mg2+ ADP ATP α-D-Fructose-6-phosphat α-D-Fructose-1,6-bisphosphat PFK Mg2+ 2/5 ATP-bildende Reaktionen: O O - - O P O O O C O C CH OH CH OH H2C H2C O O O - P - O + ADP 1,3-Bisphosphoglycerat O O H2C - O O P O - PhosphoglyceratKinase Mg2+ - O - +ATP 3-Phosphoglycerat - O P ADP + H + ATP O O C H3C C C OH C O Phosphoenolpyruvat O PyruvatKinase Mg2+, K+ O - Pyruvat Pro Molekül Glucose werden zwei Moleküle ATP gebildet. 03. (5 Punkte) In welchen Schritten des TCA-Zyklus, beginnend mit Pyruvat, werden NADH und FADH2 gebildet? NADH wird gebildet bei der Umwandlung von • Pyruvat zu Acetyl-CoA • Isocitrat zu α-Ketoglutarat • α-Ketoglutarat zu Succinyl-CoA • Malat zu Oxalacetat FADH2 wird gebildet bei der Umwandlung von • Succinat zu Fumarat 3/5 04. (2 Punkte) Läuft der TCA-Zyklus unter anaeroben Bedingungen ab? Begründen Sie Ihre Antwort. Nein. Der TCA-Zyklus benötigt NAD+ und FAD, welche in der Elektronentransportkette regeneriert werden. Diese wiederum beinhaltet den Verbrauch von Sauerstoff. 05. (6 Punkte) Was ist der Unterschied zwischen glucogenen und ketogenen Aminosäuren? Nennen Sie je zwei glucogene und ketogene Aminosäuren. Die Abbauprodukte von glucogenen Aminosäuren können in die Gluconeogenese einfließen, während die von ketogenen Aminosäuren für die Fettsäuresynthese genutzt werden können. glucogene Aminosäuren: • Alanin • Aspartat ketogene Aminosäuren: • Leucin • Lysin 06. (6 Punkte) Was sind die Unterschiede zwischen aktivem und passivem Transport? Nennen Sie je 1 Beispiel und beschreiben Sie jeweils kurz den Transportmechanismus. Für aktiven Transport muß Energie, z.B. in Form von ATP, aufgewandt werden. Der Stoff wird entgegen dem Konzentrationsgefälle transportiert. Passiver Transport verläuft mit dem Konzentrationsgefälle. Es ist kein Energie-Verbrauch nötig. Beispiel aktiver Transport: Na+-K+-ATPase: unter ATP-Verbrauch wird Na+ aus und K+ in die Zelle gepumpt (Antiporter) Beispiel passiver Transport: in Na+-Kanälen strömen Na+-Ionen entlang ihres Gradienten 4/5 07. (6 Punkte) Wie funktioniert die „Signalabschaltung“ bei G-Protein-gekoppelten Rezeptoren? Aktivierte G-Proteine schalten sich durch GTP-Hydrolyse selbständig ab. Die αUntereinheit besitze eine intrinsische GTPase-Aktivität. GTP wird zu GDP und Pi gespalten. Dieser Vorgang wird durch GTPase-aktivierende Proteine (GAP) beschleunigt. Die nun inaktive α-Untereinheit reassoziiert mit einem freien βγ-Dimer; der Ausgangszustand des G-Protein-Zyklus ist wieder erreicht. Allerdings ist damit noch nicht das Signal „abgeschaltet“. Der aktive Rezeptor würde erneut zur Aktivierung des G-Proteins führen. G-Protein-Rezeptor-spezifische Kinasen (GRK) docken an die βγ-Untereinheit an und phosphorylieren Serin bzw. Threoninreste der intrazellulären Rezeptordomäne. Daran kann Arrestin binden und den Rezeptor blockieren. 08. (8 Punkte) Beschreiben Sie, wie bei der Signalübertragung durch Rezeptortyrosinkinasen (MAP-Kinase-Kaskade) das Ras-Protein aktiviert wird. Welche Funktion hat Ras und warum tragen Tumorzellen so häufig Ras-Mutationen? Der aktivierte Rezeptor bindet das Adapterprotein Grb2, welches wiederum den GEF-Austauscher Sos angekoppelt hat. Sos kann nun im membranassoziierten Ras den Wechsel von GDP zu GTP stimulieren und somit das G-Protein in seine aktive Form überführen. GTP-Ras startet eine Kaskade von Signalen, die letztlich zur Aktivierung cytosolischer Effektorkinasen führt und von dort aus in den Zellkern weitergeleitet werden. Laufen Ras-Mutationen auf eine zu geringe GTPase-Aktivität hinaus, so ist das Protein praktisch resistent gegen GAP-Aktivatoren, die zur GTP-Hydrolyse und damit zur Inaktivierung von Ras führen. In der nun permanent vorliegenden aktiven Form regt Ras die Zellproliferation unkontrolliert an, was zur Transformation der betroffenen Zellen führt. 5/5