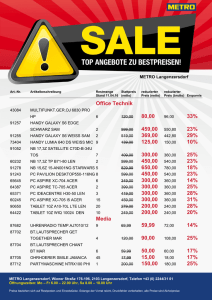
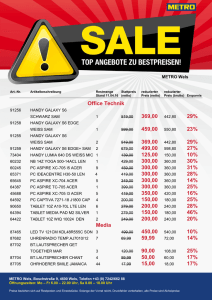
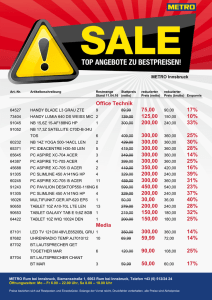
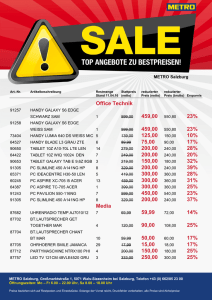
2007-4 …lesen
Werbung

Wissenschaftliche Tätigkeit Abschlussbericht 2007 Nummer der wissenschaftlichen Tätigkeit: BGB 3018 Versuchsjahr: 2007 Titel der wissenschaftlichen Tätigkeit: In-vitro-Regeneration aus Acer monspessulanum –Kalluslinien Englischer Titel: In-vitro Regeneration from Acer monspessulanum callus Projektleiter: HRISTOFOROGLU Katharina Telefonnummer: 01 8135950/330 Projektmitarbeiter: SZALAY Stefan, KÜNTZEL Nina e-Mail: [email protected] Kooperationspartner: Einleitung Von Acer monspessulanum (Französischer oder Montpellier -Ahorn) konnten an der HBLFA interessante Typen für den Gartenbau selektiert werden. Die Selektion wurde in Folge der Sichtung von Gehölzen für den pannonischen Raum durchgeführt. Die konventionelle Vermehrung erfolgt über Veredelung auf Acer campestre (Feld -Ahorn) und ist sehr aufwendig. Es wird über die Pflanzliche Gewebekultur versucht, wurzelechte Acer monspessulanum –Pflanzen zu produzieren, dies dient als Alternative. Problem- und Aufgabenstellung Über die In-vitro-Vermehrung von Acer gibt es nur vereinzelt Literaturstellen. FERNÁNDEZ-LORENZO et al. (2000) konnte Acer palmatum auf einem WPM –Nährboden, der mit dem Cytokinin TDZ angereichert wurde, etablieren. Etabliert wurden Axillarsprosse einer 4 Jahre alten Pflanze. Bei Acer caudatifolium erfolgte die Etablierung angetriebener und ruhender Axillarknospen, auf einem WPM –Nährboden welcher mit den Phytohormonen BAP und NAA angereichert wurde (DURKOVIC 2003). Bei den ruhenden Axillarknospen war keine Regeneration möglich. BGB 3018 An der HBLFA für Gartenbau wird für die Acer monspessulanum -Selektion anhand zweier Typen ein Etablierungs- und Vermehrungsprotokoll entwickelt. Versuchsdurchführung Angelehnt an die angeführten Literaturstellen wurde im Versuchsjahr 2005 und 2006 - anhand von zwei Typen (Typ1, Typ11) der A. monspessulanum – Selektion - eine In-vitro-Etablierung durchgeführt. Als Ausgangsexplantat für die In-vitro-Etablierung wurden angetriebene, vegetative und generative Knospen sowie ruhende Knospen mit verholztem Trieb genommen. Bei der In-vitro-Etablierung wurde 2006 aufgrund des Wachstumsstillstandes der durchgetriebenen Knospen, eine Induktion von Kallusgewebe vorgenommen. Im Versuchsjahr 2007 wurden die Kalluslinien vom Typ1 und Typ11 in Richtung eines weichen Kallus selektiert. Bei der somatischen Embryogenese sollte der Kallus eine bipolare Struktur ausbilden mit isodiametrischen, meristematischen Zellen und länglichen, vakuolisierten Suspensorzellen. Die Färbung der Kalluszellen erfolgte mittels Evan`s Blau und Carminessigsäure. Die Vermehrung der Kallusexplantate wurde auf den Nährböden 501 und 505, ohne beziehungsweise mit Zusatz von Apium –Extrakt durchgeführt (Tab. 1). Da sich laut EGERTSDOTTER & ARNOLD (1995) im embryogenen Kallus Proteine befinden, die für die somatische Embryogenese benötigt werden, kam ein aus embryogenem Kallus von Apium graveolens gewonnener Extrakt zur Anwendung. Herstellung von Apium -Extrakt aus embryogenem Kallus 180 g Kallus auf 1 Liter Extrakt Gut proliferierender Kallus aus Apium graveolens wurde im Mörser zerkleinert, mit 96%igen Ethanol aufgenommen und mit H2O nachgespült. Der Kallusextrakt wurde im Becherglas unter Rühren auf 50-80°C für 30 min erwärmt, danach 2 h bei Raumtemperatur stehen gelassen. Nach vorsichtigem Abfiltrieren und Verdünnung auf ungefähr 30 Vol.-% Ethanol (180g Kallus/l), erfolgte die Sterilisation mittels Sterilfilter mit 20 µm Porengröße. Der sterile Apium -Extrakt wurde portioniert und eingefroren. Der Extrakt wurde vor Verwendung mit sterilem Osmosewasser verdünnt. BGB 3018 Tab.1: Vermehrungs- und Reifungsnährböden Kohlehydrate Phytohormone Mod. WPM Interne Bezeichnung 501 3 % Saccharose TDZ (hohe Konz.) Ergänzende Bestandteile - Mod. WPM 501 3 % Saccharose TDZ (hohe Konz.) 1,5 ml/Glas Nährboden Apium -Extrakt Mod. MS 505 3 % Glucose 2,4-D, TDZ - Mod. MS 505 3 % Glucose 2,4-D, TDZ 1,5 ml/Glas Apium -Extrakt Mod. MS 23 6 % Saccharose - - Mod. WPM 500var 6 % Saccharose TDZ - Mod. WPM 501var 6 % Saccharose TDZ (hohe Konz.) - Mod. WPM=Modifizierter Woody Plant Nährboden nach MC COWN & LLOYD (1981) Mod. MS=Modifizierter MURASHIGE & SKOOG Nährboden (1962) Ergebnisse Da es im Versuchsjahr 2005 nicht möglich war über Knospen bei Acer monspessulanum eine Mikrostecklingsvermehrung zu initiieren, wurde im Versuchsjahr 2006 an den Ausgangsexplantaten Kallus induziert, um in weiterer Folge Kalluslinien aufzubauen. Zielsetzung ist die indirekte Produktion von Pflänzchen über somatische Embryogenese oder Organogenese. Hierzu wurde 2006 versucht, den an Blattanlagen und Stängel gebildeten Kallus zu etablieren. Es konnte sowohl Kallus aus Blütenanlagen (induziert am Blattgewebe beim Typ 11) als auch Kallus aus vegetativen, durchgetriebenen (induziert an Blatt- und Stängelgewebe bei den Typen A1 und A11) und vegetativen ruhenden Knospen (induziert am verholzten Trieb beim Typ A11) etabliert werden. Beim Kallus aus ruhender Knospe (Typ 11) zeigte sich im Versuchsjahr 2005 das beste Wachstum auf den Nährböden 501PPM und 502PPM, während der Kallus aus Blütenanlagen (Typ 11) und vegetativen angetriebenen Knospen auf 502PPM und 505PPM eine ausreichende Proliferation aufwies. Im Versuchsjahr 2007 erfolgte eine Selektion der etablierten Kalluslinien. Diese erfolgte auf den Vermehrungsnährböden (501 und 505) mit beziehungsweise ohne Überschichtung von aus embryogenem Apium graveolens –Kallus gewonnenem Extrakt. Zu Beginn der Kallusinduktion bildete sich bei beiden Typen (A1 und A11) der Acer monspessulanum –Selektion ein harter, krümeliger Kallus der histologisch betrachtet keine Differenzierung aufwies, sondern aus kleinen, dichten Zellen bestand. BGB 3018 Allgemein betrachtet, kommt es in der pflanzlichen Gewebekultur bei der somatischen Embryogenese zur Entwicklung von Embryonen aus somatischen Zellen. Obwohl es zu keiner Ausbildung einer Zygote kommt, gibt es große Parallelen zwischen der zygotischen und somatischen Embryogenese. Damit es zur Ausbildung von somatischen Embryonen kommt, muss die Zelle ein embryogenes Potential besitzen, um die Umwandlung von einer somatischen in eine embryogene Zelle zu initiieren. Es muss ein Stress oder geeigneter Stimulus vorhanden sein, um diese Embryonalentwicklung auszulösen. Und schlussendlich spielt der Nährboden eine wichtige Rolle. Bei der Entwicklung somatischer Embryonen können folgende Stadien unterschieden werden: Globulär-, Herz-, Torpedo- und Kotyledonenstadium. Histologische Untersuchungen dazu, zeigen bipolare Strukturen mit isodiametrischen, meristematischen Zellen und langen vakuolisierten Zellen. Es sind sowohl Wurzel- als auch Sprossanlagen vorhanden. Im Gegensatz dazu wird bei der Organogenese nur ein Organ (Sprosse, Adventivknospen, Wurzeln) ausgebildet. Sprosse besitzen keine Wurzelanlagen, die Ausbildung von Adventivwurzeln kann mit oder ohne Auxin erfolgen. Eine weitere Kennzeichnung für die Organogenese ist die klare Verbindung zum Ausgangsgewebe, währenddessen bei der Embryogenese die Verbindung zum Ausgangsgewebe sehr dünn ist, sodass die somatischen Embryonen leicht isoliert werden können. Vergleicht man zygotische und somatische Embryonen miteinander, so besitzt der zygotische Embryo im Gegensatz zum somatischen Embryo, im reifen Zustand Endosperm und Samenschale. Bei Acer monspessulanum erfolgte zu Beginn der Selektion, in den einzelnen Subkulturen eine gezielte Selektion von weichem Kallus, der nur vereinzelt auftrat. Interessanterweise kam es zu Beginn jeder Subkultur teilweise zu einer starken Braunverfärbung des frisch kultivierten Kallus, in weiterer Folge jedoch zu einer Ausdifferenzierung neuer Kalluszellen. Beim Acer monspessulanum -Typ1 wurde bis dato keine Veränderung der Kallusmorphologie beobachtet. Im Vergleich dazu konnte beim Typ11 in den einzelnen Subkulturen eine deutliche Veränderung beobachtet werden. Neben den dichten Arealen, kam es zur Induktion eines lockeren, bräunlichen Kallus (Abb. 6). Histologische Untersuchungen zeigten eine Veränderung, indem neben den dichten Zellverbänden mit kleinen Zellen, länglichen Zellen auftraten. Um die morphologische Veränderung zu forcieren, wurde untersucht inwieweit die Überschichtung von embryogenem Kallusextrakt die Morphologie beeinflusst. Diese Technik wurde unter anderem bei der somatischen Embryogenese von Koniferen angewandt, indem das embryogene Potential schwach embryogener Zelllinien mithilfe einer „nurse culture“ aus stark embryogenen Linien, positiv beeinflusst wurden. Anhand wissenschaftlicher Untersuchungen konnte festgestellt werden, dass embryogene Zelllinien extrazelluläre Proteine (Arabinogalactane) produzieren, die für die somatische Embryogenese notwendig sind (EGERTSDOTTER & ARNOLD 1995). BGB 3018 An der HBLFA für Gartenbau wurde aus embryogenem Kallus von Apium graveolens ein Extrakt gewonnen und für diese Zwecke verwendet. Nach mehrmaliger Überschichtung mit 1,5 ml Apium Extrakt wurde folgende Beobachtung gemacht: Bei der Kalluslinie A.11(b) des Typs 11, induziert an einer ruhenden Knospe konnte auf dem Nährboden 501 eine deutliche Verbesserung der Kallusstruktur festgestellt werden. Während sich ohne Apium -Extrakt vorwiegend ein krümeliger Kallus ausbildete, kam es mit Apium –Extrakt, neben den krümeligen Arealen zur Ausbildung eines weichern Kallus mit länglichen, vakuolisierten Zellen und isodimetrischen, meristematischen Zellen (Abb. 1, 3, 5). Im Vergleich dazu zeigten die Kalluslinien A.11(a), A.11(c) induziert an Sprossexplantaten und A.11/7B induziert an Blattgewebe von Blüten, nach Überschichtung mit Apium -Extrakt keine Verbesserung. Es kam zum Absterben der Explantate, mit geringer, neuer Proliferation von Kalluszellen. Dieselbe Beobachtung wurde auch bei der Kalluslinie A.1c des Typs 1 gemacht. Beim ersten Reifungsversuch der Kalluslinien A.11(a), A.11(c) und A.11(b) des Acer monspessulanum –Typ 11 auf den Nährböden 23, 500var und 501var kam es zu keiner Ausbildung von somatischen Embryonen. Vielversprechende Ergebnisse zeigten sich in der 11. Subkultur bei den Kalluslinien A.11(a) und A.11(c), induziert an Sprossexplantaten auf dem Nährboden 505 (ohne Apium -Extrakt), wo es am grünen, krümeligen Kallus zur Ausbildung von Arealen mit weichem Kallus kam. Histologische Untersuchungen zeigten bipolare Strukturen mit langen Suspensorzellen und isodiametrischen, meristematischen Zellen, die auf die Bildung von Proembryonen hinweisen (Abb. 2, 4). BGB 3018 Abb. 1-6: Kallusgewebe induziert an ruhender Knospe des Acer monspessulanum –Typs 11 (6). Differenzierte Kalluszellen aus ruhender Knospe mit isodiametrischen, meristematischen Zellen (mit Carminessigsäure rot gefärbt) und länglichen, vakuolisierten Zellen (mit Evan´s Blue blau gefärbt) nach mehrmaliger Behandlung mit Apium -Extrakt (1, 3, 5). Kalluszellen aus Sprossexplantat (ohne Apium -Extrakt), mit langen Suspensorzellen, teilweise gebündelt und verbunden mit rot gefärbtem, meristematischen Zellen, die auf die Entwicklung von Proembryonen hinweisen (2, 4). BGB 3018 Zusammenfassung Bei der Acer monspessulanum –Selektion der HBLFA für Gartenbau wurden 2006 angetriebene und ruhende Knospen zur In-vitro-Etablierung verwendet. Zu Beginn der Kallusinduktion bildete sich bei den Typen A1 und A11 ein harter, krümeliger Kallus, der histologisch betrachtet keine Differenzierung aufwies, sondern aus kleinen, dichten Zellen bestand. In den Versuchsjahren 2006 und 2007 erfolgte in den einzelnen Subkulturen eine gezielte Selektion von weichem Kallus. Vielversprechende Ergebnisse zeigten sich in der 11. Subkultur bei den Kalluslinien A.11(a) und A.11(c) des Typs 11, wo sich am krümeligen Kallus, Areale mit weichem, embryogenen Kallus bildeten. Histologische Untersuchungen zeigten bipolare Strukturen mit langen Suspensorzellen und isodiametrischen, meristematischen Zellen, die auf die Entwicklung von Proembryonen hinweisen. Summary From the Acer monspessulanum selection of the HBLFA für Gartenbau (College for Horticulture and Landscape Design and Research Institutes) sprouting and dormant buds were used for in-vitro establishment in 2006. At the beginning of the callus induction a hard and crumbly callus developed on the types A1and A11, which did not have, from a histological point of view, any differentiations, but consisted of small, dense cells. In the trial years 2006 and 2007 a systematic selection from soft callus was carried out in the individual subcultures. In the eleventh subculture rather promising results could be seen on the callus lines A11 (a) and A11(c) of the type 11, in which areas of soft, embryogenous callus were formed from crumbly callus. Histological tests showed bipolar structures with long suspensor cells and isodiametric and meristematic cells which hint on the development of pre embryos. Literatur DURKOVIC, J., 2003: Regeneration of Acer caudatifolium Hayata plantlets from juvenile explants. Plant Cell Rep. 21(11):1060-4. EGERTSDOTTER, U., ARNOLD, S., 1995: Importance of arabinogalactan proteins for the development of somatic embryos of Norway spruce (Picea abies). Physiol. Plant. 93/2, 334-345. FERNÁNDEZ-LORENZO, J.L., IGLESIAS-DÍAZ, M.I., GUTIÉRREZ-ARAUJO, O., 2000: Micropropagation of a selected rootstock of Acer palmatum. ISHS Acta Horticulturae 536: XIVth International Symposium on Horticultural Economics. MCCOWN, B.H., LLOYD, G.B., 1981: Woody plant medium (WPM) – a mineral nutrient formulation for microculture of woody plant species. HortSci 16:453 (Abstr.) MURASHIGE, T. & F. SKOOG, 1962: A revised medium for rapid growth and bio-assays with tobacco tissue cultures. Physiol. Plant. 15: 473-497 BGB 3018