Das Periodensystem der Elemente (PSE)
Werbung
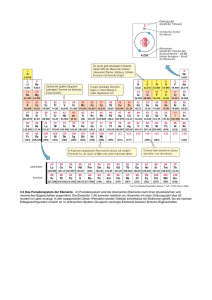
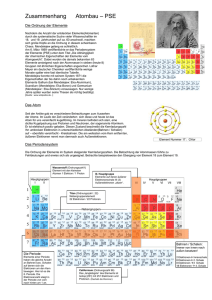
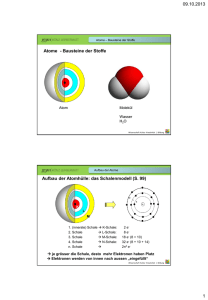
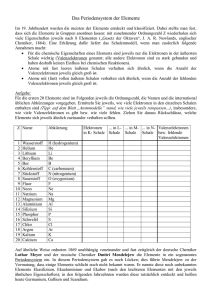
Das Periodensystem der Elemente (PSE) Unterrichtsfach Chemie Themenbereich/e Chemische Grundbegriffe; Periodensystem Schulstufe (Klasse) 8. (4.) Unterrichtseinsatz Erarbeitungsphase Sprachliche Kompetenzen Zeitbedarf Lesestrategien; Erarbeiten von Fachbegriffen und Sachtexten; eine Tabelle und einen zugehörigen Text in Beziehung setzen 1 Unterrichtseinheit Material- & Medienbedarf Kopierte Arbeitsvorlage; Lehrbuch der Klasse Sozialform/en Einzelarbeit; PartnerInnenarbeit Methodische Tools Geeignete Lesestrategien sollten bekannt sein Besondere Merkmale und Hinweise zur Durchführung Ersteller/in Langer IFSL-Arbeitsblätter für den sprachsensiblen Unterricht – Chemie © E. Langer 1/3 Das Periodensystem der Elemente (PSE) Leseübung (Einzelarbeit, dann Partnerarbeit) Im folgenden Text erfährst du etwas über die Anordnung der Elemente im Periodensystem. Überfliege den Text zunächst, um ungefähr zu wissen, worum es geht. (Lass dabei die Kästen mit den Fragen aus!) Danach liest du den Text abschnittsweise sorgfältig. Markiere dabei alle neuen Begriffe mit einem Textmarker. Bemühe dich, ihre Bedeutung aus dem Zusammenhang oder mithilfe deines ChemieBuchs zu verstehen. Löse auch die Aufgaben in den Kästen. Fasse dann den Inhalt des Textes in drei bis fünf Sätzen zusammen. Nun formulierst du zusammen mit einem Partner/einer Partnerin 6 Fragen, die ihr mithilfe des Textes beantworten könnt, und 3 Fragen, die sich ebenfalls auf den Text beziehen, auf die ihr aber keine Antwort wisst. Die Fragen aller SchülerInnen-Paare werden dann gesammelt und gemeinsam diskutiert. Im Periodensystem (PSE) werden die Elemente fortlaufend nummeriert mit der sogenannten Ordnungszahl. Die Ordnungszahl ist gleich der Anzahl der Protonen im Kern der betreffenden Atomsorte. Dadurch ergibt sich eine Ordnung nach der Größe der Atome. Die Ordnungszahl ist für die Atome eines jeden Elements eine charakteristische Kenngröße. Zusätzlich zur Ordnungszahl ist bei jedem Element auch seine "relative Atommasse" in der Einheit atomic units (u) angegeben. 1 unit entspricht ungefähr der Masse eines Protons. Diese Masse ist unvorstellbar klein1! Man kennt zur Zeit ca. 120 Elemente, aber nur jene bis zur Ordnungszahl 94 kommen in der Natur vor. Geht man im PSE von einem Element zu seinem Nachbarn, kommt im Kern ein Proton und in der Hülle ein Elektron dazu. Das erste Element (Wasserstoff, H) enthält ein Proton im Kern und ein Elektron in der Hülle. Die Zeilen des PSE heißen Perioden. Sie entsprechen den Schalen der Elektronenhülle. Die Periodennummer ist gleich der Nummer der äußersten Elektronenschale eines Elements. Silicium (14Si) steht in der 3. Periode. Gib die Anzahl der Elektro-nenschalen an! Si hat drei Elektronenschalen. Das Edelgas Krypton (36Kr) hat 4 Elektronenschalen. Gib an, in welcher Periode es steht! Kr steht in der vierten Periode. Bei den zwei Elementen der 1. Periode wird die erste Schale (K) zuerst mit einem und dann mit zwei Elektronen besetzt. Wir schreiben: 1H und 2He. Nenne die Namen der Elemente H und He: Sie heiße 1 n: Wasserstoff und 1 u = 0, 00000000000000000000000166 g IFSL-Arbeitsblätter für den sprachsensiblen Unterricht – Chemie © E. Langer 2/3 Helium. Damit ist die erste Schale gefüllt. In der 2. Periode stehen 8 Elemente mit den Ordnungszahlen 3 - 10. Bei ihnen wird die 2. Schale (L) der Reihe nach mit 1 – 8 Elektronen befüllt. Das letzte Element der Periode ist Neon (10Ne). Wie viele Protonen hat Ne im Kern? Wie viele Elektronen hat es insgesamt in der Hülle? Wie viele Elektronen sind in der ersten, wie viele in der 2. Schale? Zeichne rechts eine Skizze des Neon Atoms! Bei den 8 Elementen der 3. Periode (Natrium, Na bis Argon, Ar) wird die 3. Schale (M) mit 8 Elektronen befüllt. Gib an, wie viele Elektronen Schwefel (16S) in der 3. Schale hat. Es sind sechs Elektron en. Die Spalten des PSE nennt man Gruppen. Alle Elemente einer Gruppe haben gleich viele Elektronen in der jeweils äußersten Schale, d. h. also gleich viele Valenzelektronen. Die Zahl der Valenzelektronen beträgt für alle Elemente der 1. Gruppe: 1, der 2. Gruppe: 2, der 13. Gruppe: 3 usw.; d. h. alle Elemente der 18. Gruppe haben 8 Valenzelektronen. Bei den Elementen der 3. bis 12. Gruppe bleibt die Zahl der Valenz-elektronen (meist) bei 2 stehen. Zwar kommt auch hier von einem Element zu seinem Nachbarn immer ein Proton und ein Elektron hinzu, aber diese Elektronen finden auf weiter innen gelegenen Elektronenschalen Platz, sie sind also keine Valenzelektronen. Die Elemente einer Gruppe bilden eine Familie, sie haben ähnliche chemische Eigenschaften, denn diese hängen von der Zahl der Valenzelktronen ab. Manche dieser Gruppen haben auch „Familiennamen“. Die Elemente der 1. Gruppe (außer H) heißen z. B. „Alkalimetalle“ und jene der 18. Gruppe „Edelgase“. IFSL-Arbeitsblätter für den sprachsensiblen Unterricht – Chemie © E. Langer 3/3