9. Klasse
Werbung

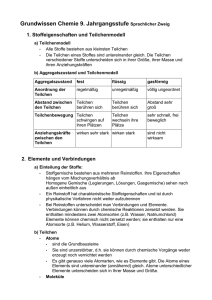
Grundwissen Chemie 9. Jahrgangsstufe Sprachlicher Zweig 1. Stoffeigenschaften und Teilchenmodell a) Teilchenmodell • Alle Stoffe bestehen aus kleinsten Teilchen • Die Teilchen eines Stoffes sind untereinander gleich. Die Teilchen verschiedener Stoffe unterscheiden sich in ihrer Größe, ihrer Masse und ihren Anziehungskräften b) Aggregatszustand und Teilchenmodell Aggregatszustand fest flüssig gasförmig Anordnung der Teilchen regelmäßig unregelmäßig völlig ungeordnet Abstand zwischen den Teilchen Teilchen berühren sich Teilchen berühren sich Abstand sehr groß Teilchen wechseln ihre Plätze sehr schnell, frei beweglich Teilchenbewegung Teilchen schwingen auf ihren Plätzen Anziehungskräfte zwischen den Teilchen wirken sehr stark wirken stark sind nicht wirksam 2. Elemente und Verbindungen a) Einteilung der Stoffe: • Stoffgemische bestehen aus mehreren Reinstoffen. Ihre Eigenschaften hängen vom Mischungsverhältnis ab Homogene Gemische (Legierungen, Lösungen, Gasgemische) sehen nach außen einheitlich aus • Ein Reinstoff hat charakteristische Stoffeigenschaften und ist durch physikalische Verfahren nicht weiter aufzutrennen • Bei Reinstoffen unterscheidet man Verbindungen und Elemente. Verbindungen können durch chemische Reaktionen zersetzt werden. Sie enthalten mindestens zwei Atomsorten (z.B. Wasser, Natriumchlorid) Elemente können chemisch nicht zersetzt werden; sie enthalten nur eine Atomsorte (z.B. Helium, Wasserstoff, Eisen) b) Teilchen • Atome • sind die Grundbausteine • Sie sind unzerstörbar, d.h. sie können durch chemische Vorgänge weder erzeugt noch vernichtet werden • Es gibt genauso viele Atomarten, wie es Elemente gibt. Die Atome eines Elements sind untereinander (annähernd) gleich. Atome unterschiedlicher Elemente unterscheiden sich in Ihrer Masse und Größe. • • Moleküle sind Molekülverbände d.h. sie bestehen aus mehreren Atomen Ionen • sind elektrisch geladene Teilchen. Man unterscheidet • Kationen (positiv geladene Teilchen) und • Anionen (negativ geladene Teilchen) • Außerdem unterscheidet man zwischen Atom- und Molekülionen 3. Chemische Reaktionen und Energie a) Chemische Reaktion Eine chemische Reaktion ist eine Umgruppierung von Atomen. Dabei werden Edukte (Ausgangsstoffe) verbraucht und Produkte (Endstoffe) gebildet. Mit chemischen Reaktionen ist ein Energieumsatz verbunden b) Reaktionsenergie • Bei jeder chemischen Reaktion ändert sich die Innere Energie der beteiligten Stoffe. Die Differenz zwischen der Inneren Energie der Produkte und der Inneren Energie der Edukte heißt Reaktionsenergie. • Bei exothermen Reaktionen ist die Innere Energie der Produkte niedriger als die der Edukte; die Reaktionsenergie ist negativ • Bei endothermen Reaktionen ist die Innere Energie der Produkte höher als die der Edukte; die Reaktionsenergie ist positiv c) Energiediagramm exotherme Reaktion: endotherme Reaktion: d) Aktivierungsenergie Die zum Auslösen einer chemischen Reaktion benötigte Energie bezeichnet man als Aktivierungsenergie e) Katalysator • Ein Katalysator ist ein Stoff, der den Ablauf einer chemischen Reaktion so ändert, dass die Aktivierungsenergie geringer ist. • Dadurch wird die Reaktion beschleunigt • Der Katalysator liegt nach der Reaktion unverändert vor 4. Die chemische Formelsprache a) Elementsymbole stehen • für die Atomart der betreffenden Elemente oder • für ein Atom eines Elements, z.B. Cu (Kupfer) oder Fe (Eisen) b) Chemische Formel • Molekülformeln (z.B. H2O) geben an, wie viele Atome welcher Art das Molekül enthält • Verhältnisformeln (z.B. NaCl) geben das Atomanzahlverhältnis der beteiligten Elemente an • Indizes gelten nur für das in der Formel davor stehende Element c) Reaktionsgleichung • Ein Reaktionsschema beschreibt eine chemische Reaktion durch die Namen der Edukte und Produkte z.B. Kupfer + Jod → Kupferiodid • Eine Reaktionsgleichung beschreibt eine chemischen Reaktion durch Formeln und Koeffizienten • Die Koeffizienten beschreiben das Mengenverhältnis, in dem die Stoffe miteinander reagieren z.B. 2 Cu (s) + I2 (g) → 2 CuI (s); exotherm d) Wertigkeit • Unter der Wertigkeit eines Atoms versteht man die Anzahl der WasserstoffAtome, die dieses Atom, in einer Verbindung bindet oder ersetzt • Wasserstoffatome sind immer einwertig • Sauerstoffatomen sind fast immer zweiwertig • In binären Verbindungen ist das Produkt aus Index und Wertigkeit für beide Atomsorten gleich. Beispiel: Im Kohlenstoffdioxid sind vierwertige Kohlenstoffatome und Sauerstoffatome verbunden. Daraus ergibt sich die Formel CO 2 5. Atombau und Periodensystem a) Atombau • Ein Atom besteht aus Atomkern und Atomhülle • Der Kern ist positiv geladen und enthält fast die gesamte Masse des Atoms • Die Atomhülle enthält die negativ geladenen Elektronen b) Bau des Atomkerns • Der Atomkern besteht aus Protonen und Neutronen • Unterscheiden sich die Atome eines Elementes in der Neutronenzahl und damit in ihrer Masse, handelt es sich um Isotope c) Aufbau der Atomhülle • Die Atomhülle ist in Energiestufen gegliedert, die als Schalen veranschaulicht werden können • Für die maximale Anzahl z an Elektronen pro Schale gilt die Gleichung z = 2n² (n = Energiestufe) • Die Verteilung der Elektronen eines Atoms auf die verschiedenen Energiestufen bezeichnet man als Elektronenkonfiguration des Atoms • Die Elektronen der äußeren Schale bezeichnet man als Außen- oder Valenzelektronen; sie bestimmen das chemische Verhalten der Elemente d) Periodensystem (PSE) • Im PSE sind die Elemente nach steigender Kernladungszahl ( = Ordnungszahl) angeordnet • Die (waagrechten) Zeilen im PSE sind die Perioden (Periodennummer= Zahl der besetzten Energiestufen • Die (senkrechten) Spalten im PSE sind die Gruppen (Gruppennummer= Zahl der Valenzelektronen • Ordnungszahl= Zahl der Protonen = Zahl der Elektronen e) Elementfamilien • Alkalimetalle (I. Hauptgruppe) sind reaktionsfreudige Leichtmetalle mit niedrigen Schmelztemperaturen und geringer Härte • Halogene (VII. Hauptgruppe) sind reaktionsfreudige Nichtmetalle, die aus zweiatomigen Moleküle bestehen • Edelgase (VIII. Hauptgruppe) kommen als einzelne, unverbundene Atome vor und gehen praktisch keine Verbindungen ein. Helium besitzt zwei, die anderen Edelgase acht Valenzelektronen („Elektronenoktett“) f) Oktettregel • In den meisten Verbindungen nehmen die Atome die Elektronenkonfiguration der Edelgasatome an, so dass sie auf der äußeren Schale acht (bzw. auf der ersten Schale zwei) Elektronen haben • Metallatome geben bei Reaktionen mit Nichtmetallatomen Elektronen ab und werden zu Kationen. Metallatome sind Elektronendonatoren • Nichtmetallatome nehmen bei chemischen Reaktionen mit Metallatomen Elektronen auf und werden so zu Anionen. Nichtmetallatome sind Elektronenakzeptoren 6. Chemische Bindungsarten Bindungstyp Ionenbindung Atombindung Metallbindung Bindungspartner Metall + Nichtmetall Nichtmetall + Nichtmetall Metalle Art der Teilchen Kationen + Anionen Moleküle Atomrümpfe (Kationen) + frei bewegliche Elektronen Bindung durch elektrostatische Anziehung Gemeinsame Elektronenzwischen Kationen und paare Anionen elektrostatische Anziehung zwischen Atomrümpfen und Elektronen Name des Verbandes Ionengitter Molekül Metallgitter Fixpunkte meist sehr hoch meist niedrig meist hoch Aggregatszustand fest bei Raumtemperatur fest, flüssig oder gasförmig fest (Ausnahme: Quecksilber) Verformbarkeit hart und spröde unterschiedlich meist gut verformbar Elektrische Leitfähigkeit Leiter 2. Klasse d.h. leiten Nichtleiter als Schmelze oder Lösung Leiter 1. Klasse d.h. leiten auch in festem Zustand 7. Valenzstrichformeln (Lewis-Formel) a) durch sie werden die Valenzelektronen eines Atoms bzw. in einem Molekül dargestellt b) Regeln zum Erstellen von Valenzstrichformeln • Ein Punkt stellt ein Elektron dar, ein Strich zwei Elektronen (ein Elektronenpaar) • Die Atomsorte, die im Molekül am seltensten vorkommt, steht meist in der Mitte, die anderen Atome sind möglichst symmetrisch darum angeordnet • Die Zahl der bindenden Elektronenpaare berechnet man so: Man berechnet die Zahl der Valenzelektronen, die benötigt würden, wenn jedes Atom einzeln Edelgaskonfiguration erreichen sollte; davon zieht man die Zahl der vorhandenen Valenzelektronen ab: Die Differenz ergibt die Zahl der bindenden Elektronen, alle anderen Valenzelektronen sind nicht bindend. • Ein Wasserstoff-Atom ist immer einbindig • Bei den Atomen der zweiten Periode darf auf keinen Fall das Elektronenoktett überschritten werden • Besonders bei den Atomen der zweiten Periode kommen auch Mehrfachbindungen (Doppel- und Dreifachbindungen) vor 9. Die Stoffmenge a) Definition 1 Mol ist die Stoffportion, die 6,022 x 1023 Teilchen eines Stoffes enthält b) Molare Größen • Die Stoffmenge n hat die Einheit mol • Die molare Masse M ist die Masse von 1 mol eines Stoffes M=m/n • Die molare Masse hat den gleichen Zahlenwert wie die Molekül- oder Formelmasse, aber statt der Einheit u die Einheit g/mol • Das molare Volumen ist für alle Gase gleich und beträgt bei Normalbedingungen 22,4 l/mol