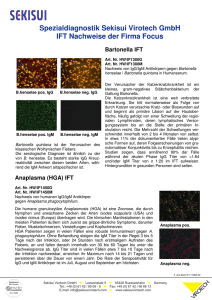
Bartonella IFA IgG (OUS)
Werbung

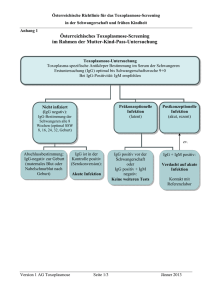
Bartonella IFA IgG (Auf Deutsch) REF IF1300G Rev. K Indirekter Immunfluoreszenztest (IFA) zum Nachweis humaner IgG Antikörper gegen Bartonella Infektionen Diese Packungsbeilage ist nur für den Export und nicht für den Vertrieb in den USA. Außerhalb der Vereinigten Staaten: Für die in vitro-Diagnostik ANWENDUNGSBEREICH Der Bartonella-Indirekte Immunfluoreszenz Assay (IFA) von Focus Diagnostics ist für die Hilfe bei der klinischen Diagnose von Bartonella Infektionen bestimmt. Das Produkt verwendet Vero Zellen, die entweder mit B. henselae oder mit B. quintana infiziert wurden, als individuelles Substrat, um einen semiquantitativen Nachweis humaner IgG Serumantikörper gegen Bartonella zu ermöglichen. ZUSAMMENFASSUNG UND ERLÄUTERUNG DES TESTVERFAHRENS Bis vor kurzem gab es keine endgültige Anwort auf die Frage nach dem etiologischen Verursacher der Katzenkratzkrankheit (cat scratch disease; CSD). Mehrere mutmaßliche Verursacher wurden mit der Krankheit in Verbindung gebracht, darunter Chlamydia sp. und Afipia felis. Heute ist allgemein anerkannt, dass der tatsächliche Verursacher der CSD ein kleines, gram-negatives Stäbchenbakterium der Gattung Bartonella (früher Rochalimaea) ist1. Die Katzenkratzkrankheit ist eine weit verbreitete Erkrankung (0.77 bis 0.86 Fälle in einer Population von 100,000) und betrifft jährlich 22,000 Menschen in den USA2,3. Die Mehrzahl der gemeldeten Fälle traten normalerweise bei männlichen Personen im Alter von unter 20 Jahren auf. Im Herbst und Winter werden die meisten Fälle gemeldet4. CSD tritt normalerweise als Folge von durch Katzen verursachten Kratz- oder Bisswunden auf und beginnt als primäre Läsion auf der Hautoberfläche, häufig gefolgt von einer Schwellung der regionalen Lymphknoten, deren lymphatisches Versorgungssystem bis an die Stelle der primären Inokulation reicht. Die Mehrzahl der Schwellungen verschwinden innerhalb von 2 bis 4 Monaten von selbst5. In etwa 11% der dokumentierten Fälle treten atypische Formen der CSD auf6. Granulomatöse Konjunktivitis, okuloglandulares Syndrom, Tonsillitis, viszerale granulomatöse Erkrankungen, Enzephalitis und zerebrale Arthritis sind die häufigsten Folgeerscheinungen in diesen Patienten6. In immunsupprimierten Personen ist B. henselae am häufigsten mit der klassischen CSD, bazilläre Angiomatose und Leberblutungen assoziiert7. Traditionell wurde die Diagnose aufgrund des Vorliegens von durch Katzen hervorgerufene Kratz- oder Bisswunden, durch den Nachweis des Organismus im Gewebe durch die Warthin-Starry-Silberfärbung oder durch positive Haut-Tests gestellt. Es ist nun möglich, einen Verdacht auf CSD serologisch zu bestätigen4. Studien zeigen, dass annähernd 90% der Fälle während der akuten Phase IgG Titer von >1:64 und/oder IgM Titer von ≥ 1:20 im IFA aufweisen8. Hintergrundtiter in gesunden Personen sind selten1. Kürzlich erregte eine andere Art der Gattung Bartonella, B. quintana, erneutes Interesse. Dieser Organismus ist der Verursacher des klassischen Wolhynischen Fiebers9. Heute wird vermutet, dass B. quintana an der Entwicklung akuter Endokarditis und bazillärer Angiomatose bei HIV-positiven Patienten beteiligt ist10,11. Die serologische Diagnose von B. quintana ist ähnlich zu der von B. henselae. Es besteht starke IgG Kreuzreaktivität zwischen diesen beiden Arten, während die IgM Antwort artspezifischer ist. Kann nur IgG nachgewiesen werden, ist daher die Differenzierung zwischen B. henselae und B. quintana typischerweise nicht möglich. In diesen Fällen ist es notwendig, Folgeseren zu untersuchen oder die klinische Symptome des Patienten zur Differenzierung heranzuziehen. Die primäre Immunantwort gegen Bartonella sind IgM Antikörper, die zu einem frühen Zeitpunkt während der Infektion auftreten und deren Nachweis hochdiagnostisch ist. Die IgG Antwort folgt der IgM Antwort in unmittelbarer Weise. Da die IgG Antwort eine ausgedehnte Kreuzreaktivität zwischen den Arten aufweist, müssen die Ergebnisse mit Vorsicht interpretiert werden. Ein Bartonella IFA Objektträger von Focus Diagnostics enthält sowohl B. henselae als auch B. quintana. Liegt das beschichtete Ende des Objektträgers auf der linken Seite, so erscheint beim Blick durch das Mikroskop B. quintana auf der linken und B. henselae auf der rechten Seite. DAS TESTPRINZIP Der indirekte Immunfluoreszenz-Antikörper (IFA) Assay ist ein Zwei-Schritt-Verfahren, ein sogenanntes Sandwich. Im ersten Schritt werden Patientenseren in PBS, welches 10% normales Ziegenserum (NZS) enthält, verdünnt. Das NZS blockiert unspezifische Bindung und reduziert so unerwünschte Hintergrundfärbung. Die verdünnten Seren werden auf die einzelnen Reaktionsfelder pipettiert und zur Erkennung und Reaktion mit dem Substrat inkubiert. Im Anschluss an die Inkubation, wird der Objektträger in phosphatgepufferter Salzlösung gewaschen, um ungebundene Serumantikörper zu entfernen. Im zweiten Schritt wird jedes Antigen-Reaktionsfeld mit fluoreszein-markierten Antikörpern gegen humanes IgG inkubiert. Auf diese Weise können Antigen-AntikörperKomplexe mit fluoreszein-markiertem Anti-IgG reagieren. Nachdem die Objektträger gewaschen, getrocknet und eingedeckt sind, können sie im Fluoreszenzmikroskop untersucht werden. Im Falle einer positiven Reaktion erscheinen die Bakterien hell und apfelgrün leuchtend. Halb-quantitative Endtiter der positiven Proben werden in einer seriellen Verdünnungsreihe bestimmt. GELIEFERTES MATERIAL Der Testkit von Focus Diagnostics beinhaltet genügend Material für die Durchführung von 80 Bestimmungen. Bartonella IFA IgG Substratobjektträger REF IF1301 Ag Bartonella IgG Substrate Slide Zehn Objektträger mit jeweils acht Reaktionsfeldern. Jedes Feld enthält 2 einzelne Antigenerkennungsstellen mit infizierten Verozellen. Verschlossene Packungen bei 2 bis 8°C aufbewahren. Die verschlossenen Objektträger sind bis zum Datum auf dem Packungsetikett haltbar. Zur Vermeidung von Kondensation, die Objektträger vor dem Öffnen der Packung auf Raumtemperatur erwärmen lassen. Bartonella IFA IgG Seite 2 Hinweis: Die meisten Fluoreszensmikroskope erzeugen ein seitenverkehrtes Abbild des Objektträgers. Bei der Darstellung im Mikroskop erscheinen die Antigene in umgekehrter Reihenfolge wie unten abgebildet. IgG Konjugat Duale Spezies, 3.5mL REF IF0011 CONJ IgG IgG Conjugate-Dual Species Ein Fläschchen mit einem Gemisch aus fluoreszein-markiertem Ziegen-Anti-Human-IgG, γ-kettenspezifisch, und fluoreszein-markierten Ziegen-Anti-Maus-IgG. Anti-Maus-IgG wurde als Kontrolle der spezifischen Antigenreaktion standardisiert. Enthält Evans-Blue Gegenfärbelösung, Proteinstabilisator und Konservierungsmittel. Sofort verwendbar. Stabil bei 2 bis 8°C bis zum Verfallsdatum auf dem Packungsetikett. Nicht verwenden bei Verfärbung, Eintrübung oder anderen Anzeichen einer bakteriellen Kontamination. Bartonella Polyvalente Nachweisbare Kontrolle, 0.30mL REF IF1314 CONTROL > Bartonella Polyvalent Detectable Control Ein Fläschchen mit Mausserum, unverdünnt verwendbar. Enthält Konservierungsmittel. Stabil bei 2–8°C bis zum Verfallsdatum auf dem Packungsetikett. Nicht verwenden bei Verfärbung, Eintrübung oder anderen Anzeichen einer bakteriellen Kontamination. Vor Gebrauch auf Raumtemperatur erwärmen lassen. Bartonella Nicht Nachweisbare Kontrolle, 0.25mL REF IF1313 CONTROL < Bartonella Non-Detectable Control Ein Fläschchen mit Humanserum, unverdünnt verwendbar. Enthält Konservierungsmittel. Stabil bei 2–8°C bis zum Verfallsdatum auf dem Packungsetikett. Nicht verwenden bei Verfärbung, Eintrübung oder anderen Anzeichen einer bakteriellen Kontamination. Vor Gebrauch auf Raumtemperatur erwärmen lassen. Nicht verdünnen. Wiederholtes Einfrieren und Auftauen beeinträchtigt die Qualität des Produkts und sollte vermieden werden. Bartonella IFA IgG Verdünnungspuffer (10X), 6 mL REF IF1316 DIL IgG 10X Bartonella IgG Sample Diluent Ein Fläschchen mit Konzentrat auf Proteinbasis für den IgG Test. Enthält Konservierungsmittel. Stabil bei 2 - 8°C bis zum Verfallsdatum auf dem Packungsetikett. Vor Gebrauch auf Raumtemperatur erwärmen lassen. Zur Herstellung einer 1X Arbeitslösung des IgG Verdünnungspuffers, 1 Volumenteil Bartonella IFA IgG Verdünnungspuffer (10X) mit 9 Volumenteilen PBS mischen. Eindeckmedium, 2.5mL REF IF0007 REAG MONT Mounting Medium Eine Tropfenspenderflasche mit phosphatgepuffertem Glycerin, pH 7,2 ± 0.1. Enthält Konservierungsmittel. Bei 2 bis 8°C bis zum auf dem Packungsetikett angegebenen Datum haltbar. Vor Gebrauch auf Raumtemperatur erwärmen lassen. PBS REF IF0005 BUF PBS Ein Fläschchen mit gepufferter Salzlösung in Pulverform. In 1L destilliertem (oder gereinigtem) Wasser auflösen. Die Lösung ist 0,01 M mit einem pH von 7,2 ± 0,1. PBS vor und nach dem Auflösen bei 2 bis 8°C aufbewahren. Vor Gebrauch auf Raumtemperatur erwärmen lassen. Nicht verwenden bei Eintrübung, Einfärbung oder anderen Anzeichen einer bakteriellen Kontamination. BENÖTIGTE MATERIALIEN, DIE NICHT IM LIEFERUMFANG ENTHALTEN SIND 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 24 X 50mm Deckgläser Teströhrchen und Gestell, Mikrozentrifugenröhrchen oder Mikrotiterplatte zur Herstellung von Serumverdünnungen. Klinische Zentrifuge 35 bis 37°C Inkubator oder Wasserbad zur Inkubation der Objektträger 2 bis 8°C Kühlschrank Spülflasche aus Plastik Kalibrierte Pipetten oder Pipettoren mit Einwegspitzen Coplingefäß oder Färbebesteck mit Objektträgerhalter Saubere Reagenzbecher oder geeichte Zylinder , 1 Liter Feuchte Kammer zur Inkubation der Objektträger Destilliertes (oder gereinigtes)Wasser Stoppuhr Absorbierendes Papier zum Abtupfen der Objektträger Fluoreszenzmikroskop; empfohlene Parameter: Exzitationsfilter 470-490nm Barrierenfilter 520-560nm Lichtquelle HBO 100W, Hg Objektiv 20-40X, Fluoreszenz, hoch trocken Bartonella IFA IgG Seite 3 WARNUNGEN UND SICHERHEITSVORKEHRUNGEN 1. 2. 3. 4. 5. 6. 7. 8. 9. Diese Packungsbeilage ist nur für den Export und nicht für den Vertrieb in den USA. Außerhalb der USA ist dieser Kit für den diagnostischen Gebrauch in vitro bestimmt. Alle Blutprodukte sollten als potentiell infektiös angesehen werden. Das Ursprungsmaterial dieses Produktes (einschließlich der Nicht Nachweisbare Kontrollen), ist mit US-FDA- anerkannten Methoden auf HBs-Antigen, Hepatitis C-Antikörper und HIV-1/2 (AIDS) Antikörper untersucht und für negativ befunden worden. Dennoch gewährleistet keine der bekannten Testmethoden absolute Garantie dafür, daß Produkte, die aus menschlichem Blut gewonnen wurden, die genannten oder andere infektiöse Krankheiten nicht übertragen können. Alle Kontrollen, Serumproben und Geräte, die in Kontakt mit den Proben kommen, sollten daher als potentiell infektiös angesehen und durch entsprechende Sicherheitsmaßnahmen dekontaminiert oder beseitigt werden. CDC und die nationalen Institute der Gesundheit empfehlen, daß möglicherweise ansteckende Mittel auf dem Biosafety Niveau 2 angefaßt werden.12,13 Evans-Blau ist potenziell krebserregend. Die Konzentration dieses Produkts liegt jedoch unter dem meldepflichtigen Grenzwert von weniger als 0,1%. Reagenzien nicht durch Komponenten anderer Packungen oder durch Reagenzien anderer Hersteller ersetzen. Nur die Protokolle auf diesem Beipackzettel verwenden. Veränderung der angegebenen Inkubationszeiten oder Temperaturen kann zu einer Verfälschung der Testergebnisse führen. Kreuzkontaminationen von Patientenproben auf den Objektträgern können zu einer Verfälschung der Testergebnisse führen. Patientenproben daher vorsichtig auf die Objektträger auftragen, um ein Zusammenmischen von Seren benachbarter Reaktionsfelder zu vermeiden. Bakterielle Kontamination von Serumproben oder Reagenzien kann zu einer Verfälschung der Testergebnisse führen. Zur Vermeidung von Kontamination sterile Arbeitstechniken benutzen. Dieser Kit und seine Bestandteile wurden speziell für die Bestimmung von IgG konzipiert. Den Kit und seine Bestandteile nicht zur Bestimmung von IgM verwenden. Der Eindeckmedium enthält 30 bis 60 % Glycerin, welches bei Inhalation oder Hautkontakt zu Reizungen führen kann. Nach Inhalation oder Berührung sollten Erste-Hilfe-Maßnahmen eingeleitet werden.. HALTBARKEITSDAUER UND HANDHABUNG DER KITS 1. 2. 3. Alle Komponenten sind stabil bis zum Monatsende des Verfalldatums bei einer Lagerung bei 2 bis 8°C. Testausrüstung und deren Bestandteile nur bis Ablauf des Verfalldatums verwenden. Reagenzien während der Lagerung oder Inkubation vor starkem Lichteinfall schützen. PROBENENTNAHME UND VORBEREITUNG Serum ist die bevorzugte Probenquelle. Es wurde nicht untersucht, ob auch andere Proben mit diesem Test untersucht werden können. Hyperlipaemische, hämolysierte, hitzeinaktivierte oder kontaminierte Seren können zu einer Verfälschung der Testergebnisse führen und ihr Gebrauch sollte daher vermieden werden. Probenentnahme und Handhabung Blutproben aseptisch unter Anwendung standardisierter Blutabnahme-Techniken entnehmen12. Vor dem Zentrifugieren bei Raumtemperatur koagulieren lassen. Sterile Abnahme des Serums in einem fest verschließbaren, sterilen Behälter für die Lagerung bei +2 bis +8 Grad Celsius. Kann der Test erst nach mehr als 5 Tagen durchgeführt werden, sollten die Proben bei mindestens -20 Grad Celsius eingefroren und erst kurz vor Gebrauch wieder aufgetaut und gut durchmischt werden. In Gefrieranlagen mit automatischer Abtauvorrichtung kann es durch wiederholtes Abtauen und Einfrieren zu einer Beeinträchtigung der Proben kommen. Probenvorbereitung Die Screening-Verdünnung der Proben ist 1:64 in der 1X Arbeitslösung des IgG Verdünnungspuffers (siehe Geliefertes Material, oben). Für die Herstellung einer seriellen Verdünnungsreihe der vorbehandelten Screening-Verdünnungen zur Bestimmung des Endtiters PBS verwenden. DAS TESTVERFAHREN (Bei 37ºC inkubieren) 1. 2. Objektträger aus dem Kühlschrank nehmen und vor dem Öffnen der Packung Raumtemperatur annehmen lassen, um Kondensation zu vermeiden. 20µL der gebrauchsfertigen Nachweisbare Kontrolle auf das vorgesehene Reaktionsfeld geben. Nachweisbare Kontrolle nicht verdünnen. Wird eine Kontrolle mit Fluoreszenzintensität von 1+ erwünscht, PBS zur Verdünnung der Nachweisbare Kontrolle verwenden (siehe Qualitätskontrolle, unten). 20μL jeder Verdünnung in das dafür vorgesehene Reaktionsfeld geben. 3. 20µL der gebrauchsfertigen Nicht Nachweisbare Kontrolle auf das vorgesehene Reaktionsfeld geben. 4. 20µL der verdünnten Serumproben (siehe Probenvorbehandlung, oben) auf die vorgesehenen Reaktionsfelder geben. Zur besseren Identifikation beim Ablesen der Ergebnisse Auftragsreihenfolge markieren. 5. Objektträger in einer feuchten Kammer für 30 ± 2 Minuten bei 35 bis 37°C inkubieren. 6. Objektträger aus der feuchten Kammer entfernen und die Reihen einzeln vorsichtig mit PBS spülen. Dabei nicht direkt auf die Reaktionsfelder zielen. Objektträger durch Eintauchen in Coplingefäß oder Färbetrog mit PBS für 10 Minuten waschen. 7. Gewaschene Objektträger kurz in destilliertem (oder gereinigtem) Wasser waschen und an der Luft trocknen. 8. Ungefähr 20µL IgG Konjugat auf jedes Reaktionsfeld geben. 9. Objektträger in einer feuchten Kammer für 30 ± 2 Minuten bei 35 bis 37°C inkubieren. 10. Waschschritte 6 und 7 wiederholen. 11. Einige Topfen Eindeckmedium auf die Objektträger auftropfen und mit einem Deckglas (24 x 50 mm) eindecken. Luftblasen absaugen und überschüssiges Eindeckmedium abtupfen. 12. Reaktionsfelder bei 400-facher Vergrößerung mit einem Fluoreszenzmikroskop untersuchen. Für optimale Fluoreszenz, die Objektträger am selben Tag untersuchen; ansonsten im Dunkeln bei 2 bis 8 °C bis zu 24 Stunden aufbewahren. DAS TESTVERFAHREN (Bei Raumtemperatur inkubieren) 1. 2. 3. 4. 5. 6. Objektträger aus dem Kühlschrank nehmen und vor dem Öffnen der Packung Raumtemperatur annehmen lassen, um Kondensation zu vermeiden. 20µL der gebrauchsfertigen Nachweisbare Kontrolle auf das vorgesehene Reaktionsfeld geben. Nachweisbare Kontrolle nicht verdünnen. Wird eine Kontrolle mit Fluoreszenzintensität von 1+ erwünscht, PBS zur Verdünnung der Nachweisbare Kontrolle verwenden (siehe Qualitätskontrolle, unten). 20μL jeder Verdünnung in das dafür vorgesehene Reaktionsfeld geben. 20µL der gebrauchsfertigen Nicht Nachweisbare Kontrolle auf das vorgesehene Reaktionsfeld geben. 20µL der verdünnten Serumproben (siehe Probenvorbehandlung, oben) auf die vorgesehenen Reaktionsfelder geben. Zur besseren Identifikation beim Ablesen der Ergebnisse Auftragsreihenfolge markieren. Objektträger abgedeckt für 60 ± 2 Minuten bei Raumtemperatur inkubieren. Objektträger aus der feuchten Kammer entfernen und die Reihen einzeln vorsichtig mit PBS spülen. Dabei nicht direkt auf die Reaktionsfelder zielen. Objektträger durch Eintauchen in Coplingefäß oder Färbetrog mit PBS für 10 Minuten waschen. Bartonella IFA IgG Seite 4 7. Gewaschene Objektträger kurz in destilliertem (oder gereinigtem) Wasser waschen und an der Luft trocknen. Hinweis: Bei Gebrauch einer automatischen Waschvorrichtung ist es ggf. nicht möglich, die Objektträger vor Zugabe des Konjugates lufttrocknen zu lassen. 8. Ungefähr 20µL IgG Konjugat auf jedes Reaktionsfeld geben. 9. Objektträger abgedeckt für 30 ± 2 Minuten bei Raumtemperatur inkubieren. 10. Waschschritte 6 und 7 wiederholen. 11. Einige Topfen Eindeckmedium auf die Objektträger auftropfen und mit einem Deckglas (24 x 50 mm) eindecken. Luftblasen absaugen und überschüssiges Eindeckmedium abtupfen. 12. Reaktionsfelder bei 400-facher Vergrößerung mit einem Fluoreszenzmikroskop untersuchen. Für optimale Fluoreszenz, die Objektträger am selben Tag untersuchen; ansonsten im Dunkeln bei 2 bis 8 °C bis zu 24 Stunden aufbewahren. QUALITÄTSKONTROLLE Jedes Mal, wenn ein oder mehrere Objektträger benutzt werden, sollten sowohl Nachweisbare - als auch Nicht Nachweisbare Kontrolle enthalten sein. 1. 2. 3. Die gebrauchsfertige (unverdünnte) Nachweisbare Kontrolle sollte auf den Antigenreaktionsfeldern mit B. quintana und B. henselae eine 3 bis 4+ Fluoreszenz aufweisen. Wird eine Kontrolle mit der Auswertung 1+ gewünscht, die Nachweisbare Kontrolle (siehe Das Testverfahren, oben) 1:8 verdünnen und mit B. quintana vergleichen. Aufgrund von Unterschieden in den Labors und der verwendeten Ausrüstung kann die 1+ Kontrolle sich um ± 1 zweifache Verdünnung unterscheiden. Die Nicht Nachweisbare Kontrolle sollte in keinem Reaktionsfeld eine Reaktion aufweisen. Weichen die Ergebnisse der Kontrollen von diesen Angaben ab, sollten die Patiententests als ungültig betrachtet und der Test wiederholt werden. INTERPRETATION DER TESTERGEBNISSE Die Intensität der Fluoreszenz und des Endtiters werden durch die Art und optische Beschaffenheit des Mikroskops und des Typs der Lichtquelle bestimmt. Bei jeder Testreihe daher die Kontrollfelder zuerst ablesen, um eine korrekte Interpretation zu gewährleisten. Ablesen der Objektträger Die Intensität der Fluoreszenz der Bakterien nach dem Ablesen wie folgt einordnen: 2 bis 4+ 1+ Negativ mittlere bis starke apfelgrüne Fluoreszenz. eindeutige, aber schwache Fluoreszenz, ähnlich wie die der Nachweisbare Kontrolle beim Endtiter. keine Fluoreszenz oder Fluoreszenz ähnlich wie auf der Reaktionsstelle der Nicht Nachweisbare Kontrolle. Interpretation der Patientenprobenergebnisse Der reziproke Wert der höchsten Serumverdünnung, die eine eindeutige (1+) apfelgrüne Fluoreszenz aufweist, wird als Endtiter bezeichnet. ≥1:256 <1:256 und ≥1:64 <1:64 IgG Endtiter von 1:256 und höher gelten als vorläufiger Beweis für eine kürzlich erfolgte Infektion. Ein IgG-Endtiter von ≥1:64 und <1:256 einer einzelnen Patientenprobe sollte als Hinweis auf eine Infektion zu einem unbestimmten Zeitpunkt angesehen werden. Eine zweite Probe sollte 10 bis 21 Tage nach der ersten Probe gewonnen und parallel mit der ersten Probe untersucht werden. Weist die zweite Probe einen Titer von <1:256 oder einen vierfachen Anstieg gegenüber der ersten Probe auf, so gilt dies als Hinweis auf eine akute, zum Zeitpunkt der Untersuchung vorhandene Infektion. Unveränderte Titer von ≥1:64 und <1:256 lassen auf eine vergangene Infektion schließen. Ein IgG Endtiter von unter 1:64 deutet an, dass der Patient keine akute Infektion aufweist. Dies kann der Fall sein bei Patienten, die nie mit Bartonella infiziert worden sind, oder bei Patienten, die in der Vergangenheit infiziert worden sind, deren Titer aber bis unter die Nachweisgrenze gefallen sind. Unspezifische Fluoreszenz In manchen Fällen kann eine Probe mit Verozellen reagieren. Der Test ist in einem solchen Fall nicht auswertbar. EINSCHRÄNKUNGEN 1. 2. 3. Es ist wichtig, dass alle Ergebnisse der Bartonellaserologien mit der klinischen Anamnese und anderen Informationen korrelieren, die dem Arzt vorliegen. Die Intensität der Fluoreszenz und des Endtiters werden durch die Art und optische Beschaffenheit des Mikroskops und des Typs der Lichtquelle bestimmt. Bei jeder Testreihe daher die Kontrollfelder zuerst ablesen, um eine korrekte Interpretation zu gewährleisten. Zu früh gewonnene Proben während der primären Infektion weisen möglicherweise keine nachweisbaren Antikörper auf. Bei Verdacht auf eine Infektion mit Bartonella, sollte eine zweite Serumprobe 10 bis 21 Tage später entnommen und parallel mit der Originalprobe untersucht werden. ZU ERWARTENDE BEFUNDE In einer Studie wiesen 95% der Patienten mit typischen Hinweisen auf CSD (klinische Befunde, Hauttest und Histopathologie) IgG Antikörper gegen B. henselae auf3. In einer anderen Studie wiesen 88% der Patienten mit klinischem Verdacht auf CSD Serumtiter im Bereich von ≥1:64 auf, während 3% der gesunden Kontrollen Nachweisbare e Titer aufwiesen1. SPEZIFISCHE LEISTUNGSDATEN Kunden ausserhalb der Vereinigten Staaten finden die spezifischen Leistungsdaten des Tests auf einem separaten Blatt. LITERATUR 1. 2. 3. 4. 5. 6. 7. 8. 9. Regnery, R., J. Olson, B.A. Perkins, and W. Bibb. 1992. Serological Response to Rochalimaea henselae Antigen in Suspected Cat-scratch Disease. Lancet 339: 1443-45. Koehler, J.E., C.A. Glaser, J.W. Tappero. 1994. Rochalimaea henselae Infection. A New Zoonosis with the Domestic Cat as Reservoir. JAMA 271: 531535. Peter, J.E., M. Boyle, M. Patnaik, T.L. Hadfield, N.E. Barka, W.A. Schwartzman, and R. S. Penny. 1994. Persistent Generalized Lymphadenopathy and Non-Hodgkin’s Lymphoma in AIDS: Association with Rochalimaea henselae infection. Clin. and Diag. Lab Immunology. Vol. 1, No. 1. 115-116. Zangwill, K.M., D.H. Hamilton, B.A. Perkins, and et al. 1993. Cat Scratch Disease in Connecticut: Epidemiology, Risk Factors, and Evaluation of a New Diagnostic Test. New Engl. J. Med. 329: 8-13. Tompkins, L.S. 1994. Rochalimaea Infections. Are They Zoonoses? JAMA 271: 553-4. Schwartzman, W.A. 1992. Infections Due to Rochalimaea: Expanding the Clinical Spectrum. Clin. Infect. Dis. 15: 893-902. Relman, D.A., S. Falkow, P.E. LeBoit, et al. 1991. The Organism Causing Bacillary Angiomatosis, Peliois Hepatis and Fever and Bacteremia in Immunocompromised Patients. New Engl. J. Med. 324: 1514-8. Hogrefe, W.R., L. Cullman. 1995. Bartonella SPP. Antibody Detection by IFA using Vero Cell Co-Culture and Blood Agar derived Antigen. Abstract, 9th European Congress of Clinical Microbiology and Infect. Dis. Hollingdale, M.R., J.E. Herrmann, and J.W. Vinson. 1978. Enzyme Immunoassay of Antibody to Rochalimaea quintana: Diagnosis of Trench Fever and Bartonella IFA IgG Seite 5 10. 11. 12. 13. Serological Cross-Reactions among Other Rickettsiae. J. Infect. Dis. 137: 578-582. Relman, D.A., J.S. Loutit, T.M. Schmidt, et al. 1990. The Agent of Bacillary Angiomatosis. New Engl. J. Med. 323: 1574-1580. Tappero, J.W., J. Mohle-Boertani, J.E. Koehler, et al. 1993. The Epidemiology of Bacillary Angiomatosis and Bacillary Peliosis. JAMA 269: 770-775. NCCLS. Procedures for the Handling and Processing of Blood Specimens; Approved Guideline (NCCLS H18-A2). 2nd ed. (1999). CDC-NIH Manual. (1999) Biosafety in Microbiological and Biomedical Laboratories. 4th ed. And National Committee for Clinical Laboratory Standards (NCCLS). Protection of Laboratory Workers from Instruments, Biohazards and Infectious Disease Transmitted by Blood, Body Fluids and Tissue (NCCLS M29-A). Dieser Paketeinsatz ist auf französisches, deutsches, italienisch und spanisch an www.focusdx.com vorhanden, und ist in anderen Sprachen von Ihrem lokalen Verteiler vorhanden. AUTORISIERTE REPRÄSENTANT mdi Europa GmbH, Langenhagener Str. 71, 30855 Langenhagen-Hannover, Deutschland BESTELLINFORMATIONEN Telefon: (562) 240-6500 (International) Fax: (562) 240-6510 PI.IF1300G.OUS-DE Rev.K Erstellungdatum: 14 Oktober 2016 TECHNISCHE HILFE Telefon: (562) 240-6500 (International) Fax: (562) 240-6526 Besuchen Sie unsere Webseite: www.focusdx.com Cypress, California 90630, U.S.A.