Kolorektale Karzinom-personalisierte, stadienadaptierte
Werbung

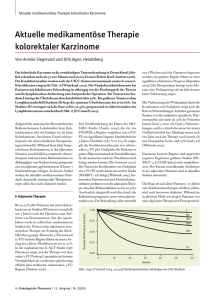
DMW Deutsche Medizinische Wochenschrift 138. Jahrgang | www.thieme-connect.de/ejournals | www.thieme.de/dmw 3 36 | 2013 Sonderdruck Nachdruck nur mit Genehmigung des Verlages 3 Kolorektale Karzinome – personalisierte, stadienadaptierte Tumortherapie Colorectal cancer – personalized, stage-adjusted tumour therapy M. Pohl, W. Schmiegel 1790 Übersicht | Review article Kolorektale Karzinome – personalisierte, stadienadaptierte Tumortherapie Colorectal cancer – personalized, stage-adjusted tumour therapy Autoren M. Pohl1 W. Schmiegel1 Institut 1 Medizinische Universitätsklinik, Knappschaftskrankenhaus Bochum Gastroenterologie, Onkologie Einleitung ▼ Adjuvante Kombinationstherapie im Stadium III Das kolorektale Karzinom (KRK) liegt bei den tumorbedingten Todesursachen in der westlichen Welt auf dem zweiten Platz. Pro Jahr kommt es in Deutschland zu über 70 000 Neuerkrankungen sowie ca. 30 000 Todesfällen. Das mediane Erkrankungsalter nimmt zu und beträgt in der Bundesrepublik Deutschland 69 Jahre bei Männern und 75 Jahre bei Frauen. Ungefähr 20 % der Patienten sind 80 Jahre oder älter [33]. Die Stadieneinteilung nach der UICC-Klassifikation bestimmt die Prognose (q Tab. 1). Patienten im Stadium I und IIA haben eine sehr gute Prognose. Schon im Stadium IIB treten in ca. 30 % der Fälle Lokalrezidive und häufiger Fernmetastasen auf. Diese werden in 85 % der Fälle innerhalb der ersten 2,5 Jahre diagnostiziert. Patienten mit Fernmetastasen (mKRK) gelten als unheilbar (Ausnahme: resektable Leber- oder Lungenmetastasen). 70–80 % der Patienten können bei Erstdiagnose durch eine chirurgische Resektion des Tumors geheilt werden. Das kumulative 5-JahresÜberleben beträgt jedoch nur ca. 60 %. Etwa 1/4 der primär palliativ behandelten Patienten wird durch eine neoadjuvante Kombinationstherapie nach Verkleinerung der Organmetastasen (Downsizing) resektabel (Konversionstherapie) [32]. In einer französischen Studie [5] erhielten über 2000 Patienten im Stadium II (40 %) und III (60 %) Oxaliplatin plus infusionales 5-FU/FS (FOLFOX4) oder infusionales 5-FU/FS alleine über 6 Monate. Die Risikoreduktion für ein Rezidiv unter Oxaliplatin betrug 20 % (HR = 0,8). Die Verbesserung des krankheitsfreien Überlebens (DFS) war nur im Stadium III signifikant (58,9 vs. 66,4 %, p = 0,005). Oxaliplatin verbesserte das Gesamtüberleben im Stadium III nach 6 Jahren um 4,4 % (68,6 vs. 73,0 %, p = 0,029) [5]. Eine internationale Phase-III-Studie [19] zeigte bei 1886 Patienten, dass Capecitabin in Kombination mit Oxaliplatin (XELOX) in der adjuvanten Therapie des Kolonkarzinoms im Stadium III 5-FU/FS überlegen ist und das DFS signifikant verlängerte. Für die Gabe von Bevacizumab zur FOLFOX-6-Chemotherapie zeigte sich im Stadium II oder III nach R0-Resektion kein Vorteil [3]. Irinotecan und zielgerichtete Therapien haben keinen Stellenwert in der adjuvanten Behandlung des Kolonkarzinoms [47]. Übersicht | Review article Schlüsselwörter kolorektales Karzinom personalisierte Tumortherapie zielgerichtete Substanzen adjuvante Therapie Palliativtherapie Sonderdruck für private Zwecke des Autors q q q q q Keywords q colorectal cancer q personalized therapy q biologicals q adjuvant treatment q palliative treatment eingereicht 22.04.2013 akzeptiert 11.07.2013 Bibliografie DOI 10.1055/s-0033-1343343 Dtsch Med Wochenschr 02013; 1380 : 1790–1795 · © Georg 0 Thieme Verlag KG · Stuttgart · New York · ISSN 0012-04721439-4 13 Korrespondenz Prof. Dr. Wolff Schmiegel Medizinische Universitätsklinik, Knappschaftskrankenhaus Bochum, Klinikum der Ruhr-Universität In der Schornau 23-25 44892 Bochum Tel. 0234/299-3400 Fax 0234/299-3409 eMail [email protected] www.medunikkh.de Adjuvante Therapie ▼ Patientenauswahl und Therapiebeginn Eine adjuvante Therapie erhalten Patienten mit einem KRK Stadium III sowie – abhängig von Risikofaktoren – Stadium II ca. 4 Wochen nach der Operation. Eine Verzögerung der adjuvanten Therapie geht mit einer signifikanten Verschlechterung (ca. 5 % pro 4 Wochen) des Gesamtüberlebens und des krankheitsfreien Überlebens einher [8]. Kontraindikationen für eine adjuvante Therapie sind ein Allgemeinzustand < WHO-Grad 2 und Therapie-limitierende Komorbiditäten wie Leberzirrhose, Nieren- und Herzinsuffizienz, Infektionen [40]. Bei Kontraindikationen für eine Oxaliplatin-haltige Kombinationstherapie sollte die adjuvante Therapie im Stadium III als Monotherapie mit Fluoropyrimidinen über 6 Monate erfolgen. Nach S3-Leitlinie kann das orale 5-FU-Prodrug Capecitabin verwendet werden. Im Stadium III war Capecitabin gleich effektiv wie ein Bolus-5-FU/FS-Protokoll, bewirkte aber signifikant weniger Neutropenien, febrile Neutropenien und Stomatitiden Grad 3–4. Das Hand-Fuß-Syndrom trat unter Capecitabin signifikant häufiger auf [19, 45]. Bei Patienten mit Niereninsuffizienz sollte die Capecitabin-Dosis angepasst oder alternativ infusionales 5-FU eingesetzt werden. Wegen schlechter Verträglichkeit sind Bolusschemata (z. B. das Mayo-Protokoll) obsolet. Eine Oxaliplatin-haltige Kombinationstherapie sollte bei älteren Patienten zurückhaltend eingesetzt werden, da sie zur einer erhöhten Sterblichkeit führt und keinen eindeutigen Vorteil gegenüber 5- Übersicht | Review article Tab. 1 Stadien, TNM-Klassifikation und Prognose beim kolorektalen Karzinom [2, 18, 50]. 5-JÜR: 5-Jahres-Überlebensrate. Dukes TNM-Klassifikation 0 A I II A B Tis T 1–2, N0, M0 97 % T 3, N0, M0 88 % II B T 4a, N0, M0 II C T4b, N0, M0 III III A 5-JÜR 72 % Gensignaturen Jedes T. N1–2, M0 C T 1 , T 2, N1a, M0 88 % T1, N2a, M0 III B T3, T4a, N1, M0 69 % (T3, N1) T2, T3, N2a, M0 T1, T2, N2b, M0 III C 75 % T 4a, N2a, M0 T3, T4b, N2b, M0 48 % (T3, N2) T4b, N1–2 51 % (T4, N1) 27 % (T4, N2) IVA D jedes T, jedes N, M1 erwähnt. Nicht alle Tumore mit KRAS-Wildtyp sprechen auf die Therapie mit EGFR-Antikörper an. 5–10 % der KRK haben eine spezifische Mutation im BRAF-Gen (V600E), bei MSI-Tumoren sogar 25–60 %. Eine BRAF-Mutationsanalyse kann zwischen HNPCC und sporadischen Tumoren mit MSI-H unterscheiden, da sie fast nie bei HNPCC vorkommt. In der COIN-Studie, die die Zugabe von Cetuximab zu einer Oxaliplatin-haltigen Erstlinientherapie untersuchte, hatten Patienten mit einer BRAF-Mutation die schlechteste Prognose; bei KRAS- und BRAF-Wildtyp war sie am günstigsten [1]. 8 % FU/FS allein besitzt [2, 43]. Eine kombinierte Analyse der adjuvanten Studien zur Therapie mit Oxaliplatin, Irinotecan oder oralen Fluoropyrimidinen für Patienten > 70 Jahre zeigte keinen Vorteil hinsichtlich des progressionsfreien (PFS) und Gesamtüberlebens (OS) für eine Oxaliplatin-haltige Kombinationstherapie [26]. Ein ähnlicher Trend war für die oralen Fluoropyrimidine nachweisbar. Adjuvante Therapie im Stadium II Notfalloperation, Tumorperforation, T4-Kategorie und zu wenige untersuchte Lymphknoten (< 12) sind als Risikofaktoren zu berücksichtigen. Liegen einer oder mehrere Risikofaktoren vor, sollte eine adjuvante Monotherapie mit einem Fluoropyrimidin im Stadium II erfolgen [40]. Neben schlechter Differenzierung bestätigte sich die T-Kategorie als negativer Prognosemarker [27]. Patienten im Stadium II ohne Risikofaktoren können nach der S3-Leitlinie [40] eine adjuvante Therapie mit 5-FU/FS erhalten. Bislang wurde in Metaanalysen kein Vorteil für eine adjuvante Therapie im Stadium II ohne Risikofaktoren gefunden [7]. Die englische QUASAR-Studie [31] konnte als größte randomisierte Einzelstudie eine signifikante Verbesserung des Rezidivrisikos im Stadium II zeigen (absolute Verbesserung des Gesamtüberlebens ca. 3 % (HR 0,82; 95 % KI: 0,70–0,95, p = 0,008). Trotz methodischer Mängel war sie Grundlage der Level-0-Empfehlung der S3-Leitlinie. Molekulare Prognosefaktoren Bei nur geringer Verbesserung des Überlebens durch eine adjuvante Therapie im Stadium II wird derzeit intensiv nach molekularen Markern oder Gensignaturen gesucht um Patienten zu identifizieren, die von einer adjuvanten Therapie profitieren (prädiktive Marker). Die Mikrosatelliteninstabilität (MSI) ist eine Längenveränderung innerhalb repetitiver DNA-Sequenzen, die auf einer fehlerhaften DNA-Reparatur beruht. Etwa 15 % der sporadischen Kolonkarzinome weisen hochgradige MSI (MSI-H) auf, während sich Mutationen im KRAS-Gen bei ca. 30–40 % finden [41]. Eine MSI im Stadium II ist ein starker positiver prognostischer Faktor, hat nach der aktuellen Studienlage jedoch keinen prädiktiven Wert [38]. Patienten mit MSI-Tumoren haben eine exzellente Prognose, so dass der Vorteil einer adjuvanten Therapie nur gering ist. Die deutsche S3-Leitlinie [40] berücksichtigt die Bestimmung von MSI vor adjuvanter Therapie nicht; jedoch wird sie in der ESMO-Guideline [41] Durch KRK-spezifische Gensignaturen können Stadium-II-Patienten mit hohem und Stadium-III-Patienten mit niedrigem Rezidivrisiko identifiziert werden. Ziel ist es, Patienten auszuwählen, die von einer adjuvanten Chemotherapie profitieren. Bisher wurden folgende Signaturen (Genanzahl) auf ihre prognostische, aber in keinem Fall auf ihre prädiktive Aussagekraft untersucht: MD Anderson (114), Agendia Coloprint (18), OncotypeDX (12), Veridex (7), Colorectal DSA (634), ColoGuideEx (13). Am Besten untersucht ist die Frischgewebe-Signatur Coloprint und die FFPE-Signatur Oncotype DX. Coloprint wird aktuell multinational prospektiv eingesetzt. Die Limitation liegt in der Asservierung des Frischgewebes [23]. Oncotype DX liefert einen kontinuierlichen Rezidivscore, der vermutlich vor allem bei Patienten mit intermediärem Risiko (MSS und T3) klinisch eine Rolle spielen könnte. Auch diese Signatur ist bezüglich 5-FU nicht prädiktiv [22]. In den USA ist Oncotype DX als Test von der FDA zugelassen. kurzgefasst Eine FOLFOX-Therapie über 6 Monate ist therapeutischer Standard für Stadium III (mit Lymphknotenbefall). Bei Kontraindikationen für Oxaliplatin sollte die adjuvante Therapie im Stadium III als Monotherapie mit Fluoropyrimidinen über 6 Monate erfolgen. Patienten über 70 Jahre profitieren von einer adjuvanten Therapie. Kombinationstherapien mit Oxaliplatin sollten bei ihnen zurückhaltend eingesetzt werden. Im Stadium II besteht die adjuvante Therapie aus einem Fluoropyrimidin. Patienten im Stadium II ohne Risikofaktoren, die eine adjuvante Therapie erhalten sollen, sollten auf Mikrosatelliteninstabilität untersucht werden. Therapie des Rektumkarzinoms ▼ Beim Rektumkarzinom Stadium I ist eine perioperative Therapie nicht indiziert; im UICC-Stadium II und III erfolgt eine neoadjuvante Radio- oder Radio-Chemotherapie. Die neoadjuvante Behandlung kann als Kurzzeitradiotherapie (5 × 5 Gy) mit anschließender Resektion oder als Langzeittherapie über mind. 5 Wochen (45–50 Gy + 5FU/Capecitabin-Chemotherapie) erfolgen [40]. Die zweite deutsche Rektumkarzinomstudie [34] zeigte eine statistisch signifikante Steigerung der Rate kompletter Remissionen durch Oxaliplatin (17 vs. 13 %; p = 0,038) bei gleicher Rate an Grad-III/IV-Toxizitäten (23 vs. 20 %). In der aktuell vorgestellten PETACC6-Studie [51] führte die Zugabe von Oxaliplatin zu einer Capecitabin-basierten Radio-/Chemotherapie zu einer verminderten Compliance und erhöhten Toxizität, verbesserte das chirurgische Ergebnis aber nicht. Bei infiltrativ wachsenden und tief gelegenen Tumoren des mesorektalen Fettgewebes mit Zweifeln an einer R0-Resektabilität sollte eine Langzeit-Radio-Chemotherapie erfolgen. Für ältere oder moribunde Patienten ist die Kurzzeitradiotherapie mit weniger Akuttoxi- Dtsch Med Wochenschr 2013; 138: 1790–1795 · M. Pohl u. W. Schmiegel, Kolorektale Karzinome – … Sonderdruck für private Zwecke des Autors UICC 1791 Sonderdruck für private Zwecke des Autors 1792 Übersicht | Review article ESMO 1 S3-LL: Gruppe 2.1. ESMO 2 S3-LL: Gruppe 2.2. ESMO 3 S3-LL: Gruppe 3 Potenziell resektable LM Nie resektable LM Nie resektable LM Ggf. Resektion nach Ansprechen auf Induktionstherapie ± lokalisierte Metastasen, z. B. LK, Operation möglich! Schnelle Progression und/oder Tumor-assoziierte Symptome und/oder Risiko der schnellen Verschlechterung, Intensive Therapie möglich! Keine Chance auf Resektion und/ oder keine Symptome oder Risiko schneller Verschlechterung und/oder Komorbidität. Keine OP/intensive Therapie! Maximales Ansprechen, Tumorschrumpfung Schnelles Ansprechen, Krankheitskontrolle Krankheitskontrolle/ geringe Toxizität Erfordert aktivste Therapie in der 1L Aktive Therapie in der 1L, mind. 2-fache Kombination Monotherapie oder gut verträgliche 2-fache Kombination zität eine Option. Die Operation erfolgt 4–6 Wochen nach Beendigung der präoperativen Radio-Chemotherapie. Nach neoadjuvanter Radio-Chemotherapie ist eine adjuvante Chemotherapie indiziert [41]. Die Strahlentherapie des Rektumkarzinoms im oberen Drittel wird kontrovers diskutiert. Es kann eine adjuvante Therapie wie beim Kolonkarzinom oder eine perioperative Radio(chemo)-therapie wie beim Rektumkarzinom erfolgen [35]. Diskutiert wird, ob bei klinischer Komplettremission nach neoadjuvanter Therapie durch eine lokale Exzision ein funktioneller Organerhalt erfolgen kann. Durch die totale Mesorektumexzision (TME) konnte die Lokalrezidivrate signifikant von ca. 20 auf 5–7 % gesenkt werden. Dabei werden die regionären Lymphknoten en bloc unter Schonung der für Kontinenz und Sexualfunktion wichtigen autonomen Innervation reseziert [20]. Im oberen Rektumdrittel sollte eine partielle mesorektale Exzision erfolgen. Eine konusartige Abtrennungdes Mesorektums vom distalen Resektionsrand ist zu vermeiden. Eine Beschädigung des Mesorektums hat einen negativen Einfluss auf die Prognose mit einer erhöhten Rate an Lokalrezidiven. Die M.E.R.C.U.R.Y.-Klassifikation erfasst die Qualität der TME am Operationspräparat in drei Kategorien (komplett, nahezu komplett, inkomplett) [40, 41]. Die TME kann durch einen erfahrenen Operateur auch laparoskopisch erfolgen, dies wird jedoch nur im Rahmen von Studien und in erfahrenen Zentren empfohlen. Bedenken wegen hoher Raten an Trokar-Metastasen haben sich als unberechtigt erwiesen. Die 10-Jahres-Langzeitergebnisse der CLASICC-Studie belegen für das Kolon- und Rektumkarzinom zwischen offen und laparoskopisch operierten Patienten in Bezug auf OS (78,3 vs. 82,7 Monate) und DFS (89,5 vs. 77,0 Monate) keinen signifikanten Unterschied [16]. Bei Tumorinfiltration des Schließmuskelapparats und Stuhlinkontinenz sollte die Indikation zur abdominoperinealen Rektumamputation mit terminalem Kolostoma überprüft werden. Eine lokale transanale Tumorresektion kann bei auf die Submukosa beschränktem uT1-low-grade Rektumkarzinom (G1 /G2) mittels Vollwandresektion erfolgen. Bei T1-Karzinomen mit Risikofaktoren (sm3, G3) oder T2-Karzinomen soll keine lokale Exzision, sondern eine Resektion nach radikal tumorchirurgischen Prinzipien erfolgen [40]. kurzgefasst Bei Rektumkarzinom Stadium II und III ist eine neoadjuvante Radio- oder Radio-Chemotherapie indiziert. Wichtigstes chirurgisches Ziel bleibt die komplette Tumorresektion (R0). Abb. 1 Therapieintensität und Therapieziele beim kolorektalen Karzinom mit Lebermetastasen, entsprechend den klinischen Patientengruppen in der deutschen S3-Leitlinie [40] und der ESMOLeitlinie [41]. Links: Gruppe 2.1, ESMO 1: primär nicht resektable, nach Konversionstherapie potenziell resektable Erkrankung. Mitte: Gruppe 2.2, ESMO 2: primär nicht resektable Erkrankung ohne Möglichkeit einer kurativen Resektion. Rechts: Gruppe 3 (ESMO 3): nicht resektable Erkrankung, Patienten ohne tumorbezogene Symptome oder Organkomplikationen und/oder schwere Komorbidität. Nicht dargestellt: Gruppe 1 (ESMO 0): Patienten mit primär resektabler Lebermetastasierung. LL: Leitlinie, LM: Lebermetastasen, LK: Lymphknoten, 1L: Erstlinientherapie. Palliative Therapie ▼ Das metastasierte Kolon- und Rektumkarzinom werden gleich behandelt, abhängig von der klinischen Situation (q Abb. 1). Die ESMO-Leitlinie [41] teilt die Patienten im Stadium I abhängig von Therapieziel und Behandlungsintensität in vier Patientengruppen (0–3) ein: In Gruppe 0 bestehen R0-resezierbare Lungen- und/oder Lebermetastasen. Mit moderater Therapieintensität kann die Kuration und Senkung des Rezidivrisikos erreicht werden. Gruppe 1 ist pulmonal oder hepatisch metastasiert und potenziell resektabel nach einer effektiven Induktions-/Kombinationschemotherapie, die eine schnelle Tumorschrumpfung erzielt. Gruppe 2 weist multiple Metastasen mit rascher Progression und/oder tumorassoziierten Symptomen und dem Risiko einer raschen Verschlechterung auf. Das Ziel ist eine rasche Tumorschrumpfung oder einen stabilen Erkrankungsverlauf zu erzielen. Patienten ohne Resektionsmöglichkeit und/oder indolentem Verlauf bzw. schweren Komorbiditaten (Gruppe 3) profitieren von einem stabilen Erkrankung unter verträglichen Therapieprotokollen. Personalisierung der Therapie durch Biomarker Der prädiktive Marker KRAS personalisiert die Therapie des mKRK. Bei KRAS-Wildtyp wird der Signalweg durch die Bindung des EGFR-spezifischen Antikörpers inhibiert. KRAS-Mutationen führen zu einem aktiven Protein, ohne durch EGFR-Signale aktiviert worden zu sein. Patienten mit KRAS-Wildtyp profitieren von einer EGFR-Antikörpertherapie. Auch die Akne-ähnliche Hautreaktion ist ein prädiktiver Biomarker. Patienten mit einer Hauttoxizität unter einer Anti-EGFR-Therapie überleben länger [46]. In einer Drittlinienstudie mit Panitumumab vs. „best supportive care“ profitierten die Patienten mit einer KRAS-Mutation nicht von Panitumumab [4, 48]. Panitumumab ist bisher für Patienten mit einem KRAS-Wildtypstatus im Tumorgewebe zugelassen. Der KRASWildtypstatus als prädiktiver Marker gilt auch für Cetuximab. Der Vorteil für die Therapie mit FOLFIRI und EGFR-Antikörper [46, 48] zeigte sich ausschließlich bei Patienten mit KRAS-Wildtyp. Dies gilt auch für eine Kombinationstherapie mit Oxaliplatin/5-FU/FS [9]. Cetuximab ist folglich nur bei KRAS-Wildtypstatus zugelassen. Aktuelle Studienergebnisse zeigen, dass die KRAS-Mutationsanalyse des Exon 2 zur Patientenauswahl für die Anti-EGFR-Therapie mit Panitumumab nicht ausreicht. KRAS-Mutationen der Exons 3 und 4, sowie NRAS-Mutationen in den Exons 2, 3 und 4 sind ebenfalls wichtige prädiktive Marker für eine Panitumumab-Therapie. Dtsch Med Wochenschr 2013; 138: 1790–1795 · M. Pohl u. W. Schmiegel, Kolorektale Karzinome – … Übersicht | Review article durch die Operation zu Langzeitüberlebenden. Die CELIM-Studie [15] überprüfte bei Patienten mit irresektablen Lebermetastasen Cetuximab + FOLFOX oder Cetuximab + FOLFIRI als Konversionstherapie. Beim KRAS-Wildtyp-KRK betrug die Ansprechrate 79 %. Bei 42 % der initial nicht-resektablen Patienten erfolgte eine Resektion mit einer R0-Resektionsrate von 35 %. kurzgefasst kurzgefasst Bei jedem Patienten im Stadium IV, für den eine systemische Kombinationstherapie in Frage kommt, sollte der KRAS/NRASMutationsstatus im Tumorgewebe untersucht werden. Eine perioperative Therapie bei resektablen Lebermetastasen eines KRK kann verabreicht werden. Es ist unklar, ob diese prä- oder postoperativ erfolgen soll. Zur Erlangung der Resektabilität wird eine Dreifach-Kombinationschemotherapie oder eine Kombination aus zwei Chemotherapeutika und Antikörper empfohlen. Personalisierung durch Tumorschrumpfung Die Tumorschrumpfung kann unter Therapie beobachtet werden. Neben der Symptom- und Chancenverbesserung auf eine Metastasenresektion geht sie mit einer Verlängerung des Langzeitüberlebens einher. In der CRYSTAL- und OPUS-Studie war eine Schrumpfung um 20 % nach den ersten beiden Behandlungsmonaten in den Cetuximab-Armen häufiger zu beobachten als unter der alleinigen Chemotherapie mit FOLFIRI bzw. FOLFOX4 (CRYSTAL: 64 vs. 45 %; OPUS: 69 vs. 46 %) [29]. Eine stärkere Schrumpfung zu einem frühen Zeitpunkt war nur bei den Cetuximab-behandelten Patienten eindeutig für einen Überlebensvorteil prädiktiv. Behandlung nach klinischen Patientengruppen Primär resektable Leber- und/oder Lungenmetastasen Bei 30 % der Patienten mit KRK entwickeln sich Lebermetastasen. Nur 15– 20 % der Metastasen sind primär resektabel. Trotz R0-Resektion beträgt das 5-Jahres-Überleben nur ca. 25–40 %. Die EORTC40983Studie konnte durch den Vergleich einer prä- und postoperativen Therapie mit jeweils 6 Gaben FOLFOX mit einer alleinigen Operation einen signifikanten Vorteil für die perioperative Therapie zeigen. Die Verbesserung liegt in einer Größenordnung, die Oxaliplatin-Kombinationen im Stadium III vs. alleinige 5-FU-Therapie erreichen [28]. Die Vorteile einer präoperativen Therapie sind die frühe Behandlung disseminierter Tumorzellen und die Prognoseeinschätzung durch das Therapieansprechen. Die S3-Leitlinie empfiehlt bei Patienten mit primär resektablen Lebermetastasen die sofortige Operation [41]. Die New-EPOC-Studie [52] untersuchte die Wirkung von Cetuximab bei KRAS-Wildtyp-Patienten mit primär operablen Lebermetastasen zusätzlich zu einer Chemotherapie. Nach einer Empfehlung des „Independent Data Monitoring Committee“ wurde die Studie gestoppt, da das PFS unter Cetuximab signifikant schlechter war als unter Chemotherapie allein. Analog dem Vorgehen im Stadium III soll durch eine postoperative (adjuvante) Therapie ein Rezidiv nach Metastasenresektion verhindert werden. Da die kumulative Therapiedosis postoperativ nicht immer erreicht wird, sollte die Möglichkeit einer präoperativen Behandlung erwogen werden [40]. Um eine sekundäre Resektabilität zu erreichen, wird bisher eine Dreifach-Kombinationschemotherapie oder eine Kombination aus zwei Chemotherapeutika und einem monoklonalen Antikörper empfohlen [40]. Da nur wenige Studien die R0-Resektabilität als Endpunkt definieren, ist die Evidenzlage dieser Empfehlung mäßig. In einer italienischen Studie [25] steigerte die Kombination aus Oxaliplatin, Irinotecan und 5-FU (FOLFOXIRI versus FOLFIRI) die Ansprechrate von 34 auf 60 % und die R0-Resektabilität von 6 auf 15 %. In CRYSTAL und OPUS [9, 11] konnte das PFS durch Cetuximab signifikant verlängert werden; bis zu 10 % mehr Patienten wurden kurativ sekundär operiert. Die Hälfte wurden Tumorbedingte Symptome, Organkomplikationen oder rasche Tumorprogression Patienten mit Symptomen sollten zeitnah eine effektive Kombinationstherapie mit FOLFIRI oder FOLFOX erhalten [13, 36]. Beide Erstlinien-Therapieprotokolle sind gleichwertig; die Substanzwahl ist vom Nebenwirkungsprofil abhängig. Capecitabin hat die gleiche Effektivität wie infusionales 5-FU, sowohl in der Zweifachkombination mit Oxaliplatin als auch in Kombination mit Bevacizumab [30]. Capecitabin in Kombination mit Oxaliplatin (XELOX) sowie in Kombination mit Oxaliplatin + Bevacizumab war dem 5-FU-haltigen FOLFOX bzw. FOLFOX + Bevacizumab hinsichtlich PFS und OS nicht unterlegen [20]. Eine deutsche Phase-II-Studie [39] verglich XELOX und XELIRI jeweils mit Bevacizumab in der Erstlinientherapie. Das PFS nach 6 Monaten, die Gesamtansprechraten (53 vs. 55 %) sowie die Tumorkontrollrate (> 80 %) waren vergleichbar. Das Nebenwirkungsprofil (Diarrhoe, Hand-Fuß-Syndrom) war im XELIRI-Arm günstiger. Die Kombination XELIRI + Bevacizumab ist eine effektive, gut verträgliche Therapieoption in der Erstlinientherapie des metastasierten KRK. Bevacizumab mit einer Oxaliplatin-haltigen Chemotherapie verlängerte die progressionsfreie Zeit von 8,0 auf 9,4 Monate (p = 0,0023) [37]. Bei Therapie bis zur Progression betrug das PFS im Bevacizumab-Arm 10,4 vs. 7,9 Monate im Placebo-Arm (p < 0,0001). In der CRYSTAL/OPUS-Studie konnte durch die Cetuximabgabe zur Chemotherapie das PFS und in der CRYSTAL-Studie im Follow-up auch das OS signifikant verlängert werden. Die Metaanalyse beider Studien bestätigte die signifikante Überlebensverlängerung durch Cetuximab in Kombination mit FOLFOX oder FOLFIRI bei Patienten mit KRAS-Wildtyp [11]. Die Phase-III-Studie PRIME zeigte für die Erstlinientherapie von KRAS-Wildtyp-Patienten mit Panitumumab ± FOLFOX 4 ein statistisch signifikant längeres PFS (9,6 vs. 8,0 Monate; p = 0,0234). Im Panitumumab-Arm traten Toxizitäten wie Diarrhoe, Hautreaktionen und Hypomagnesiämie auf [14]. In einer aktuell präsentierten, retrospektiven Analyse der PhaseIII-PRIME-Studie [53] wurden Mutationen im KRAS- und NRASGen als prädiktive Biomarker untersucht. 90% der Studienpopulation wurden untersucht. Patienten mit NRAS/KRAS-Wildtyp wiesen einen statistisch signifikanten Vorteil im Gesamtüberleben unter Panitumumab plus FOLFOX gegenüber FOLFOX alleine (26 vs. 20,2 Monate) auf. Patienten mit NRAS/KRAS-Mutationen hatten ein kürzeres PFS und OS unter EGFR-AK/Chemotherapie. Die NRAS/KRAS-Mutationen waren im Gegensatz zu BRAF-Mutationen negativ prädiktiv für das Therapieergebnis. Der Ausschuss für Humanarzneimittel der Europäischen Zulassungsbehörde (EMA) Dtsch Med Wochenschr 2013; 138: 1790–1795 · M. Pohl u. W. Schmiegel, Kolorektale Karzinome – … Sonderdruck für private Zwecke des Autors Dadurch werden nicht nur die Therapieergebnisse durch eine bessere Patientenselektion verbessert, es wird auch verhindert, dass Patienten einen Nachteil erleiden. Die umfangreichere RAS-Mutationsanalyse (KRAS + NRAS-Exons 2, 3 und 4) sollte der neue Standard zur Patientenselektion für eine Anti-EGFR-PanitumumabTherapie werden [53]. 1793 1794 Übersicht | Review article hat im Juni 2013 eine Zulassungsänderung für Panitumumab empfohlen. Es soll bei Patienten mit mKRK und RAS-Wildtyp (nicht mehr nur KRAS-Wildtyp) eingesetzt werden. Die Kombination von Panitumumab mit Oxaliplatin-haltiger Chemotherapie soll nicht bei Patienten mit mutiertem NRAS/KRAS oder unbekannten NRAS/KRAS-Mutationsstatus eingesetzt werden. kurzgefasst Die Erstlinien-Chemotherapie mit monoklonalem EGFR-Antikörper verbesserte signifikant das progressionsfreie Überleben bei Patienten mit mKRK vom NRAS/KRAS-Wildtyp. samtüberleben signifikant länger als unter Placebo (6,4 vs. 5,0 Monate; HR 0,773; p = 0,0052). Mit der signifikanten Verlängerung des PFS (von 1,7 auf 1,9 Monate) sowie einer signifikanten Verbesserung der Tumorkontrollrate (p < 0,000001) wurden zwei sekundäre Endpunkte erreicht [17]. kurzgefasst Mit den antiangiogenen Substanzen Aflibercept und Regorafenib gibt es neue Therapieoptionen für Patienten mit mKRK. Für keines dieser Medikamente gibt es bislang Biomarker. Konsequenz für Klinik und Praxis Sonderdruck für private Zwecke des Autors Erhaltungstherapie und Chemotherapiepause Die Behandlung bis zur Progression mit nachfolgender Zweitlinientherapie führt zu kumulativen Toxizitäten. Deeskalationsprotokolle und intermittierende Chemotherapiegaben sind wegen der limitierenden Oxaliplatin-Neuropathie relevant. In der Optimox1-Studie [44] waren intermittierende und kontinuierliche Oxaliplatingabe gleich effektiv bei reduzierter Neurotoxizität. Ein komplettes Absetzen der Therapie kann zu keinem Zeitpunkt empfohlen werden. Das Gesamtüberleben der Patienten mit Erhaltungstherapie war signifikant besser als bei Patienten, die eine komplette Therapiepause hatten [11]. Bei Progression sollte je nach Dauer der Krankheitsstabilisierung wieder auf die initiale Kombinationstherapie eskaliert werden. Die Behandlung des mKRK wird mit Verbesserung des Gesamtüberlebens durch personalisierte Therapieansätze zu einem individuellen „Continuum of Care“. Patienten mit multiplen Metastasen ohne Resektionsoption/ tumorbezogene Symptome (Gruppe 3, ESMO 3) sollten eine Monotherapie als Erstlinientherapie mit ggf. späterer Therapieeskalation erhalten. Durch Kombination mit Bevacizumab wird das PFS verbessert [21]. kurzgefasst Therapiedeeskalation und Erhaltungstherapien sind bei gleicher Wirksamkeit und verbesserter Lebensqualität möglich. Adjuvante Therapie des Kolonkarzinoms 3Bei Hochrisikokonstellation im Stadium II sollte, ohne Risikofaktoren kann eine adjuvante Therapie mit einem Fluoropyrimidin erfolgen. 3FOLFOX (Folinsäure, Fluorouracil, Oxaliplatin) über 6 Monate ist Standardtherapie im Stadium III. 3Bei Patienten über 70 Jahre sollte man mit Kombinationstherapien zurückhaltend sein. Therapie des Rektumkarzinoms Stadium II und III 3Standard ist die neoadjuvante Radio- oder Radiochemotherapie, gefolgt von einer totalen mesorektalen Exzision (TME) und adjuvanten Chemotherapie, mit dem Ziel einer kompletten Resektion des Tumors. Palliative Therapie 3Die palliative Therapie erfolgt bei nichtresezierbaren Metastasen. 3Der NRAS/KRAS-Mutationsstatus sollte im Stadium IV untersucht werden. 3Therapiedeeskalation und Erhaltungstherapien sind bei gleicher Wirksamkeit und verbesserter Lebensqualität durch Reduktion von Toxizitäten möglich. 3Eine optimale Therapiesequenz gibt es nicht. Entscheidend ist der Einsatz aller wirksamen Substanzen im Erkrankungsverlauf. 3Neue Substanzen wie Aflibercept und Regorafenib erweitern die Therapiesequenzen in der Palliativtherapie. Mögliche Therapiesequenz von Zweit- und Drittlinientherapie Nach Erstlinientherapie mit Irinotecan- oder Oxaliplatinkombinationen wird in zweiter Linie auf das jeweils andere Protokoll gewechselt [42]. Nach Progress unter Bevacizumab-haltiger Erstlinientherapie kann die Behandlung mit Bevacizumab bei Wechsel der Chemotherapie fortgeführt werden („bevacizumab beyond progression“) [6]. Eine Phase-III-Studie [24] bestätigte den Nutzen der Antikörpergabe nach Progression der Erstlinientherapie mit Bevacizumab und 5-FU, FOLFIRI, FOLFOX oder FOLFOXIRI. Das Fusionsprotein Aflibercept (VEGF-Trap) kann verschiedene Liganden des VEGF-1 und VEGF-2-Rezeptors binden, inkl. VEGF-B und PIGF (Placental Growth Factor). Grundlage der Zulassung war die multinationale, randomisierte Doppelblindstudie VELOUR [49], die die Wirksamkeit von Aflibercept versus Placebo in Kombination mit einer Irinotecan/5-FU-haltigen Chemotherapie (FOLFIRI) nach Versagen einer Oxaliplatin-haltigen Therapie untersuchte. Die CORRECT-Studie untersuchte den oral wirksamen Multikinase-Inhibitor Regorafenib bei Patienten mit mKRK, die auf die Standardtherapie einschließlich EGFR- (bei KRAS-Wildtyp) und VEGFAntikörper nicht ansprachen (Progression während oder < 3 Monate nach der letzten Therapie). Im Regorafenib-Arm war das Ge- Autorenerklärung: M.P. erklärt, dass er Vortrags- und/oder Beraterhonorare von Roche, Amgen, Merck Serono, Sanofi, Bayer Healthcare, Novartis, Alexion und MCI erhalten hat. W.S. erklärt, dass er Vortrags- und/oder Beraterhonorare von Abbott, Amgen, Apceth, AstraZeneca, ECM, Falk Foundation, GSB, Merck, Pfizer, Roche und Siemens Healthcare erhalten hat. Literatur 1 Adams RA, Meade AM et al. Intermittent versus continuous oxaliplatin and fluoropyrimidine combination chemotherapy for first-line treatment of advanced colorectal cancer. Lancet Oncol 2011; 12: 642–653 2 Allegra CJ, Yothers G, O'Connell MJ et al. Initial safety report of NSABP C-08: a randomized phase III study of modified FOLFOX6 with or without bevacizumab for the adjuvant treatment of patients with stage II or III colon cancer. J Clin Oncol 2009; 27: 3385–3390 3 Allegra CJ, Yothers G et al. Phase III trial assessing bevacizumab in stages II and III carcinoma of the colon. J Clin Oncol 2011; 29: 11–16 4 Amado RG, Wolf M, Peeters M et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26: 1626–1634 5 André T, Boni C, Navarro M et al. Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J Clin Oncol 2009; 27: 3109–3116 6 Bennouna J, Sastre J, Arnold D et al. Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147). Lancet Oncol 2013; 14: 29–37 Dtsch Med Wochenschr 2013; 138: 1790–1795 · M. Pohl u. W. Schmiegel, Kolorektale Karzinome – … 7 Benson AB, Schrag D, Somerfield MR et al. American Society of Clinical Oncology recommendations on adjuvant chemotherapy for stage II colon cancer. J Clin Oncol 2004; 22: 3408–3419 8 Biagi JJ, Raphael MJ, Mackillop WJ et al. Association between time to initiation of adjuvant chemotherapy and survival in colorectal cancer. JAMA 2011; 305: 2335–2342 9 Bokemeyer C, Bondarenko I, Makhson A et al. Fluorouracil, leucovorin and oxaliplatin with and without cetuximab in the first-line treatment of metastatic colorectal cancer. J Clin Oncol 2009; 27: 663–671 10 Bokemeyer C, Van Cutsem E, Rougier P et al. Addition of cetuximab to chemotherapy as first-line treatment for KRAS wild-type metastatic colorectal cancer: pooled analysis of the CRYSTAL and OPUS randomised clinical trials. Eur J Cancer 2012; 48: 1466–1475 11 Chibaudel B, Maindrault-Goebel F, Lledo G et al. Can chemotherapy be discontinued in unresectable metastatic colorectal cancer? The GERCOR OPTIMOX2 Study. J Clin Oncol 2009; 27: 5727–5733 12 Chibaudel B, Tournigand C, André T et al. Therapeutic strategy in unresectable metastatic colorectal cancer. Ther Adv Med Oncol 2012; 4: 75–89 13 Douillard J, Siena S, Cassidy J et al. Randomized phase III trial of pantinumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME trial. J Clin Oncol 2010; 28: 4697–4705 14 Douillard JY, Cunningham D, Roth AD et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first line treatment for metastatic colorectal cancer. Lancet 2000; 355: 1041–1047 15 Folprecht G, Gruenberger T, Bechstein BO et al. Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cetuximab. Lancet Oncol 2010; 11: 38–47 16 Green BL, Marshall HC et al. Long-term follow-up of the Medical Research Council CLASICC trial of conventional versus laparoscopically assisted resection in colorectal cancer. Br J Surg 2013; 100: 75–82 17 Grothey A, Van Cutsem E, Sobrero A et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT). Lancet 2013; 381: 303–312 18 Gunderson LL, Jessup JM, Sargent DJ et al. Revised TN categorization for colon cancer based on national survival outcomes data. J Clin Oncol 2010; 28: 264–271 19 Haller DG, Tabernero J et al. Capecitabine plus oxaliplatin compared with fluorouracil and folinic acid as adjuvant therapy for stage III colon cancer. J Clin Oncol 2011; 29: 1465–1471 20 Heald B, Husband EM, Ryall RD. The mesorectum in rectal cancer surgery – the clue to pelvic recurrence? Br J Surg 1982; 69: 613–16 21 Kabbinavar FF, Hambleton J, Mass RD et al. Combined analysis of efficacy: the addition of bevacizumab to fluorouracil/leucovorin improves survival for patients with metastatic colorectal cancer. J Clin Oncol 2005; 23: 3706–3712 22 Kerr D, Gray R, Quirke P et al. Validation study of a quantitative multigene reverse transcriptase-polymerase chain reaction assay for assessment of recurrence risk in patients with stage II colon cancer. J Clin Oncol 2011; 29: 4611–4619 23 Maak M, Simon I, Nitsche U et al. Independent validation of a prognostic genomic profile (ColoPrint) for stage II colon cancer (CC) patients. Ann Surg 2013; 1053–1058 24 Masi G et al. A randomized phase III study evaluating the continuation of bevacizumab (BV) beyond progression in metastatic colorectal cancer (mCRC) patients (pts) who received BV as part of first-line treatment: results of the BEBYP trial by the Gruppo Oncologico Nord Ovest (GONO). ESMO 2012; abstr. LBA 17 25 Masi G, Allegrini G, Cupini S et al. First-line treatment of metastatic colorectal cancer with irinotecan, oxaliplatin and 5-fluorouracil/leucovorin (FOLFOXIRI). Ann Oncol 2004; 12: 1766–1772 26 McCleary NJ, Meyerhardt J, Green E et al. Impact of age on the efficacy of newer adjuvant therapies in patients with stage II/III colon cancer: Findings from the ACCENT Database. J Clin Oncol 2013; Jun 3 [Epub ahead of print] 27 Niedzwiecki D, Bertagnolli MM, Warren RS et al. Documenting the natural history of patients with resected stage II adenocarcinoma of the colon after random assignment to adjuvant treatment with edrecolomab or observation. J Clin Oncol 2011; 29: 3146–3152 28 Nordlinger B, Sorbye H, Glimelius B et al. Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983). Lancet 2008; 371: 1007–1016 29 Piessevaux H, Buyse M, De Roock W et al. Radiological tumor size decrease at week 6 is a potent predictor of outcome in chemorefractory metastatic colorectal cancer treated with cetuximab (BOND trial). Ann Oncol 2009; 20: 1375–1382 30 Porschen R, Arkenau HT, Kubicka S et al. Phase III study of capecitabine plus oxaliplatin compared with fluorouracil and leucovorin plus oxaliplatin in metastatic colorectal cancer: a final report of the AIO Colorectal Study Group. J Clin Oncol 2007; 25: 4217–4223 31 QUASAR Collaborative GroupGray R et al. Adjuvant chemotherapy versus observation in patients with colorectal cancer. Lancet 2007; 370: 2020– 2029 32 Reinacher-Schick AC, Bechstein WO. Kolorektale Leberfiliae. Neoadjuvante Chemotherapie aus internistischer und chirurgischer Sicht. Internist 2007; 48: 51–58 33 Robert Koch-Institut. Krebs in Deutschland 2008. http://www.rki.de (letzter Zugriff 24.6.2013) 34 Rödel C, Liersch T, Becker H et al. Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer. Lancet Oncol 2012; 13: 679–687 35 Rosenberg R, Maak M, Schuster T et al. Does a rectal cancer of the upper third behave more like a colon or a rectal cancer? Dis Colon Rectum 2010; 53: 761–770 36 Saltz LB, Clarke S, Diaz-Rubio E et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer. J Clin Oncol 2008; 26: 2013–2019 37 Saltz LB, Cox JV, Blanke C et al. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. N Engl J Med 2000; 343: 905–914 38 Sargent DJ, Marsoni S, Monges G et al. Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J Clin Oncol 2010; 28: 3219–3226 39 Schmiegel W, Reinacher-Schick A, Arnold D et al. Capecitabine/irinotecan or capecitabine/oxaliplatin in combination with bevacizumab is effective and safe as first-line therapy for metastatic colorectal cancer. Ann Oncol 2013; 24: 1580–1587 40 Schmiegel W, Pox C (Steuerungsgruppe für Planung und Durchführung über DGVS). Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): S3-Leitlinie Kolorektales Karzinom, Langversion 1.0, AWMF Registrierungsnummer: 021-007OL (letzter Zugriff 11.07.2013) 41 Schmoll HJ, Van Cutsem E, Stein A et al. ESMO consensus guidelines for management of patients with colon and rectal cancer. Ann Oncol 2012; 23: 2479–2516 42 Tournigand C, Andre T, Achille E et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer. J Clin Oncol 2004; 22: 229–237 43 Tournigand C, André T, Bonnetain F et al. Adjuvant therapy with fluorouracil and oxaliplatin in stage II and elderly patients (between ages 70 and 75 years) with colon cancer. J Clin Oncol 2012; 30: 3353–3360 44 Tournigand C, Cervantes A, Figer A et al. OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-go fashion in advanced colorectal cancer – a GERCOR study. J Clin Oncol 2006; 24: 394–400 45 Twelves C, Wong A, Nowacki MP et al. Capecitabine as adjuvant treatment for stage III colon cancer. N Engl J Med 2005; 352: 2696–2704 46 Van Cutsem E, Köhne CH, Hitre E et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med 2009; 360: 1408–1417 47 Van Cutsem E, Labianca R, Bodoky G et al. Randomized phase III trial comparing biweekly infusional fluorouracil/leucovorin alone or with irinotecan in the adjuvant treatment of stage III colon cancer: PETACC-3. J Clin Oncol 2009; 27: 3117–3125 48 Van Cutsem E, Peeters M et al. Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol 2007; 25: 1658–1664 49 Van Cutsem E, Tabernero J, Lakomy R et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 2012; 30: 1658– 1664 50 Wittekind C, Meyer HJ. UICC: TNM Klassifikation maligner Tumoren. 7. Aufl. Weinheim, Wiley VCH 2010 51 Schmoll H, Haustermans K et al. Preoperative chemoradiotherapy and postoperative chemotherapy with capecitabine and oxaliplatin versus capecitabine alone in locally advanced rectal cancer. J Clin Oncol 2007; 25: (suppl; abstr 3531) 52 Primrose J, Falk S et al. A randomized clinical trial of chemotherapy compared to chemotherapy in combination with cetuximab in k-RAS wildtype patients with operable metastases from colorectal cancer. J Clin Oncol 2013; 31: (suppl; abstr 3504) 53 Oliner KS, Douillard JY et al. Analysis of KRAS/NRAS and BRAF mutations in the phase III PRIME study of panitumumab (pmab) plus FOLFOX versus FOLFOX as first-line treatment (tx) for metastatic colorectal cancer (mCRC). J Clin Oncol 2013; 31:(suppl; abstr 3511) Dtsch Med Wochenschr 2013; 138: 1790–1795 · M. Pohl u. W. Schmiegel, Kolorektale Karzinome – … 1795 Sonderdruck für private Zwecke des Autors Übersicht | Review article