Aktuelle medikamentöse Therapie kolorektaler Karzinome
Werbung
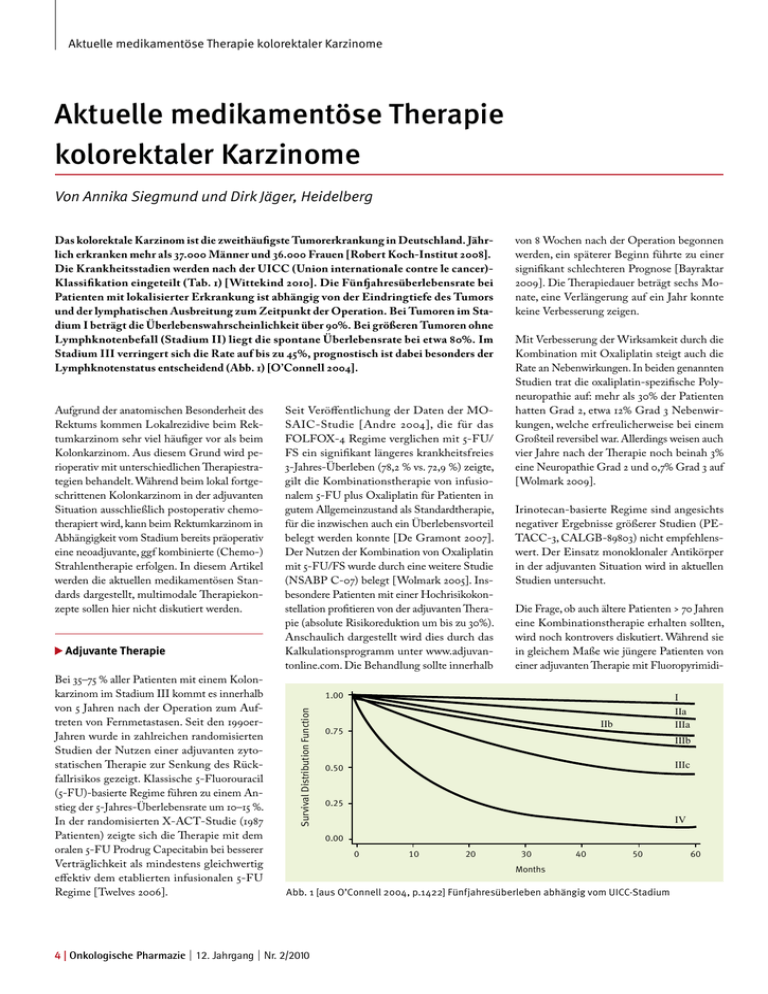
Aktuelle medikamentöse Therapie kolorektaler Karzinome Aktuelle medikamentöse Therapie kolorektaler Karzinome Von Annika Siegmund und Dirk Jäger, Heidelberg Das kolorektale Karzinom ist die zweithäufigste Tumorerkrankung in Deutschland. Jährlich erkranken mehr als 37.000 Männer und 36.000 Frauen [Robert Koch-Institut 2008]. Die Krankheitsstadien werden nach der UICC (Union internationale contre le cancer)Klassifikation eingeteilt (Tab. 1) [Wittekind 2010]. Die Fünfjahresüberlebensrate bei Patienten mit lokalisierter Erkrankung ist abhängig von der Eindringtiefe des Tumors und der lymphatischen Ausbreitung zum Zeitpunkt der Operation. Bei Tumoren im Stadium I beträgt die Überlebenswahrscheinlichkeit über 90%. Bei größeren Tumoren ohne Lymphknotenbefall (Stadium II) liegt die spontane Überlebensrate bei etwa 80%. Im Stadium III verringert sich die Rate auf bis zu 45%, prognostisch ist dabei besonders der Lymphknotenstatus entscheidend (Abb. 1) [O’Connell 2004]. Adjuvante Therapie Bei 35–75 % aller Patienten mit einem Kolonkarzinom im Stadium III kommt es innerhalb von 5 Jahren nach der Operation zum Auftreten von Fernmetastasen. Seit den 1990erJahren wurde in zahlreichen randomisierten Studien der Nutzen einer adjuvanten zytostatischen Therapie zur Senkung des Rückfallrisikos gezeigt. Klassische 5-Fluorouracil (5-FU)-basierte Regime führen zu einem Anstieg der 5-Jahres-Überlebensrate um 10–15 %. In der randomisierten X-ACT-Studie (1987 Patienten) zeigte sich die Therapie mit dem oralen 5-FU Prodrug Capecitabin bei besserer Verträglichkeit als mindestens gleichwertig effektiv dem etablierten infusionalen 5-FU Regime [Twelves 2006]. Seit Veröffentlichung der Daten der MOSAIC-Studie [Andre 2004], die für das FOLFOX-4 Regime verglichen mit 5-FU/ FS ein signifikant längeres krankheitsfreies 3-Jahres-Überleben (78,2 % vs. 72,9 %) zeigte, gilt die Kombinationstherapie von infusionalem 5-FU plus Oxaliplatin für Patienten in gutem Allgemeinzustand als Standardtherapie, für die inzwischen auch ein Überlebensvorteil belegt werden konnte [De Gramont 2007]. Der Nutzen der Kombination von Oxaliplatin mit 5-FU/FS wurde durch eine weitere Studie (NSABP C-07) belegt [Wolmark 2005]. Insbesondere Patienten mit einer Hochrisikokonstellation profitieren von der adjuvanten Therapie (absolute Risikoreduktion um bis zu 30%). Anschaulich dargestellt wird dies durch das Kalkulationsprogramm unter www.adjuvantonline.com. Die Behandlung sollte innerhalb Mit Verbesserung der Wirksamkeit durch die Kombination mit Oxaliplatin steigt auch die Rate an Nebenwirkungen. In beiden genannten Studien trat die oxaliplatin-spezifische Polyneuropathie auf: mehr als 30% der Patienten hatten Grad 2, etwa 12% Grad 3 Nebenwirkungen, welche erfreulicherweise bei einem Großteil reversibel war. Allerdings weisen auch vier Jahre nach der Therapie noch beinah 3% eine Neuropathie Grad 2 und 0,7% Grad 3 auf [Wolmark 2009]. Irinotecan-basierte Regime sind angesichts negativer Ergebnisse größerer Studien (PETACC-3, CALGB-89803) nicht empfehlenswert. Der Einsatz monoklonaler Antikörper in der adjuvanten Situation wird in aktuellen Studien untersucht. Die Frage, ob auch ältere Patienten > 70 Jahren eine Kombinationstherapie erhalten sollten, wird noch kontrovers diskutiert. Während sie in gleichem Maße wie jüngere Patienten von einer adjuvanten Therapie mit Fluoropyrimidi- 1.00 Survival Distribution Function Aufgrund der anatomischen Besonderheit des Rektums kommen Lokalrezidive beim Rektumkarzinom sehr viel häufiger vor als beim Kolonkarzinom. Aus diesem Grund wird perioperativ mit unterschiedlichen Therapiestrategien behandelt. Während beim lokal fortgeschrittenen Kolonkarzinom in der adjuvanten Situation ausschließlich postoperativ chemotherapiert wird, kann beim Rektumkarzinom in Abhängigkeit vom Stadium bereits präoperativ eine neoadjuvante, ggf kombinierte (Chemo-) Strahlentherapie erfolgen. In diesem Artikel werden die aktuellen medikamentösen Standards dargestellt, multimodale Therapiekonzepte sollen hier nicht diskutiert werden. von 8 Wochen nach der Operation begonnen werden, ein späterer Beginn führte zu einer signifikant schlechteren Prognose [Bayraktar 2009]. Die Therapiedauer beträgt sechs Monate, eine Verlängerung auf ein Jahr konnte keine Verbesserung zeigen. I IIa IIIa IIb 0.75 IIIb IIIc 0.50 0.25 IV 0.00 0 10 20 30 40 50 Months Abb. 1 [aus O’Connell 2004, p.1422] Fünfjahresüberleben abhängig vom UICC-Stadium 4 | Onkologische Pharmazie | 12. Jahrgang | Nr. 2/2010 60 Aktuelle medikamentöse Therapie kolorektaler Karzinome Tabelle 1: Stadieneinteilung nach UICC (7. Auflage) [Wittekind 2010] TNM T0 Tis T1 T2 T3 T4 T4a T4b N0 N1 N1a N1b N1c N2 N2a N2b M0 M1 M1a M1b Stadium Stadium 0 Stadium I Stadium IIA Stadium IIB Stadium IIC Stadium IIIA Stadium IIIB Stadium IIIC Stadium IVA Stadium IVB Spezifikation Kein Anhalt für Primärtumor Carcinoma in situ: intraepithelial oder Infiltration der Lamina propria Tumor infiltriert Submukosa Tumor infiltriert Muscularis propria Tumor infiltiert durch die Muscularis propria in die Subserosa oder in nicht peritonealisiertes perikolisches oder perirektales Gewebe Tumor infiltriert direkt in andere Organe oder Strukturen und/oder perforiert das viszerale Peritoneum Tumor perforiert das viszerale Peritoneum Tumor infiltriert direkt in andere Organe oder Strukturen Keine regionären Lymphknotenmetastasen Metastasen in 1-3 regionären Lymphknoten Metastasen in einem regionären Lymphknoten Metastasen in 2-3 regionären Lymphknoten Satellitenherde in der Subserosa ohne regionäre Lymphknoten Metastasen in 4 oder mehr regionären Lymphknoten Metastasen in 4-6 regionären Lymphknoten Metastasen in 7 oder mehr regionären Lymphknoten Keine Fernmetastasen Fernmetastasen Fernmetastasen in einem Organ Fernmetastasen in mehr als einem Organ oder Peritoneum T N M Tis N0 M0 T1, T2 T3 T4a T4b T1, T2 N1 T1 N2a T3, T4 N1 T2-T3 N2a T1-T2 N2b T4a N2a T3-T4a N2b T4b N1-2 Jedes T Jedes N M1a Jedes T Jedes N M1b nen profitieren [Sargent 2001], zeigen aktuelle Studien (NSABP C-08, PETACC-8) und eine Metaanalyse [McCleary 2009] einen Trend zu erhöhter Therapiemortalität bei gleichzeitig nicht belegtem Nutzen. Patientenstatus und „biologisches“ Alter sollten daher bei der Wahl der Therapie berücksichtigt werden. Entsprechend der aktuellen S3-Leitlinien [Schmiegel 2008] werden neben schlechtem Allgemeinzustand unter anderem auch unkontrollierte Infektionen, Leberzirrhose CHILD B und C, schwere koronare Herzerkrankungen und/oder Herzinsuffizienz, (prä-) terminale Niereninsuffizienz und reduzierte Knochenmarkfunktion als Kontraindikationen für die Durchführung einer adjuvanten Chemotherapie genannt. Bei Patienten im Stadium II beträgt die 5-Jahresüberlebensrate um 80%. Obgleich in einer großen Studie auch für dieses Stadium ein Überlebensvorteil durch adjuvante Chemo- therapie gezeigt werden konnte, wird die Indikation zu einer solchen bei einem absoluten Gewinn von etwa 3 – 4 % nach 5 Jahren häufig nicht gestellt [Quasar Collaborative Group 2007]. In retrospektiven Analysen konnte für ausgewählte Risikogruppen (T4-Tumor, Tumorinvasion in Venen oder Lymphgefäßen, Tumorperforation/-einriss, inadäquate Lymphadenektomie (< 12 resezierte Lymphknoten) oder Notfalloperation) ein dem Stadium III entsprechendes Überleben bzw. eine Verbesserung desselben durch Kombinationschemotherapie gezeigt werden [Andre 2004]. Die Empfehlung zur adjuvanten Therapie im Stadium II sollte insbesondere beim Vorliegen von Risikofaktoren sorgfältig mit dem Patienten besprochen werden, hierbei gilt es Nutzen und Nebenwirkungsrisiko abzuwägen. Palliative Therapie Die Behandlungsoptionen des metastasierten kolorektalen Karzinoms haben sich in den letzten Jahren gewandelt, was zu einer deutlichen Verlängerung der Überlebenszeiten geführt hat (Abb. 2) [Kopetz 2009]. Neben neuen verfügbaren Medikamenten sind interdisziplinäre Therapieansätze - und dabei insbesondere die Metastasenresektion - hierbei von großer Bedeutung. Im Falle einer auf die Leber begrenzten Metastasierung überleben etwa 30% der Patienten nach erfolgreicher vollständiger Resektion die nächsten 10 Jahre und können damit als geheilt gelten [Adam 2009]. In den regelmäßigen Verlaufskontrollen zur Evaluation des Therapieansprechens sollte auch bei initial nicht resektablen Metastasen bei gutem Behandlungserfolg immer geprüft werden, ob sekundär nicht doch Tumorfreiheit erzielt werden kann. Entsprechend behandelte Patienten zeigen ein deutlich besseres Überleben als allein chemotherapierte Patienten [Kopetz 2009], dies gilt insbesondere für Patienten, die nach Primäroperation mindestens ein Jahr tumorfrei waren. Im Folgenden werden die aktuell etablierten medikamentösen Behandlungsoptionen dargestellt. Fast 50 Jahre lang galt 5-FU in verschiedenen Regimen und in biochemischer Modulation mittels Folinsäure (FS) als die wichtigste Substanz in der palliativen Therapie des kolorektalen Karzinoms. Mitte der 1990er-Jahre führte die Entwicklung von Kombinationstherapien mit den 5-FU synergistischen Substanzen Irinotecan und Oxaliplatin zur Verlängerung der Onkologische Pharmazie | 12. Jahrgang | Nr. 2/2010 | 5 Aktuelle medikamentöse Therapie kolorektaler Karzinome Für das Alkylanz Oxaliplatin besteht Im Gegensatz zu Cisplatin keine nennenswerte Nephro- oder Ototoxizität, und auch die unter Carboplatin beobachtete ausgeprägte Knochenmarktoxizität ist selten. Die Mehrzahl der Patienten entwickelt allerdings eine überwiegend sensorische Polyneuropathie unterschiedlicher Ausprägungsgrade. Kombinationstherapien mit Oxaliplatin, 5-FU und FS (z.B. FOLFOX) zeigen in der Erstlinientherapie Ansprechraten um 50% bei medianen Überlebenszeiten von 20 Monaten (Zeit zum Progress ca. 9 Monate) [De Gramont 2000; Giacchetti 2000]. Das Camptothecin-Derivat Irinotecan entfaltet seine zytostatische Wirkung durch Hemmung der Topoisomerase I. Häufige therapieassoziierte Nebenwirkung ist eine Diarrhoe. Des Weiteren können auch anaphylaktische Reaktionen, ein sog. cholinerges Syndrom (Schwitzen, Speichel- und Tränenfluss, Sehstörungen und Bradykardie) sowie Alopezie auftreten. Da der aktive Metabolit durch die auch Bilirubin glukuronidierende UDP-Glucuronosyltransferase inaktiviert und mit der Galle ausgeschieden wird, stellen erhöhte Bilirubinwerte eine Kontraindikation gegen die Behandlung dar. Irinotecan basierte Regime (z.B.FOLFIRI) zeigen Ansprechraten von 35 bis 62 % bei einem medianen Gesamtüberleben von 17 bis 20 Monaten (Zeit zum Progress 7 bis 9 Monate) [Douillard 2000; Köhne 2005]. Viele Studien haben seither überwiegend die Gleichwertigkeit der jeweiligen Kombinationen in der Erstlinientherapie festgestellt. Während lange Zeit nach Studienlage die dauerhafte Chemotherapie bis zum Fortschreiten der Erkrankung als Standard angesehen wurde, konnte in der onkologischen Praxis bei Patienten, die unter Erstlinientherapie mindestens eine stabile Erkrankung erreicht hatten, durch Therapiepausen und Wiederaufnahme des zuletzt erfolgreichen Therapieschemas im Progress eine Reduktion der Nebenwirkungen und eine Erhöhung der Lebensqualität erreicht werden. Die Wiederaufnahme des ersten Regimes gilt in diesem Fall als Fortsetzung der Behandlung und nicht als Zweitlinientherapie. In der französischen OPTIMOX-1-Studie wurden Patienten nach einer dreimonatigen intensiven FOLFOX-Therapie entweder weiterhin mit einer FOLFOX-Kombination oder mit 5-FU alleine behandelt, Effektivität und Nebenwirkungen waren dabei vergleichbar [Tournigand 2006]. In der Folgestudie OPTIMOX-2 erhielten die Patienten nach der dreimonatigen intensiven FOLFOX-Therapie bis zum Krankheitsfortschreiten entweder eine Erhaltungstherapie mit 5-FU oder eine Therapiepause. Diese Studie wurde aufgrund des Trends zu einem schlechteren Überleben in der Patientengruppe mit Therapiepause vorzeitig hat insbesondere bei Patienten mit multiplen Metastasen ohne Option für eine sekundäre Resektion nach Metastasenrückbildung ohne tumorbezogene Symptome und/oder schwerer Komorbidität einen hohen Stellenwert. Bei Patienten mit tumorbedingten Symptomen, Organkomplikationen, raschem Progress oder im Falle einer möglichen sekundären Resektabilität nach Remissionsinduktion wird leitliniengerecht eine intensivierte Therapie empfohlen [Schmiegel 2008]. Die Evaluation sämtlicher Sequenzfolgen im Rahmen von klinischen Studien wird nicht 100 1990-1991 1992-1994 1995-1997 1998-2000 2001-2003 2004-2006 80 Overall Survival (%) medianen Überlebenszeit von gut einem Jahr mit 5-FU/FS-Therapie [Simmonds 2000] auf 1,5 Jahre und länger. In aktuellen Phase-IIIStudien mit monoklonalen Antikörpern betragen die medianen Überlebenszeiten annähernd 2 Jahre [Saltz 2008; Van Cutsem 2009]. 60 40 20 0 10 24 36 48 60 Time (months) Abb. 2 [aus Kopetz 2009, p. p.3679] Gesamtüberleben von Patienten mit metastasiertem kolorektalem Karzinom abhängig vom Jahr der Diagnosestellung abgebrochen [Chibaudel 2009]. Diskutabel bleibt ob eine nur dreimonatige Therapiezeit tatsächlich angemessen ist. Das Konzept von Therapiepause bzw. -deeskalation wird in aktuellen Studien weiter untersucht. Belegt ist, dass die Überlebenszeit der Patienten umso mehr verlängert werden kann, je mehr wirksame Medikamente sequentiell verabreicht werden. Im Falle eines Krankheitsforschreitens ist deshalb eine Salvage-Therapie indiziert. Mit einer initialen Kombinationstherapie kann gegenüber einem sequentiellen Einsatz aller wirksamen Medikamente kein klinisch relevanter Überlebensvorteil erreicht werden [Koopman 2007; Seymour 2007]. Das sequentielle Behandlungskonzept mit allen effektiven Zytostatika (Fluorouracil, Irinotecan, Oxaliplatin) praktikabel sein. Bei der Wahl der Therapie sollten sich Arzt und Patient daher neben vorhandenen Begleiterkrankungen insbesondere nach dem typischen Nebenwirkungsprofil richten und eine individuell zu rechtfertigende Einzelentscheidung treffen. Der Ersatz des zu infundierenden 5-FU/FS durch das oral zu verabreichende Capecitabin in den genannten Kombinationstherapien ist nach aktueller Studienlage [Diaz-Rubio 2007; Porschen 2007] ohne Einbuße an Wirksamkeit bei allerdings verändertem Nebenwirkungsprofil möglich, wird in Deutschland aber derzeit noch nicht als Standard angewandt. Bei guter Verträglichkeit und höherer Praktikabilität für den Patienten könnte sich dies in Zukunft allerdings zu Gunsten der überwiegend oralen Onkologische Pharmazie | 12. Jahrgang | Nr. 2/2010 | 7 Aktuelle medikamentöse Therapie kolorektaler Karzinome Behandlung ändern. Neben gastro-intestinalen Nebenwirkungen tritt unter Capecitabin auch das sog. Hand-Fuß-Syndrom, eine mit schmerzhafter Schwellung und Rötung einhergehende erythematöse Hautveränderung an den Handflächen und Fußsohlen, auf. benwirkung (67 %); in Abhängigkeit von der Ausprägung kommen verschiedene symptomatische Therapien zum Einsatz. Bemerkenswert ist dabei, dass Patienten mit Hautreaktionen höhere Remissionsraten und ein längeres medianes Überleben aufweisen. Der Einsatz monoklonaler Antikörper ermöglicht eine weitere Verlängerung des Gesamtüberlebens der Patienten. Für die Kombination des monoklonalen VEGF (Vascular Endothelial Growth Factor) Antikörpers Bevacizumab mit Chemotherapie konnte 2004 erstmals ein Überlebensvorteil von im Median 20,3 Monaten zugunsten der Kombinationstherapie gezeigt werden (gegenüber 15,6 Monaten für Chemotherapie alleine) [Hurwitz 2004]. Bei der Behandlung mit monoklonalen Antikörpern ist zu beachten, dass die Kombination aus anti-VEGF- und anti-EGFR-gerichteter Therapie in aktuellen Studien (Tol 2009; Hecht 2009) unerwarteterweise zu einem verkürzten Progressions-freien Überleben führte. Ein gleichzeitiger Einsatz dieser Medikamente kann daher nicht empfohlen werden. Da Bevacizumab mit physiologischen Prozessen wie der Wundheilung interferien kann und eine Halbwertszeit von etwa 20 Tagen hat, wird empfohlen, operative Eingriffe erst 6 – 7 Wochen nach der letzten Gabe durchzuführen und postoperativ eine Wartezeit von 28 Tagen bzw. den Abschluss der Wundheilung einzuhalten. Als weitere Nebenwirkung sind hypertensive Entgleisungen, insbesondere bei bekanntem, nicht suffizient eingestelltem Hypertonus und in selten Fällen (<1,5 %) Darmperforationen beschrieben. Als weitere biologische Therapien stehen die gegen den epidermalen Wachstumsfaktor-Rezeptor (EGFR) gerichteten Antikörper Cetuximab (chimär) und Panitumumab (vollhumanisiert) zur Verfügung. Patienten mit aktivierenden Mutationen im KRAS-Onkogen, welche sich beim Kolonkarzinom in etwa 40% aller Tumore finden, sprechen nicht auf eine anti-EGFR-gerichtete Therapie an [Amado 2008], so dass beide Antikörper nur bei nachgewiesenem KRAS-Wildtyp zugelassen sind. Die Ansprechraten für die Kombination aus anti-EGFR-gerichteter Behandlung und Chemotherapie liegen in der Erstlinientherapie bei 57%, das Gesamtüberleben bei etwa 23 Monaten [Van Cutsem 2009]. Auch bei vorbehandelten Patienten konnte das progressionsfreie Überleben verlängert werden [Amado 2008], aufgrund des Cross-over-Designs der Studien ist ein signifikanter Effekt für das Gesamtüberleben bisher nicht gezeigt. Da in der Dermis eine hohe EGFR-Expression besteht, ist die als akneiformes Exanthem der Gesichtshaut und des oberen Brustkorbs auftretende Hauttoxizität die häufigste Ne- Fazit In der adjuvanten Situation profitieren Patienten mit einem Kolonkarzinom im Stadium III von einer Kombinationstherapie nach FOLFOX-Protokoll. Bei Kontraindikationen ist auch ein Verzicht auf Oxaliplatin möglich, in diesen Fällen empfiehlt sich aus Gründen der Praktikabilität die Therapie mit dem oralen Fluoropyrimidin Capecitabin. Risikopatienten im Stadium II sollten ebenfalls über die Möglichkeit einer adjuvanten Behandlung aufgeklärt werden. Im metastasierten Stadium sollten jedem Patienten, sofern keine Kontraindikationen bestehen, alle wirksamen Medikamente (5-FU oder Capecitabin, Oxaliplatin, Irinotecan) angeboten werden. Die individuelle Situation und die Nebenwirkungsprofile der Substanzen sind wichtige Entscheidungshilfen für die Sequenz. Durch die Kombination von Chemotherapie und Antikörpern (Bevacizumab sowie bei nachgewiesenem KRAS-Wildtyp auch Cetuximab oder Panitumumab) ist eine weitere Verlängerung des Gesamtüberlebens möglich. Bei Patienten mit begrenzter Metastasierung sollte immer auch die Resektabilität überprüft werden. Literatur Adam R, Wicherts DA, de Haas RJ et al. Patients with initially unresectable colorectal liver metastases: is there a possibility of cure? J Clin Oncol. 2009;27(11):1829-1835. Amado RG, Wolf M, Peeters M et al.: Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol. 2008; 26: 1626-1634. Andre T, Boni C, Mounedji-Boudiaf L et al.: Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med 2004; 350: 2343-2351. 8 | Onkologische Pharmazie | 12. Jahrgang | Nr. 2/2010 Bayraktar UD, Bayraktar S, Herna S et al. Does delay of adjuvant chemotherapy affect the clinical outcome in patients with colon cancer? J Clin Oncol 2009; 27(15S):4046. Chibaudel B, Maindrault-Goebel F, Lledo G et al. Can chemotherapy be discontinued in unresectable metastatic colorectal cancer? The GERCOR OPTIMOX2 Study. J Clin Oncol. 2009;27(34):5727-5733. De Gramont A, Figer A, Seymour M et al. Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J Clin Oncol. 2000;18(16):29382947. De Gramont A, Boni C, Navarro M, et al.: Oxaliplatin/5FU/ LV in adjuvant colon cancer: updated efficacy results of the MOSAIC trial, including survival, with a median follow-up of six years. J Clin Oncol 2007; 25 (18S): 4007. Díaz-Rubio E, Tabernero J, Gomez-Espana A et al. Phase III study of capecitabine plus oxaliplatin compared with continuous-infusion fluorouracil plus oxaliplatin as first-line therapy in metastatic colorectal cancer: final report of the Spanish Cooperative Group for the Treatment of Digestive Tumors Trial. J Clin Oncol 2007; 25: 4224-4230. Douillard JY, Cunningham D, Roth AD et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomised trial. Lancet. 2000;355(9209):10411047. Giacchetti S, Perpoint B, Zidani R et al. Phase III multicenter randomized trial of oxaliplatin added to chronomodulated fluorouracil-leucovorin as first-line treatment of metastatic colorectal cancer. J Clin Oncol. 2000;18(1):136-147. Hecht JR, Mitchell E, Chidiac T et al. A randomized phase IIIB trial of chemotherapy, bevacizumab, and panitumumab compared with chemotherapy and bevacizumab alone for metastatic colorectal cancer. J Clin Oncol. 2009;27(5):672-680. Hurwitz H, Fehrenbacher L, Novotny W et al.: Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004; 350: 2335-2342. Köhne CH, van Cutsem E, Wils J et al. Phase III study of weekly high-dose infusional fluorouracil plus folinic acid with or without irinotecan in patients with metastatic colorectal cancer: European Organisation for Research and Treatment of Cancer Gastrointestinal Group Study 40986. J Clin Oncol. 2005;23(22):4856-4865. Koopman M, Antonini NF, Douma J et al. Sequential versus combination chemo therapy with capecitabine, irinotecan, and oxaliplatin in advanced colorectal cancer (CAIRO): a phase III randomised controlled trial. Lancet 2007; 370: 135-142. Kopetz S, Chang GJ, Overman MJ et al. Improved survival in metastatic colorectal cancer is associated with adoption of hepatic resection and improved chemotherapy. J Clin Oncol. 2009;27(22):3677-3683. McCleary NA, Meyerhardt J, Green E et al. Impact of older age on the efficacy of newer adjuvant therapies in >12,500 patients (pts) with stage II/III colon cancer: Findings from the ACCENT Database. J Clin Oncol 2009; 27(15S):4010. O’Connell JB, Maggard MA, Ko CY. Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging. J Natl Cancer Inst 2004;96(19):1420-1425. Porschen R, Arkenau HT, Kubicka S et al.: Phase III study of capecitabine plus oxaliplatin compared with fluorouracil and Lebender Kolumnentitel leucovorin plus oxaliplatin in metastatic colorectal cancer: a final report of the AIO Colorectal Study Group. J Clin Oncol 2007; 25: 4217-4223. Quasar Collaborative Group. Gray R, Barnwel J et al. Adjuvant chemotherapy versus observation in patients with colorectal cancer: a randomised study. Lancet. 2007;370(9604):2020-2029. Robert Koch-Institut (Hrsg) und die Gesellschaft der epidemiologien Krebsregister in Deutschland e.V. (Hrsg). Krebs in Deutschland 2003-2004. Häufigkeiten und Trends. 6. überarbeitete Auflage. 2008, Berlin. Saltz LB, Clarke S, Díaz-Rubio E et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol. 2008;26(12):2013-2019. Sargent DJ, Goldberg RM, Jacobson SD. A pooled analysis of adjuvant chemotherapy for resected colon cancer in elderly patients. N Engl J Med 2001;345(15):1091-1097. Schmiegel W, Reinacher-Schick A, Arnold D et al. Update S3-guideline „colorectal cancer“ 2008. Z Gastroenterol 2008;46(8):799-840. Seymour MT, Maughan TS, Ledermann JA et al. Different strategies of sequential and combination chemotherapy for patients with poor-prognosis advanced colorectal cancer (MRC FOCUS): A randomised controlled trial. Lancet 2007; 370:143–152. Simmonds PC. Palliative chemotherapy for advanced colorectal cancer: systematic review and meta-analysis. Colorectal Cancer Collaborative Group. BMJ. 2000;321(7260):531-535. Tol J, Koopman M, Cats A et al.: Chemotherapy, Bevacizumab, and Cetuximab in Metastatic Colorectal Cancer. N Engl J Med 2009; 360: 563-572. Tournigand C, Cervantes A, Figer A et al. OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer--a GERCOR study. J Clin Oncol. 2006;24(3):394-400. Twelves CJ. Xeloda in Adjuvant Colon Cancer Therapy (X-ACT) trial: overview of efficacy, safety, and cost-effectiveness. Clin Colorectal Cancer. 2006;6(4):278-287. Van Cutsem E, Köhne CH, Hitre E et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med. 2009;360(14):1408-1417. Wittekind C, Meyer HJ. TNM Klassifikation maligner Tumoren. 7. Auflage. Wiley-VCH, Weinheim 2010. Wolmark N, Wieand S, Kuebler JP. A phase III trial comparing FULV to FULV + oxaliplatin in stage II or III carcinoma of the colon: Results of NSABP Protocol C-07. J Clin Oncol 2005;23(16S):LBA3500. Autoren Dr. med. Annika Siegmund, Heidelberg [email protected] Prof. Dr. med. Dirk Jäger, Heidelberg [email protected] Nationales Centrum für Tumorerkrankungen Abteilung Medizinische Onkologie Im Neuenheimer Feld 350 69120 Heidelberg Onkologische Pharmazie | 12. Jahrgang | Nr. 2/2010 | 9











