Grundwissen 8_NTG - Christoph Probst Gymnasium
Werbung
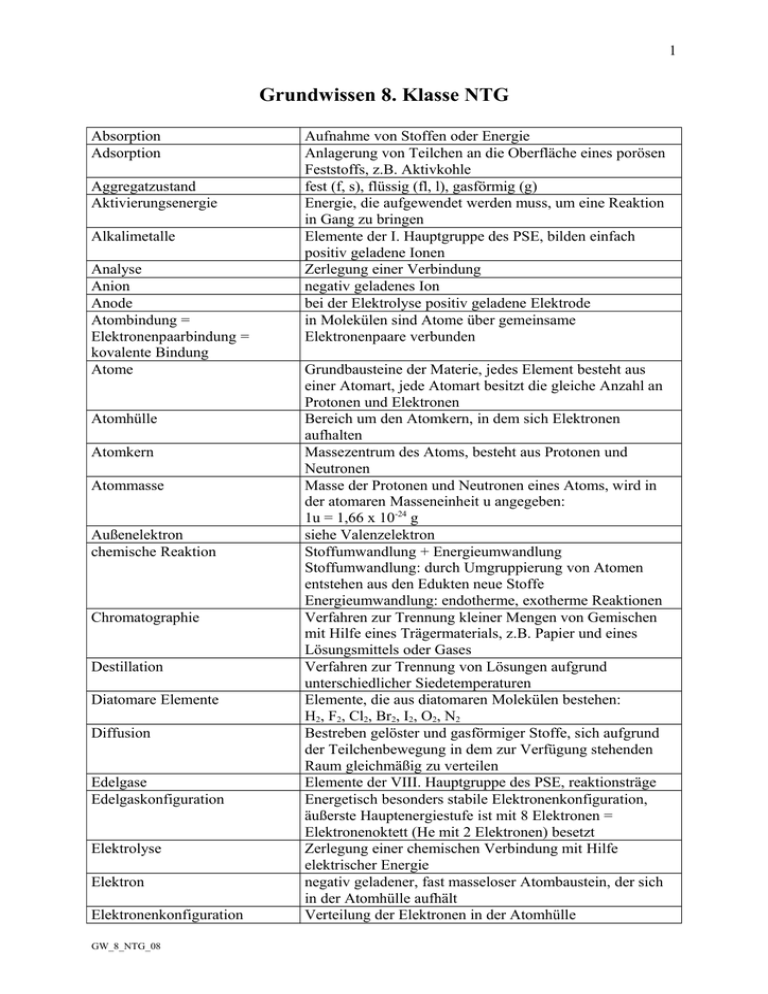
1 Grundwissen 8. Klasse NTG Absorption Adsorption Aggregatzustand Aktivierungsenergie Alkalimetalle Analyse Anion Anode Atombindung = Elektronenpaarbindung = kovalente Bindung Atome Atomhülle Atomkern Atommasse Außenelektron chemische Reaktion Chromatographie Destillation Diatomare Elemente Diffusion Edelgase Edelgaskonfiguration Elektrolyse Elektron Elektronenkonfiguration GW_8_NTG_08 Aufnahme von Stoffen oder Energie Anlagerung von Teilchen an die Oberfläche eines porösen Feststoffs, z.B. Aktivkohle fest (f, s), flüssig (fl, l), gasförmig (g) Energie, die aufgewendet werden muss, um eine Reaktion in Gang zu bringen Elemente der I. Hauptgruppe des PSE, bilden einfach positiv geladene Ionen Zerlegung einer Verbindung negativ geladenes Ion bei der Elektrolyse positiv geladene Elektrode in Molekülen sind Atome über gemeinsame Elektronenpaare verbunden Grundbausteine der Materie, jedes Element besteht aus einer Atomart, jede Atomart besitzt die gleiche Anzahl an Protonen und Elektronen Bereich um den Atomkern, in dem sich Elektronen aufhalten Massezentrum des Atoms, besteht aus Protonen und Neutronen Masse der Protonen und Neutronen eines Atoms, wird in der atomaren Masseneinheit u angegeben: 1u = 1,66 x 10-24 g siehe Valenzelektron Stoffumwandlung + Energieumwandlung Stoffumwandlung: durch Umgruppierung von Atomen entstehen aus den Edukten neue Stoffe Energieumwandlung: endotherme, exotherme Reaktionen Verfahren zur Trennung kleiner Mengen von Gemischen mit Hilfe eines Trägermaterials, z.B. Papier und eines Lösungsmittels oder Gases Verfahren zur Trennung von Lösungen aufgrund unterschiedlicher Siedetemperaturen Elemente, die aus diatomaren Molekülen bestehen: H2, F2, Cl2, Br2, I2, O2, N2 Bestreben gelöster und gasförmiger Stoffe, sich aufgrund der Teilchenbewegung in dem zur Verfügung stehenden Raum gleichmäßig zu verteilen Elemente der VIII. Hauptgruppe des PSE, reaktionsträge Energetisch besonders stabile Elektronenkonfiguration, äußerste Hauptenergiestufe ist mit 8 Elektronen = Elektronenoktett (He mit 2 Elektronen) besetzt Zerlegung einer chemischen Verbindung mit Hilfe elektrischer Energie negativ geladener, fast masseloser Atombaustein, der sich in der Atomhülle aufhält Verteilung der Elektronen in der Atomhülle 2 Element Emulsion endotherme Reaktion Enzym Erdalkalimetalle exotherme Reaktion Extrahieren Formeln Glimmspanprobe Gruppe Halogene Hauptgruppen des gekürzten PSE heterogenes Gemisch homogenes Gemisch innere Energie, ΔEi [kJ] Ionen Ionenbindung Ionenverbindung = Salz Isotope Katalysator GW_8_NTG_08 Reinstoff, der chemisch nicht weiter zerlegt werden kann und aus einer Atomart besteht; dessen Atome besitzen die gleiche Protonenzahl heterogenes Gemisch aus nicht ineinander löslichen Flüssigkeiten Reaktion, bei der aus der Umgebung Energie aufgenommen wird Eiweißmolekül, das als Biokatalysator wirkt Elemente der II. Hauptgruppe des PSE, bilden zweifach positiv geladene Ionen Reaktion, bei der Energie in die Umgebung abgegeben wird Trennverfahren, bei dem lösliche Stoffe aus einem Gemisch herausgelöst werden Verhältnisformel: gibt das Atomzahlenverhältnis an, (CH2O)6 Molekülformel: gibt die Atomzahlen in einem Molekül an, C6H12O6 Strukturformel: gibt die Anordnung der Atome in einem Molekül an Nachweis von Sauerstoff Spalte (senkrecht) im PSE, die Elemente mit der gleichen Zahl an Valenzelektronen enthält Elemente der VII. Hauptgruppe des PSE, bilden einfach negativ geladene Ionen Alkal-, Erdalkali-, Bor-, Kohlenstoff-, Stickstoff-, Sauerstoffgruppe, Halogene, Edelgase mehrphasiges Gemisch mit uneinheitlichem Aussehen mehrphasiges Gemisch mit einheitlichem Aussehen innere Energie eines Stoffes = thermische + chemische Energie Bei chemischen Reaktionen ändert sich die innere Energie, es findet ein Energieaustausch mit der Umgebung statt. ein- oder mehratomige positiv oder negativ geladene Teilchen, Na+, SO4 2Bindung in Ionenverbindungen = Salze, die auf der elektrostatischen Anziehung zwischen entgegengesetzt geladen Ionen beruht aus Ionen aufgebaute Verbindung mit hohem Schmelz- und Siedepunkt; Salzlösungen und –schmelzen leiten den elektrischen Strom Atome eines Elements mit gleicher Protonen- und Elektronenzahl, aber verschiedener Massen- und Neutronenzahl setzt die Aktivierungsenergie herab, erhöht die Reaktionsgeschwindigkeit, nimmt an der Reaktion teil, geht aber unverändert aus ihr hervor, verändert Produkte, aufgenommene bzw. freiwerdende Energie nicht, wirkt in geringen Mengen 3 Kathode Kation Kern-Hülle-Modell Knallgasprobe Kristallgitter = Gitter Lauge Legierung Leiter 1. Klasse Leiter 2. Klasse Lewis-Formel = Valenzstrichformel Lösung Massenzahl Metall Metastabiles System Modell Molekül Molekülmasse Nebel Neutron Nichtmetall Normbedingungen Nukleonen Oktettregel Ordnungszahl Oxidation Periode Periodensystem Proton Radioaktivität GW_8_NTG_08 bei der Elektrolyse negativ geladene Elektrode positiv geladenes Ion Atommodell nach Rutherford: Atom besteht aus Atomkern (positiv geladen, besitzt fast die gesamt Atommasse, besteht aus Neutronen und Protonen) und Atomhülle (negativ geladen, fast masselos, besteht aus Elektronen) Nachweis von Wasserstoff bestehen aus regelmäßig angeordneten Kristallbausteinen (Atome, Ionen oder Moleküle) wässrige Lösung eines Hydroxids homogenes Gemisch aus mehreren Metallen / Amalgam Stoffe, die sich beim Stromdurchfluss nicht verändern; Elektronenleiter; Metalle, Graphit Stoffe, die sich beim Stromdurchfluss verändern; Ionenleiter = Elektrolyte; Salzlösungen und -schmelzen Strukturformel, in der bindende und nichtbindende = freie Elektronenpaare als Strich angegeben werden homogenes flüssiges Gemisch aus mehreren Stoffen Summe der Protonen und Neutronen im Kern, steht beim Elementsymbol oben links Elektronendonator Stabil erscheinendes System, das aufgrund einer hohen Aktivierungsenergie bei Raumtemperatur nur sehr langsam reagiert vereinfachte Darstellung eines Gegenstandes oder Vorgangs, dient zur Veranschaulichung, entspricht nie ganz der Wirklichkeit Atomverbände bestimmter Zusammensetzung Summe der Atommassen heterogenes Gemisch, bei dem eine Flüssigkeit in einem Gas fein verteilt ist ungeladener Kernbaustein, m = 1u Elektronenakzeptor T = 0oC, p = 1013 hPa Gasvolumen unter Normbedingungen: 22,4 l/mol Bausteine des Atomkerns: Protonen und Neutronen Bei der Bildung chemischer Verbindungen erreichen Atome die Edelgaskonfiguration (8 Valenzelektronen). Kernladungszahl, gibt die Anzahl der Protonen und Elektronen an Sauerstoffaufnahme (Reaktion, bei der ein Stoff mit Sauerstoff zu einem Oxid reagiert) Zeile (waagrecht) im PSE, die Elemente mit der gleichen Zahl an Hauptenergiestufen enthält Ordnung der Elemente nach steigender Protonenzahl und chemischer Ähnlichkeit; positiv geladener Kernbaustein, m = 1u Strahlung, die durch den Zerfall von Atomen entsteht: α-, β-, γ- Strahlung 4 Rauch Reaktionsenergie Reaktionsgleichung Salze Schalenmodell Sedimentieren Sublimation Suspension Synthese Tendenzen im PSE Valenzelektronen Verbindung Wertigkeit GW_8_NTG_08 heterogenes Gemisch, bei dem ein Feststoff in einem Gas fein verteilt ist Bei chemischen Reaktionen ändert sich die innere Energie der reagierenden Stoffe, dabei wird Energie mit der Umgebung ausgetauscht (endo-, exotherme Reaktionen). Darstellung einer chemischen Reaktion mit Hilfe von Formeln siehe Ionenverbindung Modell, das den Aufbau der Atomhülle veranschaulicht: Elektronen befinden sich in Schalen, die ein bestimmtes Energieniveau besitzen = Hauptenergiestufen Trennverfahren für Suspensionen: Der Feststoff setzt sich aufgrund seiner Dichte ab. Übergang vom festen in den gasförmigen Zustand heterogenes Gemisch aus unlöslichem Feststoff und einer Flüssigkeit Aufbau einer Verbindung Atomradius ↓ ← Metallcharakter ↓ ← Ionisierungsenergie ↑→ Nichtmetallcharakter ↑→ (Zunahme in Pfeilrichtung) Elektronen in der äußersten Hauptenergiestufe; sie bestimmen die chemischen Eigenschaften des Elements Reinstoff, der durch chemische Reaktionen in andere Stoffe zerlegt werden kann Zahl der Wasserstoffatome, die ein Atom binden kann. Wasserstoff ist einwertig.