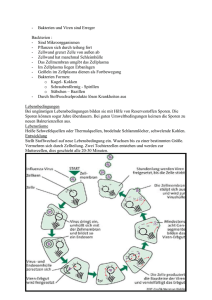
Master-Arbeit Inaktivierung von Sporen und vegetativen Zellen des
Werbung

Fachbereich Agrarwirtschaft und Lebensmittelwissenschaften Masterstudiengang Lebensmittel- und Bioprodukttechnologie Master-Arbeit Inaktivierung von Sporen und vegetativen Zellen des Bakteriums Alicyclobacillus acidoterrestris mit Hilfe von atmosphärischem Kaltplasma URN: urn:nbn:de:gbv:519-thesis2015-0048-7 vorgelegt von: Anne Joppa Erstprüfer: Prof. Dr. Steffens Zweitprüfer: Prof. Dr. Garbe Neubrandenburg, der 02.12.2015 Abstract The aim of this master thesis was to prove an inactivation of vegetative cells and spores of the bacteria Alicyclobacillus acidoterrestris due to the use of atmospheric cold plasma treatment. The germ has been given into a fluid medium as well as onto a plastic surface (Petri dish) and onto a grapefruit pericarp followed by the regarded treatment. In doing so the test results displayed an inactivating effect of the issued procedure to the bacteria. Differences between varying surrounding medias occurred. Whereas the liquid inoculation showed a low mortification of 0.9 logs, the bactericidal effect of the cold plasma on the grapefruit pericarp and the Petri dish was much stronger. The inhibition on the plastic surface also showed in opposite to the grapefruit a superiority by 1 log unit. This effect has been observed at the trial regarding the vegetative cells as well as the trial on spores. An inactivation rate of 4.2 logs during the longest application time has been reached. This suggests, the duration of the treatment is crucial to the extent of the inactivation. A fundamental difference between the inhibition of vegetative cells and spores due to the treatment has not been observed. Abkürzungs- und Symbolverzeichnis Abkürzung Bedeutung A. a. Alicyclobacillus acidoterrestris aW-Wert „activity of water“ = Wasseraktivität DBD „dielectric barrier discharge“ = dielektrisch behinderte Entladungen (DBE) KbE Koloniebildende Einheit(en) MW Mittelwert pH-Wert negativer dekadischer Logarithmus der Wasserstoffionenkonzentration ppb „parts per billion“ = 1 Milliardstel (10-9) ppm „parts per million“ = 1 Millionstel (10-6) Sp. Sporen ssp. Subspezies St.-abw. Standardabweichung veg. vegetativ v.Z. vegetative Zellen YSG-Agar Hefeextrakt-Stärke-Glucose-Agar Formelzeichen Erklärung Einheit c Konzentration g/l E Elektronenvolt eV g Erdbeschleunigung m/s2 L Länge m, cm, mm Λ Wellenlänge nm m Masse g n Drehzahl U/min t Zeit s, min, h, d T Temperatur °C V Volumen μl, ml, l Ø Durchmesser cm Inhaltsverzeichnis 1 Einleitung ................................................................................................................................ 6 2 Stand der Wissenschaft und Technik ...................................................................................... 8 2.1 Alicyclobacillus acidoterrestris........................................................................................ 8 2.1.1 Auftreten .................................................................................................................... 8 2.1.2 Beschreibung ............................................................................................................. 8 2.1.3 Reaktionsprodukte von A. a. ..................................................................................... 9 2.1.4 Sporen...................................................................................................................... 11 2.1.4.1 Ursache der Sporenbildung .............................................................................. 11 2.1.4.2 Bildung ............................................................................................................. 12 2.1.4.3 Auskeimung ..................................................................................................... 13 2.1.4.4 Resistenz........................................................................................................... 14 2.1.5 Dekontaminationsverfahren .................................................................................... 15 2.3 Kaltplasma im Lebensmittelbereich ............................................................................... 16 2.3.1 Definition ................................................................................................................ 16 2.3.2 Einteilung nach der Positionierung des Lebensmittels ........................................... 18 2.3.3 Funktionsweise der Inaktivierung von Mikroorganismen ...................................... 20 2.3.4 Einfluss auf Lebensmittel ........................................................................................ 21 2.3.5 Anwendung im Lebensmittelbereich ...................................................................... 21 2.4 Zitrusfrüchte ................................................................................................................... 23 3 Material und Methoden ......................................................................................................... 24 3.1 Verwendete Mikroorganismen und Materialien............................................................. 24 3.2 Geräte ............................................................................................................................. 25 3.3 Vorbereitung der Versuche ............................................................................................ 25 3.4 Vorbereitung des Oberflächenplasmageräts ................................................................... 26 3.5 Durchführung der Versuche ........................................................................................... 27 3.5.1 Vorversuche ............................................................................................................ 27 3.5.2 Plasmabehandlung von A. a. in einer Flüssigkeit.................................................... 29 3.5.3 Plasmabehandlung von A. a. auf einer Kunststoffoberfläche (Petrischale) ............ 29 3.5.4 Plasmabehandlung von A. a. auf einer Grapefruitschale......................................... 31 3.5.5 Vergleich der Plasmabehandlung von A. a. auf einer Grapefruitschale mit der Behandlung mit UV-Strahlen ........................................................................................... 32 3.5.6 Statistische Auswertung .......................................................................................... 33 4 Ergebnisse ............................................................................................................................. 34 4.1 Vorversuche ................................................................................................................... 34 4.2 Plasmabehandlung von A. a. in einer Flüssigkeit........................................................... 36 4.3 Plasmabehandlung von A. a. auf einer Kunststoffoberfläche (Petrischale) ................... 37 4.4 Plasmabehandlung von A. a. auf einer Grapefruitschale................................................ 42 4.5 Vergleich der Plasmabehandlung von A. a. auf einer Grapefruitschale mit der Behandlung mit UV-Strahlen ............................................................................................... 46 5 Diskussion ............................................................................................................................. 49 6 Zusammenfassung ................................................................................................................. 52 7 Literaturverzeichnis ............................................................................................................... 53 8 Abbildungs- und Tabellenverzeichnis ................................................................................... 59 9 Anlagen ................................................................................................................................. 61 1 Einleitung Eine Kernfrage der Gegenwart ist die Gewährleistung der Ernährung für eine stetig wachsende Weltbevölkerung und damit verbunden die Verhinderung des vorzeitigen Verderbs vorhandener Lebensmittel. Auf dem Weltmarkt steht eine Vielzahl von Obst zur Verfügung. Dieses reicht von einheimischen Früchten wie Äpfeln, Birnen oder Blaubeeren bis exotischen wie Bananen, Kiwis oder auch Orangen und Grapefruits. Allen gemein ist, wie auch bei anderen natürlichen Produkten, dass Mikroorganismen auf diesen vorkommen. Dabei gibt es neben Schimmelpilzen und Hefen, die die Hauptverursacher für mikrobiellen Verderb auf Früchten darstellen, auch einige Bakterien, die bei der Obstverarbeitung eine größere Rolle spielen (Müller, 1997; Innerhofer, 2005). Dazu zählen neben Essigsäure-, Milchsäure- und Buttersäurebakterien auch die Bakterien der Gattung Alicyclobacillus. Diese Mikroorganismen sind zwar nicht pathogen, allerdings verursachen sie beispielsweise in der Getränkeindustrie jährlich einen Schaden in Millionenhöhe, indem sie einen Stoff produzieren, das sogenannte Guajacol, der die Sensorik beeinträchtigt und somit das Produkt letztendlich nicht mehr verzehrfähig macht. Die Art Alicyclobacillus acidoterrestris hat dabei die größte Bedeutung. In der Lebensmittelindustrie ist es daher wichtig, möglichst Produkte herzustellen, die nur wenige solcher Mikroorganismen enthalten bzw. frei von diesen sind. Allerdings ist dieses Bakterium nur schwer abzutöten, da es sowohl hitzeresistent, acidophil als auch sporenbildend ist. Gerade bei der Herstellung von Säften wie z.B. Orangensaft, wo dieser Keim vermehrt auftritt, stellt sich die Frage wie dieser Mikroorganismus inaktiviert oder entfernt werden kann. Weder eine längere Pasteurisation noch das saure Milieu hindern den Keim am Wachstum und an der Produktion von Guajacol. (Tianli et al., 2012; Clotteau, 2014) So ist ein Ansatz, den Mikroorganismus vor der Weiterverarbeitung zu inaktivieren. Dazu existieren schon mehrere Verfahren, die allerdings aus unterschiedlichen Gründen nicht optimal sind. Beispielsweise werden Verfahren wie γ-Strahlen, die zu einer schnellen nicht thermischen Dekontamination beitragen, aufgrund fehlender gesetzlicher Regelungen und geringer Verbraucherakzeptanz nicht eingesetzt (Reineke, 2013). Methoden, die UV-Strahlung beinhalten, beschädigen bei höheren Dosen das Lebensmittel. Desinfektionsflüssigkeiten wie Chlor oder Wasserstoffperoxid kommen aufgrund ihrer Aggressivität und Gesundheitsgefahr für den Anwender durch entstehende Dämpfe auch eher selten in Frage. (Clotteau, 2014; Beer, 2009) Eine Möglichkeit jedoch, die noch nicht lange verfolgt wird, ist die Anwendung von Plasmen zur Verringerung bzw. Inhibierung von Mikroorganismen. Dabei ist vor allem Kaltplasma interessant, da das Rohmaterial bei geringen Temperaturen damit behandelt werden kann. Bei 6 verschiedensten Früchten bzw. Oberflächen wurde dieses bereits angewandt und zeigte Erfolge in der Hemmung. Deswegen sollen in dieser Arbeit Versuche unternommen werden, die vegetativen Zellen bzw. die Sporen von Alicyclobacillus acidoterrestris mit atmosphärischen Kaltplasma abzutöten bzw. zu inaktivieren. Dabei sollen sowohl Experimente durchgeführt werden, wo der Keim in einer Flüssigkeit vorliegt als auch auf zwei verschiedenen Oberflächen fixiert ist. Das Bakterium A. a. soll im verbrauchten Nährmedium auf einer Kunststoffoberfläche (Petrischale) und auf einer Grapefruitschale inaktiviert werden. 7 2 Stand der Wissenschaft und Technik 2.1 Alicyclobacillus acidoterrestris 2.1.1 Auftreten Das Bakterium Alicyclobacillus acidoterrestris wurde erstmals 1982 in Deutschland als Ursache für einen großflächigen Verderb von Apfelsäften nachgewiesen. (Cerny et al., 1984) Die Kontaminationsquelle ist der Boden. Der Keim kommt auf sehr vielen verschiedenen Früchten wie Äpfeln, Orangen, Bananen, Wassermelonen, Grapefruits, Blaubeeren sowie Zitronen vor. (Takahashi et al., 2007; Tianli et al., 2014) Somit ist er bei unterschiedlichen Produkten wie Säften, Saftmischungen, -konzentraten, kohlensäurehaltigen Fruchtgetränken und haltbaren Eistees zu finden. (Clotteau, 2014) Vielfältige Untersuchungen zum Vorkommen dieses Keims wurden daraufhin unternommen. In einer Studie der AIJN (European Fruit Juice Association) im Jahr 2005 stellte sich heraus, dass bei 45 % der 68 untersuchten industriellen Früchteverarbeiter Alicyclobacillus bereits mindestens einmal als Verderbniskeim auftrat. (Tianli et al., 2014) Bei einer anderen Befragung zeigte sich das sogar bei 60 % von 57 Firmen, wovon 35 % speziell auf Alicyclobacillus acidoterrestris zurückzuführen war. (Lee et al., 2002) Prinzipiell sind dabei bestimmte Produkte anfälliger als andere. Bei einer Analyse wurden verschiedene Risikoniveaus für die Kontamination ermittelt. Laut Clotteau (2014) sind Fruchtkonzentrate (Orange, Mango, Kokosnuss, Ananas) 8 % gefährdet, Fruchtsäfte für die Vermischung 9 bis 42,1 %, Orangensäfte 14,7 %, frische Saftprodukte 32 %, Apfelsaftkonzentrate 30,5 bis 75 %, und Orangensaftkonzentrate 82,1 %. Insgesamt gibt es allerdings kaum Statistiken, die sich mit den finanziellen Schäden dieses Keims direkt auseinandersetzen. Bei einer Berechnung aus den USA von Kang (2006) entstanden durch Alicyclobacillus spp. 0,41 Millionen US-Dollar Schaden allein im Bundesstaat Washington. Schließlich ist hieraus ersichtlich, dass dieser Keim in der Industrie auf jeden Fall Beachtung geschenkt werden sollte. 2.1.2 Beschreibung Alicyclobacillus acidoterrestris ist ein gram-positives Stäbchen. Vegetative Zellen können zwischen 2,9 bis 4,3 μm lang und 0,6 bis 0,8 μm breit werden. Zudem lebt der Mikroorganismus obligatorisch aerob. Bei ungünstigen Umweltbedingungen bildet es Endosporen aus. (Wisotzjsey et al., 1992) Es ist frei beweglich und Katalase-positiv. Sein Gehalt an Cytosin und Guanin liegt bei 51,6 bis 53,3 %. Der aw-Wert für das Wachstum des Mikroorganismus sollte über 0,984 liegen. Optimal sind 0,992. (Bevilacqua et al., 2008b) Der Temperaturbereich, indem das Bakterium überleben kann, liegt im Bereich von 20 bis 70 °C, sein pH-Bereich bei 8 2,2 bis 5,8, wobei eine Temperatur von 40 bis 45 °C und ein pH-Wert von 4,0 bis 4,5 optimal sind. (Tianli et al., 2014; Bevilacqua et al., 2008b) Alicyclobacillus acidoterrestris gehört somit zu den thermo- und acidophilen Keimen. Gegenüber NaCl ist es relativ tolerant. Erst bei der Anwesenheit von 5 % NaCl ist der Organismus nicht mehr in der Lage zu wachsen. (Wisotzjsey et al., 1992) Für seinen Stoffwechsel kann er verwenden: D-Glucose, Erythritol, D-Ribose, DXylose, D-Fructose, D-Mannose, Rhamnose, Glycerol, D-Galctose, L-Arabinose, Inositol, Mannitol, D-Sorbitol, Arbutin, Salicin, Cellobiose, Maltose, Lactose, Xylitol, D-Arabitol und Gentiobiose. (Tsuruoka et. al., 2003) Der Name dieses Keims stammt dabei von den verschiedenen ω-Cyclohexan-Fettsäuren, die in der Zellmembran dieses Bakteriums eingelagert sind. Auf diese ist auch die extreme Säure- und Temperaturresistenz zurückzuführen. Sie ermöglichen eine kompakte und stabile Struktur der Membranlipide. (Kannenberg et al., 1984) Die konkrete Zusammensetzung der Fettsäuren ist: 65,1 % ω-Cyclohexan-C17:0, 24,0 % ω-Cyclohexan-C19:0, 4,1 % 17:0 anteiso, 2,5 % 17:0 iso, 2,5 % 16:0 und Spuren von 15:0 iso und 15:0 anteiso. (Tsuruoka et al., 2003) Für die Kultivierung oder Isolierung von A. acidoterrestris wurden unterschiedliche Untersuchungen durchgeführt. Walls und Chuyate (2000) testeten Nährmedien wie OrangenSerum-Agar (OSA) oder K-Agar auf ihren möglichen Einsatz. Dabei stellte sich K-Agar als am besten geeignetstes Medium für die Isolation von Sporen heraus. Überdies gibt es weitere Medien, die für A. a. geeignet sind: angesäuerter Kartoffel-Dextrose-Agar (APDA), Hefeextrakt-Stärke-Glucose-Agar (YSG), Hiraishi-Glucose-Hefeextrakt-Agar (HGYE), B. acidoterrestris thermophiles Medium B. acidocaldarius Medium (BAT-BAM), Alicyclobacillus Medium (ALI), A. acidoterrestris Medium (AAM), SK-Agar und angesäuerter Malzextrakt Agar (MEA). (Bevilacqua et al., 2008b) YSG-Agar entspricht dabei der IFU (Internationale Fruchtsaft Union)-Standard Methode Nr. 12 für den Nachweis von Verderb produzierenden Organismen in Fruchtsäften. (Yokota et al., 2007) Beim Wachstum dieses Bakteriums auf Agar sind die Kolonien rundlich, cremefarben und teilweise transparent. Innerhalb von 6 Tagen bei einem pH-Wert von 4,0 und einer Temperatur von 50 °C können sie je nach Eignung des Mediums 3 bis 5 mm im Durchmesser betragen. (Wisotzjsey et al., 1992) 2.1.3 Reaktionsprodukte von A. a. Alicyclobacillus acidoterrestris ist ein nicht pathogener Mikroorganismus. Bei Tests mit A. a. an Mäusen und Meerschweinchen kam es zu keinerlei Beeinträchtigung. (Walls; Chuyate, 2000) Das wesentliche Problem mit diesem Keim ist die Produktion von geschmacks- und geruchsverändernden Bestandteilen. Bei sensorischen Verkostungen wurde der Geschmack 9 bzw. Geruch der verdorbenen Produkte als medizinisch, phenolisch, desinfektionsmittelartig oder rauchig beschrieben. (Clotteau, 2014). Die Haupt-Off-Flavors sind Guajacol (2methoxyphenol) und Halophenole (2,6-dibromophenol und 2,6-dichlorophenol). Bei deren Produktion entstehen allerdings keine Gase, sodass ein Verderb rein äußerlich nicht sichtbar ist. Nur manche Lebensmittel zeigen dabei Sedimente, Trübungen oder Farbveränderungen. Sensorisch wahrnehmbar ist Guajacol schon bei sehr geringen Mengen. Untersuchungen zeigten, dass bereits 0,01 bis 40 ppb reichten, um den Geruch und Geschmack erkennbar zu verändern. Guajacol wird mit Zwischenschritten aus der organischen Verbindung Ferulasäure, 4-vinylguajacol, Vanillinsäure oder direkt aus Vanillin durch den Keim gebildet. Nicht gänzlich geklärt ist eine mögliche Entstehung von Guajacol aus Tyrosin. (Tianli et al., 2014) Die Erzeugung der Stoffe Guajacol und Halophenole wird dabei durch unterschiedliche Faktoren beeinflusst. Dazu zählen vor allem der Ausgangsstoff des Saftes, die Zellkonzentration, die Temperatur und die Hitzeschockanwendung. Dabei tritt bei Apfel- und Orangensäften am häufigsten ein Verderb auf, während manche andere Säfte für das Überleben von Alicyclobacillus ungeeignet sind. Die Konzentration an Zellen muss etwa 104-105 KbE/ml betragen, bevor eine Produktion eintritt. Zudem ist eine stärkere Zunahme der Verderbnis auslösenden Stoffe bei höheren Temperaturen in bestimmten Bereichen zu finden. (Tianli et al., 2014; Clotteau, 2014) Laut Goto et al. (2008) waren manche Stämme von Alicyclobacillus acidoterrestris bei 45 °C schon nach 5 h in der Lage, über 40 ppm Guajacol herzustellen. Pettipher et al. (1997) stellte eine Produktion auch bei einer niedrigeren Temperatur von 25 °C fest. Nach 6 Tagen waren 14,1 ppb Guajacol bei einer Zellkonzentration von 6∙105 KbE/ml im Orangensaft vorhanden, im Apfelsaft nach 10 Tagen 11,6 ppb bei einer Keimzahl von 2∙107 KbE/ml. Schließlich spielt auch eine Hitzeschockanwendung, wie diese bei der Pasteurisation eintritt, eine entscheidende Rolle. Dabei werden die Endosporen angeregt, wieder auszukeimen, und tragen so zur Erhöhung der Keimzahl und zur Produktion von Guajacol bei. (Tianli et al., 2014; Clotteau, 2014) Mittlerweile stehen chemische Verfahren wie auch Nachweiskits zur Verfügung, um diese Verbindung qualitativ oder auch quantitativ zu bestimmen. Dazu werden sowohl Extraktions- als auch chromatografische Verfahren wie z.B. Festphasenextraktion oder Hochleistungsflüssigkeitschromatografie eingesetzt. (Tianli et al., 2014) 10 2.1.4 Sporen 2.1.4.1 Ursache der Sporenbildung Sporen, sogenannte Endosporen, sind stoffwechselinaktive Dauerformen. (Unden, 2014) Erkennbar sind sie anhand typischer Merkmale wie ein extrem geringer Wassergehalt, keinerlei nachweisbare Stoffwechselaktivität und Vorkommen der Verbindung Dipicolinsäure. (Cypionka, 2010) Zur Bildung der Sporen kommt es, wenn ein Nährstoffmangel induziert wird. Sinken wachstumslimitierende Faktoren wie zum Beispiel Glucose unter einen kritischen Wert, dann werden etwa 200 Gene für den Sporulationsprozess aktiv. Es erfolgt eine differentielle Genexpression, bei denen die Gene der vegetativen Zellen wiederum inaktiv werden. (Fritsche, 2002) Der letztendliche Impuls der Zelle zur Sporulation entsteht dabei durch verschiedene zelluläre und extrazelluläre Faktoren und Reize, die durch eine mehrstufige Phosphorylierungskaskade ausgelöst und durch einen sogenannten Phosphatschalter wahrgenommen werden. Dabei sind z.B. Energie- und Redoxstatus oder der Zellzyklus solche Faktoren. Sie regulieren die Aktivität von vier Sensorkinasen (KinA-KinD), die wiederum auf drei bestimmte Phosphoproteine mit Asp- oder His-Resten durch Phosphorylierung auf verschiedenen Ebenen einwirken. Ein hoher ATP-Gehalt (als Kennzeichen für gute Energieversorgung) oder eine aktive Chromosomenreplikation (als Merkmal für vegetatives Wachstum) hemmen die Kinasen direkt oder indirekt. Zudem existiert ein Phosphorelay, welches durch Phosphatasen in Abhängigkeit von zellulären Reizen dephosphoryliert und damit inaktiviert wird. Diese wirken im Zusammenspiel auf das Schalterprotein Spo0A ein. Bei ausreichender Phosphorylierung des Proteins ist die Differenzierung irreversibel. Das Protein schaltet dann die Expression der Sporulationsgene an und es kommt zur Sporenbildung. (Unden, 2014; Fritsche, 2012) 11 2.1.4.2 Bildung Die genaue morphologische Differenzierung ist in acht Entwicklungsstufen (0-VII) eingeteilt. (Unden, 2014) (Siehe Abbildung 1) Abbildung 1: Morphologische Veränderungen während der Sporulation von 0-VII (Unden, 2014) Der gesamte Prozess kann etwa 7 bis 8 Stunden dauern. Zu Beginn kommt es zu einem Proteinturnover. Es werden bestimmte Eiweiße abgebaut und Proteine neu synthetisiert. Das Chromosom wird repliziert. (0) Zudem erfolgt eine Kernteilung, allerdings ohne anschließende Zellteilung. Es findet eine asymmetrische Abschnürung eines kleinen Teils des Cytoplasmas mit einem Kernäquivalent statt, auch Sporenprotoplast genannt, woraus sich die letztendliche Endospore in der Sporenmutterzelle entwickelt. (I) Dabei verteilt sich jeweils eine Kopie der DNA auf die entstandenen Protoplasten. (II) Im Anschluss umwächst die Cytoplasmamembran der Mutterzelle die Vorspore. Sie ist dann insgesamt von drei Membranen umgeben: einer Cytoplasmamembran des Sporenprotoplasten und zwei Cytoplasmamembranen der Sporenmutterzelle. (III) Aus diesen Membranen werden die Sporenwandschichten gebildet. Die Sporenzellwand, auch Core genannt, entsteht aus der Vorsporenmembran. Zudem wird durch Anlagerung von mehreren Schichten dicht vernetzter Peptidoglykane die Sporenrinde oder Cortex von der Sporenmutterzelle nach innen synthetisiert. (IV) Der Vernetzungsgrad und die chemische Zusammensetzung des Peptidoglykangerüsts ist dabei unterschiedlich dem von vegetativen Zellen. Daraufhin beginnt die Dehydrierung. In der V. Phase folgt die Bildung der 12 Sporenhülle bzw. Coat, die überwiegend aus Polypeptiden besteht. Ein locker anliegendes Exosporum wird allerdings bei Alicyclobacillus acidoterrestris nicht gebildet. (VI) Abschließend erfolgt die Autolyse der Sporenmutterzelle und somit die Freisetzung der Endospore. (VII) (Fritsche, 2002; Unden, 2014) Diese ist elliptisch und etwa 1,5 bis 1,8 μm lang und 0,9 bis 1,0 μm breit. (Yokota et al., 2007; Clotteau, 2014) Dieser Prozess wird durch räumlich und zeitlich getrennt arbeitende Zweikomponentensysteme, sowie spezifische σ-Faktoren und Anti-σ-Faktoren reguliert. Durch die unterschiedliche Größe der beiden Kompartimente (Sporenmutterzelle und Vorspore) entstehen Konzentrationseffekte. Zudem kommt es durch die zu Beginn asymmetrisch vorliegenden chromosomalen Gene zwischen Vorspore und Mutterzelle zu Synthesen der unterschiedlichen Faktoren σ E, σK, σF und σG und damit zum Start von Expressions- und Differenzierungsprogrammen. Während der Anti-σF-Faktor in der Vorspore beispielsweise nicht synthetisiert wird, ist das in der Mutterzelle in zwei Loci (Genorten) der Fall. Dadurch findet das σF-abhängige Differenzierungsprogramm in der Vorspore statt. In der Mutterzelle ist es hingegen inaktiviert. Durch die einzelnen σ-Faktoren werden der Reihe nach die Expression weiterer Transkriptionsfaktoren reguliert, wodurch kompartimentsspezifische Proteine gebildet werden. Die Richtigkeit der zeitlichen Abfolge wird dabei durch einen Austausch von Signalen zwischen der Vorspore und der Mutterzelle durch die Membranen gewährleistet. In der Mutterzelle kommt es durch den σE-Faktor zum Umwachsen der Spore, zur Bildung der Cortex und der Hülle. σK-Faktor hingegen leitet die Phase IV und V in der Mutterzelle ein. Die σF und σG-Faktoren spielen, wie bereits erwähnt, in der Vorspore eine Rolle. Sie sorgen für den Beginn der II. Stufe (σF) bzw. der III. Phase, der Konservierung der DNA und die Vorbereitung der Keimung (σG). (Unden, 2014) 2.1.4.3 Auskeimung Die Auskeimung der Sporen erfolgt unter günstigen Umweltbedingungen. Frisch ausgebildete Sporen sind dazu nicht in der Lage. Sie müssen eine Ruhephase einlegen, die jedoch durch einen Hitzeschock wie ein Aufkochen oder mehrere Stunden Erwärmung bei 60 °C umgangen werden kann. (Fritsche, 2002) Dabei kommt es zur Ausscheidung der Dipicolinsäure und zur Freisetzung von Kationen. Es wird Wasser aufgenommen. Dadurch erfolgt der hydrolytische Abbau der Cortex. Zudem dehnt sich die Zellwand wieder aus und es kommt zu einer Stoffwechselumschaltung. (Schneider, 2014) Die zuvor katalytisch inaktiven Enzyme des Primärstoffwechsels werden reaktiviert. Außerdem erfolgen die Bildung von ATP und NADH aus gespeicherten niedermolekularen Substanzen durch den Katabolismus und der Abbau von 13 Reserveproteinen durch Proteasen. Überdies entstehen während des Auswachens Proteine, die spezifisch für diese Phase sind und vermutlich eine regulierende Funktion haben. (Fritsche, 2002) Schließlich werden auch RNA und DNA synthetisiert. Die keimende, vegetative Zelle befreit sich von der Sporenhülle und beginnt wieder mit der Zellteilung. (Fritsche, 2002; Schneider, 2014) 2.1.4.4 Resistenz Die Endosporen sind laut Cypionka (2010) in der Lage, kurzfristige Erhitzungen von 80 °C, wie sie bei einer Pasteurisation vorkommen, zu überstehen. Nach Fritsche (2002) vertragen sie aber auch stundenlanges Kochen, jahrzehntelange Trockenheit und die Einwirkung von aggressiven Chemikalien. Zudem sind sie resistent gegen ionisierende Strahlung (Unden, 2014). Die Resistenz gegenüber Hitze liegt dabei vor allem an der Bildung von Dipicolinsäure. Sie ist eine Vorstufe des Dihydrodipicolinsäure, die bei der Lysinsynthese hervorgeht. Während der Synthese wird eine große Menge an Ca2+-Ionen aufgenommen, sodass die Dipicolinsäure vermutlich als Calciumchelatkomplex vorliegt. Dieser Komplex befindet sich im Protoplasten und nimmt etwa 10-15 % der Sporentrockensubstanz ein. Die genaue Funktion ist allerdings noch nicht geklärt. (Fritsche, 2002) Die Hitzeresistenz geht allerdings, wie in 2.1.2 schon erwähnt, auch von den enthaltenen ω-Cyclohexan-Fettsäuren aus. (Kannenberg et al., 1984) Zur Definition wie stark eine Sterilisation bzw. Hitzeresistenz ist, werden der D- und z-Wert verwendet. Der D-Wert stellt die Zeit dar, bei der nur noch ein Zehntel der Population zurück bleibt. Der z-Wert hingegen gibt den Betrag an, der bei der Temperatur erhöht werden muss, um den D-Wert auf ein Zehntel zu reduzieren, d.h. den Inaktivierungsgrad auf das Zehnfache zu erhöhen. (Keding, 1993) Je nach Stamm von Alicyclobacillus acidoterrestris kann die Hitzeresistenz laut Silva und Gibbs (2001) unterschiedlich ausfallen, sodass D95 °C-Werte in Säften von 0,06 bis 5,3 min und z-Werte von 7,2 bis 12,9 °C entstehen. Andere Studien ermittelten zudem D90 °C-Werte von 16 bis 23 min. (Lee et al., 2002; Bevilacqua et al., 2008b) Typische Bedingungen einer Pasteurisation (86 bis 96 °C für 15 s bis 2 min) von Säften werden dadurch überstanden. Die Sporen werden im Gegenteil sogar zum Auskeimen stimuliert. (Clotteau, 2014) Verschiedene Parameter können den Effekt der Sterilisation verstärken oder schwächen. Dazu zählen der pH-Wert, der Trockensubstanzgehalt, das umgebene Medium und vorhandene zweiwertige Kationen. (Tianli et al., 2014) Vegetative Zellen werden hingegen bei einem pH-Wert von 4,0 bei einer 20-minütigen 80 °C Behandlung zu 99 % abgetötet. (Clotteau, 2014) 14 2.1.5 Dekontaminationsverfahren Es gab bisher vielfältige chemische und physikalische (oder auch beide in Kombination angewandt) Verfahren, die zur Inaktivierung von Alicyclobacillus acidoterrestris eingesetzt wurden. Dabei kann allerdings nicht gesagt werden, welches die effektivste Methode ist. Ein Vergleich der Wirksamkeit ist schwierig, da sowohl unterschiedliche Stämme, Medien als auch Versuchsbedingungen verwendet wurden. Teilweise waren selbst die Ergebnisse innerhalb einer Studie unterschiedlich. (Tianli et al., 2014) Zur Inaktivierung des Bakteriums wurden unter anderem verschiedene Stoffe wie ätherische Öle, Bakterizide, Lysozyme, immobilisierte Silberionen, Chlordioxid, Ozon, Desinfektionsmittel, überkritisches CO2 und Säuren in Versuchen getestet. Zudem wurde mit physikalischen Methoden wie Hochdruckhomogenisierung, hoher hydrostatischer Druck, Mikro- und Ultraschallwellen, Ohmsche Erwärmung, Gammastrahlung, UV-C Licht und thermischen Technologien experimentiert. (Tianli et al., 2014) Davon zeigten die angewandten Verfahren eine verschieden starke Wirkung auf den Mikroorganismus. Beispielsweise verlangsamten oder behinderten ätherische Öle wie Eugenol oder Zimtaldehyde die Sporenauskeimung. (Bevilaqua et al., 2008a) Nisin als Beispiel für ein Bakterizid verringerte bei einer Studie von Yamazaki et al. (2000) den D90 °C-Wert um 70 % und verhinderte das Auskeimen von Sporen. Der Effekt in Apfelsäften war allerdings, wahrscheinlich durch die enthaltenen Phenole, stark eingeschränkt. Zudem sind die Kosten dieses Stoffs erhöht. Lysozyme in der Studie von Bevilaqua et al. (2014) zeigten bei einer Konzentration von 0,25 bis 1 g/l eine Inhibierung von 100 %. Beim Einsatz von Ozon kam es zur Inaktivierung von 3 Log-Stufen bei 28 mg/ml und 60 s und zur vollständigen Inhibierung bei 18 mg/ml und 90 s. (Qiu; Chen, 2004) Trotz der Effektivität mancher Zusätze sind sie nicht immer optimal für Lebensmittel geeignet. Beim Einsatz von Zusätzen muss auch auf die Verbraucherakzeptanz und die gesetzlichen Bestimmungen geachtet werden. (Tianli et al., 2014) Bei den physikalischen Verfahren zeigte sich z.B. hoher hydrostatischer Druck (Silva et al., 2012) als effektiv für die Konservierung von empfindlichen Produkten. Bei deren Versuchen war eine Reduktion der Keimzahl um 2 bis 2,5 Log-Einheiten möglich. UV-Strahlung ist laut Baysal et al. (2013) in Grapefruitsaft sehr effektiv gewesen. Bei den Experimenten wurden je nach UV Dosis eine Minimierung um 3,5 bis 5,5 Log-Stufen erreicht, bei Apfelsaft hingegen nur 0,8 bis 2,2. Allerdings verursachen solche Verfahren höhere Anschaffungs- und Betriebskosten. Zudem besteht weiterer Forschungsbedarf. (Tianli et al., 2014) 15 2.3 Kaltplasma im Lebensmittelbereich 2.3.1 Definition Es wurden bisher drei Aggregatzustände (fest, flüssig und gasförmig) unterschieden. In der Physik definiert man „Plasma“ als vierten Zustand. Dieser entsteht, wenn durch viel Energie molekulare und atomare Strukturen eines Gases aufgebrochen werden und Elektronen und Ionen freigesetzt werden. (Niemira, 2012) Somit bezeichnet der Begriff „Plasma“ ein angeregtes Gasgemisch, das sowohl aus Neutralteilchen, Ionen, Elektronen, freien Radikalen als auch metastabilen Molekülen zusammengesetzt sein kann. Im Unterschied zu im Normalzustand befindlichen Gasen ist bei Plasma ein erhöhter Gehalt an Ladungsträgern vorherrschend. Dabei besteht nur selten ein gleich verteiltes Verhältnis von positiven und negativen Ladungen. In der Regel kommt es zur Bildung von stark fluktuierenden Ladungsüberschüssen und damit zu lokalen elektrischen Feldern. (Wintermantel; Ha, 2009) Die Entstehung und Zusammensetzung eines Plasmas ist dabei in Abbildung 2 dargestellt. Abbildung 2: Entstehung und Zusammensetzung eines Plasmas (Beer et al, 2009) Plasma kann dabei in verschiedene Gruppen unterteilt werden. Eine Möglichkeit der Einteilung ist die nach der Art des Temperaturzustandes. Die Fachbegriffe dabei sind allerdings aufgrund der noch jungen Technologie unterschiedlich. Niemera (2012) unterscheidet in thermisches und nicht thermisches Plasma. Thermisches Plasma liegt bei mehreren 100 bzw. 1.000 Grad Celsius über der Raumtemperatur. Alle Teilchen sind extrem reaktiv. Die Energie ist ausreichend hoch, sodass sich alle Partikel im Gleichgewicht befinden und kein Energieaustausch zwischen ihnen erfolgt. Thermisches Plasma findet beispielsweise fürs Lichtbogenschweißen oder für Zündkerzen eine Anwendung. Beim nicht thermischen Plasma hingegen wird bei jedem Zusammenstoß von Elektronen Energie übertragen. Die verschiedenen Partikel behalten die verliehene Energie über eine gewisse Zeitspanne. Sie geben sie ab, wenn die Partikel miteinander wechselwirken. Das wird über visuelle und UV-Strahlung vollzogen. Die Menge an vermittelter Energie durch das Plasma ist dabei von der chemischen Zusammensetzung, 16 Dichte und der Temperatur abhängig. (Niemera, 2012) Die Elektronen- und Gastemperatur weist dabei einen deutlichen Unterschied auf. Ersteres kann Temperaturen von mehreren 10.000 K annehmen, während die Gastemperatur sich weit darunter in der Nähe von Raumtemperatur befindet. Die mittlere kinetische Energie liegt dabei bei mehr als 1 eV, d.h. die Energiemenge eines Elektrons nimmt durch Beschleunigungsspannung zu (DFG, 2012). Anwendungsbeispiele für nicht thermische Plasmen sind dabei Leuchtstoffröhren oder Plasmabildschirme. Zu der Kategorie des nicht thermischen Plasmas gehört auch das Kaltplasma. Es wird wie bereits erwähnt bei bzw. in der Nähe von Raumtemperatur erzeugt und ist deswegen auch für die Anwendung von hitzeempfindlichen Objekten wie z.B. Lebensmitteln geeignet. Allerdings muss beachtet werden, dass die aktiven Teilchen des Plasmas auch mit der Oberfläche des Lebensmittels reagieren können. Insbesondere können Auswirkungen auf die Farbe, Geschmack und Aroma entstehen. Bei Lebensmitteln, die leicht anfällig sind (wie Obst und Gemüse), muss die Bedeutung gegenüber der antimikrobiellen Wirkung abgewogen werden. (Niemira, 2012) Es gibt viele Arten Kaltplasmen zu erzeugen. Dazu stehen unterschiedlichste Geräte mit verschiedenen Systemen zur Verfügung. Zum einen können die Geräte unter Atmosphärendruck oder Unterdruck arbeiten. Zum anderen kann die Energieart unterschieden werden. Das Plasmagerät wird entweder mit Elektrizität, Mikrowellen oder Laser betrieben. Als Gase werden einfache Moleküle wie Luft oder Stickstoff oder Gemische verschiedener Bestandteile wie z.B. inerte Gase Helium, Argon oder Neon in Kombination mit Sauerstoff o. ä. eingesetzt. (Niemira, 2012) Einen genaueren Einblick in die Möglichkeiten einer Plasmabehandlung zeigt Tabelle 1 auf. 17 Tabelle 1: Technische Kenngrößen und Einflussparameter zur Beschreibung einer Plasmabehandlung (DFG, 2012) Einzelsysteme Kategorie Kenngrößen Plasma Anlage Kenngrößen Applikator Kenngrößen Produkt Strahlung Geladene Teilchen Plasma Neutralteilchen Beispiele für Parameter Art der Plasmaerzeugung Geometrie Spannung Strom Druck Gasgemisch Kammervolumen Behandlungsdruck Behandlungsfläche/ -volumen Behandlungsdosis Behandlungstemperatur spektrale Leistungsverteilung Elektronendichte Ionenenergieverteilung Ionendichte Art Dichte Lebensdauer Reaktivität Temperatur 2.3.2 Einteilung nach der Positionierung des Lebensmittels Kaltplasmageräte können nach Art ihrer Anordnung zum Lebensmittel in drei Gruppen eingeteilt werden: Entfernung zur Plasmaentstehung, relative Nähe zur Quelle und unmittelbar innerhalb der Erzeugung des Plasmas. Aufgrund dieser unterschiedlichen Positionierungen kommt es zu Differenzen in der Reaktivität und Wirksamkeit des Verfahrens basierend auf den zugrunde liegenden chemischen Eigenschaften der Gase. Die erste Methode findet in der Praxis nur eine geringe Anwendung. Um das Lebensmittel zu behandeln, wird das Plasma zunächst erzeugt und auf das Produkt geleitet. Das kann entweder durch ein Transportgas oder seltener durch das Ausnutzen von Magnetfeldern geschehen. Das Lebensmittel und die Plasmaerzeugung sind separiert. Dadurch entsteht der Vorteil, dass Objekte mit unterschiedlicher Größe und Form behandelt werden können. Die zweite Möglichkeit ist ein Kaltplasmasystem mit Direktbehandlung. Hierbei stellt die Vorrichtung aktives Plasma direkt zur Behandlung des Produkts bereit. Das Plasma wird dabei 18 wie bei der ersten Methode mit Hilfe des Transportgases oder vergleichbaren Mitteln bewegt. Dieses System liefert allerdings höhere Konzentrationen an aktiven Teilchen. Der Grund dafür ist zum einen das dichter gelegene Ziel zur Generation des Plasmas. Zum anderen liegt es daran, dass das Plasma schneller in Kontakt gebracht wird, bevor die Teilchen wechselwirken und sie dadurch inaktiv werden. Zudem kann das System im Impulsbetrieb mit Frequenzen von über 100 bis mehreren 1.000 Hertz arbeiten. Ferner ist aufgrund von nur wenig bis nicht entscheidend normaler Atmosphäre zwischen der Generation und dem Zielbereich die Intensität der entstehenden UV-Strahlung auf die zu behandelnde Fläche relativ hoch. Insbesondere der aw-Wert und der Feuchtegehalt des Produkts spielen eine wichtige Rolle in Bezug auf die Leitung der Elektrizität in einer ausreichend hohen Spannung. Allerdings kann die Elektrizität, wenn sie auf tierisches oder pflanzliches Gewebe geleitet wird, auch lokale Erhitzungen verursachen, die zu einem sensorischen Schaden wie angebrannte Stellen, Proteinkoagulation oder auch Veränderungen hinsichtlich Aroma, Textur oder Aussehen führen. Punktuelle Entladung konzentriert den Stromfluss, wodurch die Hitzeschäden entstehen. Deswegen muss die direkte Leitung durch das zu behandelnde Produkt möglichst verhindert werden. Das gelingt durch exakte Anpassung des Plasmageräts. Prinzipiell sind sie dadurch allerdings etwas schwieriger zu bauen als die Systeme mit weiter entfernt liegende Plasmaquellen. Je nach Bauweise des Emitters sind die Systeme flexibel in Bezug auf die Größe und Form des behandelnden Zielobjekts. Allerdings sind, wie bereits erwähnt, dem System Grenzen gesetzt. Nicht alle Produkte sind durch die elektrische Leitung für diese Art von Plasmaprozess geeignet. Als dritte Bauart gibt es die Elektrodenkontaktsysteme, wo sich die zu sterilisierende Oberfläche zwischen den beiden Elektroden oder einer Elektrode und einem neutralen Grund befindet. Die Oberfläche liegt direkt im Feld der Kaltplasmaerzeugung. Hier besteht die höchst mögliche Intensität von Elektronen, Radikalen, Ionen und UV-Strahlung. Dadurch ist in diesem System die antimikrobielle Wirkung gegenüber des Produkts am größten. Allerdings muss hier sorgfältig die Form und der Aufbau der Elektroden zum Produkt überwacht werden, um punktuelle Entladungen und die damit verbundenen Hitzeansammlungen zu verhindern. Bei diesem System gibt es Einschränkungen in Bezug auf die zu behandelnden Lebensmittel. Es sind nur bestimmte Lebensmittelklassen für die Behandlung geeignet. Auch wenn gewisse Flexibilität durch die Verwendung von unterschiedlichen Gaszusammensetzungen und/oder dem Aufbau von einer oder beiden Elektroden besteht, sind aufgrund des eher geringen Raumes zwischen den Elektroden nur kleinere bzw. flachere Produkte für dieses System geeignet. Beispielsweise passen Nüsse, Beeren oder auch abgeflachte Lebensmittel wie Hühnerbrüste 19 zwischen bzw. unter die Elektrode. Deswegen hat dieses System seine Grenzen in der technischen Bauweise. (Niemira, 2012) 2.3.3 Funktionsweise der Inaktivierung von Mikroorganismen Bei der Anwendung von Plasma kommt es zur Reduzierung von Mikroorganismen. Der antimikrobielle Effekt tritt dabei primär auf den Oberflächen auf. (DFG, 2012) Die Mikroorganismen werden durch drei verschiedene Mechanismen inaktiviert. Es beruht zum einen auf der chemischen Interaktion der Radikale, reaktiven Teilchen oder geladenen Partikel wie Hydroxylradikale, Hydrogenperoxid, Ozon, Singulett-Sauerstoff und Superoxid mit der Zellwand der Organismen. (Niemira, 2012; DFG, 2012) Dabei kann die Elektronenenergie kovalente Bindungen in organischen Molekülen spalten. Die Energie, die für Einfachbindungen benötigt wird, liegt bei 1,5 bis 6,2 eV, bei Doppelbindungen bei 4,4 bis 7,4 eV und bei Dreifachbindungen bei 8,5 bis 11,2 eV. (DFG, 2012) Zum anderen beschädigt die auftretende UV-Strahlung (100 – 380 nm) die Membranen und die Zellbestandteile durch photochemische Reaktionen. Es kommt durch gebildete Radikale aus Sauerstoff und/oder Stickstoff zu Oxidations-, Spaltungs- oder Polymerisationsreaktionen. Außerdem werden die DNA Stränge teilweise zerstört. Die letztendliche (Letal-) Schädigung hat ihren Ursprung also in der Oxidation von Zellkomponenten, in der Akkumulation geladener Teilchen an der Zelloberfläche, im Absinken des pH-Werts mit Verlust der pH Regulation und im Zusammenbruch des Membranpotentials und der Energiegewinnung. Je nach Art des Produkts, Mikroorganismus und der Plasmamethode ist die Wirksamkeit der genannten Inaktivierungsmechanismen unterschiedlich. Bei atmosphärischen Plasma soll das Ätzen mit Radikalen die Hauptursache für die Inaktivierung sein. Der abtötende Effekt kann aber auch durch andere antimikrobielle Methoden verstärkt werden. (Niemira, 2012; DFG, 2012) Die Effektivität der Plasmabehandlung hinsichtlich einer Inhibierung wird entscheidend von der Oberflächenstruktur beeinflusst. Poren, Kapillaröffnungen, ein hoher Wassergehalt und die Pufferkapazität werden als mögliche Einflussfaktoren betrachtet. Die Wirkung weicht deswegen von Lebensmitteloberfläche zu Lebensmitteloberfläche stark voneinander ab. Aufgrund dieser Tatsache lassen sich Experimente an Modellsystemen nur mit Einschränkungen auf andere komplexe Oberflächen anwenden. Ebenso nehmen produktspezifische Eigenschaften auf das Ergebnis einen Einfluss. Dazu gehören der spezifische Energieeintrag, die Produkterwärmung, die Temperaturverteilung, die Materialeigenschaften, die Zusammensetzung und die Geometrie. Zudem ist von Bedeutung, 20 ob gleichmäßig geformte, stückige bzw. Schüttgüter oder Flüssigkeiten einer Behandlung unterzogen werden. (DFG, 2012) 2.3.4 Einfluss auf Lebensmittel Bei der Plasmabehandlung wirkt das Plasma nicht nur auf die kontaminierenden Mikroorganismen, sondern auch in gleicher Weise auf die Lebensmittel bzw. die Lebensmitteloberflächen. Bei der Entkeimung sollte zwar eine größtmögliche Reduzierung der Mikroorganismen angestrebt, allerdings auch die Lebensmittelqualität nicht vernachlässigt werden. Einige Untersuchungen zeigten Veränderungen von bestimmten lebensmittelrelevanten Verbindungen auf. (DFG, 2012) Beispielsweise lag bei Feldsalat nach der Plasmabehandlung ein ungeklärt erhöhter Gehalt an Flavonoiden vor. (Grzegorzewski et al., 2010) Bei anderen Versuchen wurden Stoffverluste festgestellt. Aber auch die Veränderung von Pflanzenoberflächen durch Kaltplasma wurde beobachtet. Unter einem Rasterelektronenmikroskop zeigte sich eine veränderte obere Epidermis aufgrund von Erosionsphänomenen. Zudem kam es bei behandelten Spinatblättern, die anschließend gekühlt gelagert wurden, zu Verfärbungen. Zudem gab es z.B. Versuche, wie die von Reineke et al. (2013), die auf Gewürzen (Paprikapulver, gerebelter Oregano, ganzer schwarzer Pfeffer) zeigten, dass keine Veränderungen in der Produktfarbe zu sehen waren. Andere Sensorische Einschränkungen wurden bisher kaum untersucht. Der Einsatz von Plasma auf Lebensmitteln ist also noch umstritten. Es ist nicht auszuschließen, dass bei dieser Plasmabehandlung Stoffe entstehen, die gesundheitsschädlich oder ähnliches sind. (DFG, 2012) 2.3.5 Anwendung im Lebensmittelbereich Industriell wird Kaltplasma schon länger in den verschiedensten Bereichen wie in der Medizintechnik, der Werkstoffherstellung oder auch Beleuchtungstechnik eingesetzt. Seit einigen Jahren wird auch auf dem Gebiet der Lebensmittelindustrie geforscht. Der Hauptteil von Untersuchungen bezog sich dabei überwiegend auf die Inaktivierung unerwünschter Mikroorganismen durch Kaltplasma bei hitzeempfindlichen Lebensmitteln. Das Kaltplasma fand dabei auf einige verschiedene Produkte und Mikroorganismen seine Anwendung. Die meist untersuchten Produkte sind stückige Lebensmittel. (DFG, 2012) Es wurden unter anderem Blaubeeren (Lacombe et al., 2015), ganzer schwarzer Pfeffer (Hertwig et al., 2015; Reineke et al., 2013) oder rotes Paprikapulver (Kim et al., 2014) direkt mit Plasma behandelt. 21 Auch bei Flüssigkeiten wie z.B. Apfelsaft (Surowsky et al., 2014) konnte der Einsatz bisher stattfinden. Untersuchungen zu Weizenmehlen (Misra et al., 2015) fanden ebenfalls statt. Außerdem wurde der Einsatz von Kaltplasma bei Innenverpackungen von Tomaten (Misra et al., 2014a) und Erdbeeren (Misra et al., 2014b) untersucht. Das Plasma wurde auch zur Oberflächensterilisation bzw. –dekontamination von hitzeempfindlichen Gegenständen eingesetzt. Mehrere Studien, wie die von Wan et al. (2009) zeigten ein hohes Potential, Keime auf Trägermaterialien wie Glas, Papier und Kunststoffen zu hemmen bzw. abzutöten. Aber auch bei der Entkeimung von Metalloberflächen wie z.B. Werkzeuge in der Fleischverarbeitung wurde Plasma erfolgreich getestet. (Leipold et al., 2009) Besonders interessant in dem Zusammenhang mit der Plasmaforschung in der Lebensmittelindustrie sind Endosporen-bildende Bakterien wie Clostridien und Bacillus Spezies. Sporen, wie die von Bacillus subtilis, waren der Mittelpunkt vielfältiger Untersuchungen. Sie sind aufgrund ihrer widerstandsfähigen Hüllschichten vergleichsweise resistent gegen herkömmliche Sterilisationsverfahren. Bei atmosphärischen Plasma waren für die Inaktivierung dieser Sporen hauptsächlich reaktive Teilchen von Bedeutung. Allerdings zeigte bei Experimenten mit einem geringen UV-Anteil eine unzureichende Inaktivierung, sodass die Parameter der Plasmabehandlung und die Zusammensetzung des Gases eine wichtige Rolle einnehmen. (DFG, 2012) Ferner wurde dieses Gasgemisch gegen verschiedene Bakterien wie z.B. Escherichia coli, Salmonella enterica serovar Typhimurium, Listeria monocytogenes (Ziuzina et al., 2014), Bacillus atrophaeus (Patil et al., 2014), Geobacillus (Bokhorst-van de Veen et al., 2015) oder auch Citrobacter freundii (Surowsky et al., 2014) angewandt. Daten zu verschiedenen Lebensmitteln und deren Entkeimung liegen vor. Es sind Inaktivierungen bis zu 6, im Einzelfall bis zu 8 Log-Stufen möglich. Biofilme stellten allerdings eine größere Hürde dar. Sie zeigen eine besondere Widerstandsfähigkeit gegenüber atmosphärischem Plasma. (DFG, 2012; Niemira, 2012) An sich stellt das Plasma dabei eine potenzielle Alternative für physikalische (z.B. ionisierende Bestrahlung, Hochdruck-, Hochspannungsimpulse) oder anderen chemischen (z.B. Chloreinsatz) Verfahren dar. Die Vorteile des Plasmas sind unter anderem eine hohe Wirksamkeit bei niedrigen Temperaturen, gezielte und verbrauchsgerechte Bereitstellung, geringe Beeinflussung der inneren Produktmatrix, wasser- bzw. lösemittel- und rückstandsfreie sowie ressourceneffiziente Anwendung. (DFG, 2012) 22 2.4 Zitrusfrüchte Der Begriff „Zitrusfrüchte“ ist definiert als eine Sammelbezeichnung für Früchte der Gattungen Citrus, Fortunella und x Citrofortunella. Dazu gehören unter anderem Orangen, Mandarinen, Grapefruits und Zitronen. Sie gehören zu den Rautengewächsen. (Liebster; Levin, 2002) Die Schale (Perikarp) der reifen Frucht besteht aus drei Schichten, dem Exo-, Meso- und Endokarp. Außen befindet sich das Exokarp. Es besteht aus einer wachsbedeckten Epidermis und schützt vor Austrocknung und Schädlingsbefall. (Liebelei; Reisdorff, 2007; Liebster; Levin, 2002) Darunter schließt sich das Mesokarp an. Es nimmt den größten Anteil der Schale ein und weist zwei Farbbereiche auf. Dazu gehören überwiegend das Flavedo und das Albedo. Das erste Gewebe ist durch Carotinoide gelb bis orange gefärbt und besitzt zahlreiche Ölbehälter, die mit artspezifischen ätherischen Ölen gefüllt sind. Das Albedo enthält große Interzelluren (gasgefüllte Hohlräume) und bildet ein relativ trocken, weißlich erscheinendes Schwammgewebe aus. Die letzte Schicht ist das Endokarp. Es umschließt mit seiner Haut die Fruchtfächer. (Liebelei; Reisdorff, 2007) Zitrusfrüchte sind gegen zahlreiche Mikroorganismenarten recht widerstandsfähig. Große Schäden werden nur durch Schimmelpilze verursacht. (Müller; 1997) Deswegen findet nach der Ernte teilweise der Einsatz von Überzugsmitteln und Konservierungsstoffen statt. (Liebster; Levin, 2002) Für den Verkauf werden die Früchte zur Entfernung von Staub, Rußtau und Rückstände von Pflanzenbehandlungsmittel häufig gewaschen und die Wachsschicht geht verloren. Um den Schutz vor Austrocknen und vorzeitigem Verderb wieder zu gewährleisten, erhält die Frucht einen künstlichen Wachsüberzug mit weißem oder gelben Bienen-, Candelilla-, Carnaubawachs, Schellack, Montansäureester, Polyethylenwachsoxidate oder Glycerinester aus Wurzelharz. Die Früchte besitzen einen stärkeren Glanz und leuchtendere Farbe als unbehandelte. Allerdings müssen diese Zusatzstoffe mit dem Hinweis „gewachst“ gekennzeichnet sein. Von der Kennzeichnung bis zu einer bestimmten Höchstmenge befreit sind der Einsatz von Zuckerestern von Speisefettsäuren und der Zuckerglyceride. Zum Schutz vor Mikroorganismen werden außerdem verschiedene Konservierungsmittel eingesetzt, die fungizid wirken. Dazu zählen Thiabendazol, Orthophenylphenol und/oder Imazalil. (Liebster; Levin, 2002) 23 3 Material und Methoden 3.1 Verwendete Mikroorganismen und Materialien Für die Untersuchungen wurden folgende Materialien eingesetzt: - Alicyclobacillus acidoterrestris DSM. No.: 3922 - Hefeextrakt (Bacto Yeast Extract; DIFCO Laboratories) - Stärke (Sigma-Aldrich) - Glucose (D(+)-Glucose wasserfrei; Roth) - Agar-Agar (Roth) - Pepton (Kraemer & Martin GmbH) - Tween 80 (Roth) - Chlorwasserstoff (1 M, Riedel-de Haën) - Äpfelsäure (Pulver) - Natriumchlorid (Reinheit mind. 99,9 %, Appli Chem) - Plastikschale (etwa 20 x 12 cm) - Papiertücher - Aluminiumfolie - Malachitgrün-Oxalat (Roth) - Safraninlösung (Roth) - Methylenblau (Ferak Laborat GmbH) - Aceton (Merck Schuchardt OHG) - Plastik70 Schutzlack (CRC Industries Deutschland GmbH) - Grapefruits (Kaufland, etwa 10 cm Ø, behandelt mit Orthophenylphenol, Thiabendazol und Imazalil, gewachst) - Flächendesinfektionsreiniger (Konzentrat, Sokrena, Bode Chemie Hamburg) Zudem wurden bei den Versuchen verschiedene Labormaterialien wie Petrischalen, Reagenzgläser und Erlenmeyerkolben unterschiedlicher Größe, Laborflaschen, Dionatwasser, Messkolben, Waagen, pH-Meter, Gasbrenner, Impfösen, Drigalski-Spatel und Ethanol, Drehtische, Pipetten mit verschieden großen Pipettiermengen und Auszählgerät verwendet. 24 3.2 Geräte - Plasmaquelle (Oberflächen DBE des Leibniz-Instituts für Plasmaforschung und Technologie e.V. Greifswald mit Spannungswandler, Elektroden und Kleinteilen) - Zentrifuge (Sigma Laborzentrifuge GmbH 3K30, Rotor 12158-H & 12159-H) - Brutschrank (Heraeus Instruments Typ B 6200, 70°C) - Brutschrank (Heraeus Instruments Typ B15, 50 °C) - Schüttler (Sartorius Stedim Biotech GmbH) - Schüttler (Sartorius Certomat IS) - Wasserbad (Gesellschaft für Labortechnik) - Mikroskop (Nicon Eclipse E400) - Autoklav (UnityLab) 3.3 Vorbereitung der Versuche Für die Versuche mussten unterschiedliche Medien wie Bouillons, Petrischalen mit Agar und Reagenzgläser vorbereitet werden. Als Wachstumsmedien für den A. acidoterrestris wurden YSG-Bouillon bzw. YSG-Agar verwendet. Für die Bouillon wurden zu der festgelegten Menge Dionatwasser 0,2 % Hefeextrakt, 0,2 % Stärke und 0,1 % Glucose in einen Erlenmeyerkolben eingewogen, mit 1 M Salzsäure auf einen pH-Wert von 3,7 eingestellt und anschließend bei 121 °C autoklaviert. Für die Herstellung des Agars wurden nur in die Hälfte des Anteils an destilliertes Wasser die entsprechenden Mengen an Nährstoffen übertragen. Die weitere Vorgehensweise geschah wie bei der Bouillon. In den anderen Anteil (500 ml) sind 15 g Agar-Agar eingewogen und mit einem Rührfisch verteilt worden, da es sonst zu einer starken Klumpenbildung im Nachhinein kam. (Goto et al., 2008) Diese so gefüllten Laborflaschen wurden ebenfalls autoklaviert. Im Anschluss daran wurden die Lösungen miteinander vermengt und jeweils etwa 25 ml (im 1.Versuch 20 ml) in Petrischalen gefüllt. Die Änderung wurde aufgrund von leichtem Austrocknen am Rand vorgenommen. Der K-Agar zum Vergleich des Wachstums wurde von der Technik her ebenso wie der YSG-Agar hergestellt. Als Nährbestandteile wurden allerdings 5 g/l Pepton, 2.5 g/l Hefeextrakt, 1 g/l Glucose und 1 g/l Tween 80 verwendet (Bevilacqua et al., 2008b). Zum Einstellen des pH-Werts wurde zudem 2,5 %ige Äpfelsäurelösung anstatt Salzsäure eingesetzt. In die fertig autoklavierte YSG-Bouillon wurde der A. acidoterrestris mit Hilfe einer Impföse vom Ursprungsmedium übertragen. Der Erlenmeyerkolben wurde dann in eine Plastikschale gestellt, mit feuchten Papiertüchern umgeben und mit Aluminiumfolie umwickelt, damit die 25 Mikroorganismenkultur nicht austrocknet. Anschließend wurde sie für 5 Tage bei 45 °C im Schüttler bei 140 U/min inkubiert. In die Reagenzgläser für die Verdünnungsreihen wurden je 9 ml 0,85%ige Natriumchloridlösung gefüllt und ebenfalls autoklaviert. 3.4 Vorbereitung des Oberflächenplasmageräts Bei dieser Plasmaanwendung handelt es sich um eine direkte Behandlung mit dielektrisch behinderten Entladungen (DBE). Das Plasmagerät arbeitet unter Atmosphärendruck und als Gasgemisch kommt Luft zum Einsatz. Das Gerät besteht dabei aus verschiedenen Elementen. Dazu gehören vor allem der Funktionsgenerator, die Hochspannungsversorgung, das Steuergerät, ein Spannungswandler, mehrere Elektroden zum Wechseln mit einem Glasdeckel mit drei Bohrungen und ein Verbindungskabel, welches zwischen dem Funktionsgenerator und dem Steuergerät gesteckt wird. Diese Elemente wurden miteinander verbunden und auf dem Funktionsgenerator wurde eine Frequenz von etwa 611 mHz eingestellt. Bis auf den Funktionsgenerator befand sich alles unter einem Abzug. (Siehe Abbildung 3) Abbildung 3: Verwendete Plasmaanlage in den Versuchen Der Spannungswandler kann bis 50 kV erzeugen. Deswegen befand sich die Plasmaanlage auf elektrisch isoliertem Untergrund. Die Elektrode wurde nach einem etwa 30-minütigen Einsatz gegen eine andere Elektrode ausgetauscht. Nach der Plasmabehandlung mussten die Elektroden neu vorbereitet werden. Dazu wurden sie zunächst von restlichen Lackbestandteilen gereinigt, indem sie jeweils einzeln in ein gläsernes Becherglas mit Aceton gelegt und nach ca. 3 min wieder entnommen wurden. Anschließend wurden sie in ein Styropor-Rack gestellt und mit dem Plastik70 Lack besprüht. 26 Nach einer mindestens zweistündigen Trocknung konnten sie maximal 45 min verwendet werden, bevor sie mit dem Lack neu besprüht werden mussten. 3.5 Durchführung der Versuche 3.5.1 Vorversuche Bei den Vorversuchen wurde geprüft, inwiefern der Mikroorganismus auf dem YSG-Medium und in den Inkubatoren wächst und wie er auf die Hitzebehandlung zur Sporenisolation und auf die Plasmaeinwirkung reagierte. Dazu wurden mehrere Untersuchungen vorgenommen. Zunächst wurde versucht, das optimale Temperatur- und Zeitverhältnis für die Inaktivierung der vegetativen Zellen zu finden. Laut Pettipher et al. (1997) war eine Anwendung von 80 °C und 10 min Länge am effektivsten. So wurden unterschiedliche Kombinationen von Temperaturen und Zeiten eingesetzt. Dazu wurde in sieben mit 9 ml NaCl-Lösung gefüllte Reagenzgläser jeweils 1 ml der gleichen Bakteriensuspension pipettiert. Jeweils eins wurde in ein Wasserbad bei folgenden Bedingungen gestellt: 80 °C für 10, 20 und 30 min, 85 °C für 5, 10 und 20 min und 90 °C für 5 und 10 min. Anschließend wurden Verdünnungsreihen von 10-2 bis 10-5 erstellt, auf Agarplatten ausgestrichen und für 2 Tage bei 45 °C inkubiert. Zudem wurden mikroskopische Untersuchungen der Proben ohne Behandlung und 10minütigen 80 °C Wasserbadanwendung unternommen, um zu überprüfen, inwiefern die vegetativen Zellen gehemmt bzw. die Sporen durch das Wasserbad aktiviert wurden. Dazu wurden unterschiedliche Färbemittel angesetzt, eine 5%ige Malachitgrün-, 1%ige Safranin- und 0,4%ige Methylenblaulösung. Dabei sollten bei der Malachitgrünfärbung insbesondere Sporen, mit der Safraninlösung die vegetativen Bakterien und mit Methylenblau einzelne Zellbestandteile sichtbar werden. Um den Mikroorganismus unter dem Mikroskop zu betrachten, wurden 7 μl der Bakteriensuspension und etwa 5 mm daneben 5 μl steriles Wasser auf einen Objektträger gegeben und mit einem Deckgläschen auf dem Objektträger verteilt, sodass auf der einen Seite des Trägers eine höhere Konzentration vorlag. Anschließend wurde dieser an der Luft getrocknet und mit der beschichteten Seite nach oben dreimal kurz durch eine Gasbrennerflamme gezogen. Für die Anfärbung wurde der Ausstrich mit einer großen Menge Methylenblau bedeckt. Nach anschließender Einwirkzeit von etwa 8 min und vorsichtiger Spülung mit Wasser konnte das Präparat nach Trocknung an der Luft mikroskopiert werden. Bei der Behandlung mit Malachitgrün wurde zunächst ähnlich vorgegangen. Die luftgetrocknete und hitzefixierte Probe wurde mit der Malachitgrünlösung überschichtet. Danach wurde sie über einer Gasbrennerflamme eingedampft, bis sich eine metallisch glänzende Farbschicht zeigte. Dabei war zu beachten, dass der Objektträger nur mehrmals kurz 27 in die Flamme gehalten wurde. Nach der anschließenden 2 bis 3 minütiger Entfärbung unter fließendem Leitungswasser wurde das Präparat mit Safranin etwa 10 min gegengefärbt, um auch die vegetativen Zellen rot sichtbar zu machen. Danach folgten wieder eine Spülung mit Wasser und die Trocknung an der Luft, bevor die Probe unter dem Mikroskop betrachtet werden konnte. (Steffens, 2011) Zur Überprüfung des Wachstums wurde von der 5 Tage inkubierten YSG-Bouillon eine Verdünnungsreihe bis 103 erstellt. Von der 103 Verdünnung wurden je 0,1 ml im Oberflächenausstrichverfahren auf 4 YSG- und 4 K-Agarplatten übertragen. Im Anschluss wurde diese bei 80 °C ins Wasserbad gestellt und wie zuvor vorgegangen. Diese Proben wurden dann in den Inkubator für 1 bzw. 2 Tage bei 45 °C gelegt und im Anschluss ausgezählt und verglichen. Um herauszufinden, ob die Agarplatten im Inkubator aufgrund der erhöhten Temperatur von 45 °C eingepackt werden müssen, wurde auch dazu ein Versuch durchgeführt. Dabei wurden drei unterschiedliche Methoden angewandt. Es kam ohne Verpackung, mit Aluminiumfolie aber ohne angefeuchtetes Papier und mit Aluminium und Papier mit 5 g Wasser zum Einsatz. Dazu wurden jeweils 4 Platten mit 0,1 ml einer 103 Verdünnung der konzentrierten Bakteriensuspension belegt und dementsprechend eingepackt. Nach 2 Tagen wurden die Ergebnisse betrachtet und miteinander verglichen. Zuletzt wurde die Auswirkung des Plasmas auf Alicyclobacillus acidoterrestris überprüft. Dazu wurden aus der fünf Tage inkubierten Probe je 2 ml entnommen und in eine zuvor 2,5 min plasmabehandelte Petrischale von 6 cm Durchmessern gegeben. Auf diese wirkte dann 5, 10 oder 30 min Plasma ein. Im Anschluss wurden je 1 ml entnommen, in ein Reagenzglas mit 9 ml 0,85%ige Natriumchloridlösung gefüllt und eine Verdünnungsreihe bis 10-6 erstellt. Jeweils 0,1 ml wurden dann im Oberflächenausstrichverfahren mit dem Drigalski-Spatel auf der Agarplatte verteilt. Die Verdünnungsreihe wurde bei 80 °C für 10 min ins Wasserbad gestellt und anschließend nach kurzem Abkühlen ebenfalls ausgestrichen. Im Anschluss wurden die bestrichenen Agarplatten mit leicht feuchten Papiertüchern und Aluminiumfolie eingewickelt, sodass allerdings noch ein wenig warme Luft ins Innere gelangt und in den Inkubator bei 45 °C für 2 Tage gegeben. 28 3.5.2 Plasmabehandlung von A. a. in einer Flüssigkeit Für die Behandlung von einer in Flüssigkeit vorliegender A. a. Kultur wurden mehrere Untersuchungen vorgenommen. Es wurden insgesamt 3 Experimente durchgeführt, die ähnlich den Vorversuchen waren. Es wurden fünf 60er Petrischalen jeweils 2,5 min mit Plasma behandelt und mit 2 ml der verbrauchten Kultur befüllt. Drei wurden dann für jeweils 30 min plasmabehandelt, die anderen zwei stellten Nullproben dar. Aus diesen wurden wieder jeweils 1 ml für eine Verdünnungsreihe bis 10-6 entnommen, im Oberflächenverfahren ausgestrichen, bei 80 °C für 10 min behandelt und wieder auf Agarplatten gegeben. Diese Platten wurden in den Inkubator bei 45 °C gestellt und nach 2 Tagen ausgezählt. 3.5.3 Plasmabehandlung von A. a. auf einer Kunststoffoberfläche (Petrischale) Zudem wurden Untersuchungen durchgeführt, wo die Mikroorganismen nicht in einer Flüssigkeit während der Plasmabehandlung vorlagen, sondern getrocknet auf der Polystyroloberfläche einer 60er Petrischale. Es fanden zunächst drei Versuche statt, wo überprüft worden ist, ob es einen Unterschied zwischen vor und nach der Plasmabehandlung aktivierten Sporen gibt. Dazu wurden die 25 ml des inkubierten YSG-Medium in ein Plastikröhrchen überführt und bei 8000 g bei einer Drehzahl von 9517 U/min im Rotor 12158-H für 10 min zentrifugiert. Dabei setzten sich die Mikroorganismen und andere feste Bestandteile am Boden ab. Der Überstand wurde abgekippt und das Gefäß mit 25 ml sterilem Dionatwasser aufgefüllt und wieder bei gleichen Parametern zentrifugiert. Dieser Vorgang wurde 2-mal wiederholt, sodass die Alicyclobacillus acidoterrestris Zellen gewaschen vorlagen. Im Anschluss daran wurden zum Absatz etwa 20 ml steriles Dionatwasser gegeben. Davon wurden dann 1 ml für die Keimzahlbestimmung der Nullprobe der vegetativen Zellen und Sporen vor der Trocknung entnommen. Es wurde eine Verdünnungsreihe bis 10-6 erstellt und im Oberflächenausstrichverfahren wie bei den Vorversuchen auf den Agar gebracht. Von einem anderen Anteil der 20 ml wurden je 2 ml in vier einzelne 60er Petrischale gegeben. Die Petrischalen sind zuvor 2,5 min mit Plasma behandelt worden, um die Flüssigkeitsverteilung besser zu gewährleisten. Weitere 9 ml wurden 10 min ins 80 °C Wasserbad gestellt und danach ebenfalls in die Petrischalen wie zuvor gefüllt. Bei 45 °C wurden diese etwa 1,5 h ohne Deckel in einem Inkubator ohne Schütteln getrocknet. Im Anschluss wurden die Proben mit 0, 5, 10 oder 30 min Plasma behandelt. Beim ersten Versuch fehlte die Nullprobe allerdings. Nach diesem Vorgang sind in die Petrischalen je 2 ml 0,85%ige Natriumchloridlösung gegeben und für mindestens 1 h geschüttelt worden. Aus den 29 Schalen wurden dann je 1 ml entnommen, in ein Reagenzglas mit 9 ml übertragen, eine Verdünnungsreihe erstellt und auf Agarplatten ausgestrichen wie zuvor beschrieben. Die Reihe, die zuvor aus der Flüssigkeit ohne 80 °C Behandlung erstellt worden ist, wurde zudem auch noch ins Wasserbad bei 80 °C für 10 min gestellt und anschließend nach kurzer Wartezeit ausgestrichen, um auch die Sporenbestimmung nach der Plasmabehandlung vornehmen zu können. In weiteren Experimente wurde versucht, die Keimzahl zu erhöhen und die Wirkungsweise des Plasmas in kürzerer Zeit zu bestimmen. Dazu fanden zwei Versuche statt. Es wurden anstelle der 25 ml 75 ml YSG-Bouillon verwendet. Diese wurde in drei sterile Plastikröhrchen a 25 ml gefüllt, einmal bei den oben genannten Parametern zentrifugiert, mit je 25 ml sterilem Dionatwasser aufgefüllt und anschließend in der Zentrifuge dreimal gewaschen. Im Anschluss wurden in zwei Gefäße jeweils 5 ml gefüllt, der Absatz aufgeschüttelt, in das dritte Gefäß übertragen und mit 3,5 ml wiederholt. Dieses Behältnis wurde dann ebenfalls geschüttelt bis die Bestandteile in die Lösung übergingen. So lagen 17 ml der Bakteriensuspension vor. Es wurde die Nullprobe vor der Trocknung entnommen, vier 60er Petrischalen 2,5 min mit Plasma behandelt und mit je 2 ml Bakterienlösung gefüllt. Diese wurden wie zuvor getrocknet. Die Petrischalen mit den belegten Bakterien wurden mit 0, 1, 2 und 5 min Plasma behandelt. Im Anschluss sind dann je 2 ml Natriumchloridlösung zugegeben und über 1 h bei 100 U/m geschüttelt worden. Daraufhin wurde eine Verdünnungsreihe bis 10-5 für die Bestimmung der vegetativen Zellen erstellt, die Proben auf YSG-Agar ausgestrichen, mit 80 °C behandelt und erneut auf Agarplatten gebracht, die dann nach 2 Tagen Inkubationszeit bei 45 °C ausgezählt wurden. Zudem wurde eine noch höhere Aufkonzentration der Mikroorganismen aus der Bakterienkultur vorgenommen. Für diese insgesamt 6 Versuche wurden jeweils 450 ml YSGBouillon angesetzt. Nach der 120 h Bebrütung bei 45 °C im schüttelnden Inkubator wurde das Medium mit den Bakterien insgesamt viermal zentrifugiert. Dazu wurde das Medium in 6 größere Zentrifugengefäße a 75 ml gefüllt und im Rotor 12159-H bei 8000 g mit einer Drehzahl von 8544 U/min für 10 min zentrifugiert. Nach diesem Durchgang wurde der Überstand abgegossen und die Flaschen jeweils mit 15 ml sterilem Dionatwasser aufgefüllt. Anschließend wurden sie im Reagenzglasschüttler für 10 s gehalten, um den Absatz wieder in Flüssigkeit zu bringen und in kleinere Zentrifugengefäße a 25 ml überführt. Weitere 10 ml sind jeweils zum Ausspülen der größeren Behälter verwendet und ebenfalls in die Gefäße gegeben worden. Daraufhin wurden die Behältnisse in den kleineren Rotor 12158 gestellt und bei 8000 g mit einer Drehzahl von 9517 U/min zentrifugiert. Dieser Prozess wurde anschließend wiederholt. 30 Am Ende wurden allerdings nur 3 Gefäße genutzt, sodass im vierten Zentrifugierprozess insgesamt nur 75 ml steriles Deionatwasser verwendet wurde. Für den letzten Schritt wurden in zwei der Plastikröhrchen 5 ml pipettiert, geschüttelt bis sich der Absatz löste, in das dritte überführt und mit je 1 ml nachgespült. So standen für die Untersuchung insgesamt 17 ml zur Verfügung. Bei den ersten drei Versuchen wurden jeweils 2 ml der Bakteriensuspension in eine 60er Petrischale gegeben und anschließend im Inkubator bei 45 °C bei geöffnetem Deckel über mindestens 1 h bis maximal 2 h getrocknet. Je nach Position im Inkubator fand die Trocknung unterschiedlich schnell statt, deswegen entstanden Zeitunterschiede. Bei den anderen drei Versuchen wurde hingegen ein Schüttler eingesetzt, der die Proben allerdings ebenfalls bei 45 °C trocknete. Dabei wurden die Proben kurz 10 min angetrocknet, dann erst 10 min bei 50 U/min und anschließend etwa 45 bis 60 min bei 100 U/min geschüttelt. Im Anschluss wurden die Petrischalen mit den aufgetragenen Bakterien für 0, 1, 2, 5, 10, 20 oder 30 min plasmabehandelt. Nach diesem Vorgang erhielten sie jeweils 2 ml 0,85%ige NaCl-Lösung und wurden 1 h bei 100 U/min bzw. bei den letzten Versuchen bei einer höheren Drehzahl von 140 U/min geschüttelt, damit auch der mittlere Bereich mit den belegten Bakterien wieder in Lösung geht. Wie bei den anderen Versuchen auch wurden dann Verdünnungsreihen erstellt, die Proben auf YSG-Agarplatten ausgestrichen und für 2 Tage bei 45 °C inkubiert. 3.5.4 Plasmabehandlung von A. a. auf einer Grapefruitschale Für die Versuche, Grapefruitschalen mit Plasma zu behandeln, musste zunächst herausgefunden werden, ob sich auf der Oberfläche der Grapefruit Fremdkeime insbesondere der Art Alicyclobacillus befinden, die später die Berechnungen verfälschen könnten. Dazu wurden zwei verschiedene Methoden angewandt. Zum einen wurde ein 9 cm2 großes Stück Grapefruitschale mit einem vorher in NaCl getauchten Tupfer abgestrichen und diesen dann für 15 min in die NaCl-Lösung gegeben, zum anderen die gleiche Fläche mit 1 ml NaCl über einer Schale abgespült. Aus diesen wurden dann Verdünnungsreihen erstellt, auf YSG-Agarplatten übertragen, bei 42 °C inkubiert und über eine Dauer von 7 Tagen auf Mikroorganismen kontrolliert. Für die eigentlichen Versuche wurde die Grapefruit zunächst unter lauwarmen Wasser gewaschen. Anschließend wurde sie trotz des negativen Ergebnis auf Keime mit 2,5%ige Oberflächendesinfektionsmittellösung eingesprüht und dieses etwa 20 s einwirken lassen. Daraufhin wurden auf der Grapefruit-Oberfläche möglichst ebene Flächen herausgesucht und insgesamt sieben 3 mal 3 cm große Stücke mit einem Messer herausgeschnitten. Diese Teile 31 waren etwa 4 bis 7 mm hoch, was für die Behandlung unter der Elektrode zu dick war. Es wurde versucht, möglichst den Großteil des Mesokarps zu entfernen und so eine Dicke von etwa 2 bis 3 mm zu erreichen. Diese zugeschnittenen Quadrate wurden jeweils in eine 60er Petrischale gelegt und vorsichtig etwas platt gedrückt. Auf diese sind dann im ersten Versuch 0,5 ml und in den anderen drei Versuchen 0,3 ml der Bakteriensuspension, die wie im Versuch vorher hergestellt worden ist, geträufelt und sachte über die Oberfläche wurde, ohne dass an den Seiten die Flüssigkeit herunterrann. Die Petrischalen mit den belegten Grapefruitschalenstücken wurden für 25 min in den Inkubator bei 45 °C zum Trocknen gestellt, bis auf der Oberfläche eine leichte Schicht erkennbar wurde. Die einzelnen Stücke wurden 0, 1, 2, 5, 10, 20 oder 30 min mit Plasma behandelt. Anschließend wurden die Stücke mit einer Pinzette senkrecht über der Petrischale festgehalten. Die Grapefruitstücke wurden dann mit 3 ml NaCl-Lösung abgespült, umgedreht in die Petrischale zurückgelegt und etwa 1 h bei 100 U/min in den Schüttler gelegt. Nach dieser Zeitspanne wurden Verdünnungsreihen erstellt, auf YSG-Agar per Oberflächenausstrichverfahren aufgetragen und für 2 Tage bei 45 °C inkubiert. 3.5.5 Vergleich der Plasmabehandlung von A. a. auf einer Grapefruitschale mit der Behandlung mit UV-Strahlen In diesen beiden Versuchen wurde untersucht, ob die bei der Plasmabehandlung entstehende UV-Strahlung für die Inaktivierung der Bakterien ursächlich ist. Dazu wurden, wie beim Experiment zuvor, die Quadrate der Grapefruitschalen entnommen und mit den Bakterien belegt. Zusätzlich zur ein- bzw. fünfminütigen Plasmabehandlung wurden die Schalen zum direkten Vergleich unter eine UV-Lampe, die 41 cm über den Proben war, für 0, 1, 5, 10, 20 und 30 min gelegt. Beim zweiten Versuch kam eine zweiminütige Verweildauer unter der UVLampe hinzu. Im Anschluss wurden die Proben wie sonst 1 h bei 100 U/min geschüttelt, in Verdünnungsreihen überführt, auf YSG-Agarplatten übertragen und bei 45 °C über 2 Tage inkubiert. 32 3.5.6 Statistische Auswertung Für die statistische Auswertung der Ergebnisse wurden die Mittelwerte und Standardabweichungen bestimmt. Für die Bestimmung der signifikanten bzw. nicht signifikanten Unterschiede wurden dann zudem die Anova (engl. analysis of variance = Varianzanalyse) und der Tukey-Test durchgeführt. Als Irrtumswahrscheinlichkeit wurde dabei p=0,05 für signifikant, p=0,01 für hoch signifikant und p=0,001 für höchst signifikant angenommen. Es entsteht eine Signifikanz, wenn der berechnetet F-Wert größer als der kritische F-Wert ist. Diese Berechnungen wurden in Excel mit Hilfe eines Add-Ins ausgeführt. Dabei gilt es aber zu beachten, dass nicht alle gleich durchgeführten Versuche auf diese Weise zusammen betrachtet werden konnten, da teilweise die Ausgangskeimzahlen unterschiedlich waren. Diesem konnte durch den Bezug der entsprechenden Keimzahl zur Nullprobe Abhilfe geschaffen werden: ܳ ൌ ܧܾܭ ݀݁ͲͲͳ כ ݐ݃݊ݑ݈݄ܾ݀݊ܽ݁ܽ݉ݏ݈ܽܲݎ ݈݉ ܧܾܭ ݐܾ݁ݎ݈݈ݑܰݎݑݖൌ Ͳ ݈݄݊݅ܽݖ݉݅݁ܭ ݈݉ ݈݄݊݅ܽݖ݉݅݁ܭ Das Ergebnis dieser Formel stellt die prozentuelle Menge dar, die nach der Behandlung noch vorhanden ist. Durch diese Formel konnten Experimente mit gleichen Versuchsparametern miteinander verglichen werden. Bei den Auszählungen kam es auch vor, dass kein Keim auf den Agarplatten wuchs, sodass diese Proben mit „<10“, d.h. kleiner 10, gekennzeichnet wurden. Bei den Berechnungen wurden diese als 10 angenommen, um diese Werte verwenden zu können. 33 4 Ergebnisse 4.1 Vorversuche Bei den Vorversuchen stellten sich einige eher unerwartete Ergebnisse heraus. Das Nährmedium, wo der Keim über die fünf Tage angezüchtet worden war, änderte sowohl die Farbe als auch den Geruch. Als das Bakterium hineingegeben wurde, war das Medium orange und hatte den typischen Hefeextraktgeruch. Nach drei Tagen nahm die Flüssigkeit eine gelbe bis hellorange Farbe an. Zum fünften Tag hin veränderte es sich zu blassgelb und einem unangenehmen Geruch. (Siehe Abbildung 10 im Anhang) Daran konnte man das Wachstum des Keimes erkennen. Vermutlich stellte die geruchsbildende Komponente Guajakol dar. Ursprünglich war es vorgesehen, nach einem Tag die Platten auszuzählen. Die Kolonien waren allerdings nach 24 h sehr klein, sodass die Zeit auf 2 Tage verlängert wurde. Zudem zeigte sich, dass in die Petrischalen zu wenig YSG-Agar gegossen worden war. Sie waren an den Rändern leicht eingetrocknet. Daraufhin wurde die Menge Agar auf etwa 25 ml erhöht. Das wurde in den nächsten Versuchen explizit beachtet. Für die Inaktivierung der vegetativen Zellen, also um die Sporen beim Wachstum separat sichtbar zu machen, wurden unterschiedliche Temperaturen und Verweildauer im Wasserbad gewählt. Es stellte sich heraus, dass eine Temperatur von 80 °C und 10 min Dauer am besten dafür geeignet sind. Nach diesem Einfluss waren noch 2,4∙105 KbE/ml vorhanden. Die Ursprungskeimzahl der Lösung ohne Behandlung lag pro ml bei 5,9∙105 KbE. Es fand etwa eine Halbierung der Keimzahl statt. Bei einer Temperatur von 90 °C und 5 min Verweildauer waren nur noch sehr wenige bzw. bei 10 min gar keine Bakterien vorhanden. Bei 85 °C und 5 min Behandlung waren zwar mehr Keime (4,2∙105 KbE/ml) gezählt worden, allerdings ist hier davon auszugehen, dass auch noch vegetative Zellen darunter waren. (Siehe Tabelle 2 im Anhang) Um das zu überprüfen, wurden einige Proben verschiedener Färbemethoden unter dem Mikroskop bei unterschiedlichen Vergrößerungen dazu betrachtet. Dabei kamen nicht sehr aussagekräftige Bilder heraus. Auf den Bildern ohne Hitzebehandlung, die mit Methylenblau angefärbt wurden, sind jeweils kleinere Ansammlungen oder Verklumpungen von stäbchenförmigen Bakterien zu erkennen. Auf den Bildern der 80 °C Hitzebehandlung hingegen einzeln verteilte Bakterien, vermutlich die gebildeten Sporen. Bei der Färbung mit Malachitgrün bzw. Safranin sind Unterschiede hinsichtlich der Form erkennbar gewesen. Bei den mikroskopischen Bildern der Probe, die die Hitzebehandlung erhielt, erkennt man nur viele einzelne eher rundliche Bakterien, beim anderen sowohl Stäbchen als auch rundliche Formen (Siehe Abbildungen 11 und 12 im Anhang). Die typische Farbgebung wurde allerdings nicht erkannt. 34 Versuche mit anderen in der Literatur genannten Nährböden wurden durchgeführt, Alicyclobacillus acidoterrestris Bakterien (vegetative Zellen und Sporen) wurden sowohl auf K-Agar als auch YSG-Agar aufgetragen. Dabei wuchs der Keim auf YSG-Agar besser als auf K-Agar. Es wurden Keimzahlen von 6,0∙104 KbE/ml und 2,5∙105 KbE/ml für die vegetativen Zellen und 7,0∙104 KbE/ml und 2,3∙105 KbE/ml für die Sporen gefunden. Im Durchschnitt also 70 bis 76 % mehr Mikroorganismen beim YSG-Agar. (Siehe Tabelle 3 im Anhang) Eine Erklärung dieses Ergebnisses kann aber die Boullion sein, da sie dieselben Bestandteile enthielt wie der zuletzt verwendete Agar. Das Bakterium könnte mit seinem Stoffwechsel optimal an die Verwertungsprodukte Hefeextrakt, Stärke und Glucose angepasst gewesen sein. Auch aus diesen Gründen wurde der YSG-Agar dann in allen Versuchen verwendet. Zudem wurde versucht, herauszufinden, welches die beste Art der Verpackung der Agarplatten während der Inkubation ist. Dabei kam heraus, dass ohne Aluminiumfolie weniger Bakterien gewachsen sind als mit Folie. Im Durchschnitt waren 7,2∙105 KbE/ml auf den Platten ohne Verpackung vorhanden und 1,0∙106 mit Verpackung. (Siehe Tabelle 4 im Anhang) Zudem fiel auf, dass die Platten ohne Umhüllung teilweise sehr trocken waren. Ferner konnte man ebenfalls feststellen, dass es mit einer Einlage aus zu feuchtem Papier zum Schwärmen des Keimes kam und somit das Auszählen nicht mehr möglich war. Diese Ergebnisse beziehen sich allerdings auf nur wenige eingepackte Platten, sodass in den folgenden Versuchen mit teilweise bis zu 12 Platten übereinander und 7 Stapeln in Kreisform nebeneinander trotzdem eine Lage feuchtes Papier jeweils darunter und darüber eingelegt wurde. Bei den ersten Voruntersuchungen mit der Plasmaquelle zeigte sich keine große Veränderung der Keimzahlen. In einer Flüssigkeit wie dem verbrauchten Medium ist die Wirkung des Plasmas scheinbar nicht sehr hoch. Während vorher eine Anzahl an 1,7∙106 KbE/ml für die vegetativen Zellen und 8,7∙105 KbE/ml für die Sporen bestand, waren nach 5 bis 30 min Plasmabehandlung 7,5 bis 9,9∙105 KbE/ml bzw. 5,8∙105 bis 1,1∙106 KbE/ml vorhanden. Die stärkste Wirkung trat bei der 30-minütigen Variante auf. Es wurde eine Minimierung um 34 bis 57 % erreicht, allerdings damit nur eine Reduzierung um 0,4 Log-Stufen. (Siehe Tabelle 5 im Anhang) Anhand dieses Ergebnisses ist anscheinend eine Abtötung erkennbar, sodass weitere Experimente in dieser Richtung stattfanden. 35 4.2 Plasmabehandlung von A. a. in einer Flüssigkeit Aufgrund der Vorversuche wurde die These der inaktivierenden Wirkung einer 30-minütigen Plasmabehandlung weiterhin untersucht. Bei den Experimenten wurde diese These bestätigt. Es kam zu einer Inaktivierung von 34,7 bis 86,1 %. Damit reduzierte sich die Keimzahl um 0,2 bis 0,9 Log-Einheiten. In allen drei Versuchen wurde der Keim sowohl bei den vegetativen Zellen als auch bei den Sporen reduziert. (Siehe Abbildung 4) KbE/ml 1,0E+07 8,4E+05 1,3E+06 3,8E+05 5,2E+05 4,9E+05 1,0E+06 4,4E+05 3,4E+05 2,2E+05 2,2E+05 4,0E+05 5,2E+04 1,0E+05 3,8E+04 veg. Z.: 0 min veg. Z.: 30 min Sp.: 0 min Sp.: 30 min 1,0E+04 1 2 Experiment 3 Abbildung 4: Vergleich der Keimzahlen der vegetativen Zellen und Sporen bei einer Plasmabehandlung von 0 und 30 min Die stärkste Wirkung trat dabei beim 3. Versuch auf. Die Keimzahl der vegetativen Zellen verminderte sich von 3,8∙105 auf 5,2∙104 KbE/ml, bei den Sporen von 2,2∙105 auf 3,8∙104 KbE/ml. Es fiel zudem auf, dass die Sporenabtötung etwas niedriger war als die der vegetativen Zellen. Der Unterschied bei den ersten beiden Versuchen zwischen der Wirkung auf die vegetativen Zellen und Sporen lag bei 11,8 bzw. 17,6 %, während sich beim letzten Versuch die Inaktivierung kaum differenzierte (3,0 %). (Siehe Tabelle 6 im Anhang) Allerdings waren nicht alle Ergebnisse statistisch sicher. Die Abtötung der Sporen beim 2. Versuch und die der vegetativen beim 3. konnte zwar in den Keimzahlen erkannt werden, allerdings nicht statistisch bewiesen werden. Hingegen waren die Inaktivierung der vegetativen Zellen bei Versuch 1 und 2 und der Sporen beim 3. Experiment mit einer Irrtumswahrscheinlichkeit von 0,01 höchst signifikant. Diese Minimierung der Keime ist allerdings trotzdem relativ gering. Es stellt sich die Frage, ob eine höhere Inaktivierung durch gewaschene oder trocken vorliegende A. a. Bakterien vollzogen werden kann. Es wurde versucht, das in den nächsten Experimenten aufzugreifen. 36 4.3 Plasmabehandlung von A. a. auf einer Kunststoffoberfläche (Petrischale) Die unterschiedlichen Versuche zu den auf Petrischalen getrockneten, gewaschen vorliegenden und mit Plasma behandelten A. a. Kulturen zeigten unterschiedlich stark inaktivierende Wirkungen. Bei den drei Versuchen, wo die Sporen entweder vor oder nach der Plasmabehandlung aktiviert worden sind, trat ein starkes Schwärmen der Bakterien auf, sodass manche Agarplatten nicht auszählbar waren. Beim ersten Versuch fiel zusätzlich am 4. oder 5. Tag der Inkubator aus, sodass die Umgebungstemperatur nur bei etwa 20 °C lag und das Bakterium sich nur geringfügig entwickelte. Das Experiment wurde trotzdem als eine Art Vorversuch durchgeführt. Dabei wuchsen nur auf den Platten mit den Verdünnungsstufen 10-1 bis 10-3 vor der Trocknung die Bakterien. Allerdings waren diese aufgrund des Schwärmens nicht quantitativ auswertbar. Es kann davon ausgegangen werden, dass mindestens eine Bakterienkonzentration von 102 KbE/ml vorlag. Es sind also mindestens 102 KbE/ml reduziert worden. Da die Nullprobe nach der Trocknung nicht gemacht worden war, ist unklar, ob der Keim durch die Trocknung oder die Plasmabehandlung inaktiviert worden ist. Beim nächsten Versuch zeigte sich ein ähnliches Ergebnis. Es kam zum Schwärmen von Alicyclobacillus acidoterrestris. Auf den Agarplatten vor der Trocknung und auf der Nullprobe wuchsen allerdings die Bakterien. Zusätzlich waren auf den Agarplatten der vegetativen Zellen bei 5 min Plasmabehandlung und bei den Proben der vorher aktivierten Sporen bei der 5 und 10 minütigen Behandlung Keime zu finden. Bei den Agarplatten der Sporen, die nach der Plasmabestrahlung erst aktiviert worden sind, trat dagegen kein Wachstum auf. Werden die ermittelten Keimzahlen und qualitativen Bewertungen der geschwärmten Proben genauer betrachtet, fällt auf, dass durch die Trocknung zumindest eine Reduzierung von einer Zehnerpotenz stattfand. Die Keimzahl verringerte sich bei den vegetativen Zellen von 1,6∙105 auf etwa 103 bis 104 KbE/ml und bei den Sporen von 6,5∙104 auf 7,0∙103 KbE/ml. Zudem schienen schon 5 min Plasmabehandlung eine Wirkung auf die Mikroorganismen zu haben. Bei den vegetativen Zellen waren nur bei den 100 und der 10-2-Platten Bakterien zu finden. Außerdem war zu erkennen, dass die Sporen, die nach dem Plasmaeinsatz aktiviert worden sind, scheinbar stärker minimiert wurden. Es waren, wie bereits erwähnt, dort keine Kolonien bis auf eine bei der Platte mit der 10-2-Verdünnung der 5 minütigen Plasmabehandlung entstanden, währenddessen beim anderen von der Nullprobe zur 5 bzw. 10 min und zur 30 min Anwendung vermutlich eine Reduzierung um jeweils eine Zehnerpotenz vorherrschend war. Beim dritten Versuch wurde dieses Ergebnis bestätigt. Bei diesem Experiment waren alle Agarplatten quantitativ bestimmbar. Kein Schwärmen war erkennbar. Es kam wieder zu einer Minimierung der 37 Keimzahl von mindestens einer Zehnerpotenz während der Trocknung. Die Keimzahl sank von 1,8∙105 auf 6,5∙103 KbE/ml bei den vegetativen Zellen und von 6,3∙104 auf 4,6∙103 bzw. 5,9∙103 KbE/ml bei den Sporen. Durch die Trocknung trat somit eine Reduzierung von 92,7 bis 96,4 % auf. Bei der eigentlichen Behandlung mit Plasma zeigte sich ebenso eine Inaktivierung von Bakterien. Durch die fünfminütige Plasmabehandlung wurden die vegetativen Zellen auf 2,0∙102 und die vor der Anwendung aktivierten Sporen auf 2,7∙102 KbE/ml verringert. Bei den 10- und 30-minütigen Behandlung ging die Keimzahl noch weiter zurück. Sie lag bei den vegetativen Zellen bei bzw. unter 1,0∙101 und bei den vorher reaktivierten Sporen jeweils bei 2,0∙101 KbE/ml. Die Sporen, die im Nachhinein wieder zur Vermehrung angeregt worden sind, wurden durch das Plasma scheinbar komplett gehemmt. Auf den Agarplatten bildeten sich bis auf die 10-1-Verdünnung keine Kolonien. (Siehe Tabelle 7 im Anhang) Allerdings sind diese Ergebnisse nicht statistisch sicher. Zudem war die Ursprungskeimzahl bei allen drei Untersuchungen ziemlich gering. Möglicherweise ist noch ein größerer Inaktivierungseffekt erreichbar, wenn die Keimzahl höher ist. Daher wurde eine Aufkonzentrierung in den nächsten Versuchen vorgenommen. Die Aktivierung der Sporen vor der Plasmaanwendung wurde trotz der besseren Ergebnisse in weiteren Versuchen weggelassen, da das in der Praxis eher unrealistisch ist. Zudem wurde aufgrund der starken Reduzierung eine 1 und 2 minütige Plasmabehandlung zusätzlich zur 5 minütigen Anwendung durchgeführt. Dabei kam bei den meisten der aufkonzentrierten Versuche heraus: Je länger die Behandlung war, desto weniger Keime waren vorhanden. Allerdings zeigte sich das im 1. Versuch weniger stark als beim zweiten. (Siehe Abbildung 5) Kolonienanzahl in KbE/ml 1,0E+07 1,0E+06 veg. Zellen (1.) 1,0E+05 Sporen (1.) veg. Zellen (2.) 1,0E+04 Sporen (2.) 1,0E+03 0 1 2 3 4 Zeit der Plasmabehandlung in min 5 Abbildung 5: Inaktivierung von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung von 0, 1, 2 und 5 min im 1. und 2. Versuch 38 Die Ursprungskeimzahl nach der Trocknung fiel von 6,1∙104 auf 4,0∙104 KbE/ml nach 1 min und auf 2,8∙103 KbE/ml nach 2 min bei den vegetativen Zellen und von 1,6∙104 KbE/ml auf 2,2∙103 (1 min) bzw. 3,4∙103 (2 min) und 2,4∙103 KbE/ml nach 5 min bei den Sporen. Hier wurde eine Hemmung von 79,4 bis 95,4 % (0,8 Log) nach 2 bzw. 5 min erreicht. Scheinbar war die Probe, die eine Plasmaanwendung von 1 min erhielt ein Ausreißer. Es ist erneut ein Schwärmen aufgetreten, wodurch Messfehler entstanden sein könnten. Im 2. Versuch entstand ein klareres Ergebnis. Dort minimierte sich durch die Plasmabehandlung insgesamt die Keimzahl um 94,2 (v.Z.) bzw. 96,4 % (Sp.). Die Ursprungskeimzahl ging von 1,3∙106 auf 7,8∙104 KbE/ml bei den vegetativen Zellen bzw. von 1,2∙106 auf 4,2∙104 KbE/ml bei den Sporen zurück. Es lag also eine Reduzierung um 1,2 bzw. 1,4 Log-Einheiten vor. (Siehe Tabelle 8 im Anhang) Bei den Versuchen mit den höheren Aufkonzentrierungen bestätigte sich teilweise dieses Ergebnis. Es zeigte sich in den Untersuchungen ohne das Schütteln beim Trocknen, dass die Inaktivierung der vegetativen Zellen stärker war als die der Sporen. In der Abbildung 6 ist die Stärke der Inaktivierung im Durchschnitt der drei Versuche zu sehen. Überlebende (% Nullprobe) 100 10 veg. Zellen Sporen 1 0 0,1 5 10 15 20 25 30 Zeit der Plasmabehandlung in min Abbildung 6: Inaktivierung von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung von 0, 1, 2, 5, 10, 20 und 30 min im Versuch ohne Schütteln Im Mittel wurden die vegetativen Zellen bei den unterschiedlichen Längen der Plasmaeinwirkung um 92,0 bis 99,3 % (1,1 bis 2,4 Log) inaktiviert, die Sporen hingegen nur um 48,9 bis 80,5 % (0,2 bis 0,6 Log). Schon die 1-minütige Plasmabehandlung zeigte eine große Wirkung auf die vegetativen Zellen. Bei längerer Anwendung des Plasmas minimierte sich die Keimzahl nur noch wenig. Bei den Sporen dagegen kam es durch eine weitere Minute 39 zum tieferen Absinken der Keimzahl. Die Sporen schienen auf der Kunststoffoberfläche widerstandsfähiger gegen das Plasma zu sein. Werden die drei Versuche im Einzelnen betrachtet, gibt es allerdings Unterschiede, vor allem beim Effekt des Plasmas auf die Sporen, sodass größere Standardabweichungen von 14,8 bis 25,6 zustande kamen. Die Plasmawirkung ist innerhalb der Experimente trotz etwa gleicher Ausgangskeimzahl von 3,6∙104 bis etwa 1,3∙105 KbE/ml verschieden (Letztere Keimzahl wurde aus dem Wert vor der Trocknung berechnet, da er nicht auswertbar war). Beim 1.Versuch lag die Zahl der Überlebenden im Bereich von 34,3 bis 72,8 %, wobei die stärksten Wirkungen nach 10 und 30 min eintraten und der schwächste Effekt nach 1 min zu sehen war. Der 2. Versuch zeigte hingegen eine Inaktivierung von 70,7 bis 98,3 % (0,5 bis 1,8 Log), d.h. es blieben nur 1,7 bis 29,3 % der Keime zurück. Zwischen der Plasmabehandlung von 5 bis 30 min bestand dabei kaum ein Unterschied, während beim Versuch zuvor noch ein stärkeres Absinken der Keimzahl von 5 zu 10 min zu beobachten war. Beim letzten Versuch trat ein Schwärmen auf und es war zu erkennen, dass wieder weniger Bakteriosporen inaktiviert wurden. Allerdings musste die Nullprobe durch Berechnungen aus der Probe vor der Trocknung ermittelt werden, wodurch auch Fehler aufgetreten sein könnten. Hier wurden die Sporen um 39,4 bis 78,3 % (0,3 bis 0,6 Log) reduziert. Die Keimzahl war im 104-Bereich wie beim 1. Versuch nach der Plasmabehandlung somit noch ziemlich hoch. Die Inaktivierung der vegetativen Zellen war bei den drei Versuchen hingegen relativ gleichwertig. Die Ausgangskeimzahlen ähnelten sich ebenfalls. Sie lagen bei 8,9∙105 bis 5,2∙106 KbE/ml. Nur die Probe aus dem 3. Versuch, die 1 min behandelt worden war, wich sehr stark ab, sodass sie nicht in die Berechnungen einbezogen wurde. (Siehe Tabelle 9 im Anhang) So lagen die Standardabweichungen im Bereich von 0,3 bis 4,8. Die Versuche, in denen während des Trocknens der Schüttler eingesetzt wurde, zeigten ein etwas anderes Ergebnis als die Experimente ohne Schüttler. Bei diesen kam im Durchschnitt ein sehr ähnliches Resultat für die vegetative Zellen und Sporen heraus. (Siehe Abbildung 7) 40 Überlebende (% Nullprobe) 100 10 veg. Zellen Sporen 1 0 0,1 5 10 15 20 25 30 Zeit der Plasmabehandlung in min Abbildung 7: : Inaktivierung von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung von 0, 1, 2, 5, 10, 20 und 30 min im Versuch mit Schütteln Im Mittel wurden die vegetativen Zellen auf 0,2 bis 19,9 % reduziert. Es fand eine Minimierung um 0,7 bis 2,7 Log-Einheiten. Wenn man anhand der erhöhten Standardabweichung von 20,3 annimmt, dass im 3. Versuch bei der 2-minütigen Plasmabehandlung ein Ausreißer aufgetreten ist, dann blieben nur bis zu 9,8 % der ursprünglichen Keimzahl von 5,1∙104 bis 1,9∙105 KbE/ml nach der Anwendung erhalten. Diese 90,2 %ige Minimierung trat nach 1 min auf. Bei längerer Einwirkung des Plasmas ging die Keimzahl weiter zurück. Zwischen der 5 bis 30-minütigen Behandlung waren allerdings nur noch minimale Unterschiede zu erkennen. Die Anova und der anschließende Tukey-Test dazu bestätigte auch nur mit einer Irrtumswahrscheinlichkeit von p=0,001 die Differenz zwischen der Nullprobe und den übrigen Proben. Bei den Keimzahlen der Sporen sah es ähnlich aus. Auch hier gab es einen stärkeren Ausreißer beim 3. Experiment bei der Probe, auf die 2 min lang Plasma angewendet worden war. Die Standardabweichung wies auch hier einen erhöhten Wert von 16,1 auf. Da es sich um dieselbe Probe wie bei den vegetativen Zellen nur mit dem Zusatz einer 80 °C Erhitzungsphase handelt, trat vermutlich bei dieser Probe ein Messfehler auf. Mit dieser Annahme kam es insgesamt zu einer Hemmung um 95,6 bis 99,9 %, d.h. es blieben im Durchschnitt 0,1 bis 4,6 % der Keime an Alicyclobacillus acidoterrestris zurück und es fand eine Reduzierung um 1,3 bis 3,0 Log-Stufen statt. Die statistische Sicherheit der Wirkungsweise des Plasmas auf das Bakterium wurde auch hier mit höchst signifikant bestätigt. Genauer die einzelnen Versuche betrachtet, war das 2. Experiment am erfolgreichsten. Hier wurde die höchste Inaktivierungswirkung erzielt. Auf den Agarplatten der Sporen wuchsen ab der 5-minütigen Probe keine Keime mehr, sodass sich ein Wert für die Keimzahl von <10 41 KbE/ml ergab und somit eine Hemmung von mehr 99,9 %. Selbst 1 min Plasmaanwendung zeigte eine große Wirkung. Es blieben nur 1,9 % der Keime. Ähnlich war es auch bei den vegetativen Zellen. Dort ging die Keimzahl von 5,1∙104 auf unter 101 KbE/ml bei der 10- und 30-minütigen Probe zurück. (Siehe Tabelle 10 im Anhang) Es stellt sich die Frage, ob das Schütteln beim Trocknen einen direkten Einfluss auf die Behandlung nahm oder die Ergebnisse nur zufällig so entstanden sind. Es ist möglich, dass die bessere Substanzverteilung beim Schütteln das Einwirken des Plasmas auf die Mikroorganismen optimierte. Zusammengefasst zeigten diese Untersuchungen insgesamt einen unterschiedlich starken Effekt des Plasmas auf Alicyclobacillus acidoterrestris, die auf einer Kunststoffoberfläche aufgebracht wurden. Allerdings fand bei jedem Experiment eine Inaktivierung statt, sodass die Keimzahl teilweise um mehrere Log-Stufen reduziert wurde. Die Höhe der Ursprungskeimzahl nahm dabei scheinbar nur eine geringe bis gar keine Rolle ein. 4.4 Plasmabehandlung von A. a. auf einer Grapefruitschale Bei der Untersuchung, ob sich Fremdkeime auf der Grapefruit befinden, kam ein negatives Ergebnis heraus. Selbst nach 7 Tagen waren auf den Agarplatten keine Mikroorganismen zu finden. Wahrscheinlich zeigte die erzeugerseitige Oberflächenbearbeitung mit Orthophenylphenol, Thiabendazol und Imazalil ihre Wirkung oder es lag an der eher schlechten Möglichkeiten für Bakterien auf der Frucht zu überleben. Für die Untersuchung, inwieweit Alicyclobacillus acidoterrestris auf Grapefruitschalen inaktiviert werden kann, wurden mehrere Versuche unternommen. Zu Beginn der Versuche zeigten sich einige Probleme. Durch die flüssige Bakteriensuspension und die leicht gewölbte Oberfläche der Grapefruitschale war der Auftrag der Bakterien nicht einfach. Beim ersten Experiment liefen zunächst eingesetzte 0,5 ml teilweise von der Grapefruitschale in die Petrischale, was das Ergebnis hätte verfälschen können. Deswegen wurde nach dem ersten Versuch die Menge auf 0,3 ml reduziert. Zudem war es aufgrund der unterschiedlichen Dicke der Schalen und der ungleichmäßigen Trocknung durch den Inkubator nicht möglich, die exakte Zeit für die Trocknung zu bestimmen. Es bildete sich bei zu langer Trocknung auf manchen Stückchen eine stark abblätternde Haut (Siehe Abbildung im Anhang), die dann wieder mit einem Tropfen sterilem Dionatwasser auf die Oberfläche aufgebracht werden musste. Darauf folgte wieder eine kurze Trocknungsphase. Bei der Plasmabehandlung an sich gab es weitere Störfaktoren. Durch die Trocknung wölbten sich manche Schalen nach oben, sodass sie nicht unter das Plasmagerät passten. Diese wurden 42 dann vorsichtig mit einem sterilen Glasstab heruntergedrückt, wobei bei zu starkem Druck teilweise ätherische Öle austraten, die eventuell auch einen Einfluss auf die Mikroorganismen hatten. Trotz des Plattlegens kam es teilweise dazu, dass sich die Schalen wieder aufstellten und während der Plasmabehandlung ein Funkenschlag von der Elektrode zur Grapefruitschale entstand, der dann einen Brandschaden auf der Oberfläche der Grapefruitschale hinterließ. (Siehe Abbildung im Anhang) Zudem musste die Plasmabehandlung aufgrund der Brandgefahr unterbrochen werden. Erst nachdem die Schale wieder flach auf der Petrischale auflag, konnte die Anwendung weiter von statten gehen. Trotzdem ergab sich in jedem Experiment ein positives Ergebnis hinsichtlich der Inaktivierung. Es zeigte sich ein direkter Zusammenhang der Minimierung der Keimzahl zur Dauer der Plasmabehandlung. Bei der größten Verringerung sank die Keimzahl um mehr als 3 Zehnerpotenzen. Die Inaktivierung lag somit bei mehr als 99,9 %. Es zeigte sich allerdings kaum ein Unterschied zwischen der Behandlung der vegetativen Zellen und der Sporen. Die Agarplatten waren bei diesen Untersuchungen gut auszählbar. Es kam nur bei wenigen Platten im ersten Versuch zum Schwärmen. Ansonsten zeigte sich eine deutliche Tendenz der Abhängigkeit der Keimzahl von der Zeit der Plasmaanwendung. Nach der Trocknung war beim 1. Versuch eine Keimzahl von 1,6∙105 bei den vegetativen Zellen vorhanden. Diese stieg laut Betrachtung zunächst nach 1 min Plasma auf 3,6∙105 an. Es ist möglich, dass durch die kurze Anwendung die Sporen von Alicyclobacillus acidoterrestris aktiviert worden sind und so die Erhöhung zu Stande kam. Allerdings könnte bei der Verdünnungsreihe auch ein Fehler aufgetreten sein, da auf der 10-2 Verdünnung 389, aber auf der 10-3 nur 2 Kolonien zu finden waren. Bei den anderen Plasmabehandlungen sank die Keimzahl wie erwartet. Dort waren nach der Anwendung noch 0,7 bis 13,8 % der Bakterien vorhanden. Die stärkste Inaktivierung fand mit 2,1 Log-Einheiten nach 20 min statt. Es blieben 1,1∙103 KbE/ml zurück. Die 13,8 % (1,8∙104 KbE/ml) bezogen sich auf die 2 min, welche sich kaum von dem 5-minütigen Plasmaeinsatz mit 11,6 % bzw. 1,8∙104 KbE/ml unterschied. Dasselbe war auch bei der Keimzahl der Sporen zu finden. Auch hier kam es nach 1 min zunächst zu einer Erhöhung von 1,4∙104 auf 1,6∙104 KbE/ml. Ansonsten war die Wirkung der 20-minütigen Behandlung am stärksten (7,1∙101 KbE/ml) und die der 2-minütigen (2,3∙103 KbE/ml) am schwächsten. Letzteres ähnelte sich wie zuvor auch der 5-minütigen Anwendung. Beim zweiten Versuch wurde die These der stärkeren Inaktivierung bei längerer Behandlungszeit im Wesentlichen bestätigt. Die Mikroorganismen wurden durch die 1minütige Plasmabehandlung im Gegensatz zur ersten Untersuchung reduziert, was eventuell auch am Funkenschlag bei dieser Probe gelegen haben könnte. Die ursprünglichen 3,0∙104 43 KbE/ml bei den vegetativen Zellen nahmen um 86,7 % (0,8 Log) ab. Die anderen Minderungen waren recht ähnlich zueinander. Sie lagen im Bereich von 95,3 bis 99,9 %, wobei die 20- und 30-minütige Behandlung mit 1,8 und 3,0 Log gegenüber der von 2 und 5 min mit 1,3 und 1,5 Log eine stärkere Inaktivierung aufwiesen. Bei den Sporen waren die Keimzahlen etwa gleich bis auf einen Ausreißer bei der 5-minütigen Probe. Es fand eine Verminderung um 69,8 bis mindestens 99,8 % von der Nullprobe 6,1∙103 KbE/ml statt. Dieses Mal allerdings war laut den Keimzahlen die 5-minütige Behandlung am wenigsten wirksam. Am stärksten zeigte sich der Effekt bei der Probe, wo 20 min lang Plasma eingesetzt wurde. Hier wuchs nur auf der 10 -1Verdünnung eine Kolonie heran. Beim dritten Versuch stimmten die Ergebnisse mit den vorherigen in etwa überein. Die unterschiedlich langen Plasmaanwendungen zeigten sich allerdings nur gering in den Keimzahlen. Die Inaktivierungen lagen mit Ausnahme von der 10-minütigen Plasmabehandlung bei den vegetativen Zellen im Bereich von 92,8 bis 99,5 % (1,1 bis 2,3 Log) und bei den Sporen bei 93,3 bis 99,9 % (1,2 bis 3,0 Log). Die Plasmaanwendung scheint also sehr effektiv gewesen zu sein. Die Keimzahl ging von 1,3∙104 (v.Z.) bzw. 2,5∙104 KbE/ml (Sp.) auf maximal 6,3∙101 (v.Z.) bzw. 3,6∙101 KbE/ml (Sp.) zurück. Die stärksten Wirkungen wiesen dabei die Anwendungen mit einer Zeit von 20 und 30 min auf. Bei der 10-minütigen Probe wurden immerhin 73,1 bzw. 81,9 % Hemmung erreicht. Hier lag gewiss eine Abweichung vor. Der vierte Versuch bestätigte diese starke Inaktivierung bei den längeren Plasmabehandlungen. Auch hier bestand kaum ein Unterschied zwischen der Hemmung der vegetativen Zellen und der Sporen. Es fand bei den Anwendungen von 5, 10, 20 und 30 min eine Reduzierung um 95,8 bis 99,5 % (1,4 bis 3,0 Log) bei den vegetativen Zellen und 99,4 bis mindestens 99,9 % (2,2 bis 3,0 Log) bei den Sporen statt. Eine geringere Wirkung trat bei den 1- und 2-minütigen Behandlungen ein. Dort wurden die Mikroorganismen von 4,2∙103 KbE/ml (v.Z.) um 85,7 bzw. 63,2 % und von 1,5∙104 KbE/ml (Sp.) um 91,0 bzw. 76,2 % reduziert. (Siehe Tabelle 11 im Anhang) Durch die Doppelbestimmungen besteht hier eine größere Sicherheit als bei den vorherigen Versuchen. Eine statistische Sicherheit wird allerdings erst durch eine Anova und anschließendem Tukey-Test erreicht. Bei diesen kam heraus, dass sich die Keimzahlen von den Plasmabehandlungen und die von der Nullprobe bis auf die 1-minütige Probe bei den vegetativen Zellen signifikant mit einer Irrtumswahrscheinlichkeit von 0,05 unterscheiden. Die Plasmaanwendungen von 5 und 20 min wiesen bei den vegetativen Zellen im Vergleich zur Nullprobe sogar eine hohe Signifikanz auf. Bei den Sporen ist das Ergebnis statistisch noch sicherer. Hier war es höchst signifikant. 44 Abschließend lässt sich im Vergleich der Versuche zueinander also sagen, dass eine Hemmung von Alicyclobacillus acidoterrestris auf den Grapefruitschalen stattgefunden hat. Statistisch sicher war dieses allerdings nur im Vergleich zur Nullprobe. Anhand der Mittelwerte der Inaktivierungen war dagegen auch ein Unterschied zwischen den einzelnen Behandlungslängen sichtbar. (Siehe Abbildung 8) Überlbende (% Nullprobe) 100,0 10,0 veg. Zellen Sporen 1,0 0 0,1 5 10 15 20 25 30 Zeit der Plasmabehandlung in min Abbildung 8: Inaktivierung von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung von 0, 1, 2, 5, 10, 20 und 30 min auf einer Grapefruitschale Beim Betrachten dieses Diagramms fällt die hohe Inaktivierung durch Anwendungen von 2, 5, 10, 20 und 30 min auf. Nur die 1-minütige Behandlung weicht stark ab. Es besteht allerdings dort eine große Standardabweichung von 83,3 bei den vegetativen Zellen bzw. 42,5 bei den Sporen. Das lag an den teilweise verschiedenen Ergebnissen der Versuche. Zudem ist zu erkennen, dass sich die Werte von den 5- zu 10-minütigen und 20- zu 30-minütigen Behandlungen sehr ähneln. Es wurde dort im Durchschnitt etwa die gleiche Hemmung erreicht. Im Umkehrschluss bedeutet das, dass jeweils die Plasmaanwendung mit der geringeren Dauer effektiver im Kosten-Nutzen-Verhältnis ist. 45 4.5 Vergleich der Plasmabehandlung von A. a. auf einer Grapefruitschale mit der Behandlung mit UV-Strahlen Bei der Untersuchung zur Wirkung des UV-Lichts gegenüber der des Plasmas stellte sich heraus, dass das Plasma stärker inaktivierend wirkt. Die zwei Versuche zeigten je nach Länge der UV-Einwirkung eine Hemmung von 32,4 bis 96,4 % bzw. 0,2 bis 1,4 Log-Stufen. Allerdings ist hier im Gegenteil zu den Plasmabehandlungen kein klarer Zusammenhang zur Dauer erkennbar. Die Annahme, je länger die Einwirkung, desto stärker die Inaktivierung zeigte sich nur teilweise. Der 1. Versuch wies nur eine Tendenz in diese Richtung auf. (Siehe Abbildung 9) Überlebende (% Nullprobe) 100 veg. Zellen (1.) 10 Sporen (1.) veg. Zellen (2.) Sporen (2.) 1 0 5 10 15 20 25 Zeit der UV-Behandlung in min 30 Abbildung 9: Inaktivierung von vegetativen Zellen und Sporen von A. a. bei einer UVBehandlung von 0, 1, 2, 5, 10, 20 und 30 min auf einer Grapefruitschale Die Hemmung laut den berechneten Keimzahlen trat bei den vegetativen Zellen nach 1 min stärker als bei den UV-Bestrahlungen von 5, 10 und 20 min auf. Der Effekt der 30-minütigen Behandlung lag mit einer Minimierung um 89,5 % höher als die 77,9 % (1 min). Die Keimzahl reduzierte sich von 2,2∙103 auf 2,3∙102 KbE/ml. Auch bei den Sporen war die Keimzahlverringerung bei der längsten Einwirkung am höchsten. Sie entsprach bis auf einen Ausreißer (5 min mit 85,1 %) der bisherigen These. Die Inaktivierung reichte von 43,8 bis 86,8 %. Dabei veränderte sich die Keimzahl von 3,4∙103 auf ein Minimum von 4,5∙102 KbE/ml. Bei Betrachtung der bei dem Versuch durchgeführten Plasmabehandlung mit einer Länge von 1 und 5 min zeigte sich eine stärker hemmende Wirkung als bei der UV-Anwendung. Dort blieben im direkten Vergleich nach 1 min eine Differenz von 18,9 % und nach 5 min 39,4 % 46 weniger vegetative Zellen zurück als bei der UV-Bestrahlung. Bei den Sporen gab es ein ähnliches Ergebnis. Nach 1 min wurden im Gegensatz zur UV-Strahlung 48,8 % und nach 5 min 4,8 % mehr inaktiviert. Der zweite Versuch hingegen bestätigte die These nicht weiter. Es fand trotzdem eine Inaktivierung der vegetativen Zellen und Sporen statt. Selbst nach 1 min Bestrahlung mit UVLicht zeigte sich bei den vegetativen Zellen eine Minderung der Keimzahl um 92,0 %. Bei den anderen Zeiten von 2, 5, 10, 20 und 30 min lag die Hemmung bei 66,8 bis 96,4 % (0,5 bis 1,4 Log), wobei die stärkste Wirkung bei 20 min und die schwächste bei 30 min eintrat. Bei der Betrachtung der Ergebnisse der Sporen hingegen zeigte sich der schwächste Effekt bei der 1minütigen Behandlung. Hier ging die Keimzahl nur von 1,3∙104 auf 8,6∙103 KbE/ml zurück (32,4 % Verringerung). Die anderen Bestrahlungslängen wiesen eine Reduzierung von 72,1 bis 97,9 % (0,5 bis 1,7 Log) auf. Zur größten Reaktion kam es bei der 5-minütigen Anwendung, zur kleinsten bei der 30-minütigen. Im direkten Vergleich zeigt sich in diesem Versuch nicht die Überlegenheit des Plasmas gegenüber des UV-Lichts. Die Keimzahl bei den vegetativen Zellen nach 1 min UV-Licht war um den Wert 105,8 %-Punkte geringer als nach 1 min Plasma. Bei 5 min war es hingegen andersherum. Dort lag die Differenz bei 9,5 %-Punkten. Der Unterschied bei der Keimzahl der Sporen war ähnlich. (Siehe Tabelle 12 im Anhang) Beim Zusammenfassen der Werte der UV-Behandlung fällt der große Unterschied zwischen den beiden Versuchen auf. Es ergeben sich teilweise größere Standardabweichungen. Sie liegen im Bereich von 5,7 bis 22,8. Vor allem bei den Keimzahlen der 5- und 10-minütigen UVBehandlung der vegetativen Zellen war die Standardabweichung mit 17,6 und 22,8 relativ hoch. So sind diese wie auch die Werte der Plasmaanwendung von 2 und 30 min Länge gegenüber der Nullprobe nicht statistisch unterschiedlich. Die anderen Proben (1 und 20 min) sind hingegen von dieser mit einer Irrtumswahrscheinlichkeit von 0,05 signifikant verschieden. Bei den Sporen trifft mit Ausnahme der 1-minütigen Behandlung mit p = 0,01 eine hohe Signifikanz der Abweichung zur Nullprobe zu. Untereinander sind sie hingegen statistisch als gleich anzusehen. Es kann also eine Wirkung der UV-Strahlen auf Alicyclobacillus acidoterrestris zwar bestätigt werden, allerdings nicht der zeitliche Zusammenhang. Werden diese Ergebnisse direkt mit den Versuchen bzw. Resultaten der Plasmaanwendung verglichen, fällt der Unterschied zwischen dem verwendeten UV-Licht und Plasma auf. Bis auf zwei Ausnahmen war die Hemmungswirkung des Plasmas im Wesentlichen stärker als die des UV-Lichts. Nur nach 1 min bei den vegetativen Zellen und nach 5 min bei den Sporen war die Inaktivierung des UV-Lichts im Durchschnitt höher. Ersteres lag gewiss an den zwei hohen 47 Ausreißern bei den Plasmauntersuchungen. Beim Zweiten bestand nur ein geringer Unterschied von 4,5 %, sodass dieses auch auf Messfehlern basieren könnte. Es kann also gesagt werden, dass durch die UV-Strahlung eine inaktivierende Wirkung eintritt. Allerdings ist sie in diesen Versuchen nicht so groß wie bei der Plasmabehandlung. Die Vermutung, dass allein die entstehende UV-Strahlung für die Hemmung verantwortlich ist, stimmt somit vermutlich nicht. Plasma scheint effektiver gegen Alicyclobacillus acidoterrestris zu wirken. 48 5 Diskussion Die Versuche in dieser Arbeit zur Anwendung des Kaltplasmas auf vegetative Zellen und Sporen des Bakteriums Alicyclobacillus acidoterrestris brachten vorzeigbare Ergebnisse. Es fand eine Hemmung des Keimes statt. Allerdings war diese nicht soweit ausgeprägt, dass alle Bakterien inaktiviert wurden. Es blieb auch nach 30 min Behandlung eine teilweise noch recht hohe Restkeimzahl vorhanden. Eine Reduzierung des Keims sowohl bei den vegetativen Zellen als auch bei den Sporen bis zu 4,2 Log-Stufen auf einer Kunststoffoberfläche und bis zu 3,2 auf einer Grapefruitschale fand trotzdem statt. Solch ein ähnliches Ergebnis wurde auch bei einer anderen Untersuchung mit einer DBD-Plasmaanlage und atmosphärischen Plasma beobachtet. Dabei wurden bei den Experimenten von Schwabedissen et al. (2007) Mikroorganismen auf Erdbeeren und Kirschtomaten um bis zu 4 Log-Einheiten minimiert. Auf PET-Folien wurden laut Wan et al. (2009) hingegen unterschiedliche Mikroorganismen um 5,1 bis mehr als 6,9 Log-Stufen inhibiert. Größere Unterschiede gab es allerdings bei der Hemmung in einer Flüssigkeit. In dieser Arbeit konnte nur ein Maximum von 0,9 Log-Stufen erreicht werden, während bei Shi et al. (2011) in Orangensaft durch atmosphärisches Kaltplasma einer DBD eine Inaktivierung um 5 Log-Einheiten stattfand. Dabei handelte es sich zwar um andere Mikroorganismen wie auch bei den anderen Studien, trotzdem stellt sich die Frage, ob eventuell noch ein anderer Grund dafür verantwortlich war. Möglicherweise ist der Orangensaft für das Plasma durchlässiger gewesen oder es wurden mehr aktive Teilchen gebildet. Es besteht auf jeden Fall weiterer Forschungsbedarf. So sind vielfältige Modifikationen für nachfolgende Arbeiten denkbar. Fortführend könnten andere Plasmaquellen eine noch größere Wirkung erzielen. Zudem könnten auch andere Gasgemische eine stärkere Inaktivierung zur Folge haben. Laut Lee et al. (2011) war bei ihren Versuchen eine Inaktivierung bis zu 7,6 LogStufen des Bakterium Listeria monocytogenes durch Plasma-Jet und ein Gemisch von N2 und O2 möglich. Patil et al. (2014) zeigte, dass ein Gasgemisch von 65 % O2, 30 % CO2 und 5 % N2 schon nach 30 s eine Inaktivierung um 3 bis 6 Log-Einheiten von Bacillus atrophaeus Sporen auslöste. Um die Plasmabehandlung besser mit der Anwendung der UV-Strahlung vergleichen zu können, wäre hier auch ein Ansatzpunkt für weitere Versuche. Es ist weiterhin unklar, ob eventuell das entstehende UV-Licht den Hauptteil der Inaktivierung ausmacht. Die in diesen Versuchen verwendete UV-Lampe war relativ weit von den Proben entfernt gelegen. Zudem war die Wellenlänge unbekannt, die auf die Grapefruitschalen und den Mikroorganismen wirkte. Es sollte eine UV-Bestrahlung vorgenommen werden, wie sie auch bei der Plasmabehandlung entsteht, d.h. mit gleichem Abstand und gleicher Wellenlänge. Darüber 49 hinaus könnte auch die Oberflächenbeschaffenheit der Grapefruitschale für einen verminderten Effekt gesorgt haben. Da diese eher uneben mit Vertiefungen ist als glatt, führte das zum Schutz der Keime durch eventuell auftretenden Schatten. Experimente auf einer Kunststoffoberfläche, wie die der Petrischale, wären sinnvoll. Für weitere Versuche sollte eventuell die Anfangskeimzahl noch erhöht werden. Bei den ersten Versuchen war diese teilweise bis zu 3 log-Stufen höher als zum Ende. Allerdings ist die generelle Gesamtkeimzahl als auch die Anzahl an vegetativen Zellen oder Sporen des Bakteriums Alicyclobacillus acidoterrestris auf einer bestimmten Fruchtschale wie der Grapefruit auch aufgrund verschiedener antibakterieller Vorgehensweisen sehr gering. Außerdem könnten die Bakterien auch noch auf anderen Oberflächen bestimmter Obstsorten aufgebracht werden. Dabei wäre speziell die Untersuchung der Wirkung der Inaktivierung auf anderen Zitrusfrüchten interessant. Es wäre denkbar, dass der Effekt aufgrund der unterschiedlichen Oberflächenbeschaffenheit stärker oder schwächer ausfällt. Es könnten zudem noch Versuche unternommen werden, wo die Bakterien zwar gewaschen worden sind, aber nicht getrocknet. Möglicherweise geht durch die Komponenten des Nährmediums eine Schutzfunktion gegen die Plasmaanwendung aus, sodass weniger Bakterien inaktiviert werden. Das wäre beispielsweise für die Anwendung auf flüssige Produkte wie Säfte o.ä. entscheidend. Zudem sollte bei weiteren Untersuchungen die Betrachtung der Guajacolproduktion durch den Mikroorganismus mit einbezogen werden. Es ist möglich, dass der Keim zwar in seinem Wachstum gehemmt wurde, allerdings noch Guajacol produzieren kann. Da der Keim nicht gesundheitsgefährdend ist, stellt sich überdies die Frage, inwiefern sich die Anwendung des Plasmas aus finanzieller Sicht lohnen würde. Die Anschaffung und das Betreiben solcher Plasmaanlagen sind nicht günstig (Niemera, 2012). Hierbei müssten die Verwender eine Kosten-Nutzen-Analyse durchführen. Dazu sollte ebenso die Dauer der Anwendung betrachtet werden. Wie bei den Versuchen gezeigt wurde, waren die Ergebnisse der 20- und 30-minütigen Behandlung teilweise fast identisch. Zudem waren die Plasmaanwendungen mit weniger Zeit auch schon sehr effektiv. Da ein Wert von 0 nie erreicht werden würde, sollte die Frage gestellt werden, wie sinnvoll dann die Inaktivierung von nur weniger Keimen mehr ist. Auch die Inaktivierung bei geringerer Dauer als 1 min wäre interessant. Es wurde gezeigt, dass die Plasmabehandlung z.B. auf der Grapefruitschale bei mehreren Versuchen schon nach 1 min um 80 bis 90 % der Keime inaktiviert hat. Das führt zu der Überlegung, ob auch wenige Sekunden eine Wirkung zeigen würden. Eventuell würde ein 50 Effekt in diesem Bereich reichen, um einen entscheidenden Teil der Mikroorganismen zu hemmen. Zudem könnte es zu Abweichungen während der Untersuchungen gekommen sein. Eventuell war das Alter der verwendeten Kultur für die späteren Versuche entscheidend. Die Ursprungskeimzahl nach der Trocknung nahm trotz gleicher Bedingungen und Aufkonzentration bei den späteren Untersuchungen immer weiter ab. Während der Dauer der Versuchsreihen lagerte die Kultur auf einer YSG-Platte im Kühlschrank bei 6 °C. Das ist für vegetative Zellen von Alicyclobacillus acidoterrestris außerhalb des Lebensbereichs. Allerdings sollten sie sporulieren und somit überlebensfähig bleiben. Deswegen stellt sich die Frage, womit diese Abnahme der Keimzahl zu erklären ist. Es ist durchaus möglich, dass dieses auch einen Einfluss auf die Plasma- bzw. UV-Behandlung nahm. Deshalb sollte bei Weiterführung versucht werden, immer eine „frische“ Kultur einzusetzen. Möglicherweise sind auch durch die Unterbrechungen während der Plasmabehandlung Messfehler entstanden. Zudem könnten Bakterien auf dem Glas beim Plattdrücken der Grapefruitstücke haften geblieben sein. Auch eine Abtötung durch den Funkenschlag anstatt bzw. zusätzlich zum Plasma wäre möglich. Teilweise wurde bei den einzelnen Versuchen keine Doppelbestimmung von Proben durchgeführt, sodass es nicht auszuschließen ist, dass auch so Fehler entstanden sein könnten. Allein durch die Annahme, dass die ursprüngliche Keimzahl in den einzelnen Proben mit der Nullprobe überall identisch ist, führt zu weiteren möglichen Abweichungen. Es ist auch denkbar, dass der hemmende Effekt auf dem aufgetragenen Schutzlack des Plasmageräts beruht. Dieser könnte durch das Plasma gasförmig und/oder zu schädlichen Verbindungen für den Alicyclobacillus acidoterrestris geworden sein. Das lässt sich allerdings nur schwer überprüfen, da dieser Lack zum Schutz der Elektroden aufgetragen werden muss. 51 6 Zusammenfassung Das Ziel dieser Masterarbeit war es, vegetative Zellen und Sporen des Bakterium Alicyclobacillus acidoterrestris mit Hilfe von atmosphärischen Kaltplasma zu inaktivieren. Dazu wurde der Keim sowohl in flüssigem Medium, als auch auf einer Kunststoffoberfläche (Petrischale) und Grapefruitschale plasmabehandelt. Dabei zeigen die Versuchsergebnisse eine inaktivierende Wirkung des atmosphärischen Kaltplasmas auf das Bakterium. Es gab zwischen den verschiedenen Umgebungsmedien Unterschiede. Während im flüssigen Medium nur eine geringe Abtötung um 0,9 Log-Stufen gelang, war die inaktivierende Wirkung auf der Oberfläche der Petri- und auch der Grapefruitschale stärker. Die Inhibierung auf der Kunststoffoberfläche zeigte zudem gegenüber der der Grapefruit eine Überlegenheit um 1 Log-Einheit. Sowohl bei vegetativen Zellen als auch bei den Sporen wurde dieser Effekt festgestellt. Es kam bis zu einer Inaktivierung von 4,2 Log-Stufen bei der längsten Anwendung. Scheinbar ist also auch die Länge der Anwendung entscheidend. Einen grundlegenden Unterschied zwischen der Hemmung von vegetativen Zellen und Sporen gab es dabei nicht. 52 7 Literaturverzeichnis Baysal, A.; Molva, C.; Unluturk, S.: UV-C light inactivation and modeling kinetics of Alicyclobacillus acidoterrestris spores in white grape and apple juice. International Journal of Food Microbiology (2013), Vol. 166, S. 494-498 Beer, T.; Knospe, A.; Buske, C.; Wintermantel, E. (Hrsg.); Ha, S.-W. (Hrsg.): Medizintechnik. Life Science Engineering. Interdisziplinarität, Biokompatibilität, Technologien, Implantate, Diagnostik, Werkstoffe, Zertifizierung, Business. Atmosphärisches Plasma in der Medizintechnik. 5. Auflage. Berlin/Heidelberg: Springer, 2009 Bevilacqua, A.; Corbo, M.;Sinigaglia, M.: Inhibition of Alicyclobacillus acidoterrestris spores by natural compounds. International Journal of Food Science & Technology (2008a), Vol. 43, S. 1271–1275 Bevilacqua, A.; Sinigaglia, M.; Corbo, M.: Alicyclobacillus acidoterrestris: New methods for inhibiting spore germination. International Journal of Food Microbiology (2008b), Vol. 125, S. 103-110 Bevilacqua, A.; Ciuffreda, A.; Sinigaglia, M.; Corbo, M.: Effects of lysozyme on Alicyclobacillus acidoterrestris under laboratory conditions. International Journal of Food Science & Technology (2014), Vol. 49, S. 224–229 Bokhorst-van de Veen, H. van; Xie, H.; Esveld, E.; Abee, T.; Mastwijk, H.; Groot, M.: Inactivation of chemical and heat-resistant spores of Bacillus and Geobacillus by nitrogen cold atmospheric plasma evokes distinct changes in morphology and integrity of spores. Food Microbiology (2015), Vol. 45, S. 26-33 Cerny, G.; Hennlich, W.; Poralla, K.: Spoilage of fruit juice by bacilli: isolation and characterization of the spoiling microorganism. Zeitschrift für Lebensmittel-Untersuchung und –Forschung (1984), Vol 179, S. 224-227 Clotteau, M.: Alicyclobacillus spp. Control in the Fruit Juice Industry. 01/2014. http://www.pall.com/pdfs/Food-and-Beverage/FBTBTABFJEN.pdf, 15.11.2015 53 Cypionka, H.: Grundlagen der Mikrobiologie. 4. Auflage. Berlin, Heidelberg: Springer, 2010 DFG Senatskommission zur gesundheitlichen Bewertung von Lebensmitteln (SKLM): Stellungnahme zum Einsatz von Plasmaverfahren zur Behandlung von Lebensmitteln. 25.05.2012. http://www.dfg.de/download/pdf/dfg_im_profil/reden_stellungnahmen/2012/ sklm_plasmastellungsnahme_120525.pdf, 15.10.2015 Fritsche, W.; Laplace, F.: Mikrobiologie. 3. überarb. Auflage. Berlin, Heidelberg: Spektrum Akademischer, 2002 Goto, K.; Nishibori, A.; Wasada, Y.; Furuhata, K.; Fukuyama, M.; Hara, M.: Identification of thermos-acidophilic bacteria isolated from the soil of several Japanese fruit orchards. Applied Microbiology (2008), Vol. 46, S. 289-294 Grzegorzewski, F.; Rohn, Kroh, L.W.; Geyer, M.; Schlüter, S.: Surface morphology and chemical composition of lamb’s lettuce (Valerianella locusta) after exposure to a low pressure oxygen plasma. Food Chemistry (2010), Vol. 122, S. 1145 Hertwig, C.; Reineke, K.; Ehlbeck, J.; Knorr, D.; Schlüter, O.: Decontamination of whole black pepper using different cold atmospheric pressure plasma applications. Food Control (2015), Vol. 55, Nr. 221-229 Innerhofer, G.: Das große Buch der Obstverarbeitung. handbuch_für_praktiker. Leopoldsdorf bei Wien: aV Buch im Agrarverlag, 2005 Kang, D.: Development of Simple Differentiation Method between Guaiacol Producing and Non-guaiacol Alicyclobacillus. 2006. http://impact.wsu.edu/publications/fact_sheets/fs_kang_ development_of%20simple_differentiation_method.htm, 28.11.2015 Kannenberg, E.; Blume, A.; Poralla, K.: Properties of ω-cyclohexane fatty acids in membranes. FEBS (1984), Vol. 172, S. 331-334 54 Keding, K.; Dittrich, H. (Hrsg.): Mikrobiologie der Lebensmittel. Getränke. Haltbarmachung von Getränken. Hamburg: Behr´s, 1993 Kim, J.; Lee, D.-U.; Min, S.: Microbial decontamination of red pepper powder by cold plasma. Food Microbiology (2014), Vol. 38, S. 128-136 Lacombe, A.; Niemira, B.; Gurtler, J.; Fan, X.; Sites, J.; Boyd, G.; Chen, H.: Atmospheric cold plasma inactivation of aerobic microorganisms on blueberries and effects on quality attributes. Food Microbiology (2015), Vol. 46, S. 479-484 Lee, H.; Jung, H.; Choe, W.; Ham, J.; Lee, J.; Jo, C.: Inactivation of Listeria monocytogenes on agar and processed meat surfaces by atmospheric pressure plasma jets. Food Microbiology (2011), Vol. 28, S. 1468-1471 Lee, S.; Dougherty, R.; Kang, D.: Inhibitory Effects of High Pressure and Heat on Alicyclobacillus acidoterrestris Spores in Apple Juice. Applied and Environmental Microbiology (2002), Vol 68, S. 4158-4161 Leipold, F.; Kusano, Y.; Hansen, F.; Jacobsen, T.: Decontamination of a rotating cutting tool during operation by means of atmospheric pressure plasmas. Food Control (2010), Vol. 21, S. 1194-1198 Lieberei, R.; Reisdorff, C.: Nutzpflanzenkunde. 7. vollst. überarb. Auflage. Stuttgart: Georg Thieme, 2007 Liebster, G.; Levin, H.-G.: Warenkunde Obst und Gemüse. Band I – Obst. 2. vollst. überarb. Auflage. Weil der Stadt: Walter Hädecke, 2002 Misra, N.; Kaur, S.; Tiwari, B.; Kaur, A.; Singh, N.; Cullen, P.: Atmospheric pressure cold plasma (ACP) treatment of wheat flour. Food Hydrocolloids (2015), Vol. 44, S. 115-121 Misra, N.; Keener, K.; Bourke, P.; Mosnier, J.; Cullen, P.: In-package atmospheric pressure cold plasma treatment of cherry tomatoes. Journal of Bioscience and Bioengineering (2014a), Vol. 118 Nr. 2, S. 177-182 55 Misra, N.; Patil, S.; Moiseev, T.; Bourke, P.; Mosnier, J.; Keener, K.; Cullen, P.: In-package atmospheric pressure cold plasma treatment of strawberries. Journal of Food Engineering (2014b), Vol. 125, S. 131-138 Müller, G.: Mikrobiologie der Lebensmittel. Lebensmittel pflanzlicher Herkunft. Hamburg: Behr´s, 1997 Niemira, B.: Cold Plasma Decontamination of Foods. Annu. Rev. Food Science Technology (2012), Vol. 3, S. 125-142 Patil, S.; Moiseev, T.; Misra, N.; Cullen, P.; Mosnier, J.; Keener, K.; Bourke, P.: Influence of high voltage atmospheric cold plasma process parameters and role of relative humidity on inactivation of Bacillus atrophaeus spores inside a sealed package. Journal of Hospital Infection (2014), Vol. 88, S. 162-169 Pettipher, G.; Osmundson, M.; Murphy, J.: Methods for the detection and enumeration of Alicyclobacillus acidoterrestris and investigation of growth and production of taint in fruit juice and fruit juice-containing drinks. Applied Microbology (1979), Vol. 24, S. 185-189 Qiu, N.; Chen, Y.: Solution properties of ozone in water and its non-thermal sterilizing effect on Alicyclobacillus. Transactions of The Chinese Society of Agricultural Engineering (2004), Vol. 20, S. 157-159 Reineke, K.; Weber, G.; Ehlbeck, J.; Schlüter, O.: Kaltplasma. Schonende Dekontamination von Gewürzen. DLG Lebensmittel (2013), Vol. 3, S. 20-21 Schwabedissen, A.; Lacinski, P.; Chen, X.; Engemann, J.: PlasmaLabel – a New Method to Disinfect Goods Inside a Closed Package Using Dielectric Barrier Discharges. Contributions to Plasma Physics (2007), Vol. 47, S. 551-558 Schneider, E., Fuchs, G. (Hrsg.): Allgemeine Mikrobiologie. Die Besonderheiten prokaryontischer Zellen. 9. überarb. u. erw. Auflage. Stuttgart, New York: Georg Thieme, 2014 56 Shi, X.; Zhang, G.; Wu; X.; Li, Y.: Effect of Low-Temperature Plasma on Microorganism Inactivation and Quality of Freshly Squeezed Orange Juice. IEEE Transactions on Plasma Science (2011), Vol. 39, S. 1591-1597 Silva, F.; Gibbs, P.: Alicyclobacillus acidoterrestris spores in fruit products and design of pasteurization processes. Trends in Food Science & Technology (2001), Vol. 12, S. 68–74 Silva, F.; Tan, E.; Farid, M.: Bacterial spore inactivation at 45-65 °C using high-pressure processing: study of Alicyclobacillus acidoterrestris in orange juice. Food Microbiology (2012), Vol. 32, S. 206-211 Steffens, K.: Modul B19 Grundlagen der Mikrobiologie und Biochemie. Praktikum – Versuchsanleitungen. Neubrandenburg: 2011 Surowsky, B.; Fröhling, A.; Gottschalk, N.; Schlüter, O.; Knorr, D.: Impact of cold plasma on Citrobacter freundii in apple juice: Inactivation kinetics and mechanisms. International Journal of Food Microbiology (2014), Vol. 174, S. 63-71 Takahashi, K.; Goto, K.; Tanaka, T.; Tanada, S.; Sawaki, T.; Yamamoto, R.; Yokota, A. (Hrsg.); Fujii, T. (Hrsg.); Goto, K. (Hrsg.): Alicyclobacillus. Factors of spoilage caused by Alicyclobacillus and prevention measures. Japan: Springer Science + Business Media, 2007 Tsuruoka, N.; Isono, Y.; Shida, O.; Hemmi, H.; Nakayama, T; Nishino, T.: Alicyclobacillus sendaiensis sp. nov., a novel acidophilic, slightly thermophilic species isolated from soil in Sendai, Japan. International Journal of Systematic and Evolutionary Microbiology (2003), Vol. 53, S. 1081–1084 Unden, G.; Fuchs, G. (Hrsg.): Allgemeine Mikrobiologie. Regulation des Stoffwechsels und des Zellaufbaus von Bakterien. 9. überarb. u. erw. Auflage. Stuttgart, New York: Georg Thieme, 2014 Walls, I.; Chuyate, R.: Isolation of Alicyclobacillus acidoterrestris from Fruit Juice. Journal of AOAC International (2000), Vol. 83, S. 1115-1120 57 Wan, J.; Coventry, J.; Swiergon, P.; Sanguansri, P.; Versteeg, C.: Advances in innovative processing technologies for microbial inactivation and enhancement of food safety - pulsed electric field and low-temperature plasma. Trends in Food Science & Technology (2009), Vol. 20, S. 414-424 Wintermantel, E.; Ha, S.-W.: Medizintechnik. Life Science Engineering. Interdisziplinarität, Biokompatibilität, Technologien, Implantate, Diagnostik, Werkstoffe, Zertifizierung, Business. 5. Auflage. Berlin/Heidelberg: Springer, 2009 Wisotzkey, J.; Jurtshuk, P.; Fox, G.; Deinhard, G.; Poralla, K.: Comparative Sequence Analyses on the 16s rRNA (rDNA) of Bacillus acidocaldarius, Bacillus acidotenestris, and Bacillus cycloheptanicus and Proposal for Creation of a New Genus, Alicyclobacillus gen. nov. International Journal of Systematic Bacteriology (1992), Vol. 42, S. 263-269 Yamazakia, K.; Murakamia, M.; Kawaia, Y.; Inouea, N.; Matsuda, T.: Use of nisin for inhibition of Alicyclobacillus acidoterrestris in acidic drinks. Food Microbiology (2000), Vol. 17, S. 315–320 Yokota, A.; Fujii, T.; Goto, K.: Alicyclobacillus: Thermophilic Acidophilic Bacilli, Tokyo, Berlin, Heidelberg, New York (Springer), 2007 Ziuzina, D.; Patil, S.; Cullen, P.; Keener, K.; Bourke, P.: Atmospheric cold plasma inactivation of Escherichia coli, Salmonella enterica serovar Typhimurium and Listeria monocytogenes inoculated on fresh produce. Food Microbiology (2014), Vol. 24, S. 109-116 58 8 Abbildungs- und Tabellenverzeichnis Abbildung 1: Morphologische Veränderungen während der Sporulation von 0-VII (Unden, 2014)......................................................................................................................................... 12 Abbildung 2: Entstehung und Zusammensetzung eines Plasmas (Beer et al, 2009) ............... 16 Abbildung 3: Verwendete Plasmaanlage in den Versuchen .................................................... 26 Abbildung 4: Vergleich der Keimzahlen der vegetativen Zellen und Sporen bei einer Plasmabehandlung von 0 und 30 min ...................................................................................... 36 Abbildung 5: Inaktivierung von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung von 0, 1, 2 und 5 min im 1. und 2. Versuch .............................................. 38 Abbildung 6: Inaktivierung von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung von 0, 1, 2, 5, 10, 20 und 30 min im Versuch ohne Schütteln .................. 39 Abbildung 7: : Inaktivierung von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung von 0, 1, 2, 5, 10, 20 und 30 min im Versuch mit Schütteln .................... 41 Abbildung 8: Inaktivierung von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung von 0, 1, 2, 5, 10, 20 und 30 min auf einer Grapefruitschale .................... 45 Abbildung 9: Inaktivierung von vegetativen Zellen und Sporen von A. a. bei einer UVBehandlung von 0, 1, 2, 5, 10, 20 und 30 min auf einer Grapefruitschale ............................... 46 Abbildung 10: Veränderung des Nährmediums von Tag 0 über Tag 3 zu Tag 5 .................... 61 Abbildung 11: Mit Methylenblau angefärbte Alicyclobacillus acidoterrestris Bakterien bei 600facher Vergrößerung (links: ohne Hitzebehandlung, rechts: mit 80 °C Hitzebehandlung) 61 Abbildung 12: Mit Malachitgrün bzw. Safranin angefärbte Alicyclobacillus acidoterrestris Bakterien bei 600facher Vergrößerung (links: ohne Hitzebehandlung, rechts: mit 80 °C Hitzebehandlung) ..................................................................................................................... 62 Abbildung 13: Abblätternde Schicht auf der Oberfläche einer 9 cm² großen Grapefruitschale .................................................................................................................................................. 72 Abbildung 14: Brandschaden auf der Oberfläche der Grapefruitschalen der 20- und 30minütigen Plasmabehandlung .................................................................................................. 72 59 Tabelle 1: Technische Kenngrößen und Einflussparameter zur Beschreibung einer Plasmabehandlung (DFG, 2012) .............................................................................................. 18 Tabelle 2: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei verschiedener Temperatur und Dauer ...................................................................................... 61 Tabelle 3: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. einer 10-3-Verdünnung auf K- und YSG-Agar .................................................................................. 62 Tabelle 4: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. einer 10-3-Verdünnung bei unterschiedlicher Verpackung ............................................................... 62 Tabelle 5: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Nährflüssigkeit von 0, 5, 10 und 30 min bei unterschiedlichen Verdünnungen .......................................................................................................................... 63 Tabelle 6: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Nährflüssigkeit von 0 und 30 min bei unterschiedlichen Verdünnungen .................................................................................................................................................. 64 Tabelle 7: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Kunststoffoberfläche von oT, 0, 5, 10 und 30 min bei unterschiedlichen Verdünnungen .......................................................................................................................... 65 Tabelle 8: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Kunststoffoberfläche von oT, 0, 1, 2 und 5min bei unterschiedlichen Verdünnungen .......................................................................................................................... 66 Tabelle 9: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Kunststoffoberfläche von oZ, oT, 0, 1, 2, 5, 10, 20 und 30 min bei unterschiedlichen Verdünnungen (Trocknung ohne Schüttler) ............................................... 67 Tabelle 10: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Kunststoffoberfläche von oT, 0, 1, 2, 5, 10, 20 und 30 min bei unterschiedlichen Verdünnungen (Trocknung mit Schüttler) .................................................. 68 Tabelle 11: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Grapefruitschalen von oZ, oT, 0, 1, 2, 5, 10, 20 und 30 min bei unterschiedlichen Verdünnungen ............................................................................................. 70 Tabelle 12 : Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung von 1 und 5 min und einer UV-Behandlung der Grapefruitschalen von oT, 0, 1, 2, 5, 10, 20 und 30 min bei unterschiedlichen Verdünnungen .................................. 73 60 9 Anlagen Abbildung 10: Veränderung des Nährmediums von Tag 0 über Tag 3 zu Tag 5 Tabelle 2: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei verschiedener Temperatur und Dauer vegetative Zellen Temperatur in °C Zeit in min 10-2 10-3 10-4 10-5 KbE/ml - - 606 44 2 0 5,9E+05 10 20 30 5 10 20 5 10 247 85 46 453 8 22 5 0 15 12 4 14 3 1 0 0 0 1 0 0 0 0 0 0 1 0 0 0 0 0 0 0 2,4E+05 8,8E+04 4,5E+04 4,2E+05 1,0E+04 2,1E+04 5,0E+03 < 1,0E+01 80 Sporen 85 90 Abbildung 11: Mit Methylenblau angefärbte Alicyclobacillus acidoterrestris Bakterien bei 600facher Vergrößerung (links: ohne Hitzebehandlung, rechts: mit 80 °C Hitzebehandlung) 61 Abbildung 12: Mit Malachitgrün bzw. Safranin angefärbte Alicyclobacillus acidoterrestris Bakterien bei 600facher Vergrößerung (links: ohne Hitzebehandlung, rechts: mit 80 °C Hitzebehandlung) Tabelle 3: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. einer 10-3-Verdünnung auf K- und YSG-Agar Agar K YSG K YSG Form vegetative Zellen Sporen I 8 40 10 48 II 0 12 8 18 III 6 28 5 15 IV 10 21 5 12 KbE/ml 6,0E+04 2,5E+05 7,0E+04 2,3E+05 I-IV = Anzahl Platten Tabelle 4: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. einer 10-3-Verdünnung bei unterschiedlicher Verpackung Verpackung ohne I II III IV KbE/ml 73 64 80 71 7,2E+05 mit Aluminiumfolie, ohne Papier 103 98 111 92 1,0E+06 mit Aluminiumfolie, mit feuchtem Papier (5g Wasser) S S S S n.a. I-IV = Anzahl Platten, S = Schwärmen, n.a. = nicht auswertbar 62 Tabelle 5: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Nährflüssigkeit von 0, 5, 10 und 30 min bei unterschiedlichen Verdünnungen Form vegetative Zellen Zeit in min 0 5 10 30 0 5 Sporen 10 30 10-1 10-2 10-3 10-4 10-5 10-6 10-7 KbE/ml n.a. n.a. 701 581 174 32 117 81 120 86 81 58 84 44 82 56 18 8 11 15 2 34 15 61 36 11 4 6 1 0 1 1,7E+06 1 0 0 7,6E+05 1 0 0 9,9E+05 8 0 1 0 0 0 7,5E+05 8,7E+05 0 0 0 1,1E+06 0 0 0 6,4E+05 1 1 38 5,8E+05 n.a. = nicht auswertbar 63 Tabelle 6: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Nährflüssigkeit von 0 und 30 min bei unterschiedlichen Verdünnungen Versuch 1 Form vegetative Zellen Sporen vegetative Zellen Sporen vegetative Zellen Sporen Zeit in min 0 0 30 30 30 0 0 30 30 30 10-1 10-2 10-3 n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. 1298 n.a. 366 376 545 382 538 170 223 260 0 0 30 30 30 0 0 30 30 30 n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. n.a. 865 816 402 413 326 547 492 339 335 192 T 0 0 30 30 30 0 0 30 30 30 n.a. n.a. 476 586 554 n.a. n.a. 226 452 472 397 364 48 43 27 207 213 49 24 34 112 14 151 19 55 (74) 37 (73) 69 8 74 25 61 (305) 21 (86) 29 5 23 3 Versuch 2 41 8 108 11 57 (14) 73 (52) 42 (37) 56 2 51 7 39 (19) 36 (26) 32 (15) Versuch 3 34 5 29 3 2 0 1 0 4 1 44 1 32 1 4 1 2 0 5 0 10-4 10-5 10-6 KbE/ml 1 3 (23) (16) 5 2 2 (25) 2 2 0 0 (7) (16) (85) (4) (4) (1) (81) (28) 1,3E+06 1,6E+06 3,8E+05 3,8E+05 5,6E+05 4,3E+05 5,5E+05 1,7E+05 2,3E+05 2,6E+05 6 1 (86) (184) (163) (28) (17) (100) (318) (185) 0 0 0 0 - 8,3E+05 8,4E+05 4,2E+05 4,4E+05 3,3E+05 5,5E+05 5,0E+05 3,4E+05 3,4E+05 3,2E+04 1 0 (1) 0 0 0 0 0 (1) 0 0 0 (25) (6) (10) (23) 0 (6) (1) (5) 3,9E+05 2,9E+04 4,7E+04 5,7E+04 5,3E+04 2,3E+05 2,2E+05 4,8E+04 2,4E+04 5,0E+03 MW 1,3E+06 4,4E+05 4,9E+05 2,2E+05 8,4E+05 4,0E+05 5,2E+05 3,4E+05 3,8E+05 5,2E+04 2,2E+05 3,8E+04 n.a. = nicht auswertbar, T=trockene Stellen, in Klammern stehende Zahlen wurden nicht zur Berechnung der Keimzahl verwendet 64 Tabelle 7: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Kunststoffoberfläche von oT, 0, 5, 10 und 30 min bei unterschiedlichen Verdünnungen Versuch 2 Form vegetative Zellen Zeit in min 100 10-1 10-2 10-3 10-4 10-5 10-6 KbE/ml oT - S 159 S S 0 0 0 0 0 0 1,6E+05 0 - S S 0 0 S >1,0E+03 5 10 30 S 0 0 102 82 7 (1) 0 0 S 0 0 0 8 10 0 0 0 0 0 0 0 0 0 0 0 0 0 0 S 0 0 0 0 (7) 0 (4) S >10 <10 <10 S 1 0 (1) - 0 >100 10 30 S 0 0 0 0 0 S >102 S >32 0 S S S >145 0 0 0 587 664 S 0 0 0 S S 0 - 0 0 >30 <10 oT 0 5 10 30 oT 0 5 10 30 0 5 10 30 616 19 0 1 457 0 0 0 581 27 2 2 0 >100 (2) 1 0 0 (4) 0 - 0 (7) - n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. 1,8E+05 6,5E+03 2,0E+02 <10 1,0E+01 6,3E+04 4,6E+03 <10 <10 <10 5,9E+03 2,7E+02 2,0E+01 2,0E+01 oT Sporen (nachher) 0 5 10 30 0 Sporen (vorher) 5 vegetative Zellen Sporen (nachher) Sporen (vorher) S 0 0 0 0 0 Versuch 3 1801 192 16 86 23 1 3 0 0 0 0 0 0 0 0 630 54 11 46 3 0 0 0 0 0 0 0 (10) 0 0 74 4 2 0 0 0 0 0 0 0 0 0 6,5E+04 7,0E+03 <10 <10 <10 >100 oT = ohne Trocknung, S = Schwärmen, n.g. = nicht getestet, in Klammern stehende Zahlen wurden nicht zur Berechnung der Keimzahl verwendet 65 Tabelle 8: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Kunststoffoberfläche von oT, 0, 1, 2 und 5min bei unterschiedlichen Verdünnungen Versuch1 Form Zeit in min oT vegetative Zellen 0 1 2 5 Sporen (nachher) vegetative Zellen Sporen (nachher) oT 0 1 2 5 oT 0 1 2 5 oT 0 1 2 5 100 10-1 10-2 10-3 S S >200 S >100 >1000 >2000 S >200 61 S >1000 S >49 36 8 S >200 30 1 S S S >100 S S >1000 2312 289 30 1452 292 64 4 219 19 1 S S >100 35 2 (11) S >300 24 (122) (262) Versuch 2 n.a. n.a. 267 n.a. n.a. 1268 168 n.a. n.a. 501 (396) n.a. 1512 S >100 130 n.a. 619 234 (423) n.a. n.a. 407 n.a. n.a. 1112 187 n.a. n.a. 322 (227) n.a. 1108 108 38 n.a. 379 85 (179) - 10-4 10-5 KbE/ml 82 (179) 8,2E+06 S S (65) - 6,1E+04 4,0E+04 2,8E+03 - - n.a. (39) (8) S (36) - (138) - 2,4E+05 1,6E+04 2,2E+03 3,4E+03 2,4E+03 38 49 n.a. (665) 106 (696) n.a. (109) - (103) (644) - 2,8E+06 1,3E+06 5,0E+05 1,6E+05 7,8E+04 4,7E+06 1,2E+06 3,2E+05 1,1E+05 4,2E+04 oT = ohne Trocknung, S = Schwärmen, n.a. = nicht auswertbar, in Klammern stehende Zahlen wurden nicht zur Berechnung der Keimzahl verwendet 66 Tabelle 9: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Kunststoffoberfläche von oZ, oT, 0, 1, 2, 5, 10, 20 und 30 min bei unterschiedlichen Verdünnungen (Trocknung ohne Schüttler) Versuch 1 Form vegetative Zellen Sporen vegetative Zellen Sporen Zeit in min oZ oT 0 1 2 5 10 20 30 oZ oT 0 1 2 5 10 20 30 100 10-1 10-2 10-4 10-5 10-6 10-7 KbE/ml n.a. n.a. n.a. n.a. n.a. 2056 2092 1232 1668 1384 5460 2200 1216 n.a. 680 718 464 1980 213 268 205 113 92 53 (55) 60 3 (14) (8) 2 (19) (11) - 14 (5) (29) (4) - (16) (1) (21) (23) - 5,5E+05 5,4E+07 2,9E+06 2,3E+05 1,2E+05 1,0E+05 6,8E+04 7,2E+04 4,7E+04 2,0E+05 3,1E+05 3,6E+04 2,6E+04 2,1E+04 2,1E+04 1,2E+04 1,6E+04 1,3E+04 oT 0 1 2 5 10 20 30 oT 0 1 2 5 10 20 30 n.a. n.a. 3448 358 351 650 409 272 108 114 577 438 511 372 25 24 174 96 56 34 4 12 544 121 14 n.a. 520 60 260 257 50 22 104 27 (44) 96 16 (87) n.a. (107) 77 9 48 6 192 27 5 231 106 2 2 76 5 (6) 12 3 (27) 45 16 (9) 28 13 (187) >200 34 6 Versuch 2 45 10 96 2 133 14 (35) 43 2 (10) 67 1 (2) 36 11 13 8 1 4 22 1 6 0 20 1 (5) 22 5 (7) 8 (13) (7) 11 (2) 3 (2) 7 (14) - 1 (6) (3) (2) (1) (10) - (6) (2) (2) (8) - (4) (2) (7) (8) - 5,0E+05 8,9E+05 6,5E+04 4,4E+04 5,2E+04 3,5E+04 3,6E+03 3,4E+03 2,1E+05 6,0E+04 1,8E+04 7,0E+03 4,3E+03 2,9E+03 1,0E+03 1,2E+03 10-3 67 vegetative Zellen Sporen oZ oT 0 1 2 5 10 20 30 oZ oT 0 1 2 5 10 n.a. n.a. S S S n.a. n.a. >500 >100 0 S 20 30 S S S S S 160 S 2452 S 260 S S Versuch 3 1044 153 0 n.a. n.a. 181 S 321 182 S S 137 73 9 (7) S 76 >100 S S 4 (30) 5 S 288 41 n.a. 622 68 n.a. n.a. S S S S 42 30 (15) S (61) S S S - 0 14 74 >200 (29) 3 S (37) - 18 0 2 S - n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. 1,1E+06 1,8E+07 5,2E+06 1,4E+07 7,5E+04 7,6E+05 n.a. 1,5E+04 5,0E+03 2,8E+05 6,3E+05 n.a. n.a. 2,7E+04 n.a. n.a. 328 S S - - - n.g. 3,3E+04 >200 77 S - - - n.g. 7,7E+04 oZ = ohne Zentrifuge, oT = ohne Trocknung, S = Schwärmen, n.a. = nicht auswertbar, n.g. = nicht getestet, in Klammern stehende Zahlen wurden nicht zur Berechnung der Keimzahl verwendet Tabelle 10: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Kunststoffoberfläche von oT, 0, 1, 2, 5, 10, 20 und 30 min bei unterschiedlichen Verdünnungen (Trocknung mit Schüttler) Versuch 1 Form vegetative Zellen Sporen Zeit in min 100 10-1 10-2 10-3 10-4 10-5 KbE/ml oT 0 1 2 5 10 20 30 oT 0 1 2 5 10 1052 n.a. 363 223 212 58 138 84 13 18 n.a. 892 123 70 17 5 9 0 1868 323 10 7 1 2 428 124 6 10 1 1 3 0 170 34 2 0 1 0 53 12 0 (32) 0 0 0 0 25 8 0 0 0 (1) 6 9 (11) (6) (1) 0 1 0 (1) (2) 0 (5) 2 (17) - 4,4E+05 9,3E+04 1,1E+04 7,3E+03 3,4E+03 2,1E+03 2,0E+03 5,8E+02 1,9E+05 3,3E+04 1,4E+03 8,3E+02 1,4E+02 1,8E+02 68 vegetative Zellen Sporen vegetative Zellen Sporen 20 30 55 7 oT 0 1 2 5 10 20 30 oT 0 1 2 5 10 20 30 638 171 21 0 2 0 21 9 0 0 0 0 oT 0 1 2 5 10 20 30 oT 0 1 2 5 10 20 30 889 n.a. 160 106 117 2 336 1508 11 86 23 0 1 0 0 0 Versuch 2 296 39 486 63 126 2 12 1 1 1 0 (7) 0 0 0 0 604 47 127 16 6 1 3 0 0 0 0 0 0 0 0 0 Versuch 3 n.a. 814 n.a. 203 57 2 n.a. 80 5 1 4 7 6 2 0 0 n.a. 225 399 52 17 0 110 17 2 3 12 6 3 0 0 (3) (2) (1) - - 5,1E+02 7,0E+01 2 8 1 (6) (2) 2 2 0 0 0 - 2 5 1 0 - 0 (3) - 3,1E+04 5,1E+04 6,9E+03 1,7E+03 2,1E+02 <10 2,0E+01 <10 5,9E+04 1,3E+04 2,5E+02 1,1E+02 <10 <10 <10 <10 54 11 2 24 (27) 22 5 (1) 1 (11) - (92) (31) 10 0 - n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. 7,9E+05 1,9E+05 8,6E+03 9,5E+04 1,5E+03 1,1E+03 1,1E+03 2,0E+01 2,3E+05 4,1E+04 3,2E+03 1,5E+04 1,4E+02 9,4E+02 2,4E+02 <10 oT = ohne Trocknung, n.a. = nicht auswertbar, n.g. = nicht getestet, in Klammern stehende Zahlen wurden nicht zur Berechnung der Keimzahl verwendet 69 Tabelle 11: Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung der Grapefruitschalen von oZ, oT, 0, 1, 2, 5, 10, 20 und 30 min bei unterschiedlichen Verdünnungen Versuch 1 Form Zeit in min oZ oT 1 2 5 10 20 30 611 61 377 122 7 64 oZ oT 0 1 2 5 10 20 30 oZ oT 0 1 2 5 128 141 106 2 45 45 188 0 vegetative Zellen 1 2 5 10 20 30 oZ oT 0 Sporen vegetative Zellen Sporen 100 10-1 10-2 10-3 S >200 S >20 S >10 S >500 173 199 5 139 1 389 2 220 20 0 168 32 2 81 8 2 59 0 0 21 2 0 S >50 1 0 S >100 S >50 21 1 7 1 16 0 24 1 1 24 7 0 11 0 0 0 0 0 13 2 0 Versuch 2 710 90 (122) 439 55 >653 28 5 38 6 0 8 6 17 11 3 0 10 1 0 0 1 2 3 10 407 109 7 253 53 63 4 6 14 1 1 5 0 15 14 2 0 70 10-4 10-5 KbE/ml 0 80 0 0 0 0 0 0 S 0 0 0 0 6 - 1 1 0 0 0 1 0 0 - n.a. 2,3E+06 1 6 19 0 4 3 16 3 - 7 3 - 7,3E+04 4,5E+05 3,0E+04 4,0E+03 1,3E+03 1,4E+03 1,1E+03 2,0E+01 4,4E+02 4,7E+04 2,8E+05 6,1E+03 1,4E+03 4,5E+02 1,8E+03 1,6E+05 3,6E+05 2,2E+04 1,8E+04 6,3E+03 1,1E+03 3,6E+03 n.a. n.a. 1,4E+04 1,6E+04 2,3E+03 2,8E+03 1,2E+03 7,0E+01 7,1E+02 Form 10 20 30 47 0 15 6 1 3 1 0 1 Versuch 3 2 5 - - - 4,9E+02 <10 1,7E+02 Zeit in min oT 100 10-1 10-2 10-3 10-4 10-5 KbE/ml 38 100 119 305 16 5 31 185 50 439 3 2 164 101 3 5 4 86 0 2 164 62 8 2 14 59 1 3 155 1 0 3 0 14 0 60 2 2 1 5 3 1 - 23 0 1 39 2 0 - 1 2 - 1,2E+06 65 60 204 81 15 19 20 10 0 0 1 3 - 30 44 1 (41) 32 17 1 4 0 0 0 0 0 0 255 44 1179 12 16 0 1 7 2 0 0 1527 42 9 0 0 0 5 1 41 Versuch 4 1115 17 1 (1) (13) 8 0 0 (15) 0 0 0 (1) 0 0 1475 20 3 166 1 0 130 1 1 20 53 - n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. 1,2E+06 0 vegetative Zellen 1 2 5 10 20 30 oT 0 Sporen 1 2 5 10 20 30 oT 0 1 2 vegetative Zellen 5 10 20 30 oT Sporen 0 71 1,3E+04 3,7E+02 9,5E+02 1,2E+03 3,5E+03 1,6E+02 6,3E+01 1,5E+06 2,5E+04 3,5E+02 1,7E+03 5,8E+02 4,5E+03 3,6E+01 4,5E+01 4,2E+03 6,0E+02 1,5E+03 1,8E+02 1,5E+02 <10 2,0E+01 1,5E+06 1,5E+04 1 2 5 10 20 30 223 51 343 355 6 10 11 2 0 0 0 0 10 5 42 24 0 1 0 0 0 0 0 0 2 (23) 4 2 (7) (1) 0 0 0 (1) 0 0 - - n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. 1,3E+03 3,5E+03 8,1E+01 6,5E+01 <10 <10 oZ = ohne Zentrifuge, oT = ohne Trocknung, S = Schwärmen, n.a. = nicht auswertbar, n.g. = nicht getestet, in Klammern stehende Zahlen wurden nicht zur Berechnung der Keimzahl verwendet Abbildung 13: Abblätternde Schicht auf der Oberfläche einer 9 cm² großen Grapefruitschale Abbildung 14: Brandschaden auf der Oberfläche der Grapefruitschalen der 20- und 30minütigen Plasmabehandlung 72 Tabelle 12 : Kolonienanzahl und Keimzahl von vegetativen Zellen und Sporen von A. a. bei einer Plasmabehandlung von 1 und 5 min und einer UV-Behandlung der Grapefruitschalen von oT, 0, 1, 2, 5, 10, 20 und 30 min bei unterschiedlichen Verdünnungen Versuch 1 Form Anwendung ohne vegetative Zellen Plasma UVStrahlung ohne Plasma Sporen UVStrahlung ohne Plasma vegetative Zellen UVStrahlung ohne Sporen Plasma UVStrahlung Zeit in min oT 0 1 5 1 5 10 20 30 oT 0 1 5 1 5 10 20 30 7 43 42 130 138 50 23 25 34 206 51 122 78 44 oT 0 1 5 1 2 5 10 20 30 oT 0 1 5 1 2 5 184 31 255 - 100 10-1 10-2 10-3 10-4 10-5 KbE/ml 99 22 1 0 (1) 0 (1) 9 2 11 0 14 1 8 1 2 0 258 36 1 0 (1) 0 (1) 2 0 4 0 0 0 5 0 5 0 Versuch 2 8 91 0 3 1 6 1 13 0 10 2 63 5 1 0 37 3 11 92 8 17 3 86 0 18 5 2 1 73 21 1 (6) (2) 0 (3) (4) 12 0 (8) (1) (41) (1) 0 5 5 - n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. n.g. 1,1E+05 2,2E+03 7,0E+01 4,3E+02 4,8E+02 1,3E+03 1,4E+03 5,3E+02 2,3E+02 2,5E+05 3,4E+03 2,5E+02 3,4E+02 1,9E+03 5,0E+02 1,2E+03 7,5E+02 4,5E+02 158 0 0 0 0 0 0 1 0 36 3 2 16 0 0 0 21 0 0 (1) (1) 0 3 5 3 0 0 (7) 2 0 - 1,6E+06 8,0E+03 9,1E+03 3,6E+02 6,4E+02 1,3E+03 1,1E+03 2,3E+03 2,9E+02 2,7E+03 3,5E+05 1,3E+04 9,2E+03 1,8E+03 8,6E+03 2,1E+03 2,7E+02 10 20 30 175 60 350 11 5 39 3 2 5 1 (27) - - - 1,7E+03 6,0E+02 3,5E+03 oT = ohne Trocknung, n.g. = nicht getestet, in Klammern stehende Zahlen wurden nicht zur Berechnung der Keimzahl verwendet 74 Erklärung über die selbstständige Anfertigung der Arbeit Hiermit erkläre ich, dass ich die vorliegende Arbeit selbstständig angefertigt habe und keine anderen als die angegebenen Quellen und Hilfsmittel benutzt habe. Weiterhin bestätige ich, dass die elektronische Fassung der Arbeit mit der gedruckten Version übereinstimmt. ___________________________________ Ort, Datum ____________________________ Unterschrift 75