Arbeitsblätter - ftb
Werbung

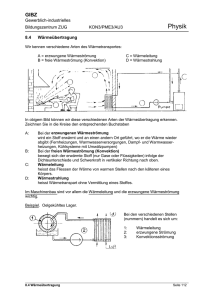
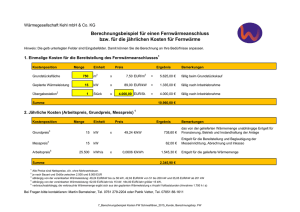
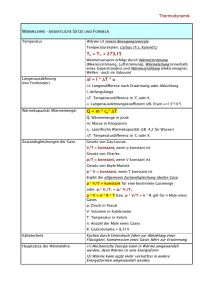
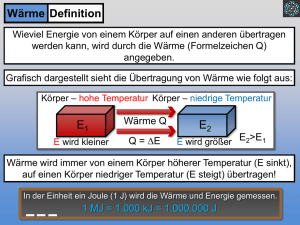
GIBZ Gewerblich-industrielles Bildungszentrum ZUG Physik KON3/PME3/AU3 8.5 Die Wärmemenge In ein Becken mit 1 Liter Wasser (= 1 kg) wird während 1/2 Minute eine Hand eingetaucht, wobei die Wassertemperatur vorher und nachher gemessen wird. Beobachtung: 1 kg Wasser wurde um 1 0C erwärmt. Die herkömmliche Einheit für die Wärmemenge ist die Kilokalorie (1 kcal) = 1000 cal) und stellt die im obigen Versuch in 1 kg Wasser eingebrachte Wärmemenge dar. 1 kcal ist die Wärmemenge, die die Temperatur von 1 kg Wasser um 1 0C erhöht. Die Einheit kcal ist speziell auf die Wassererwärmung ausgerichtet. Neuerdings wird die Wärmemenge in J (= Joule, sprich: Dschuul) angegeben, da die meisten technischen Wärmeberechnungen damit einfacher werden. 1 kcal = 4186,8 J = ca. 4200 J = 4,2 kJ (Kilojoule) 4,2 kJ (genau: 4,187 kJ) ist die Wärmemenge, die 1 kg Wasser um 1 °C erwärmt Diese Zahl nennen wir die spezifische Wärmekapazität, Symbol c Aufgabe: Berechnen Sie die benötigte Wärmemenge in kJ um die 20 m3 Wasser eines Schwimmbeckens von 12 0C auf 22 °C auf zu heizen Lösung: Wärmemenge Q * m * T = c = = = 4,2 kJ * Wassermasse * T 20 000 kg * 4,2 kJ * 10 K 840 000 kJ Aufgabe: Einem Kühlwasserbecken von 200 Liter Inhalt und 20 0C Anfangstemperatur werden 4000 kJ Wärme zugeführt. Wie hoch ist danach die Wassertemperatur? Lösung: Q = = c * m * 4,2 kJ/kgK * 200 kg * T = 4000 (kJ) -----------------------------------------4,2 (kJ/kgK) * 200 (kg) T T = 4000 kJ = 4,76°C Endtemp.= 20 °C + 4,76 °C = ca. 25°C 8.5 Wärmemenge Seite 116 GIBZ Gewerblich-industrielles Bildungszentrum ZUG KON3/PME3/AU3 Physik Wenn wir in der Badewanne sitzen und das Wasser allmählich zu kühl wird, drehen wir den Warmwasserhahn so lange auf, bis die Temperatur wieder angenehm wird. Bei diesem alltäglichen Vorgang bewirken wir zweierlei: wir erhöhen die Wassermenge in der Badewanne (damit das Wasser nicht über den Rand läuft gibt es einen Ueberlauf) wir fügen dem Wasser in der Wanne zusätzliche Energie (Wärme) zu. Diese Wärmemenge ist einerseits abhängig von der Menge Wasser, die wir hineinlassen, andrerseits von der Temperaturdifferenz zwischen dem Wasser aus dem Hahn und das Wasser in der Wanne. Welche Temperatur stellt sich nun ein? Das Wasser in der Wanne wird wärmer, das Wasser aus dem Hahn kühlt so weit ab, bis beide Wassermengen die gleiche Temperatur, die sogenannte Mischtemperatur aufweisen. Zum Beispiel: In der Badewanne befinden sich 100 l Wasser mit einer Temperatur von 30°C, dazu füllen wir 30 l Wasser mit einer Temperatur von 50°C hinzu. Welche Temperatur stellt sich ein? Nennen wir die Mischtemperatur x Das Wasser in der Wanne wird wärmer, die Temperaturzunahme beträgt (x – 30) °C, das Wasser aus dem Hahn wird kühler, die Temperaturdifferenz beträgt (50 – x) °C. Die vom Wasser aus dem Hahn abgegebene Wärme wird vom Wasser in der Wanne aufgenommen oder Qabgegeben = Qaufgenommen. Q = c * m * T = oder Qabgegeben = Qaufgenommen 4,187 kJ/kg°C * 30 kg * (50 – x) °C = 4,187 kJ/kg°C * 100 kg * (x – 30) °C 6280.5 kJ -125.61 * x kJ = 418.7 * x kJ – 12561 kJ 18841 kJ = 544.31 * x kJ x = 34,61°C Beobachtungen: 1. Die zugeführte Wärme verteilt sich gleichmäßig auf das neue Volumen (neue Menge). 2. Die Wärmemenge (oder Wärmeinhalt) ist erhalten geblieben. 3 Es lässt sich in einer kleinen Wassermenge gleichviel Wärme unterbringen, wie in einer grossen Flüssigkeitsmenge. Die Temperaturen sind aber verschieden hoch. kleine Menge hohe Temperatur, grosse Menge niedrige Temperotur. Anmerkung: Der Wärmeinhalt eines Körpers ist die gesamte innere Bewegungsenergie seiner Atome, bzw. seiner Moleküle 8.5 Wärmemenge Seite 117 GIBZ Gewerblich-industrielles Bildungszentrum ZUG KON3/PME3/AU3 Physik Formel zur Mischtemperaturberechnung: Durch Umwandlung der Gleichung Qaufgenommen = Qabgegeben entsteht die Formel zur Mischtemperaturberechnung: Uebungsaufgaben: 1. Berechnen Sie die Wärmemenge in kJ in 316 L Wasser von 20°C, bezogen auf die absolute Nulltemperatur von -273°C (0K) 2. Berechnen Sie die Wärmemenge in kJ in 316 L Wasser von 40°C, bezogen auf die absolute Nulltemperatur von -273°C (0K) 3. Wieviel mehr Wärme enthalten 316 L Wasser von 40°C als die gleiche Menge von 20°C ? 4. In einem Gefäss befinden sich 20 L Wasser mit einer Temperatur von 23°C. Welche Temperatur stellt sich ein, wenn 15 Liter Wasser mit einer Temperatur von 47°C hinzu gegeben werden? Die spezifische Wärmekapazität ist von Material zu Material unterschiedlich (deshalb spezifische Wärmekapazität, oder kurz: spezifische Wärme): Aluminium: Eisen Kupfer Silber Wasser Oel c = 0.896 kJ/kgK c = 0.439 kJ/kgK c = 0.381 kJ/kgK c = 0.237 kJ/kgK c = 4.187 kJ/kgK c = 1.8 kJ/kgK Offensichtlich lässt sich in Wasser wesentlich mehr Wärme (Energie) speichern als in der gleichen Menge verschiedener Metalle. 8.5 Wärmemenge Seite 118 GIBZ Gewerblich-industrielles Bildungszentrum ZUG KON3/PME3/AU3 Physik Uebungsaufgaben: 1 Berechnen Sie die Temperaturzunahme eines Wasserbades von 50 Liter Inhalt (=50 kg Wasser) und eines 0elbades von 50 Liter Inhalt (= 46 kg Oel) wenn beide zu Beginn 20°C zeigten und darin je 15 kg Stahl von der Härtetemperatur 800°C abgeschreckt wurden. Stahl: c = 0,5 kJ/kg K 2. Welche Wärmemenge ist erforderlich, um 150 kg Polycarbonat beim Trocknen von 20 °C auf 80 °C zu bringen? cPC = 1,2 kJ/kg.K 3. Wieviel Liter Alkohol werden von der Wärmemenge Q = 39 kJ von 20 °C auf 40 °C erwärmt? cAlkohol = 2,332 kJ/kg.K, (Alkohol) = 0,789 g/cm3 4. Wieviel Kilogramm Wasser von 21 °C können mit 33 076 kJ zum Sieden (100 °C) gebracht werden? c (H20) = 4,1868 kJ/kg.K 5. In einer Härterei werden 8 kg glühende Stahlteile von 1150°C in 4 Liter Wasser von 20°C geworfen. Wieviel Wasser verdampft dabei ? (Verdampfungswärme von Wasser: 2257 kJ/kg) 6. Durch eine Warmwasserheizung fließen stündlich 180L Wasser von 90 °C. Welche Wärme gibt das Wasser ab, wenn es auf 45 °C abkühlt? c = 4,19 kJ/kg K. 7. Die Kühlwasserleitung eines Werkzeugs soll in einer Stunde die Wärmemenge 2,4 MJ aufnehmen. Wie viel Liter Wasser sind erforderlich, wenn sich das Wasser von 22 °C auf 52 °C erwärmen soll? 8. Eine Messingkugel der Masse 100 g wird in der Flamme eines Bunsenbrenners auf helle Rotglut erhitzt. Dann wird sie an einer Kette in einen Styroporbecher mit 400 g Wasser gehalten. Die Wassertemperatur steigt dabei von 19,0°C auf 39,0°C. Berechnen Sie die Temperatur der glühenden Messingkugel. (c = 0,385 J / (g K)). 9 Ein Zimmer ist 5,0 m lang, 4,0 m breit und 2,5 m hoch. Es wird von 0,0°C auf 20°C aufgewärmt. Der Luftdruck bleibt dabei konstant weil durch undichte Fenster und Zimmertür ein Luftaustausch stattfinden kann; Wärmeverluste werden nicht berücksichtigt. (cHolz = 0,50 J / g K; cLuft = 1,0 J / (g K); ρLuft = 0,0012 g /cm3) (a) Welche Energie nimmt dabei die Luft auf ? (b) Welche Energie nimmt dabei ein Holztisch der Masse 35 kg auf ? (c) Im Winter strömt bei gekipptem Fenster kalte Luft ins Zimmer und warme ins Freie. Dadurch gehen in einer Stunde ungefähr 1 bis 2 MJ Energie „verloren“. Lüftet man energiesparend, indem man kurzzeitig die gesamte Zimmerluft bei ganz geöffnetem Fenster austauscht, oder indem man längere Zeit das Fenster kippt ? Begründen sie Ihre Antwort ! 10. (a) (b) (c) (d) (e) Um wie viel erwärmt sich 1,0 m3 Wasser bzw. 1,0 m3 Stein, wenn es die Energie 10 MJ aufnimmt ?( ρ Stein = 2,4 g /cm3; cStein = 0,88 J / (g K)) Warum wird Gestein im Gegensatz zu Wasser durch die Sonne nur in der obersten Schicht erwärmt ? Nimmt im Sommer der Ozean oder das Festland eine höhere Temperatur an ? Kühlt sich im Winter der Ozean oder das Festland auf eine tiefere Temperatur ab ? Was folgt daraus für den Temperaturunterschied zwischen Sommer und Winter bei Meeresklima und bei Landklima ? 8.5 Wärmemenge Seite 119 GIBZ Gewerblich-industrielles Bildungszentrum ZUG 8.6 KON3/PME3/AU3 Physik Die Wärmepumpe - Die Kältemaschine Wir erinnern uns: Der Siedepunkt einer Flüssigkeit ist vom umgebenden Druck abhängig. So siedet z.B. Wasser bei einem Ueberdruck von 1 bar erst bei 118 0C. Andererseits siedet Wasser bei einem bestimmten Unterdruck (Vakuum) bereits bei 50 0C. Wird eine Menge Wasserdampf von 100°C unter einem hohen Druck gesetzt, so kondensiert der Dampf zu Wasser von 100°C unter Abgabe von Wärme. Diese Eigenschaften der Flüssigkeiten und Dämpfe werden ausgenützt bei der Wärmepumpe, bzw. der Kältemaschine. Das Prinzip der Wärmepumpe Im Raum rechts ist ein Gefäss mit einer Flüssigkeit, die unter Wärmeaufnahme zu Dampf verdampfte. Im Raum rechts herrscht ein niedrigerer Druck, als im Raum links. Durch mechanischen Arbeitsaufwand wird das Gefäss (Kolben) in den Raum links verschoben, wo ein höherer Druck herrscht. Jetzt kondensiert der Dampf wieder zu Flüssigkeit infolge des höheren Druckes im linken Raum. Dabei gibt der Dampf seine aufgenommene Verdampfungswärme als Kondensationswärme wieder ab. (Im Fall von Wasser sind das 2258 kJ pro 1 kg Wasser) 8.5 Wärmemenge Seite 120 GIBZ Gewerblich-industrielles Bildungszentrum ZUG KON3/PME3/AU3 Physik Schema einer Wärmepumpe: Im Raum rechts neben dem Kompressor herrschen ein niedriger Druck und eine tiefe Temperatur (-20°C). Die hier aufgenommene Wärme bewirkt ein Verdampfen der Flüssigkeit. Dieser Dampf wird mittels eines Kompressors in den Kondensator gepumpt. Infolge des hohen Drucks im Kondensator, kondensiert die Flüssigkeit, wobei Wärme freigesetzt wird. Diese Wärme wird z.B. über einen Radiator abgegeben. Das Drosselventil sorgt dafür, dass die Flüssigkeit wieder in den Niederdruckbereich fliessen kann, während gleichzeitig der Druck um Kondensator erhalten bleibt. Schema einer Kältemaschine: Die Kältemaschine (z.B. der Kühlschrank) arbeitet nach dem gleichen Prinzip. Hier soll lediglich einem Raum Wärme entzogen werden. 8.5 Wärmemenge Seite 121