Uebungen zur Prüfungsvorbereitung 9
Werbung

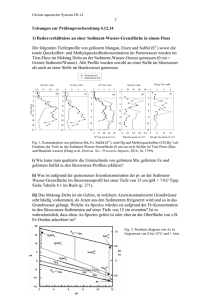
Chemie aquatischer Systeme HS 12 1 Uebungen zur Prüfungsvorbereitung 13. 12.12 1) Redoxverhältnisse in zwei Seen Die folgenden Tiefenprofile von gelöstem Mangan, gelöstem Eisen und gelöstem Sulfid (Summe von H2S, HS- und S2-) wurden in zwei Seen (Clearwater Clw und McFarlane McF) an der Sediment-Wasser-Grenzfläche gemessen (0 cm = Grenzfläche Sediment / Wasser). Fig. 1. Konzentration von gelöstem Mn, Fe und Sulfid in Funktion der Tiefe an der Sediment-Wasser-Grenzfläche (0 cm) in zwei Seen (Clw und McF). i) wie kann man qualitativ die Unterschiede in gelöstem Mn, gelöstem Fe und gelöstem Sulfid in diesen beiden Seen erklären ? ii) Was ist aufgrund des gemessenen Sulfids der pε an der Sediment-Wasser-Grenzfläche im McF-See (pH = 7.0, [SO42-] = 1x10-4 M ) ? iii) In diesen Seen wurde der Kreislauf von Antimon untersucht, einem Spurenelement, das als Sb(III) und Sb(V) vorkommt. Sb(V) kommt im neutralen pH-Bereich vor allem als Sb(OH)6-, Sb(III) als Sb(OH3)0 vor. Die Redoxreaktion für diese Spezies ist: 1/2 Sb(OH)6- + e- + 3/2 H+ 1/2 Sb(OH)3 + 3/2 H2O log K = 9.9 Erwarten Sie, dass Sb als Sb(V) oder Sb(III) in den Sedimenten des McF-Sees vorkommt (pH = 7.0 wird angenommen) ? Tabelle 1. Gleichgewichtskonstanten Reaktion Fe(OH)3(s) + 3 H+ + e Fe2+ + 3 H2O 2+ 1/8 SO4 + 9/8 H + e 1/8 HS- + 1/2 H2O H2S HS- + H+ log K 16 4.25 -7.0 Chemie aquatischer Systeme HS 12 2 2) Adsorption von Kupfer an einem Flusssediment Die Adsorption von Kupfer als Cu(II) an einem festen Flusssediment wurde in Funktion des pH untersucht und ergibt die in Figur 1 dargestellten Resultate. Die Zusammensetzung des festen Sediments ergibt: 63% SiO2(s); 7% FeOOH(s); 16% Al2O3(s) (Gewichtsprozente). Fig. 2. Adsorption von Cu(II) an einem Flussediment; % adsorbiertes Cu in Funktion von pH. i) Formulieren Sie mögliche Reaktionen für die Adsorption von Cu(II) an den festen Phasen dieses Sediments. ii) Wie erklärt sich die beobachtete pH-Abhängigkeit der Adsorption ? Chemie aquatischer Systeme HS 12 3 3) Anoxisches Tiefenwasser In einem See weist das Tiefenwasser im Sommer folgende Zusammensetzung auf: [Fe2+] = 2 x10-5 M [HS-] = 1x10-5 M [NH4+] = 1x10-4 M [PO4] (total ) = 1x10-5 M Alkalinität = 3x10-3 M pH 7.2 a) Ist es aufgrund dieser Zusammensetzung wahrscheinlich, dass die feste Phase Vivianit (Fe3(PO4)2.8H2O(s)) im Sediment vorhanden ist ? b) Wieviel Sauerstoff wird bei der Durchmischung des Sees total (pro Liter Wasser) zur Oxidation der reduzierten Spezies dieses Wassers verbraucht ? Wie verändert sich nach der Oxidation die Zusammensetzung des Wassers bezüglich Fe-, S-, N-Spezies, sowie Phosphat und Alkalinität (qualitativ)? Tab. 3. Gleichgewichtskonstanten: log K Fe3(PO4)2.8H2O(s) 3Fe2+ + 2 PO43- + 8 H2O HPO42- PO43- + H+ H2PO4- HPO42- + H+ H3PO4 H2PO4- + H+ - 36.0 -12.2 - 7.2 - 2.1 Chemie aquatischer Systeme HS 12 4 4) Wasserstoff als Indikator der Redoxbedingungen Elementarer Wasserstoff (H2) tritt als Zwischenprodukt bei mikrobiellen Umsetzungen auf. Die Konzentration von H2 in anoxischen Wässern kann verwendet werden, um die Redoxverhältnisse zu charakterisieren. a) In einem Grundwasser werden folgende Konzentrationen gemessen: H2 (aq) = 1x10-10 M pH = 7 Es wird angenommen, dass diese Wasserstoffkonzentration die Redoxverhältnisse im Gleichgewicht anzeigt. Erwarten Sie, dass in diesem Wasser die reduzierten Spezies Fe(II) und S(-II) auftreten ? b) Welche gelöste Konzentration von Fe wäre in diesem Wasser im Gleichgewicht vorhanden, wenn die gelöste S(-II)-Konzentration (S-II)tot = 1x10-4 M ist ? c) Diskutieren Sie, wie eine H2-Skala mit der pε− oder Redoxpotentialskala zur Charakterisierung der Redoxverhältnisse zu vergleichen ist. Tab. 3. Gleichgewichtskonstanten H+ + eFe(OH)3(s) + 3 H+ + e1/8 SO42- + 9/8 H+ + eH2(g) FeS(s) + H+ H2S 1/2 H2(g) Fe2+ + 3 H2O 1/8 HS- + 1/2 H2O H2(aq) Fe2+ + HS HS- + H+ log K 0 16 4.25 -3.0 -4.2 -7.0 Chemie aquatischer Systeme HS 12 5 5) Nitrat und Ammonium im See Fig. 3. Nitrat (NO3-, schwarze Kreise), Ammonium (NH4+, weisse Kreise) und Sauerstoff (gestrichelte Linie) in Funktion der Tiefe in Lake Tanganyika. In diesem Tiefenprofil aus dem Lake Tanganyika sind Nitrat, Ammonium und Sauerstoff in Funktion der Tiefe im See dargestellt. i) Welche Vorgänge im See können zu diesem Tiefenprofil von Nitrat führen ? ii) Durch welche Vorgänge kann die Konzentration von Ammonium in der Tiefe des Sees zunehmen ? iii) Ammonium kann durch Sauerstoff zu Nitrat oxidiert werden oder es kann anaerob mit Nitrit (NO2-) zu elementarem Stickstoff umgesetzt werden. Formulieren Sie die Stöchiometrie dieser beiden Reaktionen. Chemie aquatischer Systeme HS 12 6 6) Löslichkeit und Toxizität von Cd in anoxischen Sedimenten Für die Toxizität von Cadmium in Sedimenten auf aquatische Organismen, die an der Sediment-Wasser-Grenzfläche leben, ist die Löslichkeit von Cadmium wesentlich. In anoxischen Sedimenten ist die Löslichkeit der Sulfide massgebend. Sulfid bildet mit Cd eine schwerlösliche feste Phase und lösliche Sulfidkomplexe entsprechend den Angaben in Tabelle 4. Ein anoxisches Sediment ist mit grösseren Mengen von Cadmium verunreinigt. In der festen Phase sind Cadmiumsulfid und Eisensulfide vorhanden. Im Porenwasser dieses Sediments werden folgende Konzentrationen gemessen: pH = 7.1, totale Konzentration der Sulfidspezies (H2S + HS-) = 2 x 10-5 M. a) Wieviel Cd liegt im Gleichgewicht mit der festen Phase CdS(s) gelöst unter den angegebenen Bedingungen vor ? Welche ist die wichtigste gelöste Spezies ? b) Eine Methode zur Abschätzung der Toxizität von Cadmium in Sedimenten beruht auf der Messung des Verhältnisses zwischen Cd in der festen Phase und dem “acid volatile sulfide (AVS)”, d. h. dem unter sauren Bedingungen flüchtigen Sulfid ebenfalls in der festen Phase. AVS wird gemessen, indem das Sediment mit 6 M HCl behandelt wird und das freiwerdende H2S gemessen wird. Welche Reaktionen spielen sich bei der Behandlung dieses anoxischen Sediments mit HCl ab ? Warum ist das Verhältnis von Cd zu AVS nützlich zur Abschätzung der Toxizität ? c) Welche Auswirkungen auf die Mobilität von Cadmium würden Sie voraussagen, falls dieses Sediment mit Sauerstoff in Kontakt kommen würde ? Chemie aquatischer Systeme HS 12 7 Tabelle 4. Gleichgewichtskonstanten Feste Phasen log K CdS(s) + H+ Cd2+ + HS- -13.4 FeS(s) + H+ Fe2+ + HS- - 4.2 Lösliche Komplexe Cd2+ + HS- CdS° + H+ 4.7 Cd2+ + HS- CdHS+ 6.4 Cd2+ + 2 HS- Cd(HS)20 13.8 Cd2+ + 3 HS- Cd(HS)3- 16.0 Cd2+ + 4 HS- Cd(HS)4- 18.4 H+ + HS- Säure-Base H2S -7.1