Neues zu Teriflunomid vom ENS 2012 Multiple - Neuro
Werbung

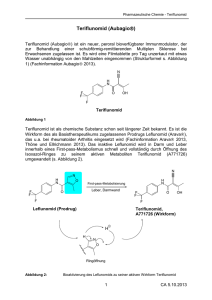
2S-Teriflunomid_ND07-2012-Fin_PD2 27.08.12 13:19 Seite 1 Multiple Sklerose Moderne orale MS-Therapie mit Potential Neues zu Teriflunomid vom ENS 2012 Für die MS-Therapie befinden sich einige neue Wirkstoffe in der klinischen Prüfung. Die einmal täglich oral eingenommene 14-mgDosis von Teriflunomid senkte in der TEMSO-Studie die Schubrate und bremste die Behinderungsprogression der Patienten jeweils signifikant. In TOWER, der zweiten großen Phase-III-Studie eines der umfassendsten Studienprogramme auf dem Feld der MS, wurden die Wirkungen bestätigt. Die gesamte bisherige Studienlage zeigt bei allgemein guter Verträglichkeit weder ein erhöhtes Risiko für Malignome noch für schwere (opportunistische) Infektionen, wie MS-Experten jetzt beim ENS 2012 berichten. Sie unterstreichen das hohe Potential von Teriflunomid als neue orale Therapie für viele MS-Patienten. Beim Entwicklungsprogramm zu Teriflunomid (Abb. 1) handelt es sich, erläuterte Prof. Mathias Mäurer, Bad Mergentheim, um ein „beeindruckendes Studienprogramm", das viele klinische Fragestellungen, auch die des praktisch arbeitenden Neurologen beinhaltet. tive Risikoreduktion für Gd-anreichernde T1-Läsionen lag bei 80% (p < 0,001) und für die Anzahl sichtbarer, weiterhin aktiver Einzelherde pro MRT-Scan bei 69% (p < 0,001). Also „ein konsistentes Ergebnis, was alle Parameter betrifft“, so Mäurer. Verträglich und sicher Therapieerfolg in TEMSO anstiege (12,0 bzw. 14,2 vs. 6,7%) und eine Verminderung der Haardichte (10,3 bzw. 13,1 vs. 3,3%) traten am häufigsten auf. Zumeist waren die UE leicht bis mittelschwer, teils nur vorübergehend, konnten meist mit herkömmlichen Therapien kontrolliert werden und führten nur selten zum Therapieabbruch. Bei 3- oder 5facher Erhöhung der Leberwerte bestand kein Unterschied zu Plazebo, betonte Mäurer, und attestierte Teriflunomid hinsichtlich der Leber und insgesamt ein gutes Verträglichkeitsprofil. Bei den mit Teriflunomid behandelten Patienten traten keine schwerwiegenden opportunistischen Infektionen auf, und es ereignete sich kein Todesfall. Teriflunomid ist eine „intelligente Substanz“, sie bewirkt keinen Zusammenbruch der Immunität, erläuterte der Experte. Die Rate an Therapieabbrechern aufgrund deutlicher Krankheitsprogression war in der 14-mg-Gruppe signifikant niedriger als unter Plazebo (p = 0,02), und auch Malignome traten mit einem Fall vs. drei Fällen seltener auf. Insgesamt also, so Mäurer, „keine Signale, die Anlass zur Besorgnis geben würden.“ Unerwünschte Ereignisse (UE), In der zweijährigen Studie TEMSO an schwerwiegende UE (SUE) und zum The126 Zentren in 21 Ländern (O’Connor P et rapieabbruch führende UE waren unter al., N Engl J Med 2011; 365: 1293-1303) 7 mg und 14 mg Teriflunomid ähnlich Positive Langzeiterfahrungen wurden 1088 relativ lang erkrankte und häufig wie unter Plazebo. Durchfall (14,7 relativ stark behinderte (EDSS: 2,6) Pa- bzw. 17,9 vs. 8,9%) und Übelkeit (9,0 bzw. Nach 108 Wochen wurden 742 Patientienten mit schubförmiger MS behandelt. 13,7 vs. 7,2%) sowie – in der Mehrzahl ten in der TEMSO-Extensionsstudie mit Sowohl die 14-mg- als auch die 7-mg- leichte, asymptomatische – Leberenzym- einer der beiden Teriflunomid-Dosen weiDosis senkten das jährliche terbehandelt. Dabei nahm die Schubrisiko vs. Plazebo jeschon niedrige jährliche Klinisches Entwicklungsprogramm weils signifikant um 31,5% Teriflunomid bei schubförmiger MS (RMS) und klinisch isoliertem Syndrom (KIS) Schubrate über die folgenden bzw. 31,2% (p < 0,005 bzw. (bis zu) fünf Jahre weiter tendentiell ab (auf 0,234 unter < 0,001) (Abb. 2, S. 2). AußerPhase II RMS / vs. Plazebo (PBO) gefolgt von Verlängerungsstudie 7 mg bzw. 0,206 unter 14 mg). dem blieben mit 56,5% bzw. TEMSO-Verlängerungsstudie TEMSO: RMS/Teriflunomid vs. PBO „Die Wirkung der Substanz 53,7% vs. 45,6% signifikant TOWER-Verlängerungsstudie TOWER: RMS/Teriflunomid vs. PBO bleibt auch über den Nachbemehr Teilnehmer schubfrei TENERE-Verlängerungsstudie TENERE: RMS/Terifl. vs. IFN-1a obachtungszeitraum erhal(p = 0,003 bzw. p = 0,01). Monotherapie TOPIC: KIS/Teriflunomid vs. Plazebo ten“, konstatierte der Experte. Das Risiko einer über 12 Die Sicherheitsdaten über vier Wochen anhaltenden BehinJahre zeigen ebenfalls weder derungsprogression nach Phase II RMS/+ IFN Adjuvante TERACLES: RMS/IFN + PBO vs. IFN Therapie eine Häufung schwerwiegenEDSS, „die Feuerprobe für + Teriflunomid Phase II RMS /+ GA* der oder schwerer opportuSubstanzen“, so Mäurer, Phase II Verlängerung nistischer Infektionen noch wurde unter der Dosis von 14 *GA: Glatirameracetat März 2012 ein Signal für ein erhöhtes mg um ca. 30% gesenkt (p = 0,03) (Abb. 2, S. 2). Schließlich Abb. 1: Das Studienprogramm zu Teriflunomid (Aubagio®) ist mit über Malignom-Risiko, erläuterte wurde unter 14 mg Terifluno- 4000 Teilnehmern in 36 Ländern eines der am breitesten angelegten, Mäurer. Die zwei Todesfälle umfangreichsten klinischen Programme, die mit einer in der Entwickmid auch die MS-Last in der lung begriffenen oralen Substanz gegen die MS durchgeführt werden. scheinen in keinem ZusamMRT signifikant (um 67,4%; Mit TEMSO, TOWER und TENERE sind drei der fünf klinischen Phase-III- menhang mit dem MS-Medikament zu stehen. Auch die p < 0,001) reduziert. Die rela- Studien bereits abgeschlossen. Neuro-Depesche 7-8 / 2012 2S-Teriflunomid_ND07-2012-Fin_PD2 27.08.12 13:19 Seite 2 Multiple Sklerose lungen“, fasste der Neurologe zusammen, „die ErgebMS-Schübe Behinderungsprogression nisse von TEMSO Plazebo zu replizieren.“ Die – Teriflunomid 730mg/d 0,54 n = 363 Teriflunomid 14 mg/d häufigsten, in den Verum-Armen häuRRR: 20 – 7 mg/d 31,2%* 7 mg/d vs. PBO 0,37 figer als unter Plan = 365 HRR: 23,7% p = 0,0835 zebo berichteten RRR: 10 – 14 mg/d vs. PBO 14 mg/d HRR: 29,8% 31,5%* UE waren Kopf0,37 p = 0,0279 n = 358 * p < 0,001 schmerz, Anstiege I I I I I I I I I I I I I I I I I 0 0,1 0,2 0,3 0,4 0,5 0,6 0 12 24 36 48 60 72 84 96 108 der AlanintransAdjustierte jährliche Schubrate Studienwoche aminase (ALT), (RRR: Relative Risk Reduction) (HRR: Hazard Rate Ratio; PBO: Plazebo) Haarverdünnung, mod. nach O’Connor et al., N Engl J Med 2011; 365: 1293-1303; Miller et al., AAN 2011; 76 (9 Suppl 4): A563 Durchfall, Übelkeit Abb. 2: Klinische Wirksamkeit: Neben der Schubrate wird auch die und Neutropenie. EDSS-Progression durch das neue Teriflunomid deutlich verringert. Letztere – Folge Langzeitbehandlung erscheint sicher, des „Mode of action“ von Teriflunomid – ebenfalls ergab eine Phase-II-Studie mit war aber nur leicht ausgeprägt, betonte einer Verlängerung über bis zu 8,5 Jahre Mäurer in Prag. Im Plazebo-Arm trat ein keine neuen Sicherheitsbedenken. Todesfall (Atemwegsinfektion) auf, in den beiden Teriflunomid-Armen drei Todesfälle (Verkehrsunfall, Suizid und Sepsis). Bestätigung in TOWER Die vollständigen Daten der TOWER-StuDie Ergebnisse der ebenfalls randomi- die sollen beim ECTRIMS-Kongress im sierten und plazebokontrollierten Dop- Oktober 2012 vorgestellt werden. pelblindstudie TOWER mit 1169 MS-Patienten bestätigen die TEMSO-Ergeb- Vergleich in TENERE nisse. So kam es zu einer signifikanten Reduktion der jährlichen Schubrate um In der zweijährigen randomisierten Ver36,3% unter 14 mg (p < 0,0001) und um gleichsstudie TENERE, berichte Prof. Pa22,3% unter 7 mg (p = 0,02). Erneut zeigte trick Vermesch, Lille/Frankreich, beim die zulassungsrelevante Dosis von 14 mg ENS, wurde Teriflunomid (7 bzw. 14 mg) gegenüber Plazebo eine signifikante Ver- gegen 3 x 44 µg/Woche IFN-1a s.c. minderung des Risikos für eine über 12 (Rebif) bei 324 Patienten geprüft. Im RiWochen bestätigte EDSS-Zunahme (um siko für ein Therapieversagen (Schuber31,5%; p = 0,0442). „Es ist in TOWER ge- eignis oder Abbruch) wurde die vorteilhafteste Rate mit 37,8% für die 14-mgDosis festgestellt (7 mg: 48,6%; IFN: IMPRESSUM 42,3%), doch es ergab sich keine statistiHerausgeber: ST Science Transmitter, München sche Überlegenheit. Die Effektivität anV. i. S. d. P.: Hans Spude hand dieses zusammengesetzten EndRedaktion: GFI. Gesellschaft für punkts „bewegt sich im selben Bereich medizinische Information mbH, wie Rebif“, sagte Mäurer. Darüber hinaus München war auch der Prozentsatz an Patienten Quelle u. a.: „MS aktuell: Neues vom ENS mit therapieassoziierten UE in allen drei und mehr“, Vortrag und Genzyme-Satellitensymposium „Adressing unmet needs in Armen vergleichbar, wenngleich die Rate rare diseases and multiple sclerosis – diadauerhafter Therapieabbrüche aufgrund gnostic challenges and novel treatment options“ am10/11.06.2012 im Rahmen des behandlungsassoziierter UE unter Rebif 22. Treffens der European Neurological Somit 21,8% höher ausfiel als im 7-mg- bzw. ciety (ENS) in Prag 14-mg-Arm mit 8,2% bzw. 10,9%. Layout: vm-grafik, München Beide Dosen waren im Allgemeinen Druck: Vogel Druck, Höchberg gut verträglich. Die meisten der unter TeMit freundlicher Unterstützung der riflunomid (und häufiger als unter Rebif) Genzyme GmbH, Neu Isenburg verzeichneten UE wie Nasopharyngitis, Progression (%) Teriflunomid Plazebo Signifikante Reduktion von Schubrate und EDSS-Progression unter Teriflunomid in der TEMSO-Studie über zwei Jahre Herr Professor Mäurer, wo liegen die Chancen, wo mögliche Grenzen einer zukünftigen Therapie der MS mit Teriflunomid? Prof. Dr. med. Mathias Teriflunomid ist Mäurer, Klinik für Neuroeine orale MS- logie am Caritas-KrankenTherapie und hat haus Bad Mergentheim daher die Chance einer höheren Akzeptanz im Vergleich zu parenteralen Therapien, insbesondere da es nur einmal tägl. eingenommen werden muss und das Nebenwirkungsprofil akzeptabel ist. Die Wirksamkeit ist vergleichbar mit den verfügbaren Basistherapeutika, die für viele Patienten ausreichen, um die MS zu kontrollieren – aber eben nicht für alle. Teriflunomid hat daher ähnliche Grenzen wie die Interferone oder Glatirameracetat. Und für welche Patienten dürfte Teriflunomid am ehesten in Frage kommen? Auch wenn man diese Frage natürlich erst nach der Entscheidung der EMA endgültig beantworten kann, so denke ich doch, dass Teriflunomid für die Basistherapie der MS zugelassen wird. Die Studien haben eine Wirksamkeit auf die Schubrate und Behinderungsprogression gezeigt, die der der etablierten Basistherapeutika entspricht – und im direkten Vergleich mit IFN-beta 1a (in der TENERE-Studie) war es nicht unterlegen. Durchfall, Haarverdünnung und Rückenschmerz waren nur leichter Art. Im RebifArm wurden (häufiger als unter Teriflunomid) erhöhte ALT-Werte, Kopfschmerz und grippeähnliche Symptome dokumentiert. Die Patientenzufriedenheit nach dem Treatment Satisfaction Questionnaire for Medication (TSQM) fiel übrigens zugunsten der oralen Therapie aus. Fazit: Wertvolle orale Option Mit der in TEMSO und TOWER belegten anhaltenden Wirksamkeit, den positiven (Langzeit-)Sicherheitsdaten und dem insgesamt günstigen Verträglichkeitsprofil erscheint Teriflunomid als ein Medikament mit einem guten Nutzen-/Risiko-Verhältnis, das das Therapiespektrum bei der MS um eine wertvolle orale Option bereichern könnte. Die Zulassungsanträge von Teriflunomid zur Therapie der schubförmigen MS werden derzeit von der FDA und EMA geprüft. Neuro-Depesche 7-8 / 2012