Solubilisierung in Mizellen
Werbung

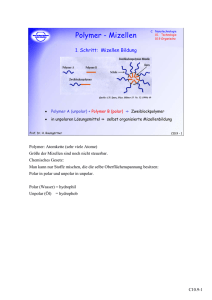
Solubilisierung in Mizellen Abstract 1 Theoretische Grundlagen Tenside sind Moleküle, die aus einem hydrophilen (polaren) und einem hydrophoben (unpolaren) Molekülteil bestehen(Abbildung 1). hydrophobe Kette hydrophile Kopfgruppe Abb.1: Schematische Darstellung eines Tensids Nach der Ladung der hydrophilen Kopfgruppe werden Tenside folgendermaßen eingeteilt: -nicht-ionische -anionische -kationische -zwitterionische Tenside Die chemische Verknüpfung von einem hydrophoben, wasserunlöslichen und einem hydrophilen, wasserlöslichen Molekülteil erklärt die charakteristischen Eigenschaften der Tenside: Verringerung der Grenzflächenspannung Anreicherung in Grenzflächen Bildung von Mizellen Gibt man Tenside in Wasser, tauchen die hydrophilen Kopfgruppen in das Wasser ein, während die hydrophoben Ketten aus dem Wasser heraus in die angrenzende unpolare Phase ragen, die fest, flüssig oder gasförmig sein kann. Diese Anordnung ist für die Tensidmoleküle 1 energetisch besonders günstig. Gleichzeitig wird der Zusammenhalt der Wassermoleküle gestört und die Oberflächenspannung wird herabgesetzt. Die führt u.a. zu einer besseren Benetzbarkeit von Oberflächen. Im Wasser bilden die Tensidmoleküle ab einer kritischen Konzentration, der kritischen Mizellenkonzentration (cmc), Aggregate, die Mizellen genannt werden. Dabei richten sich die Tensidmoleküle so aus, dass die hydrophoben Ketten im Mizelleninneren kaum Kontakt zum polaren Lösungsmittel haben, während die polaren Gruppen an der Mizellenoberfläche, die näherungsweise eine Kugelschale ist, das ganze Aggregat in Lösung halten (siehe Abb. 3) Mizellen besitzen einen Durchmesser von 3 – 50 nm. Der Radius ist durch die Länge der hydrophoben Alkylkette festgelegt. Dies gilt auch für die Zahl der Tensidmoleküle pro Mizelle (Aggregationszahl) (ungefähr 100 bei Tensiden mit 16 CH2- Gruppen). Bei Zunahme der Tensidkonzentration oberhalb der kritischen Mizellenkonzentration (cmc) erhöht sich die Zahl der Mizellen, während die Größe der Mizellen und die Aggregationszahl in erster Näherung konstant bleiben. Die Mizellenbildung ist die Voraussetzung für die Fähigkeit der Tenside; Substanzen, die in wässriger Lösung unlöslich sind, löslich zu machen (Solubilisierung), indem diese Substanzen in Mizellen eingebaut werden. In Waschmitten, Spülmitteln, Shampoos, Duschgels usw. werden daher Tenside verwendet, um die „Löslichkeit“ von Fett- und Schmutzpartikeln, die in der Wäsche oder am Körper haften, in Wasser zu erhöhen. Zusätzlich bewirkt die Erniedrigung der Grenzflächenspannung des Wassers eine bessere Benetzbarkeit der zu reinigenden Oberflächen. Von großer Bedeutung ist auch die Fähigkeit der Tenside, Dispersionen und Emulsionen zu stabilisieren. So lassen sich wasserunlösliche Farbstoffe mit geeigneten Tensiden in Wasser so fein verteilen, dass sich keine Farbstoffpartikel absetzen (Dispersionsfarben). Als Emulsion bezeichnet man ein fein verteiltes Gemisch zweier Flüssigkeiten, die sich nicht oder kaum ineinander lösen wie z.B Öl und Wasser. Eine Flüssigkeit bildet kleine Tröpfchen, verteilt in der anderen Flüssigkeit. Die Phase, die Tröpfchen bildet, nennt man disperse Phase. Die Phase, in der die Tröpfchen "schwimmen", wird Dispersionsmedium genannt. Emulsionen gehören zu den dispersen Systemen und unterscheiden sich von Gemischen mischbarer Flüssigkeiten, wie zum Beispiel Ethanol und Wasser. Wird. Öl mit Wasser gemischt und 2 Tenside als Emulgator eingesetzt, werden die kleinen Öltröpfchen mit den Tensidmolekülen umgeben, wobei die lipophilen Teile in die Tröpfchen hineinragen und die hydrophilen Teile nach außen orientiert sind. Da jedes Tröpfchen so von einer negativen geladenen Schicht umgeben ist, stoßen sich die Tröpfchen gegenseitig ab und laufen nicht wieder zusammen. Die Entmischung wird so verhindert. Ziel dieses Versuches ist es, die Bildung von Mizellen nachzuweisen und die Solubilisierung eines wasserunlöslichen Farbstoffes in einer mizellaren Tensidlösung zu untersuchen. 3 (a) Messmethoden und Versuchsdurchführung Nachweis von Mizellen durch durch Lichtstreuung (Tyndall-Effekt): Mizellen sind so groß, dass Licht an ihnen gestreut wird. Die Lichtstreuung durch eine kolloidale Lösung wurde erstmals im Jahre 1871 von Tyndall in der Literatur beschrieben. Quantitative Lichtstreuungsexperimente liefern wichtige Informationen über die Gestalt und Größe des streuenden Teilchens. Sicherheitshinweis In diesem Versuch wird ein Laserpointer der Gefahrenklasse 1 mit 3mW Dauerleistung verwendet. Das bedeutet, dass bei direkter Betrachtung des Laserstrahls die Netzhaut zerstört wird, was zum Erblinden führen kann. Destilliertes Wasser, sowie eine Tensidlösung, bei der die Tensidkonzentration oberhalb der kritischen Mizellenkonzentration (cmc) liegt, werden jeweils in eine Küvette gefüllt. Die beiden Küvetten werden vom Lichtstrahl eines Laserpointers durchstrahlt. In der Küvette mit dest. Wasser ist der Lichtstrahl von der Seite nicht zu erkennen. In der Küvette mit der mizellaren Lösung ist der Lichtstrahl von der Seite deutlich sichtbar, da das Licht an den Mizellen gestreut wird. Seifenlösungen erscheinen daher im Licht immer ein wenig trübe. Wird die Lichtstreuung in Abhängigkeit von der Tensidkonzentration untersucht, ergibt sich der folgenden Zusammenhang: 3 Die Abbildung zeigt, dass die Messung des Trübungsgrades (dies ist ein Maß für die Stärke der Lichtstreuung) von Tensidlösungen in Abhängigkeit von der Tensidkonzentration verwendet werden kann, um die kritische Mizellenkonzentration (cmc) zu bestimmen. (b) Solubilisierung in Mizellen Die Solubilisierung in Mizellen kann durch folgendes Experiment nachwiesen werden. Ein wasserunlöslicher Farbstoff wird in einem unpolaren organischen Lösungsmittel, z.B. Cyclohexan, gelöst. Als Farbstoff wird Sudan Rot verwendet, so dass man eine tiefrote Lösung erhält. Als Tensid wird das zwitterionisch Sulfobetaine 12 eingestzt, dessen kritische Mizellenkonzentration bei 3.6 10-3 mol/l liegt. Es wird eine Konzentrationsreihe (10 Lösungen) des Tensids hergestellt (nähere Anleitung von der Tutorin). In jedes Reaktionsgefäß werden nun 100 µl der Farbstofflösung gefüllt und kräftig geschüttelt. Nach einer Wartezeit von ca. 30 min beobachtet man in den Reaktionsgefäßen, in denen die Tensidkonzentration unterhalb der kritischen Mizellenkonzentration liegt, dass sich beide Phasen wieder entmischen und dass die wässrige Phase nahezu farblos bleibt. Bei Tensidkonzentrationen oberhalb der kritischen Mizellenkonzentration bilden sich Mizellen in der wässrigen Phase und die hydrophoben Farbstoffmoleküle werden in die Mizellen eingebaut. Die wässrige Lösung wird nun farbig. Mit Hilfe einer Spritze wird die wässrige Phase aus den Reaktionsgefäßen entnommen und in eine optische Küvette gefüllt. Die Bestimmung der Farbstoffkonzentration in der wässrigen Phase erfolgt nun durch Messung der Extinktion am Absorptionsmaximum des Farbstoffes. 4 Dazu steht ein Photometer Shimadzu UV – 1800 zur Verfügung. Eine schematische Darstellung des optischen Systems im UV-1800 zeigt die folgende Abbildung: Das Licht aus der Lichtquelle (Deuterium-Lampe D2 oder Halogen-Lampe WI) wird vom Spiegel L.M. reflektiert und tritt dann in den Monochromator ein. Der Wechsel der Lichtquelle erfolgt vollautomatisch, wobei das Gerät die nächste Lampe durch Drehen des Spiegels L.M. der Wellenlänge entsprechend aussucht. [ D2: Deuterium-Lampe; WI: Halogen-Lampe; F: Filter, GR: Gitter; S1: Eintrittsspalt; S2: Austrittsspalt; W: Fenster; L.M.: Spiegel für den Wechsel der Lampe; M1~M5: Spiegel; B.S.: Strahlteiler; L: Linse; Sam: Zelle der Probenseite; Ref: Zelle der Referenzseite; P.D.: Photodioden ] Deuterium-Lampe: 190 nm bis zur Wechselwellenlänge; Halogen-Lampe: Wechselwellenlänge bis 1100 nm; Die Lampen-Wechselwellenlänge kann im Bereich zwischen 295,0 und 364,0 nm festgelegt werden (Standardeinstellung: 340,8 nm). Grundlage der Messmethode ist das LAMBERT-BEERsche Gesetz, welches die Schwächung des Lichtes beim Durchgang durch die absorbierende Probe beschreibt: I I0 e dc oder lg I0 E d c I 5 mit 2,303 dabei ist I0 die Lichtintensität des Referenzstrahls und I die Intensität des Probenstrahls, c die Konzentration des absorbierenden Stoffes, d die Schichtdicke der Küvette und der dekadische Extinktionskoeffizient. E heißt (dekadische) Extinktion oder optische Dichte. Der Extinktionskoeffizient ist eine von der Wellenlänge der einfallenden Strahlung abhängige stoffspezifische Konstante. Die Extinktion eines Farbstoffes in Abhängigkeit von der Wellenlänge (bzw. Frequenz) des eingestrahlten Lichts wird als Absorptionsspektrum bezeichnet. Das Verhältnis I/I0 entspricht der Transmission der Probe. Folgende Messungen sollen durchgeführt werden: (1) Zur Messung der Basislinie von 300 nm bis 700 nm (Bestimmung des Nullpunktes für jede Wellenlänge) stellen Sie die Küvette mit dest. Wasser in das Spektralphotometer und drücken die Taste „Baseline“. Anschließend überprüfen Sie durch eine Messung, dass die Kalibrierung geklappt hat. (2) Messen Sie das Absorptionsspektrum von Sudan Rot in Cyclohexan im Bereich von 300 nm bis 700 nm, indem Sie die ausstehende konzentrierte Lösung um den Faktor xxxx verdünnen. (3) Messen Sie das Absorptionsspektrum der wässrigen Phase von der verschiedenen Proben im Bereich von 300 nm bis 700 nm. 5 Auswertung Die Bestimmung der Farbstoffkonzentration in der wässrigen Phase erfolgt nun durch Messung der Extinktion am Absorptionsmaximum des Farbstoffes. Für den dekadischen Extinktionskoeffizienten verwenden Sie den Wert 33600 M-1cm-1. Tragen Sie die berechnete Farbstoffkonzentration gegen die Tensidkonzentration auf und bestimmen Sie graphisch die kritische Mizellenkonzentration von dem Tensid Sulfobetaine 12. 6 Literaturhinweise H.-D. Dörfler, Grenzflächen- und Kolloidchemie. VCH, Weinheim, 1994. B. Fabry, Tenside,, Chemie in unserer Zeit, 1991, 214 - 222 H. Hofmann und W. Ulbricht, Chemie in unserer Zeit, 1995, 76-86 6 T. Hofmann, Chemie in unserer Zeit, 2004, 24-35 Wikepedia 7