Frankfurter Rundschau - Grünalgen als Lichtbringer
Werbung

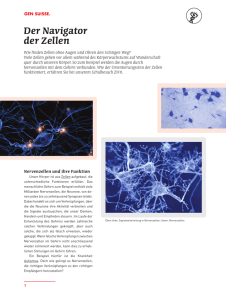
Frankfurter Rundschau - Grünalgen als Lichtbringer http://www.fr-online.de/wissenschaft/forschung-gruenalgen-als-lichtbri... Wissen - 3 | 5 | 2012 FORSCHUNG Grünalgen als Lichtbringer Von Silvia von der Weiden Mit lichtsensiblen Eiweißen lassen sich Nerven an- und ausknipsen. Die Technik soll einst Blinden helfen Vor drei Milliarden Jahren machten Algen eine geniale Erfindung. Sie entwickelten ein lichtempfindliches Eiweißmolekül, eine Art Auge, das sie in ihre Zellmembran einbauten. Damit legten sie den Grundstein für die Evolution komplexer Nervensysteme. Das wegen seiner roten Färbung Rhodopsin genannte Molekül haben die Nachfahren der einstigen Pioniere weiterentwickelt. In Form des Sehpurpurs sorgt es in den Lichtsinneszellen der Der Fadenwurm Caenorhabditis elegans lässt sich bereits durch Licht steuern. Gelbes Licht bewirkt, dass er sich wie auf Kommando bewegt. Foto: AG Gottschalk/Uni Frankfurt (2) menschlichen Netzhaut dafür, dass wir Helligkeitsabstufungen und Farben präzise wahrnehmen. Damit orientieren sich nicht nur lichthungrige Grünalgen. Mit dem vorn sitzenden rot schimmernden „Augenfleck“ misst das Geißeltierchen Euglena Intensität und Richtung des einfallenden Lichts. So kann sich der Einzeller im Wasser gezielt bewegen. In Form des Sehpurpurs sorgt das in den Lichtsinneszellen der menschlichen Netzhaut eingebettete Rhodopsin dafür, dass wir Helligkeitsabstufungen und Farben präzise wahrnehmen. Das Rhodopsin aus den Algen kann noch mehr. Trifft blaues Licht auf das Molekül, verändert es spontan seine Struktur und bildet einen Kanal. Durch ihn strömen positiv geladene elektrische Teilchen von außen in die Zelle und lösen so winzige Ladungsverschiebungen in der Membran aus, die die Schlagbewegungen der Geißeln und damit die Schwimmrichtung des Einzellers steuern. Nach dem Effekt heißt das Molekül, das Forscher am Max-Planck-Institut für Biophysik in Frankfurt und ihre Kollegen vor rund zehn Jahren bei der Grünalge Chlamydomonas (großes Foto) entdeckten, Kanalrhodopsin. Ein Eiweiß als Schalter Mit einem verwandten Mechanismus wandelt auch die menschliche Netzhaut Licht- in Nervensignale um. Sogar Bakterien haben das Prinzip für sich entdeckt. Aus einer salzliebenden Mikrobe stammt das Halorhodopsin, das den gegenteiligen Effekt bewirkt. Wird die Zelle mit gelbem Licht bestrahlt, strömen negativ geladene Teilchen ein, was Nervenimpulse unterdrückt. Diese Schalterfunktion macht die lichtempfindlichen Moleküle zum Ausgangspunkt für eine neue Forschungsrichtung: die Optogenetik. Dabei wird die genetische Information für eine oder mehrere Rhodopsinvarianten in lebende Organismen eingebaut. Als Gentaxi dient ein Virus. Rhodopsin wird nur von Nervenzellen ausgeprägt. Wird der Organismus oder das Gewebe mit Licht einer bestimmten Farbe bestrahlt, löst das einen Nervenimpuls aus. So können Wissenschaftler mit Hilfe von Lichtblitzen Nervenreaktionen steuern und auf Knopfdruck sogar Vorlieben und Verhalten von Lebewesen manipulieren. Wie das funktioniert, demonstriert Alexander Gottschalk, Professor für Biochemie an der Universität Frankfurt am Main. Sein Versuchstier ist der nur einen Millimeter große Fadenwurm Caenorhabditis elegans. Mit dem Mikroskop erkennt man die Eingeweide durch den transparenten Körper des sich munter in der Petrischale schlängelnden Tierchens. Gottschalk lässt gelbes Licht auf den Wurm fallen. Der erstarrt auf der Stelle. Dann schaltet der Forscher das gelbe Licht wieder ein und erweckt auf diese Weise den Wurm aus seiner Bewegungslosigkeit. Er schlängelt und windet sich mit aller Kraft voran. Die durch das Licht aktivierten Neurone lösen Muskelkontraktionen in seinem Körper aus, die das Tierchen vorantreiben, ob es will oder nicht. Gottschalk ist begeistert: „Die Optogenetik erlaubt es erstmals, einzelne Nervenzellen allein durch Licht präzise an- und abzuschalten.“ Das ermögliche Einblicke in die neuronale Aktivität. Auch wenn die Erkenntnisse bislang vor allem der Grundlagenforschung nutzen, könnten sie helfen, Mechanismen zu erhellen, die Erkrankungen beim Menschen zugrunde liegen. 1 von 3 04.05.2012 18:26 Frankfurter Rundschau - Grünalgen als Lichtbringer 2 von 3 http://www.fr-online.de/wissenschaft/forschung-gruenalgen-als-lichtbri... Lesen sie weiter: Welche Perspektiven sich bei Parkison ergeben. Ein Modell zielt auf Nervenzellen, die den Botenstoff Dopamin bilden. Gottschalks Mitarbeiter haben deshalb die Dopamin-bildenden Neurone seiner Fadenwürmer mit Rhodopsinschaltern ausgerüstet. Auch das menschliche Gehirn bildet Dopamin in bestimmten Nervenzellen. Sie sind wesentlich für die Koordinierung präziser Bewegungen. Bilden sie zu wenig von dem Botenstoff, löst das beim Menschen die Schüttellähmung oder Parkinson-Krankheit aus. Die Neurone beim Fadenwurm schütten den Botenstoff aus, wenn dieser auf eine Futterquelle gestoßen ist. Das bewirkt, dass sich die Vorwärtsbewegungen des Tieres verlangsamen und es sein Ziel nicht verfehlt. In seinem Modell kann Gottschalk diese Funktion der Nervenzellen nachahmen, indem er den Wurm mit blauem Licht anstrahlt. Mit experimentellen Studien an Mäusen ist der Medizinforscher Karl Deisseroth von der kalifornischen Stanford University noch einen Schritt weitergegangen. Um die Dopamin-gesteuerten Nervenschaltkreise bei den Nagern genauer auszuloten, rüstete er die Neurone mit den lichtempfindlichen Molekülschaltern aus. Per Glasfaserkabel leitete er dann Lichtsignale in die betreffende Hirnregion ein. Sie ist bei Patienten, die an einer schweren Form von Parkinson erkrankt sind, das Zielgebiet für die Behandlung mit der Tiefenhirnstimulation. Die im Nervengewebe implantierten Elektroden sollen die heftigen Zitterbewegungen lindern. Im Tiermodell wies Deisseroth nach, dass die Elektroden ein deutlich größeres Areal stimulieren als bekannt. Die Erkenntnis half bereits, Tiefenhirn-Elektroden bei Patienten präziser zu platzieren. Perspektive bei Parkinson Das sei erst der Anfang, meint Stefan Herlitze, Professor für Neurobiologie und Zoologie an der Ruhr-Universität Bochum: „Mit Hilfe optogenetischer Methoden können wir jetzt an neuen therapeutischen Ansätzen forschen.“ Der Forscher hat die Technik bei Ratten erfolgreich erprobt. Die Atemmuskulatur der Tiere war durch eine künstliche Rückenmarkläsion halbseitig gelähmt. Mit einem per Gentherapie eingeführten Rhodopsinschalter reaktivierte er die stillgelegten Nervenleitungen, so dass die Tiere wieder normal atmen konnten. Die Idee des Forschers: Querschnittgelähmte Patienten könnten mit Hilfe der Technik die Funktionen von Blase und Schließmuskel wieder steuern. Die Lichtquelle in Form einer kleinen Diode für Blau- und Gelblicht könnte man implantieren und mit einer drahtlosen Energiequelle von außen steuern. Noch ist das Vision. Auch müsste sich der Patient einer Gentherapie unterziehen, bislang ein Eingriff mit ungewissem Ausgang. Der Einsatz der Optogenetik bei der Behandlung von Augenleiden setzt ganz auf die ureigene Stärke der Technik: Licht fällt auf natürlichem Wege von außen ins Auge. Die Funktion kranker oder erblindeter Sehzellen übernimmt ein künstlicher Sensor, der Licht mit Hilfe von Rhodopsin in Nervensignale umwandelt. Dass der Ansatz im Prinzip funktioniert, hat Botond Roska vom FriedrichMiescher-Institut in Basel nachgewiesen, wenn auch erst im Mausmodell. Er schleuste die Erbinformation für Halorhodopsin in die defekten Sehzellen von Mäusen ein. Die Tiere waren an Retinitis pigmentosa erkrankt und erblindet. Tatsächlich gelang es Roska so die Sehzellen zu reaktivieren. Messungen und ausgeklügelte Verhaltenstests bewiesen, dass die Tiere wieder auf Licht reagierten. Kontraste und gerichtete Bewegungen konnten sie allem Anschein nach wieder wahrnehmen. Nun will Roska die optogenetische Therapie an Affen erproben. Sollten die Tests positiv verlaufen, könnten in ein paar Jahren erste klinische Studien mit Patienten beginnen. Optische Werkzeuge für die Gentechnik In der Optogenetik dienen lichtaktivierbare Moleküle als Werkzeuge, um biologische Vorgänge gezielt zu steuern. Das Wissenschaftsjournal Nature Methods erkor die Technologie zur Methode des Jahres 2010, da mit ihrer Hilfe detaillierte Einsichten in komplexe biologische Abläufe möglich werden. Inzwischen steht der Optogenetik ein ansehnlicher Werkzeugkasten aus funktionalen Molekülen zur Verfügung. Neben Lichtschalterproteinen wie den Rhodopsinen gehören auch Leuchtproteine dazu. Sie nutzen Organismen etwa aus der Tiefsee zur Signalgebung. Das aus der Qualle Aequorea victoria stammende Gen für ein solches grün fluoreszierendes Protein lässt sich als hochsensibler Sensor nutzen, wenn es in lebende Zellen eingeschleust wird. Das Protein, das von ihm codiert wird, bindet nur an bestimmte Strukturen und lässt diese bei Bestrahlung mit Licht einer bestimmten Wellenlänge unter dem Mikroskop grün schimmern. Durch Abwandlung des ursprünglichen Leuchtproteins haben Forscher ein ganzes Spektrum verschiedener Reporterverbindungen geschaffen, mit deren Hilfe unterschiedliche Prozesse in Zellen und Geweben zeitgleich analysiert werden. Krebszellen etwa lassen sich so von gesunden unterscheiden. Artikel URL: http://www.fr-online.de/wissenschaft/forschung-gruenalgen-als-lichtbringer,1472788,15091874.html 04.05.2012 18:26 Frankfurter Rundschau - Grünalgen als Lichtbringer 3 von 3 http://www.fr-online.de/wissenschaft/forschung-gruenalgen-als-lichtbri... Copyright © 2010 Frankfurter Rundschau 04.05.2012 18:26