Xeloda® – in allen Phasen der Darmkrebstherapie als Standard
Werbung

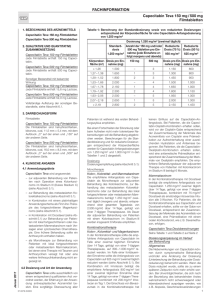
Xeloda® – in allen Phasen der Darmkrebstherapie als Standard akzeptiert Xeloda® – in allen Phasen der Darmkrebstherapie als Standard akzeptiert Berlin (1. Oktober 2008) - Xeloda® (Capecitabin) gilt sowohl in der adjuvanten Situation des Kolonkarzinoms als auch in der First- und Second-Line-Therapie des metastasierten kolorektalen Karzinoms (mCRC) als zeitgemäßer Standard. Der hohe Stellenwert des oralen Fluoropyrimidins, der sich auch in den Empfehlungen der aktuellen S3-Leitlinie widerspiegelt, resultiert aus konsistent guten klinischen Daten und der patientenfreundlichen Anwendung, so die übereinstimmende Meinung der Experten bei einem Pressegespräch der Roche Pharma AG im Rahmen der Jahrestagung der Deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten in Berlin.1 Überlegenheit gegenüber 5-FU/FS in der adjuvanten Situation Nach Operation eines Kolonkarzinoms im Stadium III stellt Capecitabin nicht nur eine patientenfreundliche, besser verträgliche Alternative zu Fluorouracil/Folinsäure (5-FU/FS) dar, sondern ist nach den aktuellen Ergebnissen der Phase-III-Studie X-ACT (Xeloda in Adjuvant Colon Cancer 1/7 Xeloda® – in allen Phasen der Darmkrebstherapie als Standard akzeptiert Therapy) auch wirksamer als ein 5-FU-Bolusregime (Mayo-Schema). Mit einem unter Capecitabin verbesserten krankheitsfreien 5-Jahres-Überleben (60,8 % vs. 56,7 %; p=0,07) und 5-Jahres-Gesamtüberleben (71,4 % vs. 68,4 %; p=0,06) zeigte eine Effektivitätsanalyse die Gleichwertigkeit der beiden Regime und deutete zugleich auf eine potenzielle Überlegenheit von Capecitabin hin.2 „Außerdem zeigte Capecitabin ein besseres Toxizitätsprofil mit weniger Durchfällen, Übelkeit, Stomatitis und febrilen Neutropenien als das Mayo-Protokol“, so Prof. Dr. Stefan Kubicka, Hannover. Die Ergebnisse einer vorab geplanten Multivarianzanalyse der X-ACT-Studie, in der mögliche Prognosefaktoren wie Alter, Zeitspanne zwischen Operation und Randomisierung, Nodalstatus und erhöhtes CEA (karzinoembryonales Antigen) berücksichtigt wurden, belegten nun auch eine statistisch signifikante Überlegenheit des oralen 5-FU-Prodrugs. Bei einer Abnahme des Progressionsrisikos um 17 % (HR 0,826; p=0,01) reduzierte Capecitabin das Sterberisiko um 21 % (HR 0,788; p=0,02).3 Empfehlung in aktueller S3-Leitlinie Das in der X-ACT-Studie belegte günstige Nutzen-Risiko-Profil hat dazu geführt, dass Capecitabin sehr schnell in die deutschen Leitlinien aufgenommen wurde. Entsprechend dem 2008 publizierten Update der S3-Leitlinie „Kolorektales Karzinom“ sollte in der adjuvanten Situation, wenn eine Monotherapie mit Fluoropyrimidinen indiziert ist, Capecitabin der Vorzug vor infusionalen 5-FU-Schemata gegeben werden (Empfehlungsgrad A, Evidenzstärke 1, starker 2/7 Xeloda® – in allen Phasen der Darmkrebstherapie als Standard akzeptiert Konsens).4 Zeitgemäßer Kombinationspartner in der First- und Second-Line-Therapie Bei Patienten mit metastasiertem kolorektalen Karzinom (mCRC) ist Capecitabin heute in allen gängigen Chemotherapie-Schemata mit oder ohne Avastin® (Bevacizumab) uneingeschränkt zugelassen. Damit kann das orale 5-FU-Prodrug in allen Phasen der Erkrankung die aufwändigen Protokolle mit infusionalem 5-FU/FS ersetzen und entwickelt sich beim mCRC zunehmend zu einem neuen Therapiestandard, wie Priv.-Doz. Dr. Anke Reinacher-Schick, Bochum, feststellte. Grundlage der Zulassung von Capecitabin in Kombination mit Oxaliplatin (XELOX) beim mCRC waren die Ergebnisse der internationalen Phase-III-Studien NO16966 (First-Line-Therapie) und NO16967 (Second-Line-Therapie), in denen XELOX mit dem etablierten FOLFOX-4-Schema verglichen wurde. Beide Studien erreichten ihren primären Endpunkt, der als Nichtunterlegenheit von XELOX hinsichtlich des progressionsfreien Überlebens (PFS) definiert war. Bei ähnlich langem Gesamtüberleben (OS) zeigten die Nebenwirkungsprofile deutliche Unterschiede, wobei unter XELOX signifikant weniger schwere Neutropenien auftraten.5,6 3/7 Xeloda® – in allen Phasen der Darmkrebstherapie als Standard akzeptiert Bestätigt wurde die Äquivalenz von XELOX und FOLFOX beim mCRC durch die Ergebnisse von zwei großen Metaanalysen. Bei insgesamt 2.575 Patienten, die in fünf randomisierten Phase-II- und –III-Studien eine First-Line-Therapie mit Oxaliplatin in Kombination mit 5-FU oder Capecitabin erhielten, fanden Porschen et al. weder Unterschiede im progressionsfreien Überleben (HR 1,05; 95 % CI: 0,97-1,14; p=0,25) noch im Gesamtüberleben (HR 1,05; 95 % CI: 0,95-1,15; p=0,34).7 Und auch Cuppone et al., die die Daten von sechs randomisierten klinischen Studien mit insgesamt 3.405 Patienten analysierten, zeigten mit einer Hazard Ratio von 0,98 (PFS) bzw. 1,02 (OS) die Gleichwertigkeit von XELOX und FOLFOX in der First-Line-Therapie des mCRC.8 AIO-Studie definiert neues XELIRI-Regime Dass Capecitabin auch in Kombination mit Irinotecan (XELIRI) ein hoch aktives und sicheres Regime darstellt, verdeutlichten die aktuellen Ergebnisse der AIO (Arbeitsgemeinschaft für Internistische Onkologie)-Studie 0604. In der randomisierten Phase-II-Studie wurden 255 Patienten in der ersten Therapielinie mit Bevacizumab plus XELOX oder Bevacizumab plus XELIRI behandelt. Zur Verbesserung der gastrointestinalen Verträglichkeit von XELIRI wurde die Dosierung von Capecitabin und Irinotecan um jeweils 20 % reduziert.9 Mit einer progressionsfreien Überlebensrate nach 6 Monaten (=primärer Endpunkt) von 84 % und einem medianen PFS von 12,1 Monaten zeigte XELIRI 4/7 Xeloda® – in allen Phasen der Darmkrebstherapie als Standard akzeptiert plus Bevacizumab eine vergleichbar hohe Aktivität wie XELOX plus Bevacizumab mit einer PFS-Rate von 76 % und einem medianen PFS von 10,4 Monaten. Bei einer im XELIRI/Bevacizumab-Arm zugleich niedrigeren Diarrhö-Rate sprechen die aktuellen Daten dafür, das XELIRI-Schema mit niedriger dosiertem Capecitabin (800 mg/m2) und Irinotecan (200 mg/m2) als neuen Therapiestandard zu definieren. Überlegenheit auch bei fortgeschrittenem Magen- und Ösophaguskarzinom Wie beim kolorektalen Karzinom hat Capecitabin auch in der First-Line-Therapie des fortgeschrittenen Magen- und Ösophaguskarzinoms das Potenzial, sich zum neuen 5-FU-Standard zu entwickeln. Dies zeigen die Ergebnisse einer Metaanalyse mit mehr als 1.300 Patienten, die in der ersten Therapielinie verschiedene Cisplatin-haltige Schemata mit Capecitabin oder infusionalem 5-FU erhielten. Primärer Endpunkt der Metaanalyse war das Gesamtüberleben. Verglichen mit dem bisherigen 5-FU-Standard, verbesserte Capecitabin statistisch signifikant das Gesamtüberleben, wie sowohl die Hazard Ratio von 0,87 (95 % CI: 0,77-0,98; p=0,02) als auch der Vergleich der medianen Überlebenszeiten zeigte: Mit 322 Tagen lebten die Patienten im Capecitabin-Arm im Mittel 37 Tage länger als in der Kontrollgruppe.10 5/7 Xeloda® – in allen Phasen der Darmkrebstherapie als Standard akzeptiert Vorteile in der täglichen Praxis Bei einer im Vergleich zu konventionellen 5-FU-Schemata mindestens äquivalenten Wirksamkeit und geringeren Rate schwerer hämatologischer Nebenwirkungen ist die patientenfreundliche Capecitabin-Therapie mit einem deutlichen Gewinn an Lebenszeit und Lebensqualität verbunden. In der täglichen Praxis relevant sind dabei nicht nur die erhebliche Verkürzung der Infusionsdauer sowie der Ambulanzbesuche und Krankenhausaufenthalte, sondern auch das niedrigere Komplikationsrisiko, da bei Einsatz des oralen 5-FU-Prodrugs auf eine Portimplantation verzichtet werden kann. „Angesichts der sehr guten Wirksamkeit und ausgezeichneten Verträglichkeit kann Capecitabin als ein neuer Standard bei der Behandlung gastrointestinaler Tumoren gelten“, resümierte Priv.-Dozentin Dr. Anke Reinacher-Schick. Quellen Pressegespräch im Rahmen der Jahrestagung des DGVS „Xeloda® als Standard in allen Phasen der Darmkrebstherapie“, Berlin, 1. Oktober 2008 Twelves et al., WCGIC 2008, Abstract O-033 6/7 Xeloda® – in allen Phasen der Darmkrebstherapie als Standard akzeptiert - Glen H, Cassidy J., Expert Rev Anticancer Ther 2008;8: 547-551 Schmiegel et al., Z Gastroenterol 2008;46: 799-840 Cassidy et al., J Clin Oncol 2008;26: 2006-2012 Rothenberg et al., Ann Oncol, 2008 Jun 10 (Epub ahead of print) Porschen et al., ASCO 2008, Abstract 4055 Cuppone et al., ASCO 2008, Abstract 4056 Reinacher-Schick et al., ASCO 2008, Abstract 4030/oral presentation Okines et al., ESMO 2008, Poster 513PD Quelle: Pressekonferenz der Firma Roche Pharma zum Thema „Xeloda® als Standard in allen Phasen der Darmkrebstherapie“ am 01.10.2008 in Berlin (medical relations). 7/7