CHE 151.1: Organische Chemie fŁr die Biologie - UZH
Werbung

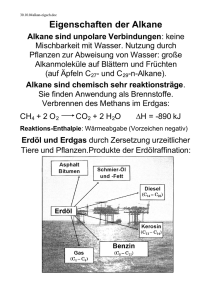
Inhalt Index 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen. Glücklicherweise können diese Verbindungen auf Grund ihrer funktionellen Gruppen in Substanz-Klassen eingeordent werden. Die funktionellen Gruppen bestimmen die Eigenschaften und die Reaktivität des gesamten Moleküls, und chemische Reaktionen laufen fast ausschliesslich an ihnen ab. z.B. Die C=C Doppelbindungen in Ethylen und α-Pinen reagieren mit Brom in ähnlicher Weise: Eine Liste der am häufigsten vorkommenden funktionellen Gruppen ist separat beigelegt. Sie können, zum Beispiel, in folgende Kategorien eingeteilt werden: Funktionelle Gruppen mit C-C Mehrfachbindungen Eine Einfachbindung zwischen C und einem elektronegativen Atom Funktionelle Gruppen mit einer C=O Doppelbindung (Carbonyl Gruppe) 2.2 Alkane (Moleküle ohne funktionelle Gruppen): Nomenklatur, Isomerie, Konformation. Moleküle, deren empirische Formel der allgemeinen Form CxHy entspricht, bezeichnet man als Kohlenwasserstoffe. Kohlenwasserstoffe, die nur Einfachbindungen enthalten, tragen die Bezeichnung Alkane oder gesättigte Kohlenwasserstoffe (saturated hydrocarbon). Alkane lassen sich aufgrund ihrer Struktur in verschiedene Typen unterteilen: die geradekettigen Alkane, die verzweigten Alkane, in denen sich in der Kohlenstoffkette ein oder mehrere Verzweigungspunkte befinden, und die cyclischen Alkane oder Cycloalkane sowie die komplizierteren bicyclischen, tricyclischen und polycyclischen Alkane. 3D-Ansicht Moleküle, die dieselbe Molekularformel (Summenformel) haben, aber unterschiedliche chemische oder physikalische Eigenschaften besitzen, nennt man Isomere. z.B. existieren zwei C4H10 Moleküle und drei mögliche C5H10 Moleküle. Mit der Summenformel C30H62findet man 4,111,846,763 mögliche Isomere. Man unterscheidet zwischen zwei Arten von Isomerie : Konstitutionsisomerie und Stereoisomerie. Beide kann man in allen organischen Stoffklassen antreffen (Stereoisomerie wird später behandelt). Konstitutionsisomere besitzen die gleiche Summenformel, aber sie unterscheiden sich durch die Verknüpfungsweise ihrer Atome und Gruppen. Sie unterscheiden sich also in ihren Konstitutionen (Atomverknüpfungen, Konnektivitäten) : z.B. 3D-Ansicht Die ersten vier Alkane haben eigene Namen, die in das IUPAC-System mit aufgenommen wurden (International Union of Pure and Applied Chemistry), aber alle enden auf -an : Namen der geradkettigen Alkane CnH2n+2 ; Mit Ausname der vier ersten setzen sich die Namen der Alkane aus dem griechischen Zahlwort für die Anzahl der C-Atome und der Endung -an zusammen. n Name Formel n Name Formel 1 Methan CH4 11 Undecan CH3(CH2)9CH3 2 Ethan CH3CH3 12 Dodecan CH3(CH2)10CH3 3 Propan CH3CH2CH3 13 Tridecan CH3(CH2)11CH3 4 Butan CH3CH2CH2CH3 14 Tetradecan CH3(CH2)12CH3 5 Pentan CH3(CH2)3CH3 15 Pentadecan CH3(CH2)13CH3 6 Hexan CH3(CH2)4CH3 16 Hexadecan CH3(CH2)14CH3 7 Heptan CH3(CH2)5CH3 17 Heptadecan CH3(CH2)15CH3 8 Octan CH3(CH2)6CH3 18 Octadecan CH3(CH2)16CH3 9 Nonan CH3(CH2)7CH3 19 Nonadecan CH3(CH2)17CH3 10 Decan CH3(CH2)8CH3 20 Eicosan CH3(CH2)18CH3 Die formal durch Abspaltung eines H-Atoms gebildete Gruppe (CH3, C2H5, C3H7.... ) erhält die Endung -yl ( Methyl, Ethyl, ....). Wenn man verzweigte Alkane benennen möchte, muss man den IUPAC-Nomenklatur-Regeln folgen (kurz beschrieben im Lehrbuch von Fox & Whitesell S.22). i) Suchen Sie die längste Kette von Kohlenstoffatomen im Molekül und benennen Sie sie diese Bei zwei Ketten mit der gleichen Länge, hat die Kette mit mehr Substituenten Vorrang. ii) Bestimmen Sie die Namen, der an die längste Kette gebundenen Alkylgruppen iii) Numerieren Sie die Kohlenstoffatome der längsten Kette von dem Ende her, das einer Substitution am nächsten ist. und bei 2 Substituenten mit dem gleichen Abstand vom Kettenende dann alphabetisch. iv) Schreiben Sie den Namen des Alkans, indem Sie zunächst die Namen der Seitenketten in alphabetischer Reihenfolge ordnen (jedem geht die Nummer des Kohlenstoffatoms, an das es gebunden ist und ein Bindestrich voraus), und fügen sie dann den Namen des Stammalkans, wie am Rand gezeigt, hinzu. 2.3 Physikalische Eigenschaften der Alkane Wie sehen nun die dreidimensionalen Strukturen der Alkane aus, und welche physikalische Eigenschaften haben sie ? Bei Raumtemperatur sind die homologen Alkane mit kleinerer molarer Masse Gase oder farblose Flüssigkeiten, die mit grösserer molarer Masse Feststoffe. z.B.: Schmelzpunkte, Siedepunkte und Dichte ([D204] bei 20 oC bezogen auf Wasser von 4 oC ) in Abhängigkeit von der Molekülgrösse geradkettiger Alkane 2.4 Chemische Eigenschaften Bei Raumtemperatur sind die Alkane gegenüber den meisten Reagenzien praktisch völlig inert. Wird ein Gemisch eines Alkans mit Chlor oder mit Brom kräftig belichtet, findet eine Halogenierung statt . Die Verbrennung der Alkane zu CO2 und H2O verläuft stark exotherm : Die grössten natürlichen Quellen von Alkanen sind im Erdöl. In den USA stammen um 99% aller organischen Rohstoffe aus Erdöl : 2.5 Konformation Strukturen, die durch Drehung um Einfachbindungen ineinander überführt werden können, bezeichnet man als Konformationen. Für das Molekül des Ethans, dessen C-C-Bindung eine rotationssymmetrische σ-Bindung ist, würde man erwarten, dass um die C-C-Bindung freie Rotation möglich ist. Aber experimentelle Untersuchungen und berechnete thermodynamische Daten stimmen nur dann überein, wenn man für die Rotation eine Energiebarriere von etwa 12.6 KJ/mol (3.0 Kcal/mol) annimmt, die dem Energieunterschied zwischen gestaffelter und ekliptischer Konformation entsprechen muss : Sägeblock-Projektion (Sawhorse projection) Rotation um 60o ethan1.pdb Newman-Projection ethan2.pdb Potentielle Energie der Konformationen des Ethans als Funktion des Torsionswinkels : Moleküle, die in Konformationen vorliegen, welche den Energieminima entsprechen, nennt man Konformere (oder Konformationsisomere). Während beim Propan die Energiedifferenz zwischen gestaffelter und ekliptischer Konformation trotz des Vorhandenseins einer weiteren Methylgruppe an Stelle eines Wasserstoffatoms nur geringfügig erhöht ist gegenüber dem Ethan (14.6 KJ/mol), unterscheiden sich beim n-Butan wegen der grösseren Wechselwirkungen zwischen zwei Methylgruppen die verschiedenen Konformationen energetisch stärker von einander : Bei höheren Alkanen sind natürlich noch viel mehr verschiedene ausgezeichnete Konformationen möglich als beim Ethan oder n-Butan. Die Energieunterschiede zwischen ihnen sind jedoch ebenfalls nur gering, so dass die Konformere nicht als Substanzen fassbar sind. Im festen Zustand treten am häufigsten nur zickzackförmige Ketten auf, wobei die Wasserstoffatome durchwegs in antiperiplanarer Stellung zueinander stehen : 2.6 Cyclische Alkane Die Nomenklatur dieser Verbindungsklasse ist ganz einfach : Dem Namen des offenkettigen Alkans mit derselben Zahl von Kohlenstoffatomen wird einfach die Vorsilbe cyclo vorangesetzt : Untersucht man Molekülmodelle disubstituierter Cycloalkane, bei denen sich beide Substituenten an unterschiedlichen Kohlenstoffatomen befinden, so sieht man, dass es in jedem Fall zwei mögliche Isomere gibt. z.B. Hier handelt es sich nicht um Konstitutions-Isomere, sondern um Stereoisomere. Stereoisomere haben dieselbe Konstitution aber unterschiedliche Geometrien und Topographien (d.h. sie unterscheiden sich in der räumlichen Anordnung der gebundenen Atome oder Gruppen). 2.7 Die Struktur der Cycloalkane Cyclopropan besitzt die Gestalt eines ebenen gleichseitigen Dreiecks, die C-C-C-Winkel betragen daher 60o, was eine beträchtliche Abweichung von 109.5o bedeutet. Ausserdem stehen alle Wasserstoffatome ekliptisch zueinander. Cyclopropan ist weitaus instabiler, als man es für ein Molekül mit drei Methylengruppen erwarten sollte : Alle drei C-C Bindungen sind gebogen (Orbitalwinkel 104o), obwohl die Überlappung genügend gross ist um zu einer Bindung zu führen. Die Bindungsdissoziationsenergien (C-C) = 272 KJ/mol (65 Kcal/mol) sind relativ schwach (reaktiver!). Die Struktur von Cyclobutan zeigt, dass das Molekül nicht eben, sondern gefaltet ist. Die Spannung, die durch die acht ekliptisch stehenden Wasserstoffatome entsteht, wird hierdurch teilweise verringert : Man könnte erwarten, dass Cyclopentan eben gebaut ist, da die Winkel in einem regelmässigen Fünfeck 108o betragen. Eine solche planare Anordnung wäre jedoch mit zehn ungünstigen ekliptischen H-H Wechselwirkungen verbunden. Dies wird duch Falten des Ringes umgangen (envelope "Briefumschlag" Struktur): Der Cyclohexanring ist eine der am häufigsten vorkommenden und wichtigsten Struktureinheiten in der Organischen Chemie. Ein hypothetisches ebenes Cyclohexan enthielt zwölf ekliptische H-H Wechselwirkungen und eine sechsfache Winkelspannung. Es gibt jedoch eine nahezu spannungsfreie Konformation des Cyclohexan : eine Sesselkonformation Methylengruppen sind als gauche-Substituenten der benachbarten C-C-Bindung anzusehen. Ein antiKonfomer ist in einem Sechsring nicht möglich : Konfomer ist in einem Sechsring nicht möglich : Sechs C-H Bindungen stehen parallel zu der Drehachse des Moleküls, und werden als axial bezeichnet. Die anderen sechs stehen senkrecht zu dieser Achse - sie werden äquatorial genannt : Es gibt noch weitere (weniger stabile) Konformationen des Cyclohexans. Eine von ihnen ist die Wannen- (Boot-) Form: Sie ist 30 KJ/mol energiereicher als die Sesselform. Rotiert man eine der C-C Bindungen des Ringes relativ zu der benachbarten, stabilisiert sich die Konformation etwas, weil die Wechselwirkungen zwischen den inneren Wasserstoffatomen aufgehoben werden. Diese neue Konformation bezeichnet man als Twist-Form ( 23 KJ/mol energiereicher als die Sesselform). Cyclohexan ist kein starres Gebilde ! Es gibt nur ein Isomer von Methyl- oder Brom-cyclohexan (nicht zwei : axial vs. äquatorial). Eine Sesselkonformation geht in die andere über, wodurch axiale und äquatoriale Wasserstoffatome ihre Positionen tauschen, d.h. dass beim Umklappen des Ringes alle axialen Wasserstoffatome zu äquatorialen werden und umgekehrt : (a,a) ==> (e,e) cyclohexan1.pdb cyclohexan2.pdb Die Aktivierungsenergie für diesen Prozess beträgt 45.2 KJ/mol (klein genug, dass sich die beiden Sesselformen bei RT ausserordentlich schnell ineinander umlagern). In der folgenden Animation kann man die potentielle Energie und Konformationsänderung des Cyclohexanmoleküls während des Umklappvorgangs verfolgen. Mit Hilfe der Kontrollfelder (links unten) kann die Animation gestoppt bzw. einzelne Konformationen separat betrachtet werden. (© Ian Hunt, University of Calgary) Im Methylcyclohexan kann die Methylgruppe entweder eine äquatoriale oder eine axiale Position einnehmen : Beim äquatorialen Konformer ragt die Methylgruppe in den Raumbereich, in dem sich keine anderen Teile des Moleküls befinden, während im axialen Konformer der Methylsubstituent gauche zu zwei C-C Bindungen und sehr nahe bei zwei axialen Wasserstoffatomen auf derselben Seite des Ringes steht ; bezeichnet als 1,3-diaxiale Wechselwirkungen. Beide Sesselformen von Methylcyclohexan stehen miteinander im Gleichgewicht, wobei das äquatoriale Konformer im Verhältnis 95:5 begünstigt ist. Die freie Enthalpiedifferenz, ∆Go, zwischen dem axialen und dem äquatorialen Isomer ist bei vielen monosubstituierten Cyclohexanen gemessen worden (Vgl. Tabelle unten). Unterschiede in der freien Enthalphie zwischen axialen und äquatorialen Konformeren des Cyclohexans (bei allen Beispielen ist die äquatoriale Form stabiler) Substituent ∆Go/(kJ/mol) Substituent ∆Go/(kJ/mol) H- 0 F- 1.05 CH3- 7.12 Cl- 2.18 CH3CH2- 7.33 Br- 2.30 (CH3)2CH- 9.21 I- 1.93 (CH3)3C- ~38 HO- 3.94 -COOH 5.90 CH3O- 3.14 -COOMe 5.40 H2N- 5.86 Anmerkung:Da ∆Go = -RTlnKeq gilt, bedeutet ∆Go = 5.4 kJ/mol 90% des stabileren Isomers bzw. ∆Go = 11.3 kJ/mol 99% liegen vor. In vielen Fällen (aber nicht in allen) nimmt der Energieunterschied zwischen beiden Formen mit der Grösse des Substituenten zu. Mit tBu-Cyclohexan ist der Energieunterschied so gross, dass nur ein geringer Anteil (0.01%) des axialen Isomers in Lösung vorliegt (Der tert-Bu Substituent fixiert die Konformation). 2.8 Mehrfach-Substituierte Cyclohexane Bei disubstituierten Cyclohexanen ist allgemein die Konformation mit der grössten Zahl von äquatorialen Substituenten die bevorzugte, z.B.: 1,2-Dimethylcyclohexan 1,3-Dimethylcyclohexan und 1,4-Dimethylcyclohexan ? Betrachten wir nun ein Cyclohexan mit zwei unterschiedliche Substitueten - cis- und trans-1-Brom-3Methylcyclohexan : die stabilsten Konformationen ? 2.9 Polycyclische Alkane Im Decalin-Molekül teilen zwei Cyclohexanringe zwei Kohlenstoffatome miteinander, beide Ringe sind kondensiert oder anneliert ; Steroide kommen häufig in der Natur vor, und eine Reihe von Steroiden wirken als Hormone. z.B.: Inhalt Index