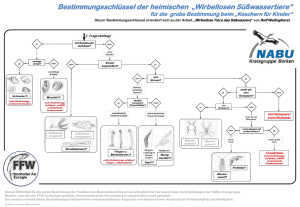
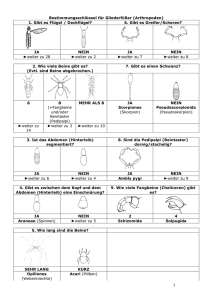
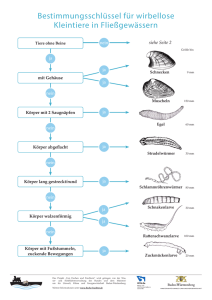
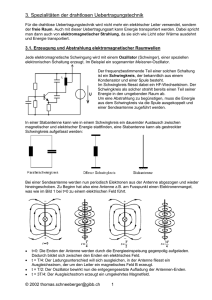
Schlupfwespen der Schweiz - Naturhistorisches Museum Bern
Werbung

Schlupfwespen der Schweiz Systematik, Biologie, Diversität, Bestimmung Hannes Baur & Seraina Klopfstein P. Vonlanthen Naturhistorisches Museum der Burgergemeinde Bern Inhaltsverzeichnis Was sind Schlupfwespen? 3 Biologie von Schlupfwespen 6 Diversität von Schlupfwespen 18 Fang, Präparation und Konservierung 19 Bestimmungsschlüssel zu den Schlupfwespenfamilien der Schweiz 24 Katalog der Schlupfwespenfamilien der Schweiz 46 Literaturverzeichnis 82 Appendix: Hersteller und Produkte 85 Glossar 86 Dank Wir danken Yvonne Kranz-Baltensperger (Naturhistorisches Museum Bern) für die Durchsicht des Manuskripts und Wolfgang Nentwig (Zoologisches Insititut, Universität Bern) für die Unterstützung bei der Organisation des Kurses Anschrift der Autoren Hannes Baur & Seraina Klopfstein Abteilung Wirbellose Tiere Naturhistorisches Museum Bernastrasse 15 3005 Bern, Schweiz E-Mail: [email protected] E-Mail: [email protected] 2007, Naturhistorisches Museum Bern; Version 3 Dieses Skript ist unpubliziert und darf nicht in wissenschaftlichen Publikationen zitiert werden Einführung Was sind Schlupfwespen? Stellung im taxonomischen System Zu den Hautflüglern (Hymenoptera) gehören alle holometabolen Insekten mit beissenden Mundwerkzeugen und zwei Paar häutigen Flügeln. Ein diskretes, aber phylogenetisch wichtiges Merkmal sind die winzigen Häckchen am vorderen Rand des Hinterflügels, die sogenannten Hamuli, welche im Flug am Vorderflügel eingehängt werden. Innerhalb der Hautflügler lassen sich drei grosse Gruppen unterscheiden: – die meist phytophagen Pflanzenwespen (Symphyta), denen die für die beiden nächsten Gruppen charakteristische Wespentaille fehlt; – die artenreichen Schlupfwespen (Parasitica) (Abb. 1), von denen sich die allermeisten als Parasitoide entwickeln (siehe unten); – und schliesslich die wohlbekannten Stechimmen (Aculeata), zu denen Bienen, Ameisen, Faltenwespen, aber auch Gold-, Weg- und Grabwespen gehören. Abb. 1. Männchen von Megarhyssa rixator, einer charakteristischen Schlupfwespe von im Holz lebenden Pflanzenwespen. R. Burri. Einführung Während der Legebohrer der Pflanzenwespen dazu dient, Eier ins Innere von Pflanzenteilen einzustechen, benutzen die Schlupfwespen ihn für die Eiablage in oder neben den Wirt. Bei den Stechimmen ist dieser Legebohrer zu einem Stechapparat umgewandelt, der mit Giftdrüsen in Verbindung steht. Er wird nicht mehr zur Eiablage verwendet. Dieser Abwehrstachel ist ein abgeleitetes (apomorphes) Merkmal der Stechimmen, welche u.a. dadurch als eine natürliche Abstammungseinheit angesehen werden. Sie werden dementsprechend auch als monophyletisch bezeichnet. Die Schlupfwespen weisen dagegen nur ursprüngliche (plesiomorphe) Merkmale auf, d.h. es fehlen ihnen die abgeleiteten Merkmale der Stechimmen. Sie sind daher paraphyletisch, wobei die Ichneumonoidea (Echte Schlupf- und Brackwespen) wahrscheinlich die ­Schwestergruppe der Aculeata sind. Ansonsten sind viele verwandtschaftliche Beziehungen innerhalb der Parasitica noch ungeklärt (vgl. Abb. 2). Begriff «Parasitoid» Parasitoide sind dadurch gekennzeichnet, dass sich ihre Larven parasitisch an oder in anderen Insekten, seltener in anderen Arthropoden (z.B. Spinnen, Tausendfüssler, Asseln etc.) entwickeln. Eine Parasitoidenlarve benötigt meist nur ein einziges Wirtsindividuum zu ihrer Entwicklung und fast immer wird der Wirt durch die Schmarotzerlarve abgetötet. Man bezeichnet deshalb die Parasitoide auch als «Raubparasiten», da sie eine Mittelstellung zwischen typischen Räubern Symphyta (Pflanzenwespen) Cynipoidea Heloridae Proctotrupidae Vanhorniidae Pelecinidae Mymarommatoidea Chalcidoidea Platygastroidea Roproniidae Maamingidae Diapriidae Austroniidae Monomachidae Trigonaloidea Megalyroidea Evanioidea Ceraphronoidea Stephanoidea Ichneumonoidea Aculeata (Stechimmen) Abb. 2. Stammbaum der Hymenopteren, mit Schwerpunkt bei den Parasitica. Die fett gedruck­ ten Taxa kommen auch bei uns vor. Zu beachten sind die vielen Polytomien an der Basis des Stammbaums. Nach Ronquist (1999), Dowton & Austin (2001) und Sharkey & Roy (2002). Einführung (Prädatoren) und echten Parasiten einnehmen. Typische Parasiten (z.B. Tierläuse) töten nämlich in der Regel den Wirt nicht, sondern haben im Gegenteil ein Interesse daran, dass er möglichst lange überlebt, damit ihn noch weitere Generationen von Parasiten nutzen können. Die Imagines von Parasitoiden sind, anders als die Larven, oft Vegetarier und ernähren sich von Nektar, Pollen, Honigtau und Pflanzensäften. Häufiger als früher angenommen kommt das sogenannte «host feeding» (direkt übersetzt: «Wirts-Fressen») vor. Dabei wird der Wirt vom Schlupfwespenweibchen angestochen und die austretende Haemolymphe aufgesogen, um so den ­Eiweissbedarf für die Eireifung zu decken. Die parasitoide Lebensweise findet sich quer durch die Ordnungen der Insekten hindurch, wo sie jeweils unabhängig (konvergent) entstanden ist. Schätzungen gehen davon aus, dass etwa ein Viertel aller ­Insektenarten sich als Parasitoide entwickeln. Am meisten ins Gewicht fallen dabei die artenreichen Schlupfwespen (Parasitica), aber selbst bei einigen Stechimmen (Aculeata) und Pflanzenwespen (Symphyta, Abb. 3) ist diese Lebensweise anzutreffen. Bei uns weit verbreitet sind auch die Raupenfliegen, deren Larven sich in Schmetterlingsraupen entwickeln, und die häufig mit verschiedenen Schlupfwespenarten in Konkurrenz um die Wirte leben. Ebenfalls als Parasitoide entwickeln sich die zu den Netzflügler gehörenden Fanghaften (Mantispidae), deren Larven sich meist in einer Zwischenform zwischen räuberischer und parasitoider Lebensweise in den Eikokons von Spinnen entwickeln. Auch bei den Käfern ist innerhalb verschiedener Familien eine parasitoide Lebensweise entstanden. So entwickeln sich die Larven der Ölkäfer als Brutparasiten von solitären Bienenarten. Ganz der parasitoiden Lebensweise verschrieben haben sich die ­Fächerflügler (Strepsiptera). Bei den auch bei uns beheimateten Arten der Gattung Stylops werden die vivipar geborenen Primärlarven, die gut beweglich sind, auf Blüten abgelegt. Dort warten sie auf ein Wespen-, Grabwespen- oder Bienenweibchen und lassen sich von ihm zum Nest transportieren (Phoresie), wo sie sich endoparasitisch in der Brut der Stechimmen entwickeln. Im Puppenstadium des Wirtes bewegen sie sich ins Abdomen, wo die Stylops-Weibchen auch ihr restliches Leben lang bleiben – zur Eiablage und Begattung stossen sie einfach ihren Hinterleib durch die Intersegmentalhäute des Wirtes. Abb. 3. Ein Vertreter der Orussiden, der Schwestergruppe der Taillenwespen (Apocrita). Obwohl noch keine «richtige» Schlupfwespe, entwickeln sie sich als Parasitoide von Holzinsekten. Biologie Biologie von Schlupfwespen So artenreich die Parasitica sind, so vielfältig ist auch ihre Biologie. Somit kann dieses Skript nur eine flüchtige Idee von der Vielfalt und Komplexität der Lebensweise dieser Gruppe geben und nur einen Einblick in deren Evolution gewähren. Zum vertieften Studium sei auf die Literatur­ verzeichnis am Ende dieses Skripts verwiesen. Obschon die parasitoide Lebensweise klar den Grundtyp darstellt, können auch sekundär phytophage Arten sowie diverse Zwischenstadien zwischen parasitoider und phytophager Lebensweise sowie zwischen parasitoider und räuberischer Lebensweise gefunden werden. So ernähren sich z.B. viele Parasitoide von Solitärbienen erst einmal von der Larve des Wirtes, also parasitoid. Später jedoch verzehren sie auch noch die Pollenvorräte, welche die Biene zur Aufzucht der Larve in die Brutzelle eingetragen hat. Weiter müssen die Schlupfwespen, welche sich in den Kokons von Spinneneiern entwickeln, als einfache Räuber angesehen werden. Auch innerhalb der parasitoiden Lebensweise gibt es wieder die verschiedensten Möglichkeiten, auf welche in den folgenden Kapiteln näher eingegangen wird. Weiter wird die Wechselbeziehung zwischen Wirt und Parasitoid näher erörtert. Auch der Fortpflanzungsbiologie der Parasitica und ihren Lebensräumen wird ein Unterkapitel gewidmet. Schliesslich soll noch auf die ökonomische Relevanz dieser Gruppe eingegangen werden. Endo- und Ektoparasitismus, Koino- und Idiobiontie Bei der Kategorisierung der parasitoiden Lebensweise haben sich vor allem die Einteilung in Endo- und Ektoparasitoide sowie in Koinobionten und Idiobionten durchgesetzt. Diese Begriffe sind im folgenden näher erläutert. Endo- und Ektoparasitoiden Als Endoparasitoiden bezeichnet man diejenigen Schlupfwespen, welche ihre Larvalentwicklung im Innern des Wirtskörpers, z.B. in einer Raupe oder Puppe (Abb. 4), abschliessen. Im Gegensatz Abb. 4. Eine Brachymeria femorata (Chalcididae) beim Schlupf aus einer Puppe des Baumweiss­ lings. Viele Chalcididae sind Endoparasitoide von Schmetterlingsraupen und Puppen. F. Amiet. Biologie dazu entwickeln sich Ektoparasitoide ausserhalb des Wirtes und konsumieren dessen Hämolymphe von aussen her. Wenigstens innerhalb der Schlupfwespen stellt die ektoparasitoide Lebenweise wahrscheinlich die ursprüngliche Form dar, während der Endoparasitismus mehrfach aus ektoparasitischen Formen hervorgegangen ist. Sehr häufig bevorzugen Ektoparasiten versteckt lebende Wirte wie zum Beispiel xylophage Käfer oder Holzwespen, Bewohner von Gallen (Abb. 14, S. 64) oder Käfer und Schmetterlinge, die sich in Blattrollen entwickeln. Endoparasiten wiederum sind häufiger auf freilebenden Wirten anzutreffen. Hier gibt es aber zahlreiche Ausnahmen und Übergänge. Idiobionten und Koinobionten Ein weiteres wichtiges Einteilungskriterium ist, wie weit der Parasitoid eine Weiterentwicklung des Wirts zulässt. Bei den Idiobionten stoppt die Entwicklung des Wirts in dem Moment, wenn das Parasitoidenei in oder an ihm abgelegt wird. Meist geschieht dies, indem das Parasitoidenweibchen den Wirt durch ein Gift paralysiert, oder indem die Parasitoidenlarve chemische Stoffe abgibt, welche die Wirtsentwicklung hemmen. Bei den meisten Idiobionten geschieht danach die Larvalentwicklung des Parasitoiden sehr rasch. Koinobionten andererseits lassen eine weitere Entwicklung des Wirtes meist über mehrere Stadien hinaus zu, und töten ihn erst bei Erreichen einer bestimmten Grösse resp. eines bestimmten Stadiums ab, z.B. nach der Verpuppung. In der Regel leben Ektoparasitoide idiobiontisch – dies, um möglichen Attacken durch den Wirt zu entgehen oder dem Abfallen während dessen Häutung vorzubeugen. Endoparasiten sind andererseits meist Koinobionten, da eine exponierte Lebensweise bei bewegungsaktiven Wirten risikoreich sein kann. Wie fast immer in der Ökologie gibt es auch hier zahlreiche Ausnahmen und Übergangsformen. Weitere Kategorien der parasitoiden Lebensweise Es gibt zahlreiche weitere Möglichkeiten, die parasitoide Lebensweise einzuteilen, sei es nach befallenen Wirtsstadien, Anzahl der pro Wirt abgelegten Eier oder auch Zustand des Wirts im Moment der Parasitierung. Einteilung nach Wirtsstadien Die Eiparasitoide schliessen ihre gesamte – meist recht kurze – Larvalentwicklung im Ei des Wirtes ab, aus welchem sie dann auch schlüpfen. Zu ihnen gehören die kleinsten bekannten Insektenarten. Die zahlreichen Larvenparasitoide befallen frühe oder auch späte Larvalstadien, wobei sie auch über mehrere Häutungsstadien hinweg am oder im Wirt bleiben können. Larven-Puppen-Parasitoide hingegen legen ihre Eier in ein frühes oder spätes Larvalstadium des Wirtes, die Parasitoide warten dann aber ab, bis der Wirt sich zur Puppe entwickelt, und schliessen ihre Entwicklung erst in diesem Stadium ab. Durch ihren langen Wirtskontakt steigt die Gefahr, dass das Immunsystem des Wirts sich erfolgreich gegen sie zur Wehr setzt oder, im Falle von Ektoparasitoiden, dass sie vom Wirt abgestreift werden. Reine Puppenparasitoide müssen zwar weniger grosse Anpassungen entwickeln, um dem ­Immunsystem des Wirtes zu entgehen, aber sie verwenden dafür grösseren Aufwand darauf, die unbeweglichen und häufig gut verborgenen Puppen aufzuspüren. Schliesslich sind auch Imaginal-Parasitoide bekannt, die sich also auf dem adulten Wirt entwickeln. Als Beispiel seien die Spinnenparasitoide Polysphincta und Zaglyptus aus der Familie der Ichneumonidae und der Borkenkäferparasitoid Tomicobia seitneri (Pteromalidae, Abb. 5 nächste Seite) genannt. Biologie Solitär- und Gregärparasitoiden Ausser nach Wirtsstadien kann man die Parasitoide auch danach einteilen, ob sie für die erfolgreiche Entwicklung ein gesamtes Wirtsindividuum brauchen (Solitärparasitoide), oder ob sich gleich mehrere Geschwister vom selben Wirt ernähren (Gregärparasitoide). Im Falle der gregären Entwicklung gibt es die Möglichkeit, dass das Weibchen gleich mehrere Eier in den Wirt ablegt, oder dass sich im Innern des Wirts aus einem einzigen Ei durch Teilung und durch Aufnahme von Nährstoffen aus der Wirtshämolymphe bis zu 2000 Parasitoiden-Embryonen entwickeln (Polyembryonie). Weitere Formen der parasitoiden Lebensweise Eine weitere Einteilung richtet sich nach dem Zustand des Wirtes bei der Parasitierung. Der einfachste Fall ist der eines Primärparasitoiden, welcher einen noch unbefallenen Wirt befällt. ­Sekundärparasitoide hingegen befallen – fakultativ oder auch obligatorisch – bereits von einem Primärparasitoiden befallene Wirte, eine Entwicklungsweise, welche auch als Hyperparasitismus bezeichnet wird. Unter Kleptoparasitismus versteht man, wenn eine Parasitoidenart nicht (mehr) fähig ist, selbstständig einen Wirt zu belegen, sondern auf eine vorangehende Parasitierung angewiesen ist. Dies kann sein, weil das Parasitoidenweibchen selbst keine Wirte finden kann, sondern auf Duftspuren von anderen Parasitoiden angewiesen ist. Andere Arten verfügen selbst nicht über die Möglichkeit, das Immunsystem des Wirtes zu umgehen, und können deshalb nur bereits parasitierte und dadurch geschwächte Wirte befallen. Ein Beispiel für die kleptoparasitische Lebensweise liefert die weiter unten vorgestellte Pseudorhyssa alpina. Abb. 5. Ein Weibchen von Tomicobia seitneri (Pteromalidae) ist soeben aus einem Buchdrucker Ips typographus geschlüpft. Man beachte das runde Loch am Hinterende des Borkenkäfers! Parasitoide von Adultstadien bilden bei Schlupfwespen eher die Ausnahme. B. Fecker. Biologie Wirtsspektren und Spezialisierung Wirte der Schlupfwespen Als Wirte von Schlupfwespen kommen in erster Linie Insekten und in zweiter Linie weitere Arthropoden (z.B. Spinnen, Tausendfüßler, Asseln etc.) zum Zuge. Auffällig ist, dass holometabole Insekten, also solche, welche ein Puppenstadium einschalten, weit häufiger befallen werden als hemimetabole Insekten. Dies könnte darauf zurückzuführen sein, dass das Puppenstadium mit seiner grundlegenden Umgestaltung der gesamten Morphologie und auch Physiologie ein Schwachpunkt in der Entwicklung darstellt, der einfach von Parasitoiden ausgenutzt werden kann. Dafür sprechen auch die zahlreichen Puppen- oder Larven-Puppen-Parasitoide. Die absolute Mehrheit der Wirtsnachweise stammt aus der Gruppe der Schmetterlinge und Nachtfalter (Lepidoptera). Sicher weist diese Gruppe eine sehr hohe Dichte an Parasitoiden auf; man muss aber auch beachten, dass Lepidopteren zu den am häufigsten gezüchteten Insekten gehören und dadurch unser Wissen über ihre Parasitoide im Vergleich zu anderen Gruppen sehr gross ist. So fehlen selbst für den Grossteil der europäischen Parasitoidenarten jegliche Wirtsnachweise. Spezialisierung Es gibt verschiedene Gründe, weshalb ein Parasitoid sich an seinen Wirt anpassen und damit ­spezialisieren muss (z.B. Scelioniden, Abb. 6). Einerseits sind gerade Endoparasitoide den Attacken des Immunsystems des Wirtes ausgesetzt und müssen sich auch sonst physiologisch auf Abb. 6. Scelioniden sind obligate Eiparasitoide, z.B. wie hier von Wanzeneiern. F. Amiet. Biologie den Wirt einstellen, um zum Beispiel die eigene Entwicklung im richtigen Moment bremsen oder beschleunigen zu können. Viele Parasitoide beeinflussen die hormonelle Entwicklung ihres Wirtes sogar so stark, dass sie die Steuerung von Häutungs- oder Verpuppungszeitpunkt vollständig übernehmen. Andere verleiten ihre Wirte zu kompleten Verhaltensänderungen. Ein Beispiel bilden Spinnen, die unter dem Einfluss des Parasitoiden völlig anders geformte Netze spinnen, in welchen sich der Parasitoid nach dem Tod der Wirtsspinne verpuppt. Ausser wegen des direkten, zum Teil sehr engen Kontakts zu ihrem Wirt müssen sich Parasitoide auch aufgrund der Wirtsfindung spezialisieren. So können sich viele Arten im Labor auch auf Wirten entwickeln, welche sie im Freiland gar nie parasitieren – aus dem einfachen Grund, weil sie sie nie finden würden. Und schliesslich müssen die Parasitoide sich in ihrer Phänologie, d.h. ihrer Entwicklung im Jahresverlauf so auf den Wirt einstellen, dass rechtzeitig mit dem Erscheinen des optimalen Wirtsstadiums legebereite Parasitoidenweibchen vorhanden sind. Häufig beobachtet man, dass Parasitoide ihre Generationenzahl pro Jahr der des Wirtes anpassen, oder aber – bei polyphagen Arten – dass sie im Jahresverlauf den Wirt wechseln. In jedem Fall ist eine möglichst exakte Synchronisierung nötig. Natürlich ist auch bei der Spezialisierung das Spektrum wieder sehr weit. Einige Arten sind monophag, das heisst, sie entwickeln sich nur auf einer einzigen Wirtsart oder -gattung. Als oligophag bezeichnet man Parasitoide, deren Wirtsspektrum mehrere Gattungen einer Familie mit einschliesst. Polyphage Parasitoide schliesslich verfügen über ein breites Spektrum an Wirten, welches sogar Wirte aus verschiedenen Ordnungen umfassen kann. Bei dieser Einteilung in Mono-, Oligo- und Polyphagie wird primär die systematische Stellung der Wirte zueinander in Betracht gezogen. Gerade bei verschiedenen Ektoparasitoiden scheinen aber Einschränkungen bei der Wirtsfindung eine grössere Rolle zu spielen als physiologische Anpassungen. So befallen gewisse Ektoparasitoide nur Wirte, die sich ökologisch sehr ähnlich sind, die aber durchaus aus verschiedenen Familien oder gar Ordnungen stammen können. Als Beispiele seien Parasitoide von Gallbewohnern oder von Wirten in Blattrollen genannt (vgl. auch Abb. 7). Hier handelt es sich also um eine ökologische Spezialisierung. Abb. 7. Dieser Thektogaster sp. (Pteromalidae) ist mit wenigen Enzianarten assoziert. H. Baur. 10 Biologie Porträts einiger Schlupfwespen Ohne Anspruch auf Vollständigkeit oder auch nur Repräsentativität werden hier einzelne Parasitoidenarten und ihre Lebensweise näher vorgestellt. Die Lagererzwespe Lariophagus distinguendus Wenn bei einer umfangreichen Insektengruppe wie den Schlupfwespen, wo oft nicht einmal Taxa der Familienebene über Trivialnamen verfügen, eine einzelne Art zu solchen Ehren kommt, dann muss sie schon etwas Besonderes sein. Bei der Lagererzwespe, wissenschaftlich Lariophagus distingendus (Pteromalidae), kommt dies wohl daher, dass sie schon lange als Haustier von angewandten Entomologen gehalten wird. Die Art entwickelt sich als Ektoparasitoid an Larven diverser Käfer, darunter einigen wichtigen Getreideschädlingen, z.B. dem Kornkäfer Sitophilus granarius oder dem Tabakkäfer Lasioderma serricorne. Diese entwickeln sich in den Getreidekörnern und richten durch Frass und Verunreinigungen grossen Schaden an. Den Forschern ist schon früh aufgefallen, dass es sich bei der Lagererzwespe um einen sehr effizienten Gegenspieler handelt. In Lagerhäusern ausgesetzt, kann Lariophagus nahezu 100% der Wirte eliminieren. Dabei werden in den Silos auch mehrere Meter weit entfernte Käferlarven zielstrebig aufgespürt. Zur Orientierung dient der Geruch von Kotspuren. Bei der Eiablage wird der Wirt durch das Korn hindurch zuerst kurz angestochen und sofort gelähmt. Anschliessend prüft die Wespe die Grösse und das Gewicht des Wirtes, wobei dieser mit dem äussert beweglichen Legebohrer abgetast und zwischendurch sogar angehoben wird. Je nach Qualität wird ein männliches oder weibliches Ei aussen an die Larve gelegt. Vor oder nach der Eiablage kommt es oft auch zu «Host feeding». Da sich der Wirt jedoch innerhalb des Korns befindet, kann die Hämolymphe nicht einfach aufgeleckt werden. Während des Anstichs scheidet das Weibchen deshalb ein Sekret aus, welches am Legebohrer entlang hinunterrinnt und nach kurzer Zeit erstarrt. Danach wird der Legebohrer sorgfältig herausgezogen, wobei eine Art Trinkhalm für eine Verbindung zwischen dem Wirt und der Aussenseite des Korns sorgt. Am äusseren Ende dieser «feeding tube» beginnt die Wespe sogleich die austretende Körperflüssigkeit aufzulecken. Erst kürzlich konnte die Lagererzwespe ihre Nützlichkeit erneut unter Beweis stellen. In einem speziellen Einsatz, der viel mediales Aufsehen erregte, wurde die Wespe zur Schädlingsbekämpfung in Kulturgut eingesetzt. Nachdem festgestellt wurde, dass sich Holzwürmer (Larven von Pochkäfern der Familie Anobiidae) am Cranacher-Altar im Erfurter Dom zu schaffen machten, konnte Lariophagus auch hier die Schädlinge weitgehend dezimieren. Seither wird für den Erfurter Dom die Ansiedlung einer permanenten Lagererzwespenpopulation in Erwägung gezogen. Die Echte Schlupfwespe Ichneumon eumerus Wie zahlreiche andere Arten der riesigen Familie der Ichneumonidae (Echte Schlupfwespen) entwickelt sich auch Ichneumon eumerus auf Schmetterlingen, genauer auf dem Ameisen-Bläuling Maculinea rebeli. Dieser Bläuling lebt assoziiert mit Ameisen, von welchen sich die junge Maculinea-Raupe sozusagen adoptieren lässt. Die Ameisen füttern und beschützen die Raupe, als gehörte sie zur eigenen Brut, was auf einer sehr komplexen chemischen Täuschung der Ameisen durch die Schmetterlingsraupe beruht. Die Ichneumon eumerus-Weibchen suchen nun zielstrebig diejenigen Ameisennester auf, in welchen sich eine oder mehrere Maculinea-Raupen eingenistet haben. Sie scheinen sich dabei praktisch nie zu täuschen! Dann produzieren sie spezielle chemische Stoffe, welche die Ameisen dazu bringen, statt die Schlupfwespe einander gegenseitig anzugreifen. So kann die Wespe ungehindert zu den tief im Nest verborgenen Maculinea-Raupen vordringen und sie mit einem Ei belegen. Dieses entwickelt sich im Innern der Raupe weiter, und schliesslich schlüpft aus der Maculinea-Puppe statt einem Schmetterling die ausgewachsene Wespe. 11 Biologie Der Hyperparasitoid Trigonalis hahnii Die auch in der Schweiz vorkommende Art Trigonalis hahnii muss als obligatorischer Hyperparasitoid angesehen werden. Die Weibchen sind ungemein fruchtbar und legen ihre etwa 0,1 mm langen, hartschaligen Eier auf die Unterseite von Blättern ab, wo sie wochenlang verbleiben können, ohne dass Larven schlüpfen. Eine Weiterentwicklung erfolgt nur, wenn die Eier von einer Schmetterlingsraupe gefressen werden und dadurch die Eihülle gesprengt wird. Sie schlüpfen darauf im Darm, von wo aus die Junglarven in die Leibeshöhle der Raupen einwandern. Ist der Primärwirt bereits durch eine Schlupfwespenlarve parasitiert, so bohrt sich die Trigonalis-Junglarve nun in den Sekundärwirt ein, um dort ihre Weiterentwicklung aufzunehmen, sobald die Primärparasitenlarve erwachsen ist und den Wirt abgetötet hat. Handelt es sich jedoch um eine unparasitierte Wirtsraupe, so wartet die Trigonalis-Larve, bis erstere von einem Primärparasiten befallen wird. Wenn das nicht der Fall ist, stirbt sie später ab. Eine erfolgreiche Entwicklung kann also nur im Sekundärwirt durchlaufen werden, wobei die ersten drei Larvenstadien sich endoparasitisch in der Ichneumoniden-Larve entwickeln. Der Kleptoparasitoid Pseudorhyssa alpina Die seltene Schlupfwespe Pseudorhyssa alpina taucht immer nur dort auf, wo auch die häufigere Rhyssa persuasoria, die Riesenholzschlupfwespe (Abb. 8) vorkommt. Rhyssa persuasoria bohrt mit ihrem mehr als körperlangen Legebohrer ein Loch ins Holz von Nadelbäumen, um so an die tief im Holz lebenden Holzwespenlarven zu gelangen. Diese werden vom Rhyssa-Weibchen mit einem Stich gelähmt, und ein Parasitoidenei wird am Wirt abgelegt. Die daraus schlüpfende Rhyssa-Larve ernährt sich ektoparasitisch von der Holzwespenlarve. Hat aber ein Pseudorhyssa-Weibchen die Eiablage beobachtet, sucht es nach dem Verschwinden der Rhyssa die Bohrstelle auf und führt den eigenen, sehr dünnen und instabilen Legebohrer durch das vorgebohrte Loch ein. Aus dem Ei, welches die Pseudorhyssa legt, schlüpft sogleich die Larve, welche vergrösserte Mandibeln aufweist und das Rhyssa-Ei oder die noch kleine Rhyssa-Larve sehr schnell ausschaltet. Dann ernährt sie sich von der bereits gelähmten Holzwespenlarve.­ Abb. 8. Die Riesenholzschlupfwespe Rhyssa persuasoria bei der Eiablage. R. Burri. 12 Biologie Wirt-Parasitoid-Interaktionen Die Beziehung zwischen Wirt und Parasitoid ist ausgesprochen komplex und schliesst Auswirkungen auf den verschiedensten Ebenen ein – Populationsdynamik, Phänologie, Morphologie, Physiologie, Evolution etc. Hier werden nur einige Aspekte beleuchtet. Immunabwehr und deren Umgehung Insbesondere Endoparasitoide sind mit dem Immunsystem des Wirtes konfrontiert. Die häufig erfolgreiche Strategie des Wirts besteht dabei in der Abkapselung des Parasitoiden-Eis oder auch der jungen Larve. Dabei umschliessen zuerst koagulierende Komponenten der Haemolymphe den Parasitoiden, worauf die Haemocyten eine Hülle bilden, die sich durch Melanisierung meist zu einer harten Kapsel verfestigt. Diese Form der Immunabwehr kann hochspezifisch nur gegen einen bestimmten Parasitoiden oder gar nur gegen eines seiner Stadien gerichtet sein, wobei bisher noch unbekannte Erkennungsmoleküle zum Zug kommen. Es sind zahlreiche Fälle von erfolgreicher Abwehr des Parasitoiden durch das Immunsystem des Wirtes bekannt, selbst wenn es sich beim Parasitoiden um einen Spezialisten handelt. Trotzdem erreichen (erfolgreiche) Parasitierungsraten im Feld häufig auch sehr hohe Prozentzahlen (bis hin zu 90% und fast 100% bei stark geklumptem Erscheinen der Wirte). Dies kommt dadurch, dass die Parasitoide einige Methoden entwickelt haben, um dem Immunsystem des Wirtes zu entkommen: – Vermeidung durch Attackieren von inaktiven Wirtsstadien: Wie oben bereits erwähnt, scheinen Ei- und Puppenparasitoide davon zu profitieren, dass die Immunabwehr des Wirts in diesen Stadien nicht voll funktionstüchtig ist. – Vermeidung durch Eiablage an spezifische Organe: Einige Schlupfwespen legen ihre Eier gezielt an bestimmte Organe (z.B. Nervenganglien oder Speicheldrüsen), wo sie von den Haemocyten nicht erreicht werden können. – Superparasitierung: Gerade bei gregären Parasitoiden kommt es häufig vor, dass das Parasitoiden-Weibchen mehr Eier in den Wirten legt, als sich darin schliesslich entwickeln können. Das Legen solcher überzähliger Eier schwächt das Immunsystem, und häufig werden nur einzelne Eier vollständig eingekapselt, während die anderen sich normal entwickeln. – Viren-ähnliche Partikel (VLP): In mehreren Familien der Parasitica konnten bisher Partikel von Poly-DNA-Viren festgestellt werden, welche während der Eiablage aus ovariellen Drüsen ausgeschieden werden. Diese Viroide sind nicht voll funktionstüchtig, sondern scheinen nur das Immunsystem des Wirtes zu unterdrücken. Produziert werden sie von der Wespe selbst, und die Bauanleitung hierfür wird im Wespengenom kodiert. Ob diese VLPs ursprünglich aus echten Viren hervorgegangen sind, oder ob sie eine Eigenentwicklung der parasitoiden Wespen darstellen, ist bislang nicht geklärt. Koevolution Auf die Koevolution von Wirt und Parasitoid wurde im Zusammenhang mit Immunsystem und Phänologie schon im Kapitel «Wirtsspektren und Spezialisierung» auf Seite 9 näher eingegangen. Einige spektakuläre Beispiele von paralleler Speziation, bei welcher der Artaufspaltung des Wirts eine ebensolche des Parasitoiden folgt, sind zum Beispiel von Feigenwespen (Agaonidae) und ihrer Wirtspflanze Ficus bekannt. Weitere Beispiele, vor allem natürlich innerhalb von hochspezialisierten Parasitica-Gruppen, werden wohl mit den durch die genetischen Methoden vorangetriebenen Stammbäumen bekannt werden. Behindert wird dieses Feld der Koevolutionsforschung jedoch durch das Fehlen akkurater Wirtsnachweise innerhalb vieler Gruppen. Es ist zu hoffen, dass auch auf diesem Feld in Zukunft weitere Fortschritte erzielt werden. 13 Biologie Wirtsfindung Das Auffinden geeigneter Wirte ist für die Schlupfwespe – neben der zeitlichen Synchronisation mit dem «passenden» Wirtsstadium – vor allem ein räumliches Problem. Zwar verpuppen sich viele Parasiten im engeren Habitat ihrer Wirte und die Weibchen sind dann beim Schlüpfen sozusagen gleich am richtigen Ort, aber in vielen Fällen geht die räumliche Koinzidenz durch Ortsveränderungen von Parasiten und Wirten zunächst verloren. Die Wirtsfindung ist in der Regel Aufgabe des Weibchens. Über die bei der Habitat- und Wirtsfindung wirksamen Orientierungsweisen wissen wir jedoch noch sehr wenig. Bei Fernorientierung (Habitatsuche) stehen neben abiotischen Faktoren wie Licht-, Temperatur- und Feuchte-Verhältnisse vor allem olfaktorische und visuelle Auslöser im Vordergrund. Häufig sind Parasitenarten wirtspflanzenspezifisch, wobei bei der Erkennung der einzelnen Pflanzenarten und Strukturen die geruchliche Komponente zu dominieren scheint. Für die Nahorientierung, also das Auffinden von Wirtsindividuen im Mikrohabitat, werden ­neben den Augen vor allem die reichlich mit Geruchs-Sinnesorganen (Sensillen) ausgestatteten Antennen der Parasitoide und auch Sinneshaare am Ovipositor eingesetzt. Daneben sind sicher Lernprozesse beteiligt, deren Kenntnis aber noch sehr im Argen liegt. Weiter können auch Vibrationsund Gehörsinnesorgane bei der Wirtssuche eine Rolle spielen. Dies gilt vor allem bei versteckt in Stängeln oder im Holz lebenden Wirten bzw. bei Wirten, welche Organe zur Lauterzeugung besitzen. Über eine besonders ausgeklügelte Methode verfügen einige Ichneumoniden und die zu den Blattwespen gehörenden und als Schwestergruppe der Taillenwespen (Apocrita mit Parasitica und Aculeata) angesehenen Orussidae (Abb. 3, S. 5). Sie spüren nämlich ihre versteckt im Substrat lebenden Wirte mittels Echo-Lokation auf, indem sie mit den Antennen auf die Substratober­ fläche (häufig Holz oder Pflanzenstängel) trommeln. Anhand des Echos können sie so Hohlräume resp. in Hohlräumen liegende, unbewegliche Wirte aufspüren. Die hochsensiblen Vibrations­Sinnesorgane, die zur Interpretation der Echolaute nötig sind, liegen in den Unterschenkeln der Weibchen. Fortpflanzungsbiologie Wie von den Bienen hinreichend bekannt, entwickeln sich die meisten Hymenopteren inklusive der Parasitica in einem Haplodiploid-System: Aus befruchteten Eiern schlüpfen die Weibchen, welche über einen doppelten, also diploiden Chromosomensatz verfügen, und aus den unbefruchteten Eiern die Männchen mit einfachem, haploiden Chromosomensatz. Das Legen unbefruchteter männlicher Eier muss als eine Form der Parthenogenese (Jungfernzeugung) angesehen werden, welche bei den Hymenopteren als Arrhenotokie bezeichnet wird. Der Haplodiploid-Mechanismus erlaubt es den Weibchen, über das Geschlecht ihrer Nachkommen im Moment der Eiablage zu entscheiden. So ist von vielen Schlupfwespenarten bekannt, dass sie das jeweilige Wirtsindividuum nach dem Auffinden erst einmal einer genaueren Unter­ suchung unterziehen und beispielsweise Grösse und Gewicht bzw. seine Aktivität abschätzen. Je nach Wirt legen sie dann entweder ein befruchtetes oder ein unbefruchtetes Ei, wobei häufig aus grösseren Wirten Weibchen schlüpfen, für welche die Körpergrösse ein limitierender Faktor für die Fekundität ist. Bei sich gregär entwickelnden Arten, bei denen mehrere Geschwister aus demselben Wirt schlüpfen, wird häufig nur ein einzelnes, unbefruchtetes und damit männliches Ei abgelegt. Dieses Männchen entwickelt sich etwas schneller als seine Schwestern, die nach der Verpuppung gleich von ihm begattet werden. In diesem Fall ist also das Geschlechterverhältnis sehr stark hin zu einem Weibchen­überschuss verschoben. 14 Biologie In Extremfällen entwickeln sich gewisse Populationen oder die gesamte Arten sogar ganz ohne den Beitrag von Männchen, indem sie zur Thelytokie, also Jungfernzeugung weiblicher Nachkommmen übergehen (z.B. bei Leucospis, Abb. 9). Dabei werden vom Weibchen Eier abgelegt, welche via verschiedene cytologische Mechanismen in den diploiden Zustand gebracht werden. Häufig ist dabei eine Form der Selbstbefruchtung, in welcher während der Meiose abgeschnürte Polkörperchen wieder mit der Eizelle verschmelzen und diese sozusagen befruchten. Dadurch wird eine Variabilität der Nachkommen aufrechterhalten, ohne unter Umständen teure Männchen zu produzieren. Neben der Kosten-Nutzen-Frage spielt auch ein Bakterium namens Wolbachia eine grosse, vielleicht sogar die Hauptrolle bei der Entstehung von thelytoken Populationen. Dieses Bakterium infisziert den Genitaltrakt von Insekten, wo es einer weit schwächeren Immunantwort ausgesetzt ist als anderswo im Körper. Die Übertragung des Bakteriums geschieht via Eizelle und nicht via Spermium, also nur durch die Mutter-Tochter-Linie. Deshalb hat Wolbachia ein Interesse daran, seinen Wirt möglichst zur thelytoken Fortpflanzung zu bringen. Das Repertoire von Wolbachia geht dabei bis hin zum selektiven Abtöten von männlichen Embryonen. Lebensräume Schlupfwespen sind in nahezu allen Lebensräumen anzutreffen, in welchen auch ihre Wirte vorkommen. Gewisse Gruppen wie die Echten Schlupfwespen (Ichneumonidae) sind stark an Feuchtigkeit (insbesondere Taubildung) gebunden und darum eher in den gemässigten Breiten als im ariden Mittelmeerraum verbreitet, und meiden häufig im Tagesverlauf die heissen Mittagsstunden. Andere wiederum brauchen eine grössere Wärmezufuhr und haben sich besser an Trockenheit angepasst, z.B. viele Erzwespen (Encyrtidae, Eurytomidae). Abb. 9. Leucospis gigas bei der Eiablage am Nest der Mörtelbiene Megachile sicula. Diese ­Leucospis pflanzt sich in einigen Regionen nur parthenogenetisch (thelytok) fort. F. Amiet. 15 Biologie Gewisse Gruppen sind vollständig an Totholz gebunden, und damit nur in Wäldern anzutreffen (z.B. Proctotrupidae, Ibalidae, Pimplinae, Rhyssinae etc.). Andere Familien wie die Pteromalidae sind typische Bewohner von offenen Habitaten. Durch die gute Flugfähigkeit der meisten Parasitica können Individuen aber manchmal auch weitab von den Habitaten der Wirte gefunden werden. Noch vor wenigen Jahren war die Ansicht weit verbreitet, dass die Schlupfwespen in den Tropen keine nennenswerte Explosion der Artenzahl aufweisen, wie man sie von anderen Gruppen (Käfer, Schmetterlinge etc.) kennt. Diese Ansicht stützte sich auf einige wenige Beobachtungen zur Artenvielfalt in den Tropen und wurde inzwischen mehrmals in Frage gestellt. Heute geht man davon aus, dass die eher geringe Zahl von Parasitoidenarten, welche man in den Tropen mit beschränktem Sammlungsaufwand fängt, rein damit zu begründen ist, dass die Individuendichte der einzelnen Art in den Tropen viel geringer ist als in den gemässigten Breiten. Dafür sprechen die weit grösseren Artenzahlen, welche in der Zwischenzeit bei aufwändigeren Sammelprojekten festgestellt wurden. Grundsätzlich kann man sagen, dass ältere Biotope häufig auch eine grössere Zahl von Parasitoidenarten aufweisen. Dies liegt daran, dass für die Koevolution von Wirt und Parasit jeweils eine gewisse Zeitspanne benötigt wird. In der Schweiz sind die alpinen Lebensräume natürlich von besonderem Interesse. Zahlreiche neue Schlupfwespen sind bereits aus dem Alpenraum beschrieben worden und viele weitere Arten sind zu erwarten. Ökonomische Relevanz Rolle der Schlupfwespen im Ökosystem Es ist sehr schwierig einzuschätzen, wie wichtig Schlupfwespen als Parasitoide und damit TopPrädatoren in unseren Ökosystemen tatsächlich sind. Klar ist jedoch, dass ihr Einfluss sehr gross sein muss. Dies bemerkt man insbesondere dann, wenn eine phytophage Art durch den Menschen in ein neues Gebiet verfrachtet wird. Dort neigt sie mangels ökologischer Gegenspieler häufig zu Massenauftreten und richtet teils grosse Schäden an. Wahrscheinlich halten also Schlupfwespen ihre Wirtspopulationen jeweils auf einem tiefen Niveau, indem bei einer grösseren Wirtsdichte oder auch lokalem Massenbefall die Parasitoidenweibchen ein leichtes Spiel beim Auffinden der Wirte haben und damit die Parasitierungsraten in die Höhe schnellen. Im Freiland beobachtete Parasitierungsraten im Bereich von 50% bis weit über 90% deuten auf einen solch grossen Effekt hin. Andererseits sind auch Beispiele bekannt, wo die Parasitoidenpopulation einen Massenausbruch des Wirtes nicht eindämmen konnte, da sie primär aus entwicklungsphysiologischen Gründen mit dem Wirt nicht Schritt halten konnte (z.B. Lärchenwickler im Kanton Graubünden). Insgesamt dürfte der Wegfall der Schlupfwespenpopulation in vielen Fällen zu unkontrollierter Vermehrung der häufig phytophagen Wirte führen. Dies wird insbesondere im Zusammenhang mit Pestiziden in der Landwirtschaft wichtig. Da Hymenopteren im allgemeinen sehr empfindlich auf Gifte aller Art reagieren, sind sie häufig die ersten, welche bei Pestizidbehandlung verschwinden. Dadurch haben z.B. Landwirtschaftsschädlinge freie Bahn. Biologische Schädlingsbekämpfung Unter biologischer Schädlingsbekämpfung versteht man einerseits das Unterstützen von natürlichen Feinden von Schädlingen (z.B. durch Ackerbrachen, die Blüten zur Ernährung der Adulttiere und Überwinterungsplätze bieten), andererseits aber auch das gezielte Freilassen von solchen 16 Biologie Nützlingen. Neben dem Einsetzen von Räubern, welche wegen ihrer meist geringen Spezialisierung auch Nicht-Zielorganismen beeinflussen können, hat sich insbesondere der Einsatz von spezialisierten Parasitoiden als zum Teil äusserst erfolgreich erwiesen. Damit die biologische Schädlingsbekämpfung erfolgreich ist und keine Nicht-Zielorganismen unter dem Einsatz zu leiden haben, müssen zuerst weitreichende Abklärungen getroffen werden. So muss die tatsächliche Wirtsspezifität des Parasitoiden überprüft werden, um zu verhindern, dass der Parasitoid später auf andere Arten übergeht. Häufig wird dies durch die meist sehr unzureichenden Kenntnisse über die jeweiligen Wirtsspektren erschwert. Weiter muss, so trivial dies tönen mag, die Identität des Parasitoiden möglichst zweifelsfrei feststehen. Aufgrund mangelhafter oder gar fehlender taxonomischer Bearbeitung in vielen Gruppen wurde dies in der Vergangenheit mehrmals unterlassen. Weiter muss man über Phänologie, Wirtsfindungsmethoden, Ausbreitungsfähigkeit und Lebensdauer der Parasitoiden Bescheid wissen, um eine möglichst hohe Parasitierungsrate der Schädlinge zu gewährleisten. Als besonders erfolgreich hat sich der Einsatz von Parasitoiden erwiesen, wenn sie in einem geschlossenen System (Schädlinge in Getreidelagern, Maisfeldern etc.) ausgesetzt wurden. Einerseits neigen die Wirte dort zu Massenvermehrung, andererseits ist die Umgebung sehr konstant, wodurch z.B. das Lernverhalten der Parasitoide stark begünstigt wird. In solch geschlossenen Systemen können die Parasitoide in gewissen Fällen den Wirt sogar ganz ausrotten. Komplexer wird die Aufgabe dann, wenn ein Parasitoid sich über längere Zeit selbst in einem Gebiet halten und als dauerhafte Kontrolle von einer Schädlingspopulation etablieren soll. Sehr erfolgreich sind hier einige Beispiele, bei denen ein Schädling in ein neues Gebiet (z.B. Kiefernblattwespen in Australien) eingeführt wurde. Während solche phytophage Insekten in ihrer ursprünglichen Heimat oft kaum auffallen, entwickeln sie sich nach einem (meist unabsichtlichen) Einführen in ein neues Gebiet manchmal zur echten Plage. Bereits in mehreren Fällen sind die natürlichen Parasitoide aus dem Ursprungsgebiet eingeführt worden und konnten sich dauerhaft etablieren. Die Gefahren, welche im Aussetzen von gebietsfremden Organismen liegen können, sind lange unterschätz worden, und viele als Nützlinge eingeführte Arten haben sich statt auf der Zielart auf anderen Arten breitgemacht und sind heute selbst Schädlinge. Prominentes Beispiel ist hier die Agakröte (Bufo marinus), die als räuberischer Gegenspieler von Arthropoden in Plantagen auf vielen Inseln und in Australien ausgesetzt wurde, und heute dort zu den berüchtigtsten Neozoen zählt. Es sind aber auch Parasitoide bekannt, welche ein zu breites Wirtsspektrum aufweisen und sich in der Folge negativ auf einige Nicht-Zielarten auswirkten. Ein gut untersuchtes Beispiel liefert die Raupenfliege Compsilura concinnata, die in Nordamerika als Gegenspieler von mehreren schädlichen Saturniiden (Pfauenspinner) eingeführt worden ist, und die nun auch bei anderen, zum Teil bedrohten Saturniiden-Arten zu grossen Ausfällen führt. Die biologische Schädlingsbekämpfung sollte also immer mit seriösen Abklärungen zu den eingesetzten Parasitoiden verbunden sein. Für die Taxonomie der parasitoiden Wespen könnten die Ansprüche der biologische Schädlingsbekämpfung zusätzliche Motivation sein, auch momentan unzureichend beachtete Gruppen genauer zu erforschen. 17 Diversität Diversität von Schlupfwespen Die Hymenopteren gehören weltweit zu den artenreichsten Insektengruppen. Schätzungen über potenzielle Artenzahlen liegen naturgemäss weit auseinander. Basierend auf Untersuchungen der Hymenopterenfauna von Costa Rica geben z.B. Gauld & Gaston (1995) eine Bandbreite von 0,3–2 Millionen Arten an. Auch wenn genaue Schätzungen derzeit nicht möglich sind, die Zahl der gegenwärtig beschriebenen Arten von über 100 000 Arten (Goulet & Huber 1993) ist gewiss bei weitem zu gering. Insbesondere Schlupfwespentaxa mit überwiegend kleinen und winzigen Arten (Chalcidoidea, Proctotrupoidea, etc.) sind nur zu einem sehr kleinen Teil taxonomisch bearbeitet. Allein bei den Chalcidoidea rechnet Noyes (2000) mit etwa dem Zwanzigfachen der ca. 22 000 beschriebenen Arten. Es ist daher leicht möglich, dass die Hymenopteren und nicht die oft zitierten, jedoch viel besser erfassten Käfer (ca. 350 000 beschriebene Arten, Grimaldi & Engel 2005) die artenreichste Gruppe unter den Insekten darstellen. Unter den Hymenopteren machen die parasitischen Wespen bei weitem den grössten Teil aus. Etwa drei Viertel der in Mitteleuropa bekannten Arten gehören in diese Gruppe, der Rest zu zwei Dritteln zu den Stechimmen (Aculeata) und zu einem Drittel zu den Pflanzenwespen (Symphyta) (Abb. 10). Trotz einer hohen Diversität und grossen Bedeutung in der angewandten Entomologie sind die Parasitica in faunistischer und taxonomischer Hinsicht nur sehr ungenügend erforscht. In Mitteleuropa sind ca. 6000 Arten bekannt, die wirkliche Zahl dürfte jedoch weit über 8000 liegen (Baur, pers. Einschätzung). In der Schweiz ist die Situation noch dramatischer: von den 6000 mitteleuropäischen Arten sind nur etwa drei Fünftel tatsächlich nachgewiesen (Abb. 10), ­wobei der Bekanntheitsgrad je nach Überfamilie unterschiedlich ist. Während artenarme Taxa fast vollständig erfasst sind, fehlen bei den artenreichen Ichneumonoidea, Chalcidoidea und Procto­trupoidea Nachweise für einen grossen Teil der Arten. Hier besteht in taxonomischer und faunistischer Hinsicht auch europaweit noch riesiger Forschungsbedarf. Über die Gründe des enormen Artenreichtums parasitischer Wespen kann nur spekuliert werden. Da in dieser Gruppe die Parasitoide dominieren, sind die Ursachen der hohen Diversität wahrscheinlich in der parasitischen Lebensweise zu suchen. Diese erfordert in der Regel eine recht starke Anpassung an die Wirte, was zu Spezialisierung mit anschliessender Artbildung geführt haben könnte. Eine Parasitierung könnte andererseits auch eine erhöhte Artbildung unter den Wirten bewirkt haben, etwa indem diese versuchen, den Parasitoiden auszuweichen. Damit ­wären neue Nischen für weitere, spezialisierte Parasitoide geschaffen. Ein solcher Prozess könnte sehr leicht zu einer hohen Diversifikation führen, zumal die Parasitoide wiederum selber Wirte von Hyperparasitoiden sind. Parasitica Aculeata Symphyta 0 2000 4000 6000 Abb. 10. Anzahl nachgewiesener Hymenopteren in der Schweiz (schwarz) und in Mitteleuropa (grau). Die Länge der schwarzen Balken zeigt an, wo bei uns Forschungsbedarf vorhanden ist. 18 Fang, Präparation, Konservierung Fang, Präparation und Konservierung Sammelmethoden Parasitische Wespen können mit verschiedenen Methoden gesammelt werden. Die wichtigsten werden hier nur kurz vorgestellt. Für weitergehende Informationen verweisen wir auf die zitierte Literatur sowie auf den Appendix mit Angaben zu Herstellern und Produkten. Mit handelsüblichen, runden Schmetterlingsnetzen können alle grösseren Arten, welche im Gelände gut sichtbar sind, eingefangen werden. Das Netz sollte leicht und handlich sein, damit man auch die flinken Arten noch erhaschen kann. Viele Parasitoide, z.B. alle Erz- und Zehrwespen sowie viele kleinere Brackwespen, sind jedoch so klein, dass sie im Feld nicht mehr von blossem Auge erkannt werden können. Hier kommt der Käscher, ein rundes oder dreieckiges Netz mit einem soliden Beutel aus feinmaschigem Stoff, zum Zug. Damit wird in regelmässigen Abständen über die Vegetation gestreift, wobei alle Insekten, die vor die Netzöffnung geraten, sozusagen blind eingesammelt werden. Nach 5–10 Schlägen muss der Netzinhalt ausgelesen werden, da zarte Insekten sonst leicht beschädigt werden. Mit etwas Übung gelingt es, auch winzige Parasitoide im allgemeinen Gewühl zu erkennen und mit einem speziellen Aufsaugapparat, dem Exhaustor, gezielt herauszupicken (Abb. 13, S. 23). Für die meisten Gruppen hat sich die dreieckige Netzkonstruktion nach Noyes (2007) als ideal erwiesen. Dort sind weitere Informationen zur Streiftechnik sowie eine detaillierte Anleitung zur Herstellung eines Exhaustors zu finden. Von allen hier vorgestellten Sammelmethoden kann mit dem Käscher weitaus am meisten Material pro Zeiteinheit gewonnen werden. Für Biodiversitätserhebungen sollten jedoch auch die folgenden Methoden zur Anwendung kommen, da gewisse Arten nie oder nur sehr selten im Käscher landen. Die Malaisefalle (Abb. 11), benannt nach ihrem Erfinder, René Malaise, ist eine Art Zeltfalle, mit der vorwiegend flugfähige, tagaktive Insekten gesammelt werden (Townes 1972). Die Insekten fliegen in ein dunkles, senkrecht gespanntes Tuch und krabbeln anschliessend gegen das Licht, Abb. 11. Georg Artmann, der Entdecker von Vanhornia leileri in der Schweiz, am Fundort bei Trimbach (Olten). Mit dieser Malaisefalle wurde 2002 ein weiteres Exemplar gefangen. H. Baur. 19 Fang, Präparation, Konservierung wo sie in einem Gefäss in 80% Alkohol gesammelt werden. Die Falle wird normalerweise während der ganzen Fangperiode (Frühling bis Herbst, abhängig von der Meereshöhe) aufgestellt, wobei sie wöchentlich geleert werden muss. Entscheidend für den Erfolg ist ein geeigneter Standort. Viele Insekten fliegen entlang von natürlichen Vegetationsgrenzen (Hecken, Wald­ rändern etc.) oder in bestimmten Korridoren (Waldschneisen). Hier sollte die Falle so aufgestellt werden, dass sie quer zur erwarteten Flugroute der Insekten steht. Mit Malaisefallen werden viele Arten erfasst, die nie mit dem Käscher gesammelt werden. Sie sind deshalb ein unverzichtbarer ­Bestandteil bei Biodiversitätserhebungen. Fensterfallen funktionieren sehr ähnlich wie Malaisefallen, hier wird anstelle des dunklen Tuchs eine Plexiglasscheibe verwendet. Die Insekten fliegen in die Scheibe und werden wiederum oben abgesammelt. Alternativ können die Scheiben auch mit Pyrethroiden eingesprayt werden, wobei die Tiere bei Kontakt mit dem Gift sofort abgetötet werden und in einen Behälter mit Alkohol fallen. Der Einsatz von Pyrethroiden bietet den Vorteil, dass auch nachtaktive Insekten gesammelt werden. Im Prinzip ähnlich funktionieren «flight intercept traps», die vor allem in den Tropen eingesetzt werden. Bei diesen Fallen besteht die vertikale Fläche aus einem 2–3 m langen und ca. 1,5 m hohen Tuch, das mit Pyrethroiden imprägniert wurde. Die toten Insekten fallen in Gefässe, die beidseits der Unterkante des Tuchs aufgestellt werden. Emergenzfallen sind geschlossene, etwa 50–100 cm hohe Zelte aus hellem Stoff mit einer Bodenfläche 0,5–1 m2. Am oberen Ende ist ein Gefäss mit Alkohol angebracht. Die Fallen werden im zeitigen Frühjahr kurz vor Beginn der Aktivitätsperiode aufgestellt. Gesammelt werden alle Insekten und Spinnen, die an der betreffenden Stelle überwintert haben. Da viele Insekten als Eier oder frühe Larvenstadien überwintern und erst im Laufe des Sommers oder Herbstes adult werden, lohnt es sich, die Fallen bis zum Winter stehen zu lassen. Mit Gelbschalen werden vor allem diejenigen Insekten gefangen, welche durch gelbe Farben angelockt werden. Gelbschalen sind runde oder rechteckige, relativ flache Behälter (Höhe ca. 6 cm) mit einer Fläche von 300–400 cm2. Innen sind sie leuchtend gelb angestrichen. Meist werden mehrere Schalen gut sichtbar in der offenen Vegetation auf den Boden gelegt. Gesammelt werden die Insekten in einem Gemisch von Ethylenglykol (50%) und Wasser (50%), in einer gesättigten Salzlösung oder in Leitungswasser unter Beigabe von ein paar Tropfen Spülmittel (Detergent). Bei Verwendung des Ethylenglykol-Wasser-Gemisches müssen die Fallen nur einmal pro Woche geleert werden, bei der Salzlösung alle 2–3 Tage und bei Wasser täglich. Das giftige Formalin wird heute kaum noch verwendet. Mit Gelbschalen werden viele der kleineren Parasitica (Chalcidoidea und Proctotrupoidea) oft sehr zahlreich gesammelt, einige Arten einzig mit dieser Methode. Je nach dem können auch andere Farben verwendet werden; so wurden für Stephaniden mit blauen Schalen wesentlich besser Fangergebnisse erzielt. Das Sieben der Laubstreu wird vielfach von Koleopterologen angewendet, die Methode fördert jedoch auch bodenbewohnende Parasitoide, z.B. viele Proctotrupoidea und vor allem Ceraphronoidea, zu Tage. Laub, Grasbüschel und ähnliches Material wird in einem Stoffsack über einem Sieb mit ca. 4–8 mm Maschenweite hin- und hergeschüttelt, wobei kleinere Insekten in den unteren Teil des Sacks fallen. Das Gesiebe wird anschliessend auf einem weissen Tuch oder mit Hilfe eines Berlese-Apparats ausgelesen. Wie beim Sieben werden mit Becherfallen vor allem bodenbewohnende Arten gesammelt. Nebst den Ceraphronoiden befinden sich oft auch flügellose Pteromaliden (Diparinae) und Ichenumoniden (Gattung Gelis) in recht grosser Zahl in den Proben. Wie bei Gelbschalen hat sich ein Ethylenglykol-Wasser-Gemisch als geeignet erwiesen. Lichtfallen werden normalerweise nur von Lepidopterologen zum Fang von Nachtfaltern verwendet. Dabei wird übersehen, dass vom Licht auch viele nachtaktive Schlupf- und Brackwespen angelockt werden. Häufig werden in unmittelbarer Umgebung der Falle auch andere Parasitoide aufgeschreckt, die dann ebenfalls ans Licht fliegen. 20 Fang, Präparation, Konservierung Das Züchten der Wirte ist die einzige Möglichkeit, um Wirtbeziehungen herauszufinden. Die Zucht der meisten Insekten setzt jedoch spezielle Kenntnisse zu deren Lebenszyklus voraus. Es lohnt sich daher, mit Spezialisten dieser Gruppen Kontakt aufzunehmen, bevor ein Projekt gestartet wird. Oft sind in deren Sammlungen auch bereits gezüchtete Parasitoide vorhanden. Abtöten des Materials Grössere Exemplare (>1 mm) werden in Tuben mit fein gelochten Deckeln gesammelt. Diese Tuben werden zusammen mit einem Tuch mit einigen Tropfen Essigäther in einen Polyethylenbeutel (geeignet sind dicht schliessende Minigrip-Beutel) oder eine grössere Weithalsflasche gelegt. Durch den perforierten Deckel dringen die Dämpfe des Essigäthers ins Innere der Tuben, ohne dass die Exemplare direkt mit der Flüssigkeit in Kontakt kommen könnten. Dadurch wird verhindert, dass bei kleinen, zarten Exemplaren die Flügel verkleben. Nach 1–2 Stunden sind die Tiere normalerweise tot. Es ist jedoch wichtig, die Exemplare vor der Präparation noch länger im Beutel zu belassen, da unmittelbar nach dem Tod die sogenannte Totenstarre die Präparation erheblich erschwert. Nach einigen weiteren Stunden ist die Totenstarre vorbei und das Material im besten Zustand für die Präparation. Winzige Chalcidoidea oder Platygastroidea (<1 mm) sollten direkt in ca. 80%igem Alkohol abgetötet werden. Wichtig ist dabei die Konzentration des Alkohols: ist sie zu niedrig (<75%), quellen die Tiere auf, ist sie zu hoch (>85%), schrumpfen sie. In beiden Fällen wird das Material für Bestimmungszwecke mehr oder weniger unbrauchbar. Nach etwa einer Stunde kann der Alkoholgehalt jedoch problemlos auf 90% erhöht werden. Anschliessend muss das Material kühl und im Dunklen aufbewahrt werden, am besten in einem Kühlschrank bei 5 °C oder noch besser in einem Gefrierfach bei –20 °C. Diese Methode kann auch bei etwas grösseren Parasitoiden angewendet werden, z.B. bei Pteromaliden und Braconiden. Behandlung für DNA-Analysen Material für molekulare Untersuchungen kann wie oben beschrieben in 80%igem Alkohol abgetötet werden, bei anschliessender Erhöhung des Alkoholgehalts auf 90%. Für Exemplare, die primär für DNA-Analysen vorgesehen sind, sollte nach Möglichkeit unvergällter Alkohol verwendet werden. Entscheidend für die Haltbarkeit der DNA ist ferner die Lagerung in einer Gefriertruhe (am besten bei –70 °C, mindestens jedoch bei –18 °C). Präparation Die Trockenpräparation von Parasitoiden für die Bestimmung ist z.T. recht aufwändig und verlangt ein gewisses Mass an Geschick. Eine ansprechende Aufarbeitung des Materials lohnt sich jedoch in jedem Fall, denn durch die erleichterte Bestimmung und Handhabung des Materials wird der Aufwand für die Präparation mehr als wettgemacht. Für die Präparation werden (1) rostfreie Insektennadeln der Grössen 0–2 und 4, (2) ein fein zugespitzter Rotmarderpinsel (Grösse 2–4), (3) eine an der Spitze leicht gekrümmte Präpariernadel, (4) feine, gerade Pinzetten, (5) rechteckige oder spitze Aufklebeplättchen, (6) Insektenleim sowie (7) eine Etikettentreppe verwendet. Die betreffenden Materialien sind im Fachhandel erhältlich (vgl. App.). Die Präparation unterscheidet sich je nach Grösse der Exemplare: 21 Fang, Präparation, Konservierung Bei grösseren, robusteren Arten (>15 mm) wird eine Insektennadel direkt durch die rechte Seite das Mesoscutum geführt, so dass sie oben nur noch 1 cm herausschaut (entspricht der obersten Stufe der Etikettentreppe). Danach werden Antennen, Flügel und Beine leicht vom Körper abgespreizt und die Exemplare an einem warmen, trockenen Ort (z.B. Wärmeschrank bei maximal 45 °C) 1–2 Tage stehen gelassen. Alle kleineren, zierlichen Arten (<15 mm) werden seitlich auf rechteckige oder spitze Plättchen geklebt (Abb. 12). Dabei muss jeweils die linke Körperseite sichtbar bleiben. Nach dem Kleben werden die Extremitäten vom Körper abgespreizt, bei echten Schlupfwespen (Ichneumonoidea) sollten die langen Antennen und Beine jedoch das Plättchen nicht zu weit überragen, da sie sonst bei späterer Manipulation leicht abbrechen. Die Präparation auf Plättchen ist auch Ausgangspunkt für mikroskopische Dauerpräparate. Für detaillierte Anleitungen zu all diesen Methoden verweisen wir auf die Quellen im Literaturverzeichnis und im Appendix. Material, das in Alkohol gelagert wurde, muss vor dem Trocknen speziell behandelt werden. Dafür hat sich die sogenannte AXA-Methode sehr bewährt. Zuerst werden die Proben mittels Alkoholreihe (für je 30 Minuten in 90 und 96–100% Alkohol) entwässert, danach für mindestens 1 Stunde zugedeckt in ein Gemisch aus 60% Xylol und 40% Alkohol gelegt. Dieses Gemisch wird für eine weitere Stunde durch Amylacetat ersetzt, welches einmal gewechselt wird. Anschliessend kann der Deckel bei geöffnetem Fenster oder in einem Abzug weggenommen werden, wobei das Amylacetat langsam verdampft. Wichtig ist, dass die Exemplare nach dem Trocknen nicht direkt auf Glas zu liegen kommen, da die Flügel leicht festkleben. Das Material sollte deshalb während der Behandlung auf ein Stück Filterpapier oder Tuch gelegt werden. Als Abb. 12. Kleine parasitische Wespen wie dieser knapp 2 mm lange Anisopteromalus calandrae (Pteromalidae) ­werden am besten seitlich auf rechteckige Plättchen geklebt. H. Baur. 22 Fang, Präparation, Konservierung sehr geeignet haben sich auch mikroporöse Kapseln erwiesen, wie sie im Fachhandel für Elektronenmikroskopie erhältlich sind (z.B. bei Plano, App.). In einer Kapsel mit Innenmass 8 × 8 mm finden problemlos 50–100 kleine Chalcidoidea oder Proctotrupoidea Platz, wobei die Exemplare später leicht von einander getrennt werden können. Durch die Behandlung mit der AXA-Methode werden die Tiere sehr schonend getrocknet; die Flügel bleiben in der Regel gestreckt und die Intersegmentalhäute relativ flexibel, so dass die Extremitäten auch in völlig trockenem Zustand leicht beweglich sind. Beschriften von Belegexemplaren Wissenschaftliches Material hat nur dann einen Wert, wenn die Herkunft genau und individuell angeben ist (Huber 1998). Auf der Fundortetikette muss stehen: Land, Region oder Kanton, Gemeinde oder grössere Ortschaft, Flurname, geografische Koordinaten (z.B. CH-­Koordinaten oder Längen- und Breitengrade), Meereshöhe, Funddatum, Name des Sammlers. Auf einer zweiten, der Bestimmungsetikette steht: lateinischer Artname mit Autor, Name des Bestimmers, Jahr der Bestimmung, z.B. «Pteromalus elevatus Walker det. H. Baur 2004» (det. = hat bestimmt). Sofern vorhanden, sind Informationen zur Wirtsart bzw. -pflanze (beides mit Angabe der Familie) auf einer dritten Etikette anzugeben. Die Etiketten dürfen bei genadelten Tieren nicht mehr als 18 × 10 mm abmessen und sind in der Reihen­folge Fundort, Wirt und Bestimmung anzustecken. Die Beschriftung erfolgt von Hand mit Tusche oder Bleistift (nie Kugelschreiber, Filzstift etc.!) oder mit Laserdrucker (Schriftgrösse 4–5 Punkt). Für die Etiketten ist nur weisses, säurefreies Papier zu verwenden (Archivqualiät!). Abb. 13. Zdenek Boucek beim Auslesen des Netzes. Der Begründer der modernen Erzwespen­ systematik ist auch ein passionierter Feldentomologe. Val Roseg GR, VIII. 2001. H. Baur. 23 Bestimmungsschlüssel Bestimmungsschlüssel zu den Schlupfwespenfamilien der Schweiz Dieser Schlüssel ermöglicht ein rasches Bestimmen der in der Schweiz nachgewiesenen Familien der Schlupfwespen. Der Einfachheit halber ist der Schlüssel um einige Ausnahmen gekürzt und liefert deshalb nicht in allen Fällen das richtige Ergebnis. Von den draussen angetroffenen Arten können damit aber ca. 95% richtig bestimmt werden. Für weitergehende ­Bestimmungsschlüssel sei auf den Katalog (S. 46) und die Literaturliste (S. 82) im Anhang verwiesen, welche die wichtigste Bestimmungsliteratur für parasitische Wespen umfasst. Quantitative Angaben im Schlüssel sind entsprechend dem System von Goulet & Huber (1993: 64) wie folgt definiert: sehr selten <1%, selten 1–10%, gelegentlich >10–25%, manchmal >25– 50%, oft >50–75%, häufig >75–90%, meist >90–99%, normalerweise >99% des vorliegenden Materials. Die Abbildungen sind Boucek (1964), Gauld & Bolten (1988), Gibson et al. (1997), Graham (1969) und vor allem Goulet & Huber (1993) entnommen. Die Zeichnungen von Vanhornia leileri stammen von Armin Coray (Basel). 1 – Voll geflügelt, Vorderflügel reichen bis deutlich hinter die Mitte des Metasomas (a) Ungeflügelt oder mit verkürzten Flügeln (aa) a 2 44 aa 24 Bestimmungsschlüssel 2 – 3 – Ohne Wespentaille, d.h. zwischen Meso- und Metasoma keine deutliche Einschnürung vorhanden (a). Vorderflügel normalerweise mit sehr vielen geschlossenen Zellen (b) SYMPHYTA [Pflanzenwespen] Mit Wespentaille, d.h. zwischen Meso- und Metasoma eine deutliche Einschnürung erkennbar (aa); falls mit undeutlicher Wespentaille (einige Chalcidoidea, vgl. aa’), dann VorderflüAPOCRITA [Taillenwespen] 3 gel ohne geschlossene Zellen (bb) a aa b bb aa’ Hinterflügel mit Anallobus, d.h. kleinem basalem Lappen (a). Nur 1 Trochanter zwischen Coxa und Femur (b) ACULEATA [Stechimmen: Bienen, Wespen etc.] Hinterflügel normalerweise ohne Anallobus (aa); falls mit Anallobus [nur EVANIIDAE], 4 dann mit 2 Trochanteren zwischen Coxa und Femur (bb) a b aa bb 25 Bestimmungsschlüssel 4 – Vorderflügel mit mindestens 3 von Adern umschlossenen Zellen (a) und Antennen normalerweise ungekniet. Körper meistens länger als 5 mm, nur selten kürzer als 3 mm 5 Entweder Vorderflügel mit höchstens 2 vollständig von Adern umschlossen Zellen (aa) 14 oder Antennen gekniet. Körperlänge nur selten über 5 mm aa a aa 5 – Vorderflügel mit sehr langer und schmaler Radialzelle (a). Metasoma stark seitlich ­zusammengedrückt, von der Seite betrachtet lang-oval, hinten breit abgerundet (b). HabiIBALIIDAE , S. 67 tus charakteristisch (c), ­Körperlänge 9–15 mm Vorderflügel mit viel kürzerer Radialzelle. Falls Metasoma seitlich zusammengedrückt, dann 6 von der Seite betrachtet hinten ± zugespitzt a b c 26 Bestimmungsschlüssel 6 – Vorderflügel mit ± dreieckiger erster Medialzelle (a). Hinterflügel mit einer unverzweigten Ader. Körper einheitlich schwarz, meist 4–8 mm lang 7 Vorderflügel ohne (aa) oder mit anders geformter erster Medialzelle (bb). Hinterflügel meist mit mehreren verzweigten Adern. Körper häufig ± aufgehellt, oft länger 8 aa a bb 7 – Mandibel exodont, d.h. Zähne nach aussen gerichtet (a). Antenne mit 11 Flagellomeren, ohne Anellus. Basale Metasomalterga zu einem Carapax verwachsen. Ovipositor sehr lang, in Ruhelage in einer Längsfurche entlang der Bauchseite liegend. Habitus (b) VANHORNIIDAE, S. 79 Mandibel endodont, d.h. Zähne nach innen gerichtet (ähnlich wie aa). Antenne mit 14 Flagellomeren, mit Anellus. Basale Metasomalterga nicht verwachsen, erstes Metasomalsegment in einen Petiolus umgewandelt. Ovipositor verborgen. Habitus (bb) HELORIDAE, S. 77 aa a b bb 27 Bestimmungsschlüssel 8 – Vorderflügel mit Costa (C) und Radius (R) verschmolzen, nur noch als eine Ader sichtbar, dadurch Vorderflügel basal mit nur 3 Längsadern oder einer 4. am Flügelhinterrand (a) 9 Vorderflügel mit Costa und Radius getrennt, dadurch basal mit 4 Längsadern (aa) 10 C+R a C R aa 9 – Vorderflügel mit Discoidial- und Cubitalzelle verschmolzen, wodurch grosse Discocubital­zelle entsteht (a). Vorderflügel normalerweise mit Ader R–M (b), diese gelegentlich spektral, ICHNEUMONIDAE, S. 72 d.h. unpigmentiert Vorderflügel meist mit Ader zwischen Discoidial- und Cubitalzelle (aa). Immer ohne Ader BRACONIDAE, S. 71 R–M (bb) a aa b bb 28 Bestimmungsschlüssel 10 Antenne mit mindestens 20 Flagellomeren. Metasoma setzt tief am Propodeum an, Distanz zu Hintercoxa deutlich kleiner als deren Durchmesser (a) 11 – Antenne mit 10–12 Flagellomeren. Metasoma setzt hoch am Propodeum an, Distanz zu Hintercoxa deutlich grösser als deren Durchmesser (aa) 12 a aa 11 Kopf rundlich, mit Zähnchen um den mittleren Ocellus (a). Körper schlank, Ovipositor mindestens körperlang. Metafemur an der Unterseite gezähnt. Vorderflügel mit 5 geschlossenen Zellen. Körperlänge 12–20 mm STEPHANIDAE, S. 80 – Kopf quer, ohne auffallende Zähnchen um den mittleren Ocellus (aa). Körper gedrungen, Ovipositor kaum vorragend (aa). Metafemur an der Unterseite nicht gezähnt (aa). Vorderflügel mit 10 geschlossenen Zellen (aa). Körperlänge 10–15 mm TRIGONALIDAE, S. 81 a aa 29 Bestimmungsschlüssel 12 Metasomalsegment 1 als Stiel ausgebildet, Rest des Metasomas scheibenförmig (a). Hinterflügel mit Anallobus (b). Propleura kurz (a). Ovipositor sehr kurz EVANIIDAE, S. 69 – Metasomalsegment 1 leicht bis stark konisch, Rest des Metasomas länglich (aa). Hinterflügel ohne Anallobus (bb). Propleura verlängert, wodurch der Eindruck eines Halses entsteht 13 (aa). Ovipositor meist länger als Metasoma a aa b bb 13 Petiolus berührt vorne fast Metanotum (a); Metatibia verbreitert (b). Antenne etwa auf mittlerer Höhe der Augen eingelenkt GASTERUPTIIDAE, S. 70 – Petiolus deutlich vom Metanotum getrennt (aa). Metatibia apikal höchstens sehr schwach erweitert (bb). Antenne auf Höhe des unteren Randes der Augen eingelenkt AULACIDAE, S. 68 a aa b bb 30 Bestimmungsschlüssel 14 Membran des Vorderflügels netzartig gemustert (a); Vorderflügel am Rand mit sehr langen Fransen besetzt (a). Erstes und zweites Metasomalsegment zylindrisch, einen zweigliedrigen Petiolus bildend (b) MYMAROMMATIDAE, S. 73 – Membran des Vorderflügels ohne netzartige Musterung, jedoch behaart (aa); Vorderflügel am Rand meist mit kürzeren Fransen (aa); Höchstens erstes Metasomalsegment zylindrisch, einen eingliedrigen Petiolus bildend (bb) 15 a aa b bb 15 Hinterflügel an der Basis gestielt (a). Toruli näher bei den Augen als beieinander liegend (b). Kopf mit H-förmigen Furchen (b) [horizontale Furche immer deutlich, die beiden vertikalen MYMARIDAE, S. 56 Furchen oft schwierig zu sehen] – Hinterflügel an der Basis ungestielt (aa). Toruli näher bei einander als bei den Augen liegend (bb). Kopf ohne H-förmige Furchen (bb) 16 a b aa b bb bb 31 Bestimmungsschlüssel 16 Hinterecke des Pronotums reicht nicht bis zur Tegula (a). Antenne normalerweise gekniet [einzige Ausnahme: EUCHARITIDAE, aber hier Körper stark metallisch glänzend]. Körper oft grün oder blaugrün mit metallischem Glanz 17 – Hinterecke des Pronotums reicht bis zur Tegula (aa). Antenne manchmal nicht gekniet. Körper einheitlich schwarz oder schwarz mit ± ausgedehnter gelblicher Zeichnung, nie me36 tallisch a aa 17 Füsse mit 3 Tarsomeren (a). Vorderflügel mit deutlichen, radialen Haarstreifen und fehlender Postmarginalader (b). Körperlänge 0,4–1 mm TRICHOGRAMMATIDAE, S. 63 – Füsse mit 4–5 Tarsomeren. Vorderflügel meist gleichmässig behart, ohne Haarsteifen (bb). 18 Körperlänge oft mehr als 1 mm b bb a 32 Bestimmungsschlüssel 18 Antenne mit 3–6 deutlich sichtbaren Flagellomeren (a) [Vergrösserung 80–100 ×]; falls mit 7 Flagellomeren, dann Füsse mit 4 Tarsomeren. Körperlänge meist weniger als 3 mm, Körper oft mit wenig sklerotisiertem, weichem Integument, d.h. Kopf und Körper schrumpfen 19 beim Trocknen – Antenne mit 8–11 deutlich sichtbaren Flagellomeren (aa); falls mit 7 Flagellomeren, dann Füsse mit 5 Tarsomeren. Körperlänge oft mehr als 3 mm, Körper meist mit stark sklerotisiertem Integument, d.h. Kopf und Körper behalten nach dem Trocknen ihre Form 21 a aa 19 Körper zwischen Meso- und Metasoma deutlich eingeschnürt (a) und Endsporn der Protibien kurz und gerade (b) [Vergrösserung 80–100 ×]. Stigmal- und Postmarginalader kurz aber klar erkennbar, bei einigen Gruppen [z.B. den meisten Tetrastichinae] Postmarginal­ader jedoch stärker reduziert bis fast fehlend. Körper häufig metallisch grün oder blaugrün EULOPHIDAE, S. 52 – Entweder Körper ohne eigentliche Einschnürung, d.h. Metasoma breit am Propodeum ­ansetzend (aa), oder Endsporn der Protibien lang, gebogen, oft an der Spitze gespalten (bb). Nur Marginalader deutlich entwickelt, Stigmalader extrem kurz und Postmarginalader normalerweise fehlend. Körper nicht metallisch, einheitlich schwarz oder ± gelblich aufge20 hellt a aa b bb 33 Bestimmungsschlüssel 20 Propodeum in der Mitte mit dreieckiger Fläche, welche durch feine Furchen begrenzt ist (a). Scutellum mit parallelem Vorder- und Hinterrand, stark quer und nur wenig länger als Metanotum (b). Füsse mit 5 Tarsomeren SIGNIPHORIDAE, S. 60 – Propodeum in der Mitte ohne dreieckige Fläche (aa). Scutellum am Hinterrand gerundet, deutlich länger als Metanotum (bb). Füsse mit 4 oder 5 Tarsomeren APHELINIDAE, S. 48 b bb a aa 21 Metafemur stark verdickt, an der Unterseite mit einem oder mehreren Zähnen (a) – Metafemur nur wenig verdickt oder an der Unterseite ohne Zähne (aa) a 22 24 aa 34 Bestimmungsschlüssel 22 Körper mit metallischem Glanz, meist grünlich mit goldenen oder kupfernen Reflexen. Habitus von Podagrion sp.(a) einige TORYMIDAE, S. 62 – Körper ohne metallischen Glanz, schwarz mit ± ausgedehnter heller Zeichnung 23 a 23 Vorderflügel in Ruhelage längsgefaltet (a). Ovipositor weit über das Metasoma zurückgebogen (b). Basale Metasomalterga beim Männchen zu Carapax verwachsen (c). Körper LEUCOSPIDAE, S. 55 schwarz mit gelben Querbändern – Vorderflügel in Ruhelage nicht gefaltet (aa). Ovipositor nur wenig vorragend, gerade (bb). Basale Metasomalterga beim Männchen nicht verwachsen (cc). Körper schwarz mit rötlicher oder gelblicher Zeichnung, aber ohne gelbe Querbänder CHALCIDIDAE, S. 49 b a c bb aa cc 35 Bestimmungsschlüssel 24 Antenne ungekniet. Pronotum von oben betrachtet nicht sichtbar (a). Körper glänzend metallisch grün EUCHARITIDAE, S. 51 – Antenne gekniet. Pronotum von oben betrachtet sichtbar. Körper oft nicht-metallisch 25 a 25 Mesopleuron regelmässig konvex, ohne schräge Vertiefung oder Furche (a). Unterseite des Mesotarsus an der Basis mit einer oder mehreren Reihen von Zäpfchen, dazwischen ein Polster mit dichtstehenden Haaren (b) [Vergrösserung 50–100 ×] 26 – Mesopleuron ± konkav und mit einer schrägen Vertiefung oder Furche (aa). Unterseite des Mesotarsus an der Basis ohne auffallende Zäpfchen und Haarpolster (bb) 27 a aa b bb 36 Bestimmungsschlüssel 26 Mesocoxa vor oder in der Mitte des Mesopleurons eingelenkt (a). Marginalader normalerweise kürzer als Stigmalader, manchmal fast punktförmig (b) ENCYRTIDAE, S. 50 – Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt (aa). Marginalader viel länger als Stigmalader (bb) EUPELMIDAE, S. 53 a b bb aa 27 Körper metallisch glänzend, von grün mit goldenen oder kupfernen Reflexen über blaugrün bis fast schwarz und Antenne (einschliesslich Anelli) mit 11 Flagellomeren (a) [Vergrösserung 50–100 ×] 28 – Entweder Körper schwarz oder gelblich, nicht metallisch glänzend oder Antenne (ein32 schliesslich Anelli) mit weniger als 11 Flagellomeren (aa) a aa 37 Bestimmungsschlüssel 28 Marginalader normalerweise weniger als 3 × so lang wie Stigmalader (a); Uncus (= fingerförmige Erweiterung des Stigmas) weit vom Flügelvorderrand entfernt (b) PTEROMALIDAE [Pteromalinae, Miscogasterinae u.a.], S. 59 – Marginalader normalerweise mehr als 3 × so lang wie Stigmalader (aa); Uncus nahe am Flügelvorderrand gelegen (bb) 29 bb b aa a 29 Metasomalterga mit auffallender, grober Skulptur (a) ORMYRIDAE, S. 57 – Metasomalterga mehr oder weniger glatt, ohne auffallende Skulptur (b) 30 a aa 38 Bestimmungsschlüssel 30 Metasoma von der Seite betrachtet mit erstem Gastraltergum basal fast rechtwinklig (a). Körper oft kompakt PERILAMPIDAE, S. 58 – Mesosoma von der Seite betrachtet mit erstem Gastraltergum basal abgerundet (aa). Kör31 per meist langgestreckt a aa 31 Letztes Metasomaltergum mit griffelförmigem Cercus (a) TORYMIDAE [Toryminae], S. 62 – Letztes Metasomaltergum mit warzenförmigem Cercus (ähnlich wie in aa) EUPELMIDAE [Männchen Eupelminae], S. 53 a aa a 39 Bestimmungsschlüssel 32 Torulus höchstens durch seinen eigenen Durchmesser vom Mundrand entfernt (a) PTEROMALIDAE [Spalanginae, Ceinae, Cerocephalinae u.a.], S. 59 – Torulus deutlich weiter vom Mundrand entfernt (aa) 33 a aa 33 Körper von grün über dunkelgrün bis fast schwarz, mit metallischen Reflexen – Körper schwarz, oft ± gelblich aufgehellt, ohne metallische Reflexe 34 35 34 Protibiae mit Endsporn gerade (a). Entweder Scutellum glatt mit 2 Paar langen Borsten (b) und Füsse beim Männchen nur mit 4 Tarsomeren [Tetracampinae] oder Körper langgestreckt und Marginalader beim Männchen stark verbreitert (c) [Platynocheilinae] TETRACAMPIDAE, S. 61 – Protibiae mit Endsporn an der Spitze gekrümmt und gespalten (aa). Scutellum gelegentlich glatt, aber immer ohne auffällig lange Borsten. Füsse beim Männchen mit 5 Tarsomeren. PTEROMALIDAE [Ormocerinae], S. 59 Körper relativ gedrungen. Marginalader schlank a aa F b c C 40 Bestimmungsschlüssel 35 Stigma des Vorderflügels tropfenförmig vergrössert, höher als lang (a). Ovipositor lang vorragend (b). Antenne mit 11 Flagellomeren. Körper schwach skulpturiert, Pronotum und Mesoscutum mit feinen Querrippen; Körper grösstenteils aufgehellt TORYMIDAE [Megastigminae], S. 62 – Stigma des Vorderflügels nicht auffallend vergrössert, mindestens so lang wie hoch (aa). ­Ovipositor höchstens leicht vorragend (bb). Antenne normalerweise mit 10 oder weniger Flagellomeren. Körper häufig stärker skulpturiert, bedeckt mit kleinen, jeweils von einem einzigen Haar besetzten Grübchen, ohne Querrippen an Pronotum und Mesoscutum; EURYTOMIDAE, S. 54 ­Körper oft einheitlich schwarz a aa b bb 36 Antenne gekniet, Scapus normalerweise mehr als 3 × so lang wie breit (a) – Antenne nicht gekniet, Scapus meist weniger als 2,2 × so lang wie breit (aa) a 37 41 aa 41 Bestimmungsschlüssel 37 Gesicht auf Höhe der Antenneneinlenkstelle stark vorstehend (a) – Gesicht auf Höhe der Antenneneinlenkstelle wenig vorstehend (aa) a DIAPRIIDAE, S. 76 38 aa 38 Submarginalader des Vorderflügels verläuft basal direkt entlang des Flügelvorderrandes (a). Protibia mit 2 Endspornen [Vergrösserung 60–100 ×]. Metasomaltergum 2 sehr lang 39 – Submarginalader des Vorderflügels verläuft basal ± parallel zum Flügelvorderrand (aa). 40 ­Protibia mit 1 Endsporn. Metasomaltergum 2 häufig kurz a aa 42 Bestimmungsschlüssel 39 Metasoma an der Basis halsförmig verschmälert (a). Vorderflügel normalerweise mit Pterostigma (b). Mesotibia mit 2 Endspornen [Vergrösserung 100 ×]. Mesoscutum normalerMEGASPILIDAE, S. 47 weise mit 3 Längsfurchen – Metasoma an der Basis ­ abrubt verschmälert (aa). Vorderflügel ohne Pterostigma (bb). ­Mesotibia mit 1 Endsporn. Mesoscutum höchstens mit 1 Längsfurche entlang der Mittel­ linie CERAPHRONIDAE, S. 46 b bb a aa 40 Metasomaltergum 2 meist gleich lang oder kürzer als 3 (a). Vorderflügel mit Stigmal- und normalerweise auch Postmarginalader (b). Antenne meist mit 9–10 Flagellomeren, selten SCELIONIDAE, S. 75 mit 8 oder weniger – Metasomaltergum 2 viel länger als 3 (aa). Vorderflügel ohne Stigmal- und Postmarginalader, manchmal überhaupt ohne Adern (bb). Antenne mit 8 oder weniger Flagellomeren PLATYGASTRIDAE, S. 74 b a bb aa 43 Bestimmungsschlüssel 41 Vorderflügel mit Pterostigma deutlich vorhanden (a) – Vorderflügel ohne Pterostigma (aa) a 42 43 aa 42 Vorderflügel mit schmaler Costal- und Radialzelle (a). Metasoma, besonders bei den Weibchen, von der Seite betrachtet nach unten gekrümmt (b); Metasomalsterna stark sklerotiPROCTOTRUPIDAE, S. 78 siert, formen konvexe Oberfläche – Vorderflügel mit Costa und Radius verwachsen, dadurch keine Costalzelle, normalerweise ohne Radialzelle (aa). Metasoma von der Seite betrachtet nicht nach unten gekrümmt; ­Metasomalsterna meist nur schwach sklerotisiert, kollabiert in luftgetrockneten ExemBRACONIDAE, S. 71 plaren a aa b 44 Bestimmungsschlüssel 43 Kopf mit ± rauer Skulpturierung. Hypopygium des Weibchens meist mit Endsporn (a). Petiolus kurz (a). Fussklauen oft mit basalem Lobus CYNIPIDAE, S. 65 – Kopf normalerweise glatt. Hypopygium des Weibchens ohne Endsporn. Petiolus manchmal FIGITIDAE, S. 66 lang (aa). Fussklauen ohne basalen Lobus a aa 44 Metasomalsegmente 1 und 2 (oder manchmal nur Segment 1) knotenförmig (a), d.h. dickFORMICIDAE [Ameisen] ste Stelle in der Mitte des Segments. Antennen gekniet (a) – Metasomalsegmente 1 und 2 gleich breit oder nach hinten erweitert. Antennen oft unge45 kniet a 45 Antenne normalerweise mit mehr als 13 Flagellomeren. Metasoma mit Sterna viel schwächer sklerotisiert als Terga, bei luftgetrockneten Tieren meist kollabiert ICHNEUMONIDAE, S. 72 – Antenne mit weniger als 13 Flagellomeren. Metasoma mit Sterna gleich stark sklerotisiert wie Terga PROCTOTRUPOIDEA, CYNIPOIDEA, CHRYSIDOIDEA, VESPOIDEA u.a. 45 Katalog: Ceraphronoidea Katalog der Schlupfwespenfamilien der Schweiz Die folgende Zusammenstellung gibt eine Übersicht zu den Überfamilien und Familien der Schlupfwespen der Schweiz. Die Habitusabbildungen stammen aus dem Werk von Goulet & Huber (1993). Es ist zu beachten, dass viele der abgebildeten Arten nicht bei uns heimisch sind. Ceraphronoidea Diagnose: Körperlänge 1–4 mm. Farbe schwarz bis gelblich, nicht metallisch glänzend. Antenne gekniet, ohne Anelli; Flügel ohne Zellen; Hinterecke des Pronotums reicht bis zur Tegula, Prepectus fehlt; Adern des Vorderflügels immer mindestens bis auf Marginal- und Stigmalader reduziert; Submarginalader des Vorderflügels verläuft direkt entlang des Fügelvorderrandes; Pterostigma fehlend oder vorhanden; Protibia mit 2, Mesotibia mit 1 oder 2, Metatibia mit 2 Endspornen; Tarsen mit 5 Tarsomeren; Ovipositor äusserlich nicht sichtbar. Ceraphronidae Artenzahlen: CH 5; D 10; CZ 7; GB 26; W 360. Diagnose: Körperlänge 1–3 mm. Farbe schwarz oder bräunlich, teilweise gelblich. Antenne mit 7–9 Flagellomeren; Mesoscutum mit 1 Längsfurche; oft kurzflüglig oder flügellos; falls geflügelt, Vorderflügel ohne Pterostigma; Mesotibia mit nur 1 Endsporn; Metasoma an der Basis abrupt verschmälert. Biologie: Wenig bekannt; gezüchtet als Endoparasitoid von Diptera (Cecydomyiidae), Lepidoptera, Neuroptera und Thysanoptera; Hyperparasitoide aus Kokons von Braconidae. Adulte zahlreich in der Laubstreu. Bemerkungen: In Mitteleuropa sehr schlecht bearbeitet, keine Bestimmungsschlüssel ausser in Trjapitsyn (1988). 46 Katalog: Ceraphronoidea Megaspilidae Artenzahlen: CH 10; D 24; CZ 13; GB 59; W 450. Diagnose: Körperlänge 1,5–4 mm. Farbe schwarz, bräunlich oder gelblich. Antenne mit 9 Flagellomeren; Mesoscutum meist mit 3 Längsfurchen; manchmal kurzflüglig oder flügellos; falls geflügelt, Vorderflügel mit breitem Pterostigma; Mesotibia mit 2 Endspornen; Metasoma an der Basis kontinuierlich verschmälert. Biologie: Wenig bekannt; Ektoparasitoide von Diptera (Cecydomyiidae, Syrphidae, Chloropidae, etc.), Homoptera, Neuroptera und Mecoptera. Viele Arten sind Hyperparasitoide an Braconidae, Cynipidae und Chalcidoidea. Adulte zahlreich in der Laubstreu. Bemerkungen: In Mitteleuropa sehr schlecht bearbeitet, keine Bestimmungsschlüssel ausser in Trjapitsyn (1988). 47 Katalog: Chalcidoidea Chalcidoidea (Erzwespen) Diagnose: Körperlänge 0,2–16 mm. Farbe oft metallisch glänzend, zuweilen schwarz oder gelblich. Antenne gekniet (ausser Eucharitidae); Flagellum oft mit einem oder mehreren Anelli; Hinterecke des Pronotums reicht normalerweise nicht bis zur Tegula; das dazwischenliegende Sklerit, der Prepectus, meist gut sichtbar, bei gewissen Gruppen jedoch recht stark reduziert; Flügel ohne Zellen; Vorderflügel immer mit stark reduzierter, variabler Aderung, jedoch oft mit deutlicher Submarginal, Marginal-, Postmarginal- und Stigmalader; Submarginalader verläuft parallel zum Flügelvorderrand; Pterostigma fehlend; Pro- und Mesotibia mit 1 Endsporn, Metatibia mit 1 oder 2 Endspornen; Tarsen mit 3–5 Tarsomeren; Ovipositor oft nur wenig, manchmal jedoch deutlich vorragend. Aphelinidae Anzahl Arten: CH 20; D 49; CZ 54; GB 38; W 1120. Diagnose: Körperlänge 0,6–1,7 mm. Farbe schwarz oder gelblich, höchstens mit obskurem Metallglanz. Antenne meist mit 3–6 Flagellomeren, gelegentlich mit kaum erkennbarem Anellus; Oberfläche des Körpers glatt; Prepectus deutlich; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel mit langer Marginal- und extrem kurzer Stigmalader, Postmarginalader fehlend; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Metafemur nicht modifiziert; Tarsen mit 4 oder 5 Tarsomeren; Mesotarsus nicht modifiziert; Propodeum ± glatt, in der Mitte ohne spezielle dreieckige Fläche; Metasoma breit am Mesosoma angesetzt, ohne differenzierten Petiolus; Metasoma meist oval; Ovipositor normalerweise wenig vorragend. Biologie: Meist Endo- oder Ektoparasitoide verschiedener Pflanzenläuse (Aleyrodoidea, Aphidoidea, Psylloidea, Auchenorrhyncha und vor allem Coccoidea); daneben auch an Eiern von Lepidopteren und Dipteren. Bei gewissen Arten leben die Männchen als Ekto-, die Weibchen als Endoparasitoide an denselben Wirten; bei wenigen Arten sind die Männchen auch obligate Hyperparasitoide ihrer eigenen Weibchen (Autoparasitismus). Bemerkungen: In Mitteleuropa sehr schlecht bearbeitet; Bestimmungsschlüssel Ferrière (1965). Zusammen mit Encyrtiden eine der wichtigsten Erzwespenfamilien in der biologischen Schädlingsbekämpfung. 48 Katalog: Chalcidoidea Chalcididae Anzahl Arten: CH 25; D 23; CZ 40; GB 7; W 1875. Diagnose: Körperlänge 2,5–12 mm. Farbe glänzend schwarz oder schwarz mit gelben oder rötlichen Partien. Antenne meist mit 8, selten 11 Flagellomeren, gelegentlich mit einem Anellus beim Männchen; Oberfläche des Körpers meist grob punktiert; Prepectus sehr klein, unauffällig; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel nicht der Länge nach gefaltet, mit langer Marginal- und kurzer Stigmalader, Postmarginalader fehlend bis lang; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Metafemur stark verdickt, an der Unterseite bedornt; Tarsen mit 5 Tarsomeren; Mesotarsus nicht modifiziert; Propodeum oft stark punktiert und gekielt; Metasoma durch kurzen oder langen Petiolus deutlich vom Mesosoma abgesetzt; Gaster relativ kurz und stark gewölbt; Ovipositor wenig vorragend. Biologie: Primär- oder Hyperparasitoide von Lepidopterenpuppen und Dipterenlarven; einige Arten attackieren Larven und Puppen von Ameisenlöwen (Neuroptera). Bemerkungen: In Mitteleuropa schlecht bearbeitet; der einzige, nach wie vor sehr gute Bestimmungsschlüssel ist von Boucek (1951)! 49 Katalog: Chalcidoidea Encyrtidae Anzahl Arten: CH 80; D 165; CZ 347; GB 201; W 3825. Diagnose: Körperlänge 0,6–3 mm. Farbe meist mehr oder weniger glänzend metallisch. Antenne mit 3–11 Flagellomeren, Anelli fehlend; Oberfläche des Körpers ± glatt; Prepectus deutlich, breit oval; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron vergrössert und stark konvex; Mesocoxa vor oder in der Mitte des Mesopleurons eingelenkt; Vorderflügel mit sehr kurzer Marginal-, Postmarginal- und Stigmalader, Marginalader gelegentlich nur punktförmig; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Metafemur nicht modifiziert; Tarsen mit 5, gelegentlich nur mit 4 Tarsomeren; Mesotarsus verbreitert, unterseits mit auffälligen Zäpfchen und Haarpolstern; Propodeum höchstens leicht skulpturiert, in der Mitte gelegentlich sehr kurz; Metasoma oft undeutlich vom Mesosoma abgesetzt, Petiolus sehr kurz und ± verborgen; Gaster meist oval; Ovipositor meist wenig vorragend, selten lang. Biologie: Meist Endoparasitoide von Schildläusen (Coccoidea), aber auch in Eiern und Larven von Coleoptera, Lepidoptera, Hymenoptera (primär und sekundär), Orthoptera etc. Arten der Tribus Copidosomatini parasitieren Schmetterlingsraupen, wobei aus einem einzigen Ei durch Zellteilung bis zu 2000 Parasitoide entstehen können (Polyembryonie). Bemerkungen: In Mitteleuropa sehr schlecht bearbeitet. Bestimmungsschlüssel fehlen selbst für die (zahlreichen) Gattungen; der Schlüssel in Trjapitsyn (1988) ist veraltet und teilweise unbrauchbar. 50 Katalog: Chalcidoidea Eucharitidae Anzahl Arten: CH 2; D 2; CZ 4; GB 1; W 380. Diagnose: Körperlänge 4–7 mm. Farbe glänzend metallisch grün. Antenne der einheimischen Arten ungekniet, mit 8–10 Flagellomeren, Anelli fehlend; Prepectus vorhanden, jedoch mit Pronotum verwachsen; Oberfläche des Körpers glatt; Mesosoma kompakt, stark gewölbt; Scutellum am Apex mit kurzer, rundlicher ­(Eucharis) oder langer, gabeliger (Stilbula) Erweiterung; Mesopleuron nicht speziell modifiziert, leicht konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel mit langer Marginal- und sehr kurzer Postmarginal- und Stigmalader; Adern zum Teil unscharf begrenzt; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit apikal leicht gekrümmtem Endsporn; Metafemur nicht modifiziert; Tarsen mit 5 Tarsomeren; Mesotarsus nicht modifiziert; Propodeum unregelmässig skulpturiert; Metasoma durch langen Petiolus deutlich vom Mesosoma abgesetzt; Gaster kurz und hoch; Ovipositor kaum vorragend. Biologie: Parasitoide in Ameisennestern. Nach einem freilebenden Planidium-Stadium ent­wickelt sich die Larve als Ektoparasitoid an Ameisenpuppen. Bemerkungen: Bestimmungschlüssel Trjapitsyn (1988). Bei uns nur die seltenen Arten Eucharis adscendens und Stilbula cyniformis. 51 Katalog: Chalcidoidea Eulophidae Anzahl Arten: CH 250; D 449; CZ 457; GB 395; W 3900. Diagnose: Körperlänge 0,4–6 mm. Farbe oft glänzend metallisch grün, manchmal matt schwarz mit ± ausgedehnten gelblichen Partien. Antenne mit 5–7 Flagellomeren, dazu mit bis zu 4 winzigen, kaum sichtbaren Anelli; Oberfläche des Körpers meist ± glatt; Prepectus breit dreieckig; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, leicht konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel mit langer Marginal- und kurzer Postmarginal- und Stigmalader; Marginalader normalerweise mehr als 3 × so lang wie Stigmalader; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ kurzem, geradem Endsporn; Metafemur nicht modifiziert; Tarsen mit 4 Tarsomeren; Mesotarsus nicht modifiziert; Propodeum variabel, glatt oder ± stark skulpturiert, mit oder ohne Längs- bzw. Querkielen; Metasoma durch kurzen bis langen Petiolus deutlich vom Mesosoma abgesetzt; Gaster kurz oval bis sehr lang und zugespitzt; Ovipositor oft wenig, gelegentlich stark vorragend. Biologie: Viele Arten ektoparasitisch an Larven von Blattminierern. Oft ist hier die ökologische Nische des Wirtes entscheidend, weniger die systematische Zugehörigkeit. So attackieren viele Arten der Unterfamilie Entodoninae sowohl Käfer, Schmetterlinge und Dipteren, vorausgesetzt, deren Larven leben als Blattminierer. Einige Eulophiden entwickeln sich in Gallen von Gallmilben (Acari), wieder andere als Eiparasitoide. Bemerkungen: In Mitteleuropa sehr schlecht bearbeitet. Ausser für die Tetrastichinen (Graham 1987, 1991) sind keine brauchbaren, umfassenden Schlüssel vorhanden. Einige Gattungen wurden jedoch in neuerer Zeit revidiert (vgl. Noyes 2007). Als eine der wenigen Familien der Chalcidoidea ist die Monophylie der Eulophiden sowohl morphologisch wie auch molekular ­unumstritten. 52 Katalog: Chalcidoidea Eupelmidae Anzahl Arten: CH 15; D 32; CZ 40; GB 14; W 900. Diagnose: Körperlänge 1,3–7,5 mm. Farbe meist glänzend metallisch, gelegentlich gelblich. Antenne mit 7–11 Flagellomeren, oft mit 1 Anellus; Oberfläche des Körpers ± glatt; Prepectus deutlich, breit oval; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron beim Weibchen vergrössert und stark konvex, beim Männchen meist nicht modifiziert, konkav; Mesocoxa immer hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel mit sehr langer Marginal- und kurzer Postmarginal- und Stigmalader; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Metafemur nicht modifiziert; Tarsen mit 5 Tarsomeren; Mesotarsus beim Weibchen verbreitert, unterseits mit auffälligen Zäpfchen und Haarpolstern, beim Männchen oft nicht modifiziert; Propodeum glatt oder leicht skulpturiert, in der Mitte oft sehr kurz; Metasoma durch kurzen Petiolus deutlich vom Mesosoma abgesetzt; Gaster oval bis länglich; Ovipositor wenig bis stark vorragend. Biologie: Meist primäre oder fakultativ sekundäre Ektoparasitoide von Larven von Lepidopteren, Coleopteren, Homopteren, Hymenopteren und Neuropteren. Gewisse Arten sind Endoparasitoide in Eiern von Blattopteren und Lepidopteren, einige sogar Räuber von Insekten- und Spinneneiern. Arten der Unterfamilie Calasotinae sind mit Holzinsekten assoziert. Bemerkungen: In Mitteleuropa schlecht bearbeitet. Bestimmungsschlüssel von Kalina (1984, Paläarktis) und Gibson (1989, 1995, Weltfauna) für Gattungen; der Schlüssel in Trjapitsyn (1988) ist veraltet. 53 Katalog: Chalcidoidea Eurytomidae Anzahl Arten: CH 40; D 111; CZ 60; GB 91; W1425. Diagnose: Körperlänge 1,4–6 mm. Farbe normalerweise schwarz, oder schwarz mit gelblichen Partien. Antenne mit 7–11 Flagellomeren, oft mit 1 Anellus; Antenne des Männchens auffallend gesägt und lang behaart; Oberfläche des Körpers oft auffallend grob punktiert; Prepectus deutlich, oft oben nach hinten verlängert; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, leicht konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel mit mittellanger Marginal-, Postmarginal- und Stigmalader; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Metafemur nicht modifiziert; Tarsen mit 5 Tarsomeren; Mesotarsus nicht modifiziert; Propodeum punktiert, oft mit Furchen und Kielen; Metasoma durch kurzen bis langen Petiolus deutlich vom Mesosoma abgesetzt; Gaster oval, seitlich zusammengedrückt; Ovipositor leicht vorragend. Biologie: Sowohl entomophage als auch phytophage Gruppen. Eurytoma und Sycophila­Arten meist ektoparasitisch an Wirten in Pflanzenmaterial, z.B. Gallbildner; Bruchophagus und ­Tetramesa dagegen phytophag in Samen von Leguminosen bzw. als Stängelminierer in Gräsern. Bemerkungen: In Mitteleuropa sehr schlecht bearbeitet; Bestimmung der mitteleuropäischen Arten z.Z. fast unmöglich: Bestimmungsschlüssel in Trjapitsyn (1988) schwierig zu gebrauchen, derjenige von Zerova (1995) in Russisch! 54 Katalog: Chalcidoidea Leucospidae Anzahl Arten: CH 4; D 3; CZ 4; GB 0; W 240. Diagnose: Körperlänge 6–17 mm. Farbe schwarz mit gelben Flecken und Streifen, sehr ähnlich gewissen Falten- und Grabwespen. Antenne meist mit 11 Flagellomeren (letztes klein), ohne Anelli; Oberfläche des Körpers recht grob punktiert; Prepectus sehr klein, unauffällig; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel der Länge nach gefaltet (ähnlich Faltenwespen), mit kurzer Marginal- und Stigmalader und langer Postmarginal­ ader; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Metafemur stark verdickt, an der Unterseite bedornt; Tarsen mit 5 Tarsomeren; Mesotarsus nicht modifiziert; Propodeum punktiert, mit erkennbaren Plica; Metasoma durch kurzen Petiolus recht deutlich vom Mesosoma abgesetzt; Gaster etwas länger als breit, nach hinten leicht verbreitert; Ovipositor lang und über den Rücken des Gasters nach vorne gebogen. Biologie: Ektoparasitoide von verschiedenen Wildbienen (Apidae), darunter der Mauerbiene Megachila parietina. Bemerkungen: In Mitteleuropa gut bearbeitet; Bestimmungsschlüssel und Verbreitungskarten für die vier seltenen Arten der Schweiz in Baur & Amiet (2000). 55 Katalog: Chalcidoidea Mymaridae (Fairy flies) Anzahl Arten: CH 30; D 104; CZ 26; GB 87; W 1400. Diagnose: Körperlänge 0,1–1,8 mm. Farbe schwarz mit ± ausgedehnten gelblichen Partien, nicht metallisch. Kopf mit H-förmigen Furchen; Antenne nahe beim Augeninnenrand eingelenkt, mit 6–11 Flagellomeren; Oberfläche des Körpers ± glatt; Prepectus klein; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, leicht konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel mit kurzer Marginal- und ± fehlender Postmarginal- und Stigmalader; Membran des Hinterflügels nicht bis zur Flügelbasis reichend, Hinterflügel daher gestielt; Flügel meist mit langen Fransen; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Metafemur nicht modifiziert; Tarsen mit 4 oder 5 Tarsomeren; Mesotarsus nicht modifiziert; Propodeum ± glatt; Metasoma durch kurzen bis langen Petiolus deutlich vom Mesosoma abgesetzt; Gaster kurz oval; Ovipositor wenig bis stark vorragend. Biologie: Solitäre Endoparasitoide von Insekteneiern. Zu den Mymariden gehört das kleinste Insekt der Welt, Dicopomorpha echmepterygis, deren flügellose Männchen knapp 100 µm lang sind! Die Art parasitiert Eier von Staubläusen (Psocoptera). Bemerkungen: In Mitteleuropa ausserordentlich schlecht bearbeitet; keine modernen Bestimmungsschlüssel vorhanden. 56 Katalog: Chalcidoidea Ormyridae Anzahl Arten: CH 5; D 12; CZ 8; GB 3; W 90. Diagnose: Körperlänge 1,1–6,7 mm. Farbe metallisch grün bis schwarz. Antenne mit 11 Flagellomeren, einschliesslich 1–3 Anelli; Oberfläche des Körpers fein skulpturiert, Gaster jedoch mit auffallend grober Skulptur; Prepectus relativ klein; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, leicht konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel mit langer Marginal- und kurzer Postmarginalund Stigmalader; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Metafemur nicht modifiziert; Tarsen mit 5 Tarsomeren; Mesotarsus nicht modifiziert; Propodeum ± fein skulpturiert; Metasoma durch sehr kurzen Petiolus deutlich vom Mesosoma abgesetzt; Gaster kurz oval; Ovipositor leicht vorragend. Biologie: Primäre oder sekundäre Parasitoide von Gallbildnern, z.B. Gallwespen, phytophagen Eurytomiden (Chalcidoidea) und Dipteren. Bemerkungen: In Mitteleuropa schlecht bearbeitet; keine umfassenden Bestimmungsschlüssel vorhanden. Bei uns nur wenige Arten in der Gattung Ormyrus. 57 Katalog: Chalcidoidea Perilampidae Anzahl Arten: CH 15; D 40; CZ 16; GB 9; W 260. Diagnose: Körperlänge 1,3–6 mm. Farbe auffallend glänzend metallisch, von schwarz über grün bis golden. Antenne mit 11 Flagellomeren, einschliesslich 1 Anellus; Oberfläche des Körpers grob punktiert; Prepectus vorhanden, oft mit Pronotum verwachsen; Mesosoma kompakt, stark gewölbt; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, leicht konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel mit langer Marginal- und kurzer Postmarginal- und Stigmalader; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Metafemur nicht verdickt, ohne Dornen; Tarsen mit 5 Tarsomeren; Mesotarsus nicht modifiziert; Propodeum glatt oder ± ausgedehnt punktiert; Metasoma durch kurzen Petiolus deutlich vom Mesosoma abgesetzt; Gaster kurz und hoch; erstes und zweites Gastraltergum dorsal verwachsen; Ovipositor kaum vorragend. Biologie: Meist Hyperparasitoide von Lepidopteren und Symphyten via Ichneumonidae und ­Tachinidae. Bemerkungen: In Mitteleuropa schlecht bearbeitet. Bestimmungschlüssel Boucek (1956). Bei uns sind die Arten der Gattung Perilampus recht häufig 58 Katalog: Chalcidoidea Pteromalidae Anzahl Arten: CH 300; D 663; CZ 474; GB 532; W 4115. Diagnose: Körperlänge 1,2–8 mm. Farbe von glänzend metallisch grün bis schwarz, manchmal matt schwarz oder gelblich. Antenne mit 6–11 Flagellomeren, meist mit 1–3 Anelli; Oberfläche des Körpers oft netzartig, gelegentlich ± glatt; Prepectus oft breit dreieckig; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, leicht konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel mit langer Marginal-, Postmarginal- und Stigmalader; Marginalader normalerweise weniger als 3 × so lang wie Stigmalader; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Metafemur selten leicht verdickt, an der Unterseite aber immer ohne Dornen; Tarsen mit 5 Tarsomeren (ausser Weibchen von Macromesus mit 4 Mesotarsomeren); Mesotarsus nicht modifiziert; Propodeum variabel, oft mit deutlichen Plica; Metasoma durch kurzen oder langen Petiolus deutlich vom Mesosoma abgesetzt; Gaster kurz oval bis lang und zugespitzt; Ovipositor meist wenig vorragend, selten länger (Roptrocerus). Biologie: Primär- und Sekundärparasitoide zahlreicher Insektengruppen. Entwicklung als Ektooder Endoparasitoide, Idiobionten oder Koinobionten, gregär oder solitär. Entwicklung einiger Arten als Räuber, wenige gar als Phytophage. Verschiedene Arten in den Unterfamilien Cleonyminae und Pteromalinae sind mit Holzinsekten assoziert. Bemerkungen: In Mitteleuropa sehr schlecht bearbeitet, trotz hervorragender Bestimmungsschlüssel von Graham (1969) und Boucek & Rasplus (1991). Die Pteromaliden umfassen einige nicht näher verwandte Taxa und sind innerhalb der Chalcidoidea nur durch ursprüngliche Merkmale charakterisiert. Die einzelnen Unterfamilien sind morphologisch so divers, dass hier leider keine umfassende Darstellung der diagnostischen Merkmale der Pteromaliden gegeben werden kann. 59 Katalog: Chalcidoidea Signiphoridae Anzahl Arten: CH 3; D 2; CZ 3; GB 2; W 80. Diagnose: Körperlänge 0,7–1 mm. Farbe schwarz oder schwarz mit orangen oder gelben Partien, höchstens mit obskurem Metallglanz. Antenne meist mit 3–5 Flagellomeren, einschliesslich langer und unsegmentierter Clava; Oberfläche des Körpers glatt; Prepectus deutlich; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Scutellum mit parallelem Vorder- und Hinterrand, stark quer; Vorderflügel mit langer Marginal- und sehr kurzer Stigmal­ ader, Postmarginalader normalerweise fehlend; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Metafemur nicht modifiziert; Tarsen mit 4 oder 5 Tarsomeren; Mesotarsus nicht modifiziert; Propodeum in der Mitte mit erhöhter, dreieckiger Fläche, welche durch feine Furchen begrenzt ist; Metasoma breit am Mesosoma angesetzt, ohne differenzierten Petiolus; Metasoma meist oval; Ovipositor normalerweise wenig vorragend. Biologie: Meist Endoparasitoide von Pflanzenläusen (Homoptera: Aleyrodoidea, Coccoidea). Bemerkungen: In Mitteleuropa schlecht bearbeitet; Bestimmungsschlüssel nur für Gattungen von Woolley (1988). Bei uns selten. 60 Katalog: Chalcidoidea Tetracampidae Anzahl Arten: CH 10; D 11; CZ 8; GB 7; W 50. Diagnose: Körperlänge 0,8–3,3 mm. Farbe glänzend metallisch grün. Antenne mit 8–10 Flagellomeren, einschliesslich 1 Anellus; Oberfläche des Körpers meist ± glatt; Prepectus breit dreieckig; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, leicht konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel mit langer Marginal- und relativ kurzer Postmarginal- und Stigmalader; Marginalader gelegentlich stark verdickt (Männchen Platynocheilus); Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ kurzem, geradem Endsporn; Metafemur nicht modifiziert; Tarsen mit 5 (Weibchen) oder 4 (Männchen der Tetracampinae) Tarsomeren; Mesotarsus nicht modifiziert; Propodeum glatt, oft auffallend lang und dicht behaart; Metasoma durch kurzen oder langen Petiolus deutlich vom Mesosoma abgesetzt; Gaster kurz bis lang oval; Ovipositor oft wenig vorragend. Biologie: Wenig bekannt: Arten der Gattungen Dipriocampe und Foersterella entwickeln sich endoparasitisch in Eiern von Buschhornblattwespen (Symphyta: Diprionidae) bzw. Blattkäfern der Gattung Cassida sp. (Coleoptera: Chrysomelidae). Bemerkungen: In Mitteleuropa schlecht bearbeitet; Bestimmungsschlüssel von Boucek (1958). 61 Katalog: Chalcidoidea Torymidae Anzahl Arten: CH 60; D 93; CZ 107; GB 75; W 1150. Diagnose: Körperlänge 1,1–7,5 mm. Farbe meist glänzend metallisch, in einigen Gruppen gewisse Partien gelblich. Antenne mit 11 Flagellomeren, meist mit nur 1 Anellus, selten mit 2–3 Anelli; Oberfläche des Körpers meist recht glatt; Prepectus breit dreieckig; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, leicht konkav; Mesocoxa deutlich hinter der Mitte des Mesopleurons eingelenkt; Vorderflügel mit sehr langer Marginal- und kurzer Postmarginal- und Stigmalader; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Metafemur gelegentlich leicht oder stark verdickt, an der Unterseite mit einem oder mehreren Dornen; Tarsen mit 5 Tarsomeren; Mesotarsus nicht modifiziert; Propodeum oft glatt, ohne Plicae, gelegentlich stärker skulpturiert; Metasoma durch kurzen Petiolus deutlich vom Mesosoma abgesetzt; Gaster oval; Ovipositor immer deutlich vorragend, oft lang bis sehr lang. Biologie: Oft Ektoparasitoide von Insekten in Pflanzenteilen, wie Gallen, Samen etc. Gewisse Arten ernähren sich zuerst vom Gallbildner, anschliessend phytophag von der Galle. Einige Taxa (Megastigmus) leben rein phytophag. Bemerkungen: In Mitteleuropa schlecht bearbeitet; Bestimmungsschlüssel von Graham & Gijswijt (1998, nur Torymus) und in Trjapitsyn (1988). 62 Katalog: Chalcidoidea Trichogrammatidae Anzahl Arten: CH 10; D 18; CZ 25; GB 29; W 675. Diagnose: Körperlänge 0,3–1,2 mm. Farbe gelblich mit ± ausgedehnter dunkler Zeichnung, ohne Metallglanz. Antenne meist mit 3–7 Flagellomeren, Clava mit 1–5 Flagellomeren; Ober­ fläche des Körpers glatt; Prepectus deutlich; Scutellum hinten gerundet, deutlich länger als Metanotum; Mesopleuron nicht speziell modifiziert, konkav; Mesocoxa deutlich hinter der Mitte des Meso­pleurons eingelenkt; Vorderflügel mit variabler Marginal- und Stigmalader, Postmarginalader normalerweise fehlend; Flügel mit deutlichen, radialen Haarstreifen; Membran des Hinterflügels bis zur Flügelbasis reichend; Protibia mit relativ langem, apikal gekrümmtem Endsporn; Meta­femur nicht modifiziert; Tarsen mit 3 Tarsomeren; Mesotarsus nicht modifiziert; Metasoma breit am Mesosoma angesetzt, ohne differenzierten Petiolus; Metasoma meist oval; Ovipositor meist wenig vorragend, selten lang. Biologie: Solitäre oder gregäre Endoparasitoide von Eiern verschiedenster Insekten, darunter Lepidopteren, Hemipteren, Thysanopteren, Hymenopteren etc. Ein paar Arten parasitieren Eier von aquatischen Insekten wie Libellen oder Wasserkäfer, wobei sie zur Eiablage unter Wasser tauchen. Bemerkungen: In Mitteleuropa sehr schlecht bearbeitet; keine empfehlenswerten Bestimmungsschlüssel. Arten der Gattung Trichogramma werden häufig in der biologischen Schädlingsbekämpfung eingesetzt. 63 Katalog: Cynipoidea Cynipoidea Diagnose: Körperlänge 0,8–15 mm. Farbe schwarz bis gelblich, nicht metallisch glänzend. Antenne ungekniet, ohne Anelli; Hinterecke des Pronotums reicht bis zur Tegula, Prepectus fehlt; Adern des Vorderflügels meist stark reduziert, meist mit weniger als 2 geschlossenen Zellen (Ausnahme: Ibalidae mit 7); Submarginalader des Vorderflügels verläuft parallel zum Flügelvorderrand; Pterostigma fehlend; Protibia mit 1, Meso- und Metatibia mit 1–2 Endspornen; Tarsen mit 5 Tarsomeren; Ovipositor wenig vorragend. Biologie: Die Cynipoidea nehmen eine Sonderstellung unter den Parasitica ein, da sich viele ­Arten als reine Phytophage entwickeln. Dies betrifft jedoch nur die Vertreter der Familie der ­Cynipidae, der echten Gallwespen, welche zumeist an Bäumen und Sträuchern charakteristische Gallen verursachen (Abb. 14). Oft wird der Ausdruck Gallwespe jedoch pauschal für die gesamte Überfamilie der Cynipoidea verwendet. Dies ist freilich nicht korrekt, denn die Arten der übrigen Familien sind Primär- oder Sekundärparasitoide von holometabolen Insekten. Abb. 14. Zwei Beispiel von Gallen der echten Gallwespen (Cynipidae): oben ein Eichengallapfel von Cynips quercusfolii, unten eine Rosengalle von Diplolepis rosae. R. Pflugshaupt. 64 Katalog: Cynipoidea Cynipidae (Gallwespen) Anzahl Arten: CH 78; D 98; CZ 162; GB 91; W 1200. Diagnose: Körperlänge 1–4(–10) mm. Antenne mit 11–12 (Weibchen) oder 12–13 (Männchen) Flagellomeren; Mesoscutum ohne Querrippen, jedoch Kopf und Körper ± rau skulpturiert; Vorderflügel mit Radialzelle breit, normalerweise deutlich weniger als 4 × so lang wie breit; ohne oder mit 1–2 geschlossenen Zellen (Radial- und Basalzelle); Meso- und Metatibia mit 2 Endspornen; Fussklauen oft mit basalem Lobus; Petiolus kurz; Gaster mässig stark seitlich zusammengedrückt, von der Seite betrachtet oval, hinten zugespitzt; Hypopygium des Weibchens meist mit Endsporn. Biologie: Die Cynipiden bilden eine der grossen phytophagen Gruppen unter den Parasitica. Die Mehrheit der Arten verursachen Gallen, vor allem an Eichen (Cynipini), daneben auch an Rosengewächsen (Rhoditini) und einigen weiteren Pflanzenfamilien. Die Galle wird nicht von der Gallwespe gebildet, sondern ist eine spezifische Reaktion der Pflanze auf den Speichel der Gallwespenlarve. Dies führt zur Bildung der arttypischen und formenreichen Gallen. Die einzelnen Arten sind meist an wenige Wirtspflanzen gebunden und legen ihre Eier in ganz bestimmte Pflanzenteile ab, z.B. in Wurzeln, Knospen, Blüten und Blätter. Bei einigen Arten wechseln sich asexuelle mit sexuellen Generationen ab, wobei die Entwicklung an unterschiedlichen Stellen der Wirtspflanze stattfinden kann. Arten der Tribus Synergini sind Inquilinen, d.h. Einmieter in den Gallen anderer Gallwespen. Sie ernähren sich ebenfalls phytophag. Bemerkungen: In Mitteleuropa recht gut bearbeitet. Die neuen Bestimmungsschlüssel von Melika (2006a, 2006b) zur ukrainischen Fauna decken auch unser Gebiet ab. 65 Katalog: Cynipoidea Figitidae Anzahl Arten: CH 10; D 104; CZ 48; GB 119; W ?1000. Diagnose: Körperlänge 0,8–5 mm. Antenne mit 13 (Weibchen) oder 11–13 (Männchen) Flagellomeren; Mesoscutum ohne Querrippen, Kopf und Körper meist ± glatt; Vorderflügel mit Radial­ zelle breit, normalerweise deutlich weniger als 4 × so lang wie breit; ohne oder mit 1 geschlossenen Zelle (Radialzelle); Meso- und Metatibia mit 1–2 Endspornen; Fussklauen ohne basalen Lobus; Petiolus kurz bis sehr lang; Gaster recht stark seitlich zusammengedrückt, von der Seite betrachtet oval, hinten zugespitzt; Petiolus kurz bis lang; Gaster mässig stark seitlich zusammengedrückt, von der Seite betrachtet oval, hinten zugespitzt; Hypopygium des Weibchens ohne Endsporn. Biologie: Die Wirtsbeziehungen variieren je nach Unterfamilie. Die Charipinen sind Hyperparasitoide von Blattlauswespen (Braconidae: Aphidiinae), die Figitinen primäre Parasitoide von Neuro­ pteren und Dipteren (Syrphidae, Chamaemyiidae). Die artenreichen Eucoilinen schliesslich sind Endoparasitoide verschiedener Dipterenlarven. Einige Arten sind von ökonomischer Bedeutung, z.B. attackiert Rhoptromeris eucera die Fritfliege Oscinella frit (Diptera: Chloropidae), während Trybliographa rapae ein wichtiger Gegenspieler der Kohlfliege Delia brassicae (Anthomyiidae) ist. Bemerkungen: In Mitteleuropa schlecht bearbeitet. Die Unteramilien Charipidae, Eucoilinae und Figitinae wurden bis vor kurzem im Rang von Familien geführt. Die Bestimmungsschlüssel von Fergusson (1986, Charipinae und Figitinae) und Quinlan (1978, Eucoilinae) für die britischen Arten sind mit Vorsicht anzuwenden, da sie die einheimische Fauna nur sehr unvollständig abdecken. 66 Katalog: Cynipoidea Ibaliidae Anzahl Arten: CH 2; D 3; CZ 2; GB 2; W 15. Diagnose: Körperlänge 9–15 mm. Antenne meist mit 11 (Weibchen) oder 13 (Männchen) Flagellomeren; Kopf und Körper teilweise skulpturiert, Mesoscutum mit kräftigen Querrippen; Vorderflügel mit Radialzelle sehr lang und schmal, ca. 9 × so lang wie breit; mit 7 geschlossene Zellen; Meso- und Metatibia mit 2 Endspornen; Fussklauen ohne basalen Lobus; Petiolus kurz; Gaster sehr stark seitlich zusammengedrückt, von der Seite betrachtet vorne und hinten breit abgerundet, in der Mitte mit Ober-und Unterseite ± parallel; Hypopygium des Weibchens ohne Endsporn. Biologie: Endoparasitoide von Holzwespen (Siricidae). Bemerkungen: In Mitteleuropa schlecht bearbeitet; Bestimmungsschlüssel von Fergusson (1986, britische Arten) und Liu & Nordlander (1994, Weltfauna). Zwei seltene Arten der Gattung Ibalia sind für die Schweiz nachgewiesen. 67 Katalog: Evanioidea Evanioidea Diagnose: Körperlänge 2–12 mm. Grundfarbe meist schwarz, oft mit rötlicher oder sonstiger heller Zeichnung, vor allem auf dem Hinterleib. Antenne gekniet bei einigen Evaniidae, sonst ungekniet, mit (8–)11–12 Flagellomeren. Hinterecke des Pronotums reicht bis zur Tegula, Prepectus fehlt. Vorderflügel mit ziemlich vollständiger Aderung, nur bei Evaniidae teilweise reduziert, immer mit mindestens 3 geschlossenen Zellen; Costa und Subcosta voneinander durch eine Membran getrennt, eine deutliche Costalzelle bildend; Pterostigma vorhanden. Das Metasoma setzt sehr hoch am Propodeum an, so dass zwischen der Ansatzstelle und den Hinterhüften ein deutlicher Zwischenraum entsteht. Sterna stark sklerotisiert, Luftlöcher auf allen ausser dem achten Metasomalsegment reduziert. Ovipositor kurz bis sehr lang. Die Evanioidea stellen wahrscheinlich keine monophyletische Gruppe dar. Aulacidae Anzahl Arten: CH 2; D 3; CZ 5; GB 1; W 150. Diagnose: Körperlänge 5–10 mm. Antenne ungekniet, beim Weibchen mit 12, beim Männchen mit 11 Flagellomeren, knapp oberhalb des Clypeus eingelenkt. Propleuren verlängert, eine Art «Hals» bildend. Flügelgeäder im Vorderflügel ziemlich vollständig, im Gegensatz zu den Evaniidae und Gasteruptiidae mit dem zweiten rücklaufenden Nerv vorhanden (2M–Cu, vgl. Ichneumonidae). Hinterflügel ohne Anallobus. Innenseite der Metacoxa beim Weibchen meist mit einer Längsfurche (Führungslinie für den Ovipositor). Metatibia nicht verdickt. Erstes Metasomalsegment konisch, Terga 1 und 2 miteinander verwachsen. Ovipositor lang bis sehr lang. Biologie: Aulacidae sind Endoparasitoide von holzbewohnenden Pflanzenwespen (Xiphydriidae) und Käfern (meist Cerambycidae und Buprestidae). Von Aulacus striatus werden die Eier direkt in die Wirtseier abgelegt, welche die adulte Wespe im Holz aufspürt, indem sie die Eiablage-Löcher der Wirte aufsucht. Die Parasitoidenlarve verhält sich nun ruhig, bis der Wirt beinahe Puppenreife erreicht und beginnt, sich aus dem Holz hinaus zu nagen. Erst kurz bevor er die Oberfläche des Holzes erreicht, frisst der Parasitoid die Holzwespenlarve vollständig auf. Aus den anderen beiden Gattungen sind keine näheren Informationen zur Biologie verfügbar. Bemerkungen: Von dieser Familie sind vergleichsweise wenige rezente Arten bekannt, dafür finden sich unter den Fossilien und in Bernstein zahlreiche Vertreter, was auf eine grössere Abundanz der Aulacidae im Mesozoikum hindeutet. Bestimmungsschlüssel von Oehlke (1984) für die deutschen, von Crosskey (1951) für die britischen Arten. 68 Katalog: Evanioidea Evaniidae (Hungerwespen) Anzahl Arten: CH 2; D 1; CZ 2; GB 2; W 400. Diagnose: Körperlänge 3–7 mm. Färbung meist ganz schwarz. Antenne ungekniet (Brachy­ gaster) oder gekniet (Evania), mit 11 (selten 8) Flagellomeren, deutlich oberhalb des Clypeus eingelenkt. Propleuren nicht verlängert, Kopf breit am Mittelsegment ansetzend. Flügel­geäder im Vorderflügel ziemlich vollständig bis hin zu stark reduziert und nur noch 3 geschlossene Zellen aufweisend; im Gegensatz zu den Aulaciden aber ohne den zweiten rücklaufenden Nerv (2M–Cu). Hinterflügel mit einem deutlichen Anallobus (vgl. Aculeata) und mit meist stark reduzierter Aderung. Metatibia nicht verdickt. Erstes Metasomalsegment als langer Stiel (Petiolus) ausgebildet, Terga 1 und 2 nicht miteinander verwachsen; Rest des Metasomas (Gaster) kurz, «taschenartig» und seitlich zusammengedrückt. Ovipositor kurz, meist nicht sichtbar. Biologie: Die Evaniidae sind vor allem in den Tropen verbreitet. Sie parasitieren Eigelege von Schaben, in deren Ootheken sie sich gleich von mehreren Eiern ernähren, was sie ­gemäss Definition zu Räubern statt Parasitoiden macht. Unsere einzige freilebende Art, Brachygaster ­minuta, attackiert verschiedene Waldschabenarten der Gattung Ectobius (s. Brown 1973). Bemerkungen: Oehlke (1984) erstellte einen Schlüssel der deutschen, Crosskey (1951) einen der britischen Arten. Neben Brachygaster minuta ist bei uns auch Evania appendigaster, ein Parasitoid von synanthropen Schaben der Gattung Periplaneta, zu erwarten. 69 Katalog: Evanioidea Gasteruptiidae (Gichtwespen) Anzahl Arten: CH 17; D 15; CZ 17; GB 3; W 500. Diagnose: Körperlänge 6–12 mm. Antenne ungekniet, beim Weibchen mit 12, beim Männchen mit 11 Flagellomeren, deutlich oberhalb des Clypeus eingelenkt. Propleuren verlängert, eine Art «Hals» bildend. Flügelgeäder im Vorderflügel ziemlich vollständig, im Gegensatz zu den Aulaciden aber ohne den zweiten rücklaufenden Nerv (2M–Cu); Flügel der Länge nach faltbar. Hinterflügel ohne Anallobus. Metatibia deutlich verdickt. Erstes Metasomalsegment konisch, Terga 1 und 2 miteinander verwachsen. Ovipositor ziemlich lang bis sehr lang. Biologie: Die europäischen Gasterupiidae entwickeln sich in den Nestern von Grabwespen, solitären Bienen und Wespen. Ihre Lebensweise muss eher als räuberisch oder kleptoparasitisch denn als parasitoid bezeichnet werden, da sie zum Teil über mehrere Brutzellen herfallen oder aber sich vorwiegend vom Nestvorrat statt vom eigentlichen Wirt ernähren. Um zu den Brutzellen zu gelangen, benutzen die Gasteruptiidae normalerweise einfach den Nesteingang. Zu den zahlreichen tropischen Arten sind noch keine biologischen Informationen vorhanden. Bemerkungen: Die adulten Gasteruptiidae zeichnen sich durch einen typischen Flugstil aus, bei welchem sie die Hinterbeine in charakteristischer Weise hängen lassen, was wegen der angeschwollenen Hintertibien noch mehr auffällt («Helikopterflug»). Oehlke (1984) erstellte einen Schlüssel der deutschen, Crosskey (1951) einen der britischen und Ferrière (1946) einen der schweizerischen Arten. 70 Katalog: Ichneumonoidea Ichneumonoidea Diagnose: Körperlänge 1,5–50 mm. Farbe sehr unterschiedlich, häufig mit vielfältiger Zeichnung, nur selten metallisch. Antenne ungekniet, lang, fadenförmig; mit mindestens 11, meist deutlich mehr (20–40) Flagellomeren. Hinterecke des Pronotums reicht bis zur Tegula, Prepectus fehlt. Vorderflügel mit mindestens 3, meist mehr geschlossenen Zellen; Costa und Subcosta direkt nebeneinander liegend oder verschmolzen, so dass Costalzelle entlang des Flügelvorderrandes fehlt; Pterostigma vorhanden. Metasomalsterna schwach sklerotisiert, bei getrockneten Exemplaren häufig kollabiert; erstes Sternum in zwei Teile geteilt, Vorderteil stark sklerotisiert und manchmal mit Tergum verwachsen, Hinterteil häutig. Ovipositor häufig lang. Braconidae (Brackwespen) Anzahl Arten: CH 934; D 1607; CZ 1081; GB 1182; W 17 605. Diagnose: Körperlänge 1,5–25 mm, im Schnitt deutlich kleiner als die Ichneumonidae. Flügelgeäder variabel, bei kleineren Arten oft teilweise reduziert; zweiter rücklaufender Nerv immer fehlend, dafür häufig mit Ader 1/Rs + M, welche die grosse Zelle unter dem Pterostigma in zwei Teile teilt. Metasomalterga 2 und 3 meist miteinander verwachsen. Biologie: Die Braconiden weisen eine Vielzahl von Lebensweisen auf, wobei ­ holometabole ­Insekten im Wirtsspektrum klar überwiegen und die meisten Arten endoparasitoide Koino­bionten sind. Dies tut aber der Vielfalt unrecht: auch die ektoparasitische, idiobionte Lebensweise ist weit verbreitet, und im Gegensatz zu den Ichneumonidae parasitieren einige Arten auch auf hemi­ metabolen Insekten und befallen manchmal auch Adultstadien des Wirts. Bemerkungen: In Mitteleuropa eher schlecht bearbeitet. Van Achterberg (1990) schlüsselte die holarktischen, Sharkey (1993) die weltweiten Unterfamilien. Artbestimmungen sind in einzelnen Unterfamilien gut möglich, häufig allerdings auf eine bestimmte Region bezogen (vgl. Yu et al. 2005); in anderen Unterfamilien, zum Beispiel den artenreichen Braconinae, sind nicht einmal für Gattungen akurate Bestimmungsschlüssel vorhanden. 71 Katalog: Ichneumonoidea Ichneumonidae (Echte Schlupfwespen) Anzahl Arten: CH 1290; D 4126; CZ 1932; GB 2446; W 23 331. Diagnose: Körperlänge 2–50 mm. Flügelgeäder sehr konstant, nur bei ganz kleinen Arten (z.B. Tersilochinae) eine sehr beschränkte Reduktion der Flügeladerung; zweiter rücklaufender Nerv fast immer vorhanden, Ader 1/Rs + M fehlend, dadurch eine grosse, ungeteilte Zelle unter dem Pterostigma. Metasomalterga 2 und 3 im Gegensatz zu den Braconidae immer voneinander getrennt und beweglich. Biologie: Der Wirtskreis von Ichneumoniden ist weit homogener als der von Braconiden, da nur die Larven von holometabolen Insekten befallen werden. Eine Ausnahme bilden einige Parasitoide von Eigelegen von Spinnen und Pseudoskorpionen und von adulten Spinnen. Sehr gut vertreten unter den Wirten sind Lepidopteren und Symphyten; letztere tauchen bei den Braconiden nur selten als Wirte auf. Bei den Ichneumoniden ist eine gregäre Entwicklung weit seltener als bei den Braconiden; eine Entwicklung als Hyperparasitoid kommt umgekehrt weitaus häufiger vor. Bemerkungen: Der Bearbeitungsstand der Ichneumonidae schwankt sehr stark je nach Unterfamilie. Eine Bestimmung der Unterfamilien kann mit dem Schlüssel von Wahl (1993) erfolgen. Für die am besten bearbeitete, grössere Unterfamilie der Pimplinae existieren mehrere Schlüssel, von denen Kasparyan (1981) die mitteleuropäischen Arten relativ vollständig abdeckt (vgl. auch Yu et al.2005). In den weiteren Unterfamilien sind noch zahlreiche Revisionen nötig. 72 Katalog: Mymarommatoidea Mymarommatoidea Die bizarren Mymarommatoidea enthalten weltweit nur 20 beschriebene Arten in 6 Gattungen, wobei nur die Hälfte der Arten rezent ist. Die ältesten Funde reichen bis in die Kreidezeit zurück. Die heutigen Arten sind wohl Relikte einer einst viel diverseren Gruppe. Durch die vielen speziellen Merkmale sind sie unverwechselbar. Mymarommatidae Anzahl Arten: CH 1; D 1; CZ 1; GB 1; W 10. Diagnose: Körperlänge 0,5–0,7 mm. Farbe bräunlich, nicht metallisch. Kopf vorne halbkugelig, hinten gerade abgestutzt; Vorder- und Rückseite des Kopfes durch eine gefaltete Membran verbunden, wobei das Hinterhaupt handorgelartig ausgeklappt werden kann; Mandibel exodont; Hinterecke des Pronotums reicht bis zur Tegula, Prepectus fehlt; Vorderflügel am Rand mit sehr langen Fransen, Membran netzartig skulpturiert; Hinterflügel ohne Membran, zu einer kurzen, an der Spitze gespaltenen Ader zurückgebildet; erstes und zweites Metasomalsegment zylindrisch, einen zweigliedrigen Petiolus bildend; Ovipositor wenig vorragend. Biologie: Unbekannt. Ein Exemplar wurde aus einem Porenpilz gezogen. Bemerkungen: In Mitteleuropa schlecht untersucht. Gibson et al. (2007) haben die Überfamilie kürzlich grundlegend revidiert und neue Familien und Gattungen beschrieben. In der Revision ist auch ein Gattungsschlüssel enthalten. Bei uns wurde bisher nur Mymaromma anomalum (= Palaeomymar) wenige Male gefunden, u.a. auch bei Trimbach (vgl. Vanhorniidae, S. 79). F C 73 Katalog: Platygastroidea Platygastroidea (Zehrwespen) Diagnose: Körperlänge 0,8–3(–8) mm. Farbe schwarz, manchmal mit gelblichen Partien oder Extremitäten, nie metallisch. Antenne gekniet, mit (4–)8–10(–12) Flagellomeren, ohne Anelli; Hinterecke des Pronotums reicht bis zur Tegula, Prepectus fehlt; Flügel ohne Zellen; Adern des Vorderflügels immer mindestens bis auf Marginal-, Postmarginal- und Stigmalader reduziert, oft fehlend; Submarginalader verläuft parallel zum Flügelvorderrand; Pterostigma fehlend; Protibia mit 1 Endsporn, Meso- und Metatibia mit 2 Endspornen; Tarsen mit 5 Tarsomeren; Ovipositor äusserlich nicht sichtbar. Platygastridae Anzahl Arten: CH 10; D 80; CZ 40; GB 157; W 1100. Diagnose: Körperlänge 0,8–2(–4) mm. Antenne meist mit 8 Flagellomeren, selten mit weniger; Männchen mit 2. oder selten 1. Flagellomer modifiziert; Vorderflügel nur mit punktförmiger Marginalader, oft überhaupt ohne Adern; zweites Metasomaltergum viel länger als das Dritte. Biologie: Wenig bekannt. Einige Arten sind Endoparasitoide von Gallmücken (Diptera: Cecidomyiidae). Platygaster zosine hat eine polyembryonale Entwicklung. Bemerkungen: In Mitteleuropa eine der am schlechtesten untersuchten Insektenfamilien; ­Bestimmungsschlüssel in Trjapitsyn (1988). Die Gattung Inostemma ist leicht erkennbar am Cornutus, einem vom ersten Metasomaltergum aus über das Mesosoma nach vorne gebogenen Horn, das als Scheide für den überlangen Ovipositor dient. 74 Katalog: Platygastroidea Scelionidae Anzahl Arten: CH 20; D 56; CZ 52; GB 102; W 3000. Diagnose: Körperlänge 1–3(–8) mm. Antenne meist mit 9–10 Flagellomeren, gelegentlich mit 8 oder weniger; Männchen mit 3. Flagellomer modifiziert; Vorderflügel meist mit Marginal-, Postmarginal- und Stigmalader, die Adern selten undeutlich oder fehlend; zweites Metasomaltergum meist gleich lang oder kürzer als das Dritte. Biologie: Endoparasitoide von Eiern verschiedener Insekten und anderer Arthropoden. Bemerkungen: In Mitteleuropa eine der am schlechtesten untersuchten Insektenfamilien; ­Bestimmungsschlüssel in Trjapitsyn (1988). 75 Katalog: Proctotrupoidea Proctotrupoidea (Zehrwespen) Diagnose: Körperlänge 1,6–10 mm. Farbe schwarz, manchmal mit ± ausgedehnten gelblichen Partien oder Extremitäten, nie metallisch. Antenne gekniet oder ungekniet, mit 9–14 Flagellomeren, meist ohne Anelli; Hinterecke des Pronotums reicht bis zur Tegula, Prepectus fehlt; Vorderflügel mit 0–5 geschlossenen Zellen, Hinterflügel oft ohne geschlossene Zellen; Adern des Vorderflügels oft stark reduziert; Pterostigma fehlend oder vorhanden. Protibia mit 1 Endsporn, Meso- und Metatibia mit 2 Endspornen; Tarsen mit 5 Tarsomeren; Ovipositor variabel. Diapriidae Anzahl Arten: CH 216; D 289; CZ 176; GB 300; W 2300. Diagnose: Körperlänge 1,5–4(–8) mm. Mandibel endodont, d.h. Zähne nach innen gerichtet; Gesicht auf Höhe der Antenneneinlenkstelle meist stark vorstehend (ausser Gattung Ismarus); Antenne gekniet, mit 9–13 Flagellomeren, ohne Anelli. Vorderflügel mit bis zu 3 geschlossenen Zellen, oft jedoch ohne oder nur mit Costal- und Radialzelle; Pterostigma fehlend; Hinterflügel manchmal mit einer geschlossenen Zelle, oft jedoch ohne; Metasoma seitlich betrachtet ± gerade; basale Metasomalterga getrennt, 1. Tergum als Petiolus ausgebildet; Ovipositor ­verborgen. Biologie: Soweit bekannt Endoparasitoide von Dipteren-Puppen, z.B. von Mycetophilidae, Sciaridae oder cyclorrhapheren Fliegenfamilien wie Chloropidae, Muscidae, Tachinidae, Calliphoridae etc. Einige Arten sind Hyperparasitoide an Braconiden und Eulophiden. Bemerkungen: In Mitteleuropa schlecht erforscht; Bestimmungsschlüssel in Trjapitsyn (1988). 76 Katalog: Proctotrupoidea Heloridae Anzahl Arten: CH 5; D 5; CZ 4; GB 3; W 7. Diagnose: Körperlänge 2,5–4 mm. Mandibel endodont, d.h. Zähne nach innen gerichtet; Gesicht auf Höhe der Antenneneinlenkstelle wenig vorstehend; Antenne ungekniet, mit 14 Flagellomeren, einschliesslich einem Anellus. Vorderflügel mit 5 geschlossenen Zellen und dreieckiger erster Medialzelle; Pterostigma vorhanden; Hinterflügel ohne geschlossene Zelle; Metasoma seitlich betrachtet leicht nach unten gebogen oder ± gerade; basale Metasomalterga getrennt, 1. Tergum als langer Petiolus ausgebildet; Ovipositor verborgen. Biologie: Endoparasitoide von Florfliegenlarven (Neuroptera: Chloropidae) Bemerkungen: In Mitteleuropa recht gut erforscht; Bestimmungsschlüssel von Pschorn-Walcher (1971) und Townes (1977, Weltfauna). Bei uns werden die Arten der Gattung Helorus gelegentlich gefunden. 77 Katalog: Proctotrupoidea Proctotrupidae Anzahl Arten: CH 35; D 43; CZ 28; GB 40; W 310. Diagnose: Körperlänge 2–10 mm. Mandibel endodont, d.h. Zähne nach innen gerichtet; Gesicht auf Höhe der Antenneneinlenkstelle wenig vorstehend; Antenne ungekniet, mit 11 Flagellomeren, ohne Anelli. Vorderflügel nur mit 2 geschlossenen Zellen (langer Costal- und kurzer Radialzelle); Pterostigma vorhanden; Hinterflügel ohne geschlossene Zelle; Metasoma seitlich betrachtet deutlich nach unten gekrümmt; basale Metasomalterga getrennt, 1. Tergum als kurzer bis langer Petiolus ausgebildet; Ovipositor immer vorragend, lang bis sehr lang. Biologie: Meist solitäre Endoparasitoide von Käferlarven in verrottendem Holz oder im Boden. Einige Arten parasitieren Pilzmücken (Diptera: Mycetophilidae). Bemerkungen: In Mitteleuropa recht gut erforscht; Bestimmungsschlüssel von Pschorn-Walcher (1971, mit Verbreitungsangaben für die Schweiz), Wall (1986) und Townes & Townes (1981, Weltfauna). 78 Katalog: Proctotrupoidea Vanhorniidae Anzahl Arten: CH 1; D 0; CZ 0; GB 0; W 3. Diagnose: Körperlänge 4,5–6 mm. Mandibel exodont, d.h. Zähne nach aussen gerichtet; Gesicht auf Höhe der Antenneneinlenkstelle wenig vorstehend; Antenne ungekniet, mit 11 Flagellomeren, ohne Anelli. Vorderflügel mit 5 geschlossenen Zellen und dreieckiger erster Medialzelle; Pterostigma vorhanden; Hinterflügel ohne geschlossene Zelle; Metasoma seitlich betrachtet ± gerade; basale Metasomalterga zu Carapax verwachsen, Petiolus nicht ausgebildet; Ovipositor in Längsfurche entlang der Bauchseite nach vorne gerichtet. [Achtung: einige Braconiden der Unterfamilie Cheloninae haben ebenfalls exodonte Mandibeln und weisen zu einem Carapax verwachsene Metasomalterga auf. Bei diesen Arten ist jedoch die Vorderflügeladerung sehr verschieden und der Hinterflügel weist geschlossene Zellen auf.] Biologie: Parasitoide von Schienenkäfern (Coleoptera: Eucnemidae) in Totholz. Bemerkungen: Die einzige europäische Art, Vanhornia leileri, wurde erst 1976 von Karl-Johan Hedqvist aufgrund eines Pärchens aus Schweden beschrieben. Erst vor wenigen Jahren wurde von dieser offenbar sehr seltenen Art bei Trimbach (Olten) ein weiteres Weibchen entdeckt. Seither sind noch zwei weitere hinzugekommen, das eine stammt wiederum aus Trimbach, das andere aus den Savoyen unweit von Genf. 79 Katalog: Stephanoidea Stephanoidea Diese Überfamilie war lange umstritten und enthält heute nur die Familie der Stephanidae. Von den Ichneumonoidea, mit welchen die Stephanoidea am ehesten verwechselt werden können, unterscheiden sie sich durch die typische Zähnchenkrone auf der Stirn und das Fehlen der ­Costalader entlang des vorderen Randes des Vorderflügels, von den Evanoidea durch die selben Merkmale und durch das zwischen den Hinterhüften ansetzende Metasoma. Weitere diagnostische Merkmale sind im Familienabschnitt zu finden. Stephanidae Anzahl Arten: CH 1; D 1; CZ 1; GB 0; W 100. Diagnose: Körperlänge 3–50 mm, bei unserer Art Stephanus serrator ca. 12–20 mm. Körper auffällig lang und schlank. Antenne ungekniet, fadenförmig, mit mehr als 20 Flagellomeren. Kopf auffällig rund und mit charakteristischen Zähnchen auf der Stirn, welche eine Art Krone bilden. Propleuren verlängert, eine Art «Hals» bildend. Hinterecke des Pronotums reicht bis zur Tegula, Prepectus fehlt. Flügelgeäder im Vorderflügel ziemlich vollständig, mit 5 geschlossenen Zellen; Costalader zwischen Flügelschüpchen und Pterostigma fehlend. Metafemur stark verbreitert und mit ventralen Zähnen. Erstes Metasomalsegment verlängert. Ovipositor lang bis sehr lang. Biologie: Die Stephanidae sind Ektoparasitoide von holzbewohnenden Käfern (v.a. Cerambycidae und Buprestidae) und Holzwespen (Siricidae). Über ihre Biologie ist sehr wenig bekannt, zumal sie als Parasitoide von Holzinsekten eher schwierig zu beobachten und züchten sind. Unsere Art ist in eher trockenen und heissen Gebieten (z.B. Wallis) anzutreffen. Bemerkungen: Die Stephaniden stellen wahrscheinlich sehr urtümliche Parasitica dar und werden als Bindeglied zwischen den Pflanzenwespen (und hier speziell den parasitischen Orussidae) und den Taillenwespen gehandelt. Oehlke (1984) behandelt die deutsche Art, Stephanus ­serrator. 80 Katalog: Trigonaloidea Trigonaloidea Diese Überfamilie enthält nur die Familie Trigonalidae. Wie bei den Stephanoidea haben wir es bei den Trigonaloidea mit einer sehr ursprünglichen Gruppe zu tun, welche noch zahlreiche Merkmale aufweist, die auch bei Pflanzenwespen zu finden sind, z.B. die charakteristischen Läppchen an den Fussgliedern. Eine Diagnose dieser Gruppe findet sich im Familienabschnitt. Trigonalidae Anzahl Arten: CH 1; D 1; CZ 1; GB 1; W 75. Diagnose: Körperlänge 10–15 mm. Antenne ungekniet, fadenförmig, mit mehr als 20 Flagellomeren; inseriert tief auf der Stirn unter zwei kleinen Lappen. Mandibeln gross, bei der ­europäischen Arten asymmetrisch mit 3 bzw. 4 Zähnen. Hinterecke des Pronotums reicht bis zur Tegula, Prepectus fehlt. Flügelgeäder im Vorderflügel vollständig, mit 10 geschlossenen Zellen im Vorder- und deren 2–3 im Hinterflügel. Unterseite der Tarsomere am Apex mit kleinen Lappen. Erstes Metasomalsegment wenig spezialisiert, ähnelt den folgenden Segmenten; Sterna stark sklerotisiert. Ovipositor reduziert, nicht sichtbar. Erinnern im Habitus an Stechimmen, vor allem an gewisse Grabwespen. Biologie: Die Trigonalidae haben eine komplexe Biologie, wobei sie meist als obligatorische Hyperparasitoide von Ichneumoniden und Braconiden oder aber als Räuber auf Gelegen von sozialen Wespen auftreten. Mehr zur Biologie der europäischen Art Trigonalis hahnii findet sich im Skript auf S. 12. Bemerkungen: Die einzige europäische Art kann mit dem Familienschlüssel bestimmt werden. Weitere Informationen finden sich in Oehlke (1984) sowie in Carmean & Kimsey (1998). Steck (1907) konnte Trigonalis hahnii während einiger Jahre recht zahlreich in der Nähe von Bern nachweisen (Grauholz, Bremgartenwald). Seither sind nur noch wenige Funde aus der Schweiz hinzugekommen. 81 Literatur Literaturverzeichnis Im Literaturverzeichnis sind einige wichtige Arbeiten (Askew 1971, Godfray 1994, Quicke 1997 etc.) verzeichnet, die nicht im Text zitiert sind. Ferner werden zwei Webseiten angegeben. Achterberg, C. v. 1993. Illustrated key to the subfamilies of the Braconidae (Hymenoptera: Ichneumonoidea). Zoologische Verhandelingen Leiden 283: 189 pp. Askew, R. R. 1971. Parasitic insects. Heinemann Educational Books, London, 316 pp. Baur, H. & Amiet, F. 2000. Die Leucospidae (Hymenoptera: Chalcidoidea) der Schweiz, mit einem Bestimmungsschlüssel und Daten zu den europäischen Arten. Revue suisse de Zoologie 107: 359–388. Boucek, Z. 1951. The first revision of the European species of the family Chalcididae (Hymenoptera). Acta Entomologica Musei Nationalis Pragae, 27, Supplementum 1: 5–108, 17 pl. Boucek, Z. 1956. Poznamky o Ceskoslovenskych Perilampidae. Notes on the Czechoslovak Perilampidae (Hymenoptera-Chalcidoidea). Acta Entomologica Musei Nationalis Pragae 30: 83–99. Boucek, Z. 1988. Australasian Chalcidoidea (Hymenoptera): a biosystematic revision of genera of fourteen families, with a reclassification of species. C.A.B. International, Wallingford, UK, 832 pp. Boucek, Z. & Rasplus, J.-Y. 1991. Illustrated key to West-Palearctic genera of Pteromalidae (Hymenoptera: Chalcidoidea). Institut National de la Recherche Agronomique, Paris, 140 pp. Brown, V. K. 1973. The biology and development of Brachygaster minutus Olivier (Hymenoptera, Evaniidae), a parasite of oothecae of Ectobius spp. (Dictyoptera, Blattidae). Journal of Natural History 7: 665–674. Carmean, D. & Kimsey, L. 1998. Phylogenetic revision of the parasitoid wasp family Trigonalidae (Hymenoptera). Systematic Entomology 23: 35–76. Crawley, M. J. 1992. Natural enemies. Blackwell Scientific Publications, London, 576 pp. Crossky, R. W. 1951. The morphology, taxonomy, and biology of the British Evanioidea (Hymenoptera). Transactions of the Royal Entomological Society of London 102(5): 247–281. Dowton, M. & Austin, A. D. 2001. Simultaneous analysis of 16S, 28S, COI and morphology in the Hymenoptera: Apocrita – evolutionary transitions among parasitic wasps. Biological Journal of the Linnean Society 74: 87–111. Fergusson, N. D. M. 1986. Charipidae, Ibaliidae & Figitidae, Hymenoptera: Cynipoidea. Handbooks for the Identification of British Insects 8(1): 1–55. Ferrière, C. 1946. Les Gasteruption de la Suisse (Hym. Evaniidae). Mitteilungen der Schweizerischen Entomologischen Gesellschaft 20: 232-248. Ferrière, C. 1965. Hymenoptera Aphelinidae d‘Europe et du Bassin Mediterranéen. Faune de l‘Europe et du Bassin Méditerranéen 1. Masson, Paris, 206 pp. Gauld, I. & Bolton, B. (eds) 1988. The Hymenoptera. Oxford University Press, Oxford, England 332 pp. Gauld, I. & Gaston, K. J. 1995. The Costa Rican Hymenoptera fauna. In: Hanson, P. & Gauld, I. (eds). The Hymenoptera of Costa Rica. Oxford University Press, 893 pp. Gibson, G. A. P. 1989. Phylogeny and classification of Eupelmidae, with a revision of the world genera of Calosotinae and Metapelmatinae (Hymenoptera: Chalcidoidea). Memoirs of the Entomological Society of Canada 149: 1–121. Gibson, G. A. P. 1995. Parasitic wasps of the subfamily Eupelminae: Classification and revision of the world genera (Hymenoptera: Chalcidoidea: Eupelmidae). Memoirs on Entomology, International 5: 1–421. 82 Literatur Gibson, G. A. P., Huber, J. T. & Woolley, J. B. 1997. Annotated keys to the genera of Nearctic Chalcidoidea (Hymenoptera). NRC Research Press, Ottawa, xi+794 pp. Gibson, G. A. P., Read, J. & Huber, J. T. 2007. Diversification, classification and higher relationships of Mymarommmatoidea (Hymenoptera). Journal of Hymenoptera Research 16: 51–146. Godfray, H. C. J. 1994. Parasitoids. Behavioral and evolutionary ecology. Princeton University, Princeton, New Jersey, 473 pp. Goulet, H. & Huber, J. T. (eds.). 1993. Hymenoptera of the world: An identification guide to families. Canada Communications Group, Ottawa, Canada, 668 pp. Graham, M. W. R. de V. 1969. The Pteromalidae of North-Western Europe. Bulletin of the British Museum (Natural History), Entomology, Supplement 16: 1–908. Graham, M. W. R. de V. 1987. A reclassification of the European Tetrastichinae (Hymenoptera: Eulophidae), with a revision of certain genera. Bulletin of the British Museum (Natural History), Entomology series 55: 1–392. Graham, M. W. R. de V. 1991. A reclassification of the European Tetrastichinae (Hymenoptera: Eulophidae): revision of the remaining genera. Memoirs of the American Entomological Institute 49: 1–322. Graham, M. W. R. de V. & Gijswijt, M. J. 1998. Revision of the European species of Torymus Dalman (s. lat.) (Hymenoptera: Torymidae). Zoologische Verhandelingen Leiden 317: 1–202. Grimaldi, D. & Engel, M. S. 2005. Evolution of the insects. Cambridge University Press, New York, 755 pp. Hanson, P. & Gauld, I. (eds). 1995. The Hymenoptera of Costa Rica. Oxford University Press, 893 pp. Hawkins, B. A. 1994. Pattern & process in host-parasitoid interactions. Cambridge University Press, Cambridge. Hawkins, B. A. & Sheehan, W. (eds.). 1994. Parasitoid community ecology. Oxford University, Oxford 516 pp. Hedqvist, K.-J. 1976. Vanhornia leileri n. sp. from Central Sweden (Hymenoptera: Proctotrupidae: Vanhorniinae). Entomologica scandinavica 7: 315–316. Huber, J. T. 1998. The importance of voucher specimens, with practical guidelines for preserving specimens of the major invertebrate phyla for identification. Journal of Natural History 32: 367–385. Kalina, V. 1984. New genera and species of Palaearctic Eupelmidae (Hymenoptera, Chalcidoidea). Silvaecultura Tropica et Subtropica 10: 1–29. Kasparyan, D. R. 1981. A guide to the insects of the European part of the USSR. Hymenoptera, Ichneumonidae. Subfamily Pimplinae (Ephialtinae) [in Russian]. Opredeliteli Faune SSSR 129: 41–97. Liu, Z. & Nordlander, G. 1994. Review of the family Ibalidae (Hymenoptera: Cynipoidea) with keys to genera and species of the world. Entomologica scandinavica 25: 377–392. Martin, J. E. H. 1977. The insects and arachnids of Canada, Part 1. Collecting, preparing, and preserving insects, mites, and spiders. Biosystematic Research Institute, Ottawa. Melika, G. 2006a. Gall wasps of the Ukraine. Cynipidae I. Schmalhausen Institute of Zoology Nas Ukraine, Supplement 21: 1–300. Melika, G. 2006b. Gall wasps of the Ukraine. Cynipidae II. Schmalhausen Institute of Zoology Nas Ukraine, Supplement 21: 301–664. Noyes, J. S. 1982. Collecting and preserving chalcid wasps (Hymenoptera: Chalcidoidea). Journal of Natural History 16: 315–334. Noyes, J. S. 2002. Interactive catalogue of world Chalcidoidea (second edition). CD-ROM. Taxapad and The Natural History Museum. 83 Literatur Noyes, J. S. 2007. Universal Chalcidoidea Database. World Wide Web electronic publication. www.nhm.ac.uk/entomology/chalcidoids/index.html [accessed 18-June-2007]. Oehlke, J. 1984. Beiträge zur Insektenfauna der DDR: Hymenoptera – Evanioidea, Stephanoidea, Trigonalyoidea. Faunistische Abhandlungen Staatliches Museum für Tierkunde in Dresden 11: 161–190. Pschorn-Walcher, H. 1971. Hymenoptera Heloridae et Proctotrupidae. Insecta Helvetica Fauna 4: 1–64. Pschorn-Walcher, H. & Heitland, W. 2007. Parasitoide Online. Eine Einführung in die Welt der parasitoide. http://www.faunistik.net/PONLINE/index.html Quicke, D. L. J. 1997. Parasitic wasps. Chapman & Hall, 470 pp. Quinlan, J. 1978. Hymenoptera, Cynipoidea, Eucoilidae. Handbooks for the Identification of British Insects 8(1): 1–58. Ronquist, F. 1999. Phylogeny of the Hymenoptera (Insecta): The state of the art. Zoologica Scripta 28: 3–11. Sharkey, M. J. & Roy, A. 2002. Phylogeny of the Hymenoptera: a re-analysis of the Ronquist et al. (1999) re-analysis, emphasizing wing venation and apocritan relationships. Zoologica Scripta 31: 57–66. Steck, T. 1907. Trigonalis hahni. Pp. 256–257 in Bericht über die Jahresversammlung der Schweizerischen Entomologischen Gesellschaft am 2. September 1906. Mitteilungen der Schweizerischen Entomologischen Gesellschaft 11: 235–258. Townes, H. K. 1972. A light-weight Malaise trap. Entomological News 83: 239–247. Townes, H. K. 1977. A revision of the Heloridae (Hymenoptera). Contributions to the American Entomological Institute 15(2): 1–12. Townes, H. K. & Townes, M. 1981. A revision of the Serphidae (Hymenoptera). Memoirs of the American Entomological Institute 32: 541 pp. Trjapitsyn, V. A. (ed.) 1988. Keys to the Insects of the European part of the USSR, Volume III, Hymenoptera, Part II. E. J. Brill, Leiden, 1341 pp. Wahl, D. B. 1993. Ichneumonidae. In: Goulet, H. & Huber, J. T. (eds). Hymenoptera of the world: An identification guide to families. Canada Communications Group, Ottawa, Canada, 668 pp. Wall, I. 1986. Die Serphiden Südwestdeutschlands (unter besonderer Berücksichtigung des Heubergs). Neue Entomologische Nachrichten Beiträger zur Faunistik und Systematik der Insekten und Spinnentiere 19: 189–251. Woolley, J. B. 1988. Phylogeny and classification of the Signiphoridae (Hymenoptera: Chalcidoidea). Systematic Entomology 13: 465–501. Yu, D. S., Achterberg, C. v. & Horstmann, K. 2005. Ichneumonoidea 2004: Taxonomy, biology, morphology and distribution. Taxapad, CD-Rom. Zerova, M. D. 1995. Parasitic Hymenoptera – Eurytominae and Eudecatominae of Palaearctics [in Russisch]. Naukova Dumka, Kiev, 457 pp. 84 Appendix Appendix: Hersteller und Produkte BioQuip, Rancho Dominguez CA, USA http://www.bioquip.com/default.asp [Hervorragende ­Entomologieartikel, u.a. gute Netze] Dr. Grogg Chemie AG, Gümligentalstrasse 83, Postfach 218, CH-3066 Stettlen/BE Tel 031 932 11 66, Fax 031 932 11 68 [Chemikalien] Faust Laborbedarf AG, Ebnatstr. 65, Postfach 422, CH-8201 Schaffhausen, Tel 052 630 01 01, Fax 052 624 02 29, www.faust.ch [Glaswaren, Laborbedarf, Chemikalien] Meier GmbH, Vosslerstr. 9, D-80689 München, Tel. 089 56 20 07, Fax 089 58 28 32 www.entomologie-meier-muenchen.de [Entomologiebedarf; alles was das Entomologenherz höher schlagen lässt!] Plano GMBH, Wetzlar, Deutschland http://www.plano-em.de/ [Artikel für Elektronenmikroskopie, darunter auch fabulöse mikroporösen Kapseln, Best.Nr. 4614] Rose Entomology, Benson AZ, USA http://www.roseentomology.com/ [State-of-the-art Entomologieartikel, u.a. professionelle Exhaustoren] Semadeni AG, Tägetlistr. 35-39, Industriezone Obere Zollgasse, Postfach, CH-3072 Ostermundigen, Tel 031 931 35 31, Fax 031 931 16 25, www.semadeni.com [Viele nützliche Kunststoffartikel] 85 Glossar Glossar Glossar mit den wichtigsten Begriffen zu den Hymenoptera, vor allem zu den als «Parasitica» zusammengefassten Familien. Verändert aus Goulet & Huber (1993). Habitusabbildung einer Taillen-Wespe mit der Bezeichnung der wichtigsten Körperteile. Die Vorsilbe «Pro» entspricht dem deutschen «Vorder», «Meso» entspricht «Mittel» und «Meta» entspricht «Hinter». 86 Glossar Alphabetisches Glossar Anellus (Pl: Anelli) Ringglied. Ringförmiges, sehr kurzes Segment der Antenne; liegt zwischen Pedicel und Flagellum. Manchmal mehrere Anelli vorhanden (Chalcidoidea). Abdomen (Adj: abdominal) Hinterster Körperteil, anschliessend an den bein- und flügeltragenden Körperabschnitt. Besteht aus 10 oder weniger sichtbaren Segmenten. Antenna (Pl: Antennae, Adj: antennal) Fühler. Paarige, segmentierte Anhänge des Kopfes zwischen den Komplexaugen. Besteht aus drei Abschnitten Scapus, Pedicel, Flagellum. Apex (Adj: apikal) Gegenteil von Basis, basal. Teil einer Struktur, der am weitesten vom Körper entfernt liegt. Abscissa (Pl: Abscissae) Ein Segment einer Flügelader, welches durch die Schnittstellen mit anderen Adern begrenzt ist. Aculeata Stechimmen; Hymenopteren, deren Weibchen einen Stechstachel tragen. Dazu gehören Apoidea (Hummeln, Bienen, Grabwespen etc.), Vespoidea (Wespen, Wegwespen, Ameisen…), Chrysidoidea (Goldwespen) u.v.a. Areola (Pl: Areolae) Die mittleren Bereiche des Propodeums, die durch Carinae umschlossen sind (Ichneumonidae). Anallobus Areolet Flügellappen aus häutiger Membran, welcher basal am Hinterflügel sitzt. Bei den Aculeata und Evaniidae. Die kleine Zelle im Zentrum des Vorderflügels der Ichneumonidae. Erste Radius-Sektor-Zelle. 87 Glossar Basis Gegenteil von Apex, apikal. Teil einer Struktur, der am nächsten am Körper liegt. Arolium (Pl: Arolia) Lappen zwischen den Tarsal-Klauen. Bulla (Pl: Bullae) Apocrita Taillenwespen. Monophyletische Gruppe der Hymenoptera, die sich durch den Besitz einer Wespentaille auszeichnet. Dazu gehören die Parasitica und die Aculeata. Unpigmentierter Teil von Flügeladern, wo die Ader von einem Flügelfalt gekreuzt wird (Ichneumonidae). Carapax Panzerartige Struktur, welche aus verwachsenen Tergiten des Metasomas besteht. Bedeckt meist dorsal praktisch das ganze Metasoma. Carina (Pl: Carinae) Axilla (Pl: Axillae, Adj: axillar) Erhebung, Grat oder Leiste, also eine erhobene Linie. Posterolateraler Teil des Mesoscutum, getrennt vom Mesoscutum lateral durch das Scutellum. Oft dreieckig. Axillula (Pl: Axillulae, Adj: axillular) Der Seitliche Anteil des Scutellums, abgetrennt durch eine longitudinale Linie (Chalcidoidea). Cercus (Pl: Cerci) Paariger hinterer Anhang am hintersten (10.) Tergit, mit Sinnesfunktion. Häufig behaart. Basal Bei Körperanhängen (Beinen, Antennen, Flügel, Mundwerkzeuge etc.): Gegen den Körper zu liegend. Gegenteil von apikal. 88 Glossar Chela (Pl: Chelae, Adj: chelat) Club Der modifizierte Tarsus der Dryinidae, bei welchem das apikale Tarsomer zusammen mit der gegenüberliegenden Kralle eine klammerartige Struktur bildet. Das oder die vergrösserten apicalen Flagellomere der Antennen (siehe auch Funikel). Clypeus (Adj: clypeal) Der mittlere Sklerit des Kopfes unmittelbar über dem Labrum. Oft dorsal und lateral abgetrennt durch die Epistomalfurche. Clavalfalte Die Falte im Vorderflügel gerade vor Ader 1A und parallel dazu. Reicht bis zur Clavalkerbe am Flügelrand. Costa Vorderste longitudinale Flügelader. Ist bei vielen Gruppen mit der Subcosta und z.T. auch noch mit dem Radius verwachsen. Costalkerbe Kerbe im Flügelrand zwischen dem Apex der Costa und der Basis des Pterostigmas. Clavallappen Der hintere Anteil des Vorderflügels hinter der Clavalfalte und vor der Jugalfalte, wenn vorhanden. Coxa (Pl: Coxen, Adj: coxal) Erstes Beinsegment, auch als «Hüfte» bezeichnet. Zwischen Körper und Trochanter. 89 Glossar Cubitus Flügelader. Posterior zur Media und anterior zur Analader; zieht vom basalen Flügelansatz bis zum Flügelrand. Discoidialzelle Flügelzelle, welche direkt unter dem Pterostigma liegt. Epicnemium Auf dem Rücken, rückenwärts. Vorderer Anteil des Mesopleurons, nach hinten durch die Epicnemialcarina begrenzt. Endodonte Mandibel Epimeron Mandibel mit Zähnen, die nach innen zeigen. Wenn geschlossen, zeigen die Zähne (oder Spitzen) gegeneinander (vergleiche «Exodonte Mandibel»). Der Anteil eines Pleuriten, der hinter der Pleural-Furche liegt (vergleiche «Episternum»). Dorsal Epipygium Epicnemialcarina Leiste auf dem Mesopleuron, welche mehr oder weniger parallel zum vorderen Rand des Mesepisternums läuft. Eine kleine, mehr oder weniger sklerotisierte, fingernagel-ähnliche Klappe, die am letzten Tergiten zwischen den Cerci ansetzt (Chalcidoidea). Episternalfurche Siehe «Mesepisternalfurche». 90 Glossar Femur (Pl: Femura, Adj: femural) Episternum Oberschenkel. Drittes Beinsegment, zwischen Trochanter und Tibia. Der Anteil eines Pleuriten, der vor der Pleuralfurche liegt (vgl. «Epimeron»). Filzlinie Epistomalfurche Longitudinale Linie aus flach anliegenden Haaren und Sekretporen seitlich auf dem Metasomalsegment 2 von Mutilidae und Bradynobaenidae. Furche, welche den lateralen und dorsalen Rand des Clypeus bestimmt. Flagellomer Segmentartiger Teilabschnitt des Flagellums. Die Flagelomere werden durchgehend von der Basis des Flagellums an nummeriert. Epomia Schräge Leiste seitlich vorne am Pronotum (Ichneumonidae). Flagellum Exodonte Mandibeln Dritter und apikalster Abschnitt der Antenne. Beginnt nach dem Pedicel. Fast immer in Segmente (Flagellomere) unterteilt. Mandibel, deren Zähne gegen aussen zeigen. Wenn geschlossen, zeigen die Spitzen nach vorn oder auseinander. 91 Glossar Foramen Eine Öffnung in der Körperwand, durch welche Nerven und Gefässe ziehen. Das Foramen magnum ist die Öffnung auf der Kopfhinterseite, das Propodealforamen das Loch am Hinterende des Propodeums, wo das Metasoma ansetzt. Frontalcarina Eine longitudinale Leiste oder ein Paar solcher Leisten auf der Frons zwischen den Toruli, diese manchmal z.T. überdeckend. Funikel Die Flagellomere zwischen dem Pedicel und dem Club. Frenum (Pl: Frena, Adj: frenal) Die transversale Linie auf dem Scutellum, welche dessen hinteren Teil, den Frenalbereich abtrennt (Chalcidoidae). Frons Gaster Bereich des Kopfes zwischen dem ventralen Rand der Toruli und dem ventralen Rand des mittleren Occelus. Teil des Metasomas hinter dem Petiolus, also dem stielchenförmig verlängerten ersten (und manchmal zweiten) Metasomalsegment. 92 Glossar Gastrocoelus – Thyridium (Pl: Gastrocoeli) Die transverse Vertiefung anterolateral auf Metasomaltergum 2. Die Gastrocoeli enthalten das Thyridium, womit die speziell skulpturierte Fläche bezeichnet wird, während der Gastrocoelus die Vertiefung an sich sind. Glymma Longitudinale Linie aus flach anliegenden Haaren und Sekretporen seitlich auf dem Metasomalsegment 2 von Mutilidae und Bradynobaenidae. Habitus Gesamtes Erscheinungsbild. Gena Wange. Der seitliche Anteil des Kopfs zwischen den Komplexaugen und, wenn vorhanden, der Occipitalcarina. Ist diese nicht vorhanden, der untere (bei hypognathen Arten) oder der vordere (bei prognathen Arten) Anteil des Hinterkopfs zwischen Komplexaugen und Occiput. Hamulus (Pl: Hamuli) Einer von vielen borstenartigen Haken auf dem Vorderrand des Hinterflügels. Diese Haken verbinden Vorder- und Hinterflügel während des Fliegens. Bei einigen Gruppen ist eine basale und eine apikale Gruppe von Hamuli vorhanden. Gesicht Parasitica: Die vordere Fläche des Kopfs zwischen den Komplexaugen, den Einlenkstellen der Antennen und dem ventralen Rand, ohne Clypeus. Symphyta & Aculeata: Die vordere Fläche des Kopfs zwischen Komplexaugen, Ocelli und Ventralseite, inkl. Clypeus. Humeralplatte Der vorderste Sklerit des Vorderflügels an der Basis der Costa. 93 Glossar Hypopygium Letzter sichtbarer Sternit des Abdomens. Manchmal auffällig vergrössert. Labium Integument Hinterer, mittlerer Anhang der Mundwerkzeugen zwischen und hinter den Maxillen. Haut. Äusserste Begrenzung des Körpers. Konkav Lineare oder flächige Struktur, die nach innen gewölbt ist. Konvex Lineare oder flächige Struktur, die nach aussen gewölbt ist. Labrum Verderer, mittlerer Anhang der Mundwerkzeuge. An der Unterseite des Clypeus fixiert, manchmal darunter hervorstehend. Kopf Vorderster Teil des Körpers. Trägt Mundwerkzeuge und Antennen. Laterotergit Seitlicher Teil eines Tergiten des Metasoma. 94 Glossar Malarraum Kürzeste Distanz wischen der Basis der Mandibeln und dem Rand des Komplexauges. Manchmal mit Subokularfurche. Maxilla Paarige Mundwerkzeuge zwischen Mandibeln und Labium. Media Flügelader. Posterior vom Radius und anterior vom Cubitus (manchmal allerdings auch mit diesem verwachsen). Mandibel Paarige, stark sklerotisierte Mundwerkzeuge zwischen Labrum und Maxillen. Werden zum Beissen und Kauen verwendet. Medialzelle Zelle im Vorderflügel, welche von Media und Cubitus umschlossen ist. Bei einigen Parasitica dreieckig ausgebildet. MesoMittel-, mittlerer Anteil. Marginalader (Abb. S. 103) Ader in einem reduzierten Flügelgeäder, welche dem anterioren Flügelrand entlang läuft. Setzt sich basal in die Submarginalader fort und wird apikal durch das Pterostigma oder durch die abzweigende Stigmalader begrenzt. Mesepisternum Vorderer Anteil des Mesopleuron. 95 Glossar Mesosternum Mesonotum Sternum des Mesothorax, normalerweise nicht sichtbar, sondern von den Pleuriten überdeckt. Dorsaler Anteil des Mesothorax. Mesosoma Mesopleuron Lateraler und ventraler Anteil des Mesothorax. Mittlerer grosser (sichtbarer) Anteil des Körpers. Dieser wird in Kopf, Mesosoma und Metasoma unterteilt. Entspricht bei den Symphyta dem Thorax, bei den Apocrita allerdings dem Thorax plus dem ersten Abdominalsegment («Propodeum»), da letzteres mit dem Thorax verwachsen ist. Mesoscutum Mesonotum ohne Scutellum. Mesothorax Zweiter und grösster Anteil am Thorax, trägt das mittlere Beinpaar und, wenn vorhanden, die Vorderflügel. MetaLetzter, hinterster, Hinteranteil. 96 Glossar Metanotum Dorsaler Anteil des Metathorax. Metathorax Dritter der drei Anteile des Thorax, trägt das hinterste Beinpaar und, wenn vorhanden, die Hinterflügel. Metapleuron Lateraler und ventraler Anteil des Metathorax. Notaulus (Pl: Notauli) Die normalerweise schrägen Furchen auf dem Mesoscutum. Metasoma Letzter grosser (sichtbarer) Anteil des Körpers. Dieser wird in Kopf, Mesosoma und Metasoma unterteilt. Bei den Symphyta ist das Metasoma äquivalent zum Abdomen, während bei den Apocrita das Metasoma erst ab Segment 2 des Abdomens berechnet wird, da Abdominalsegment 1 («Propodeum») mit den Thorakalsegmenten verwachsen ist. Occipitalcarina Eine Leiste auf der Rückseite des Kopfes. 97 Glossar Pedicel Ocellus (Pl: Ocelli) Punktaugen. Meist drei kleine, aus jeweils nur einer Facette bestehende Augen, oberhalb der Komplexaugen liegend. Scheinen einen Zusammenhang mit dem Orientierungssinn im Flug zu haben. Zweiter Teil der Antenne, setzt basal an den Scapus an und wird apikal von den Flagellomeren oder von Anelli gefolgt. Petiolus Ovipositor Legestachel. Nadel-, säge- oder röhrenförmige, paarige Struktur, welche zum Ablegen der Eier ins Substrat oder z.T. bei Parasitoiden in den Wirt verwendet wird. Kann im Körper verborgen oder stark verlängert sein. Bei den Aculeata zu einem Wehrstachel (verbunden mit Giftdrüse) umgewandelt. Parasitica Schlupfwespen im weiteren Sinne. Paraphyletische Gruppe der Apocrita, deren Vertreter sich durch eine parasitoide Lebensweise auszeichnen oder gallbildend sind. Enthält grössten Artenreichtum der Hymenoptera. «Stielchen». Erstes (meist) Metasomalsegment, welches bei den Apocrita meist stielförmig ausgebildet ist. Weist meist eine andere Form und Skulptur auf als die weiteren Metasomalsegmente. Plantarlobus Läppchenförmiger Anhang apikal an den Tarsomeren von Symphyten und den apokriten Trigonalidae. Parasitoid Form der parasitischen Lebensweise; die Larven von Parasitoiden entwickeln sich an Larven oder auch adulten Individuen anderer Insektenarten, wobei es im Unterschied zur Lebensweise von Parasiten zum Tod des Wirts kommt. Die adulten Parasitoiden nehmen entweder gar keine Nahrung zu sich oder ernähren sich von Nektar und Pollen. Pleuron, Pleurit (Pl: Pleura, Pleuren, Pleuriten) Seitliche Körperplatte. Beim Thorax bedecken die Pleuren den Körper auch ventral. Posterior Hinten, gegen das hintere Körperende. 98 Glossar Postmarginalader (Abb. S. 103) Flügelader, welche apikal zur Marginalader am vorderen Vorderflügelrand verläuft, und zwar vom Pterostigma oder von der abzweigenden Stigmalader aus. Propodeum Postpectalcarina Bei den Ichneumonoidea, die posteriore, transverse Carina ventral auf dem Mesopleuron, direkt vor den Mesocoxen. Nur bei den Apocrita: Posteriorer Anteil des Mesosomas, entspricht dem mit dem Thorax verwachsenen ersten Abdominaltergit. ProVorder-, vorderster, anteriorer Anteil. Prosternum Der ventrale Sklerit des Prothorax, zwischen den Propleuren. Pronotum Dorsaler Sklerit (Tergit) des Prothorax, also des ersten Thoraxsegmentes. Zieht sich bei dem meisten Hymenopteren bis auf die Seiten des Prothorax hinunter. Prothorax Propleuron Seitlicher Anteil des ersten Mesosomalsegmentes (Prothorax). Die erste der drei Anteilde des Thorax, besteht aus Pronotum, Propleuron und Prosternum. Pterostigma Flügelmal. Siehe Stigma. 99 Glossar Radius Flügelader. Posterior zur Costa und Subcosta (manchmal allerdings auch mit denen verwachsen), anterior zur Media. Radialzelle Flügelzelle im Vorderflügel, welche anterior durch den Flügelrand und posterior durch den Radius begrenzt wird. Apikal vom Pterostigma. Segment Ein Ring oder Anteil des Körpers oder eines Körperanhangs zwischen flexiblen Bereichen. Scapus Erstes Segment der Antennen, häufig verlängert und / oder verdickt. Wenn verlängert, wirkt der Fühler gekniet. Schliesst basal an die Toruli und apikal and den Pedicelus. Spirakel Atemloch. Ein kleines, rundes oder ovales Loch auf einem Körpersegment, durch welches Luft in die Tracheen strömt. Scutellum Die mittlere Region des Mesonotums oder Metanotums, hinter dem Scutum. Bei den Apocrita ist nur das Mesoscutellum ausgebildet und wird dann simpel als Scutellum bezeichnet, während bei den Symphyta beide ausgebildet sind. Sternaulus Die horizontale, lateroventrale Carina oder Grube nahe dem unteren Rand des Mesopleurons. Führt vom unteren Ende der Epicnemialcarina zur Mesocoxa. Häufig teilweise reduziert. 100 Glossar Sternum, Sternit Subokulargrube Bauchplatte. Ventrale Begrenzung eines Körpersegments. Mehr oder weniger stark sklerotisiert. Eine Grube zwischen dem ventralen Augenrand und der Basis der Mandibeln. Symphyta Pflanzenwespen. Paraphyletische, basale Gruppe der Hymenopteren, welche sich durch das Fehlen einer Wespentaille auszeichnet. Stigma (Pl.: Stigmen) Flügelmal, in unserem Text immer als Pterostigma bezeichnet; sklerotisierter und normalerweise stark pigmentierter Bereich am Vorderflügelrand, apikal der Costalader. Tarsomer Ein Anteil des Tarsus. Jeder Tarsus hat 3-5 Tarsomere. Stigmalader (Abb. S. 103) Z.B. bei den Chalcidoidea (reduziertes Flügelgeäder), die zwischen Marginal- und Postmarginalader abzweigende, kurze Ader. Sitzt anstelle des Pterostigmas. Tarsus Subcosta Flügelader. Posterior zur Costa, anterior zum Radius. Manchmal mit der ein oder anderen, manchmal aber auch mit beiden verwachsen. Fuss. Fünftes und apikales Segment des Beines, besteht aus Tarsomeren. Ist basal an der Tibia befestigt und trägt apikal meist Klauen. Submarginalader (Abb. S. 103) Ader in einem reduzierten Flügelgeäder, welche posterior zur Costalzelle verläuft und parallel zum Vorderflügelvorderrand verläuft. Setzt basal an der Flügelbasis an. Tegula (Pl: Tegulae) Flügelschüppchen. Dorsal über und vor der Ansatzstelle des Vorderflügels liegendes Schüppchen. 101 Glossar Trochanter Tergum, Tergit (Pl: Terga, Tergiten) Auf deutsch auch «Schenkelring». Zweites Segment der Beine, liegt zwischen Coxa (Hüfte) und Femur (Oberschenkel). Bei den «Parasitica» sind zwei Trochanter ausgebildet, wobei der zweite als Trochantellus bezeichnet wird. Rückenplatten, sklerotisierte dorsale Platten auf einem Körpersegment. Uncus Bei den Chadicoidea, eine kurze, schmale Erweiterung nahe am Apex der Stigmalader, welche Richtung der Postmarginalader zeigt. Ventral Thorax Bauchseitig, bauchwärts. Mittlerer Körperanteil («Brust»). Trägt die drei Bein- und die beiden Flügelpaare. Bei den Apocrita mit dem Propodeum (1. Abdominalsegment) verwachsen. Zelle Tibia Flügelbereich, der durch Adern oder den Flügelrand begrenzt wird. Unterschenkel. Geht basal in den Femur, apikal in die Tarsomere über. Zusätzliche Ader Torulus (Pl: Toruli) Paariger Sockel zwischen den Komplexaugen, an welchen der Scapus und damit die ganze Antenne ansetzt. Eine Flügelader, welche nicht mit der Standard-Aderung homologisiert werden kann. 102 Glossar Bezeichnungen der Adern bei Taxa mit stark reduziertem Flügelgeäder (Chalcidoidea, Platygastroidea, Proctotrupoidea etc.) Submarginalader Marginalader Postmarginalader Stigma Stigmalader PTEROMALIDAE Submarginal- Marginalader Stigmalader APHELINIDAE Marginalader Submarginalader Stigmalader ENCYRTIDAE 103