Bundesrealgymnasium Imst Chemie 2010
Werbung

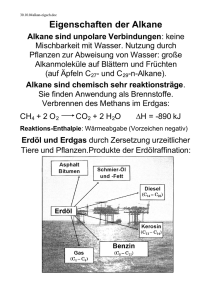
Bundesrealgymnasium Imst Chemie 2010-11 Klasse 8 Aliphate Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet wird, als dies im Skriptum der Fall ist. Ergänzungen zum Skriptum werden während des Unterrichts durchgeführt. In diesem Skriptum sind nur wenige Diagramme und Zeichnungen enthalten. Die fehlenden Diagramme werden im Unterricht erarbeitet. Inhalt 2 Aliphate ............................................................................................................................. 8 2.1 Einteilung der Kohlenwasserstoffe ............................................................................ 8 2.2 Aufbau und Bindung in Kohlenwasserstoffen ........................................................... 8 2.3 Alkane ........................................................................................................................ 8 2.3.1 Systematik der Namensbildung ............................................................................ 9 2.3.2 Radikale ................................................................................................................ 9 2.3.3 Verzweigte Alkane ............................................................................................... 9 2.3.4 Physikalische Eigenschaften ................................................................................ 9 2.3.5 Konformationsisomere ....................................................................................... 10 2.3.6 Cycloalkane ........................................................................................................ 10 2.4 Alkene ...................................................................................................................... 10 2.4.1 Systematik der Namensbildung .......................................................................... 10 2.4.2 Entstehung der Doppelbindung (sp2-Hybridisierung) ........................................ 11 2.5 Alkine ....................................................................................................................... 11 2.5.1 Systematik der Namensbildung .......................................................................... 11 2.5.2 Entstehung der Dreifachbindung (sp-Hybridisierung) ....................................... 12 2.6 Diene und Polyene ................................................................................................... 12 Chemie Klasse 8 2 2.1 Aliphate Aliphate Einteilung der Kohlenwasserstoffe Abb. 2-1: Übersicht über die organischen Verbindungen. 2.2 Aufbau und Bindung in Kohlenwasserstoffen Die Vielfalt der organischen Verbindungen ist an die besonderen Eigenschaften des Kohlenstoffs offs und dessen Verbindungen geknüpft: • Die Elektronegativität erlaubt es dem Kohlenstoff, mit Atomen der 2. Bis 7. Hauptgruppe Elektronenpaarbindungen einzugehen. • Die hohe Bindungsenergie in Verbindungen zwischen Kohlenstoffatomen selbst, die die Ausbildung langer Kohlenstoff-Ketten Kohlenstoff ermöglicht. • Die geringe Größe des Atoms erlaubt Mehrfachbindungen zu anderen KohlenstoffKohlenstoff Atomen • Die fast unpolare Bindung zwischen C-Atomen C und H-Atomen, Atomen, die zu nahezu unpolaren C-H-Bindungen Bindungen führt. 2.3 Alkane Ein C – Atom besitzt 4 Valenzelektronen und kann daher 4 Atombindungen aufbauen. Sind die C –Atome Atome im Molekül nur über Einfachbindungen verbunden und die restlichen Bindungen mit H – Atomen belegt spricht man von gesättigten Kohlenwasserstoffen Alkane Einfachstes Molekül: Methan CH4 Für die räumliche Struktur des Methanmoleküls sind die vier Elektronenpaare ausschlaggebend (VSEPR – Theorie). Die H – Atome ordnen sich in den Ecken eines Tetraeders an, in dessen Zentrum das C –Atom sitzt. Dr. K.-H. Offenbecher Seite 8 Chemie Klasse 8 Aliphate 2.3.1 Systematik der Namensbildung Der kleinste und einfachste Vertreter der Alkane ist das Methan: CH4 Längere Kohlenstoffketten bzw. größere größere Kohlenwasserstoffmoleküle bilden sich im einfachsten Fall der Alkane durch wiederholtes Anfügen einer CH2 Gruppe. Eine Reihe von Verbindungen,, bei denen sich die Moleküle aufeinander folgender Glieder jeweils um ein Kettenglied unterscheiden nennt man homologe Reihe. 2.3.2 Radikale Trennt man ein H-Atom Atom von einem Alkan ab, entsteht dort aufgrund der homolytischen Bindungsspaltung ein freies, ungepaartes Elektron. Sie sind meist sehr reaktiv und reagieren unter Kupplung (Radikalkombination) mit ungesättigten Verbindungen durch Addition oder mit anderen Molekülen unter Abspaltung eines Atoms. Radikale, die sich von Alkanen ableiten, werden durchh die Endung –yl gekennzeichnet. Aus Alkan wird Alkyl. 2.3.3 Verzweigte Alkane Wenn man versucht, anhand der Summenformel von Alkanen Strukturformeln aufzustellen, stellt man fest, dass sich ab dem Butan (C4H10) verschiedene Strukturen zeichnen lassen: geradkettige oder verzweigte Moleküle, die gleiche Summenformeln haben, aber unterschiedliche Strukturen, bezeichnet man als Isomere. Teilweise wird dem Namen des Moleküls der Buchstabe „n“ (normal) für geradkettige bzw. „i“ (iso) für verzweigte Moleküle vorangestellt. vorangeste Abb. 2-2:: Strukturformeln des Butans: geradkettig n-Butan; verzweigtkettig i--Butan. • • • • • Um die Vielzahl der organischen Verbindungen benennen zu können, hat die IUPAC gewisse Benennungsregeln festgesetzt: Ermittlung der längsten Kohlenstoffkette (Hauptkette) und entsprechende Benennung Benennung der Seitenketten in alphabetischer Folge. Bei den Seitenketten ändert sich die Endung von –an an auf –yl. Die Anzahl gleicher Seitenketten wird als griechisches griechisches Zahlwort (di-, (di tri-, tetra-) als Vorsilbe eingefügt. Die Hauptkette ist stets so durchzunummerieren, dass die Verknüpfungsstellen die kleinstmöglichen Zahlen erhalten. Die Namen der Seitenketten werden dabei, im Gegensatz zu den Vorsilben, großgeschrieben. großgesch 2.3.4 Physikalische Eigenschaften Wichtige physikalische Eigenschaften sind die Schmelzpunkte und vor allem die Siedepunkte der Kohlenwasserstoffe. Beide steigen mit zunehmender Kettenlänge an. Die kurzkettigen Dr. K.-H. Offenbecher Seite 9 Chemie Klasse 8 Aliphate Alkane (niedere Alkane mit 1 – 4 C-Atomen) sind bei Zimmertemperatur gasförmig und werden vorwiegend als Heizgase verwendet. Die mittleren Alkane (bis zu 16 C-Atome) sind bei Zimmertemperatur flüssig und bilden den Hauptbestandteil der Benzine. Höhere Alkane mit mehr als 17 C-Atomen sind fest und werden als Paraffine bezeichnet. Sie werden zur Herstellung von Kerzen oder Vaseline verwendet. Letzteres kommt sowohl als Schmiermittel und als Grundsubstanz für Cremes und Salben zur Anwendung. Der Anstieg der Siedetemperaturen kann durch die zunehmende Masse der Moleküle erklärt werden. Damit nehmen auch die Van-Der-Waals’schen Kräfte zu, die den Zusammenhalt der Moleküle untereinander bewirken. Dadurch wird zu deren Trennung mehr Energie benötigt. Neben der Kettenlänge spielt auch die Verzweigung eine entscheidende Rolle. Mit zunehmender Verzweigung nimmt die Oberfläche der Moleküle ab und somit die Angriffsfläche für Van-Der-Waals’sche Kräfte. Zur Trennung wird weniger Energie gebraucht. 2.3.5 Konformationsisomere Atome und Atomgruppen eines Moleküls sind um eine Einfachbindung frei drehbar. Daraus ergeben sich bei gleicher Konstitution bei Drehung um eine Einfachbindung unterschiedliche räumliche Anordnungen, die Konformere. Stehen sich die Wasserstoffatome direkt gegenüber (verdeckte Konformation) ist die Verbindung am energiereichsten und deswegen am instabilsten, weil die C – H Einfachbindungen in Wechselwirkung treten. Die gestaffelte Konformation ist energieärmer und stabil. Dazwischen liegen aber noch unendlich viele andere Möglichkeiten. 2.3.6 Cycloalkane Neben den kettenförmigen Alkanen können die gesättigten Kohlenwasserstoffe auch Ringe bilden. Chemische Verbindungen, deren Strukturformeln einen oder mehrere Ringe aufweisen, bezeichnet man als cyclische Verbindungen. Abb. 2-3: Strukturformel des einfachsten Cycloalkans: Cyclopropan. Durch Einfügen von CH2 Bausteinen kann die homologe Reihe der Cycloalkane entwickelt werden. Ein typischer Vertreter der Cycloalkane ist das Cyclohexan C6H12. Wie bei den kettenförmigen Kohlenwasserstoffen sind auch hier die Atombindungen an jedem C-Atom tetraederförmig angeordnet, was beim Cyclohexan zu einer 3D-Struktur führt. Es entsteht entweder eine Wannenform oder eine Sesselform. Bei Raumtemperatur liegt zu 99 % die Sesselform vor, weil dies der energieärmere und damit stabilere Zustand ist. 2.4 Alkene Alkene gehören zu den ungesättigten Kohlenwasserstoffen. Da sie weniger H-Atome binden als die Alkane besitzen sie mindestens eine C – C Doppelbindung. Die allgemeine Summenformel für Alkene lautet CnH2n. 2.4.1 Systematik der Namensbildung Die Alkene bilden wie die Alkane eine homologe Reihe. Die Namen lassen sich von jenen der Alkane ableiten, jedoch wird die Endung –an durch –en bei den Alkenen ersetzt. Dr. K.-H. Offenbecher Seite 10 Chemie Klasse 8 Aliphate Bei ungesättigten Kohlenwasserstoffen hlenwasserstoffen mit mehr als 3 C-Atomen C Atomen muss die Lage der Mehrfachbindung angegeben werden. Der systematische Namen der Alkene enthält die Nummer des ersten an der Doppelbindung beteiligten C-Atoms, C z. B. But-22-en. Im Gegensatz zu den reaktionsträgen Alkanen Alkanen weisen die ungesättigten Kohlenwasserstoffe aufgrund der Mehrfachbindung eine hohe Reaktionsfähigkeit auf. Aufgrund der hohen Elektronendichte an der Mehrfachbindung reagieren Alkene unter Addition zu einer Vielzahl unterschiedlicher Verbindungen. Wirdd an einem Alken ein weiteres H-Atom H Atom entfernt bleibt ein freies Elektron zurück und es entsteht ein Radikal. Anders als bei den Alkanen wird die Endung –yl yl angehängt und ersetzt nicht die ursprüngliche Endung –en. en. Es entsteht also ein Alkenyl (z. B. Ethenyl) Etheny 2.4.2 Entstehung der Doppelbindung (sp2-Hybridisierung) Sind C–Atome Atome durch eine Doppelbindung verknüpft, bilden diese nur zu 3 Atomen eine Bindung aus. Die Atome eines so verknüpften Moleküls liegen in einer Ebene. Bei der sp2 – Hybridisierung wird ein 2s--Orbital mit zwei 2p-Orbitalen Orbitalen kombiniert. Man erhält drei gleichwertige Hybridorbitale. Mit je einem Bindungswinkel von 120°. Senkrecht zur Ebene der drei sp2-Hybridorbitale Hybridorbitale befindet sich das in Gestalt und Energie unveränderte 2pz-Orbital. Die C – C-Doppelbindung ndung im Ethenmolekül resultiert zum einen aus der Überlappung von zwei sp2-Hybridorbitalen Hybridorbitalen und zum anderen daraus, dass sich die beiden pz-Orbitale der Kohlenstoffatome durchdringen. Das für die Doppelbindung notwendige pz-Orbital wird nicht hybridisiert. Abb. 2-4: Aufbau einer C = C-Doppelbindung. Doppelbindung. Die Bindung, die durch die sp²-Hybridorbitale sp² Hybridorbitale entsteht, wird als sp²-sp²-σ-Bindung bezeichnet. Diese Bindung wäre rotationssymmetrisch. Die zweite Bindung bildet sich aber aus zwei p-Orbitalen Orbitalen und ist aus diesem Grund nur noch flächensymmetrisch. Diese Bindung wird als p-p-π-Bindung bezeichnet. 2.5 Alkine Alkine sind ungesättigte aliphatische aliphatische Kohlenwasserstoffe der Summenformel CnH2n-2. Sie enthalten mindestens eine Dreifachbindung und bilden eine dritte homologe Reihe der Aliphate. 2.5.1 Systematik der Namensbildung Die Namen der Alkine werden aus dem Wortstamm der entsprechenden Alkane und der Endsilbe –in in gebildet; z. B. Ethin (Acetylen, C2H2), Propin (C3H4), Butin (C4H6). Bei Alkinen mit mehr als drei C-Atomen C Atomen wird die Nummer des ersten an der Dreifachbindung beteiligten C-Atoms Atoms im Namen angegeben; z. B. But-2-in, But in, entsprechend der Nomenklatur der Alkene. Dr. K.-H. Offenbecher Seite 11 Chemie Klasse 8 Aliphate Alkine können, entsprechend der anderen Aliphate, H-Atome abgeben und Radikale bilden. Auch hier wird dem durch den Endungszusatz –yl Rechnung getragen; z. B. Ethinyl, But-2-inyl 2.5.2 Entstehung der Dreifachbindung (sp-Hybridisierung) Die beiden, an einer Dreifachbindung beteiligten, C-Atome sind sp-hybridisiert. Der Winkel zwischen den beiden sp-Hybridorbitalen beträgt 180°. Die beiden C-Atome bilden über jeweils ein s-Hybridorbital eine sp-sp-σ-Bindung. Die beiden nicht hybridisierten p-Orbitale der C-Atome bilden bei ihrer Überlagerung zwei p-p-π-Bindungen, die flächensymmetrisch in einem Winkel von 90° zueinander stehen. Dreifachbindungen zwischen zwei C-Atomen bestehen aus einer sp-sp-σ-Bindung und zwei p-p-π-Bindungen. Wie bei Doppelbindungen ist auch hier eine Drehbarkeit nicht gegeben. 2.6 Diene und Polyene Diene sind ungesättigte aliphatische (Alkadiene) oder zyklische (Cyclodiene) Kohlenwasserstoffe mit zwei Doppelbindungen im Molekül. Bei Polyenen beinhaltet ein Molekül entsprechend mehr Doppelbindungen. Im Molekül benachbarte Doppelbindungen, d. h. ein C-Atom ist auf beiden Seiten durch eine Doppelbindung gebunden, nennt man kumulierte Doppelbindung. Liegt zwischen zwei C-Atomen, die eine Doppelbindung zu anderen C-Atomen ausgebildet haben, eine Einfachbindung, d. h. sind die Doppelbindungen abwechselnd mit Einfachbindungen angeordnet, spricht man von konjugierten Doppelbindungen. Sind Doppelbindungen durch mehr als eine Einfachbindung getrennt, liegen isolierte Doppelbindungen vor. Dr. K.-H. Offenbecher Seite 12 Chemie Klasse 8 Aliphate Aufgaben 1. Wie lassen sich die organischen Verbindungen einteilen? 2. Was sind Alkane? 3. Was versteht man unter gesättigten Kohlenwasserstoffverbindungen? 4. Erkläre den Begriff „homologe Reihe“! 5. Beschreibe den Molekülbau des Methans! 6. Was sind Isomere? 7. Was ist eine Methylgruppe? 8. Skizziere die Strukturformel von 2,2,4-Trimethylpentan. 9. Was versteht man unter einem Cycloalkan? 10. Erkläre, warum Cyclohexan nicht eben gebaut ist? 11. Beim Cyclohexan ergeben sich zwei unterschiedliche Strukturen. Skizziere die Raumstruktur des stabileren Cyclohexans! 12. Was versteht man unter „ungesättigten Verbindungen“? 13. Formulieren Sie alle denkbaren nicht ringförmigen Isomere eines Kohlenwasserstoffs mit fünf Kohlenstoffatomen und einer Doppelbindung! Wie heißen diese Verbindungen? 14. Was versteht man unter „Hybridisierung“? 15. Zu welcher homologen Reihe gehört das Ethin? Nennen Sie drei weitere Glieder dieser Kette! Wie lautet die allgemeine Summenformel? 16. Stellen Sie die vollständige Reaktionsgleichung für die Verbrennung von Ethin auf! 17. Für welchen Bindungstyp gelten folgende Aussagen (Mehrfachnennung möglich)! Einfachbindung Doppelbindung Dreifachbindung a) sp²-Hybrid, b) eine sigma-Bindung, c) keine pi-Bindung, d) sp-Hybrid, e) keine sigma-Bindung, f) zwei pi-Bindungen, g) frei drehbar, h) sp³-Hybrid 18. Warum kann man durch das Hybridisierungsmodell die Geometrie einer Vielzahl von Verbindungen abschätzen? 19. Von der Summenformel CH2Cl2 lassen sich zwei Strukturformeln zeichnen. Geben diese beiden Strukturformeln zwei verschiedene Bindungen wieder? Begründen Sie die Antwort! 20. Was ist eine sigma-Bindung? 21. Warum ist eine C – C-Doppelbindung nicht frei drehbar? 22. Zeichnen Sie die Strukturformel von folgender Verbindung und benennen Sie sie nach dem IUPAC-System: CH3-C(CH3)-C(CH3)-CH2-CH3 Dr. K.-H. Offenbecher Seite 13