Drucken - journalMED
Werbung

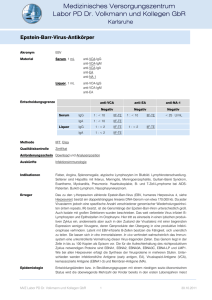
01. Juli 2012 Epstein-Barr Virus (EBV)-assoziierte Erkrankungen Das Spektrum von Erkrankungen, die mit Epstein-Barr-Virus (EBV) assoziiert sind, ist sehr breit und geht von der Mononukleose über verschiedene chronische Erkrankungen mit einer deutlichen Immunpathogenese bis zu zahlreichen Tumorerkrankungen. Abbildung 1 verdeutlicht das Auftreten von EBV-assoziierten Erkrankungen bei Immungesunden und Immunsupprimierten. Begriff Krankheitswert Bemerkung Chronische EBV Infektion Normalbefund Jede EBV Infektion ist chronisch EBV Reaktivierung Normalbefund 80% aller Menschen scheiden Virus aus Chronisches Müdigkeitssyndrom Erkrankung Vermutlich nicht durch EBV verursacht Postinfektiöse Müdigkeit Syndrom Nach Mononukleose möglich, keine Virusvermehrung Chronisch aktive EBV Infektion (CAEBV) Schwere Erkrankung Sehr selten, hohe Mortalität Immer wieder wurde diskutiert, ob das chronische Müdigkeitssyndrom durch EBV verursacht wird. Bei den Patienten konnte in der Regel allerdings keine relevante Virusvermehrung festgestellt werden, dafür aber oftmals veränderte Antikörpermuster (nicht nur gegen EBV). Aktuell geht man davon aus, dass diese Erkrankung durch eine Immundysregulation verursacht wird und nicht unmittelbar durch EBV. In zwei kleinen Studien wurde Valacyclovir und Valgancyclovir bei Patienten mit chronischem Müdigkeitssyndrom probiert, und es zeigten sich leichte Verbesserungen (9, 10). Für eine generelle Therapieempfehlung scheinen diese Evidenzen aber nicht ausreichend zu sein. Interessante Ansätze gibt es in der Zwischenzeit für eine EBV-Impfung: Es gibt einige Studien, die EBV Impfstoffe erprobt haben. Ihnen ist gemeinsam, dass sie die Infektion nicht verhindern, wohl aber die Erkrankung (11-14). Es bleibt abzuwarten, welcher klinische Benefit sich daraus ableiten lässt. Insbesondere bleibt die Frage, wie sich eine EBV-Infektion bei Patienten unter einer Immunsuppression verhalten wird, noch offen. Kurzfristig ist deswegen nicht mit einem marktfähigen Impfstoff zu rechnen. Autoimmunerkrankungen und EBV Es gibt zahlreiche Autoimmunerkrankungen, die einen Zusammenhang mit EBV zeigen. Am deutlichsten ist dies sicher bei der multiplen Sklerose (MS). Aber auch beim systemischen Lupus erythematosus (SLE) und bei der rheumatoiden Arthritis (RA) gibt es Hinweise auf einen Assoziation mit EBV. Es sind verschiedene Mechanismen für die Rolle von EBV bei diesen Erkrankungen in der Diskussion. Epigenetische Faktoren scheinen eine wichtige Rolle zu spielen (15). Dazu gehört auch eine Aktivierung von humanen endogenen Retroviren durch EBV. Theoretisch könnte sich daraus sogar eine Therapieoptionen aus dem Bereich der antiretroviralen Therapie ergeben (16). Multiple Sklerose (MS) Es gibt in der Zwischenzeit zahlreiche Untersuchungen, die den Zusammenhang zwischen MS und EBV nahelegen. Der genaue Mechanismus, wie EBV mit der MS interagiert, ist hingegen noch unklar. Es hat sich gezeigt, dass unter EBV-negativen Personen eine MS eine Seltenheit ist (17). Das Risiko, an einer MS zu erkranken, ist bei Patienten mit symptomatischer Mononukleose etwa doppelt so hoch wie bei Patienten, die eine asymptomatische Erstinfektion hatten (18). Außerdem findet man häufig erhöhte EBV Antikörper (vor allem EBNA-1-IgG) bei Patienten, die später eine MS entwickeln (19). Bezüglich der Viruslast hingegen zeigten sich keine deutlichen Erhöhung bei Patienten mit MS (20). Aus diesen Gründen ergeben sich aktuell keine Anhaltpunkte dafür, dass eine antivirale Therapie sinnvoll sein könnte. Rheumatoide Arthritis (RA) Auch bei der rheumatoiden Arthritis haben sich in den letzten Jahren die Hinweise auf einen Zusammenhang mit EBV verdichtet. Patienten mit RA haben oftmals erhöhte EBV-Viruslasten im Blut (21). Zudem findet man typischerweise bei Patienten mit RA ein etwa doppelt so hohes Risiko, ein Lymphom zu entwickeln, von denen viele wiederum EBV-positiv sind (22). Systemischer Lupus erythematosus Auch beim SLE zeigen viele Patienten veränderte Antikörpermuster, Zytokinmuster und T-Zellreaktivität in Bezug auf EBV (23). Die symptomatische Mononukleose scheint anders als bei der MS kein Risikofaktor für SLE zu sein (24). Da einige Antigene von EBV denen des SLE ähnlich sind, könnten EBV im Sinne eines molekularen Mimikri einen SLE triggern (25). 1.2 Tumorerkrankungen bei Immungesunden Es sind zahlreiche Tumorerkrankungen mit EBV assoziiert. Am deutlichsten ist der Zusammenhang beim Naso-Pharynx-Karzinom mit einer Assoziation von fast 100%. Etwas niedriger ist sie beim Burkitt-Lymphom (endemisch ca. 85%, sporadisch 20-40%). Bei allen anderen Tumoren ist die Assoziation in der Regel deutlich niedriger. So findet man EBV-DNA in zahlreichen anderen Lymphomen, z.B. auch in Hodgkin-Lymphomen (ca. 40%) (26, 27). Magenkarzinome sind nur zu ca. 10% EBV-assoziiert und zeigen einige epidemiologische Besonderheiten, so dass sie als eigene Entität betrachtet werden müssen (28). Sehr umstritten ist hingegen ein Zusammenhang zwischen EBV und Mamma- oder Lebertumoren (29-31). Der Mechanismus, über den EBV die Tumorentstehung unterstützt, ist allerdings noch immer unklar. Vermutlich spielen wiederum, wie bei den Autoimmunerkrankungen, epigenetische Veränderungen durch EBV einen wichtige Rolle (z.B. Hypermethylierungen von Tumorsuppressorgenen). Therapieansätze, welche die EBV-Infektion im Fokus haben, sind bisher noch wenig evaluiert. Einzig die Therapie mit EBVspezifischen T-Zellen, wie sie zuerst bei Posttransplantationslymphomen zur Anwendung kamen (s.u.), hat bisher beim Naso-PharynxKarzinom einige Erfolge zeigen können (32, 33), während bei M. Hodgkin keine relevanten Therapieerfolge möglich waren (34, 35). Daher stehen noch immer die klassischen Therapieschemata der Onkologie im Zentrum der Therapie. Chronisch aktive EBV-Infektion Die sog. chronisch aktive EBV-Infektion (CAEBV) ist eine sehr seltene Erkrankung (am häufigsten aus Japan berichtet), die sich meist im Kindesalter manifestiert (36). In der Regel findet sich eine klonale Expansion von EBV- infizierten T- oder NK-Zellen (36), wobei bei Patienten vorwiegend aus den USA ein Schwerpunkt auf der Infektion von B-Zellen liegt (37). Die Erkrankung hat eine hohe Mortalität und endet meist in Lymphomen oder einem Hämophagozyten-Syndrom. Die Stammzelltransplantation schein eine vielversprechende Option bei dieser Erkrankung zu sein (37, 38). Auch hat sich durch den anti-CD20 Antikörper Rituximab eine deutliche Verbesserung der Prognose ergeben (37). Erkrankungen bei Immunsupprimierten Bei Immunsupprimierten kommt es bei reduzierter T-zellulären Immunantwort oftmals zur unkontrollierten Vermehrung von EBV-DNA. Meist handelt es sich dabei nicht um eine lytische Infektion mit Produktion von echten Viren, sondern um eine Vermehrung von EBVDNA in den EBV-infizierten Zellen oder um eine Vermehrung der EBV-infizierten Zellen. Diese Lymphoproliferationen stellen eine Gruppe von sehr heterogenen Erkrankungen dar. In den letzten Jahren haben sich sowohl die Diagnostik wie auch die Therapie dieser Erkrankungen deutlich verbessert. In der Diagnostik (vor allem bei der Erkrankungen nach Transplantation) hat sich ein EBVViruslastmonitoring durchgesetzt, das aktuell noch an der fehlenden Standardisierung der Teste krankt (39). Allerdings wurde kürzlich ein internationaler EBV-Standard hergestellt, der mittelfristig sicher zu einer Angleichung der Viruslastmessungen und zu einem Qualitätssprung führen wird (40). Posttransplantationslymphome (PTLD) Bei Transplantierten sind die Lymphome sicher die häufigsten Tumorerkrankungen. PTLD sind eine sehr heterogene Gruppe von Erkrankungen, die sich definiert als Lymphoproliferation- die zeitlich nach einer Transplantation auftritt. Damit reicht das Spektrum von der Mononukleose nach Transplantation bis hin zum malignen Lymphom, wie es auch bei Immungesunden auftreten kann. Klinisch fällt der meist extranodale Befall auf (70%) wobei ZNS-Lymphome nicht selten sind (ca. 10%). Früher ging man davon aus dass ca. 95% der PTLDs EBV-positiv sind. In neueren Arbeiten hat sich dieser Prozentsatz aber deutlich verringert auf ca. 50%. Dies kann daran liegen, dass sich durch eine besser gesteuerte Immunsuppression heute vor allem Lymphome manifestieren, die EBV-negativ sind, weil diese schlechter auf eine Reduktion der Immunsuppression ansprechen als die EBV-positiven Tumore (41, 42). EBV-positive PTLD sind in der Regel durch eine hohe Virusvermehrung bei schlechter zellulärer Kontrolle charakterisiert, wenn es auch bei ca. 10% der Patienten nicht zu einer nennenswerten Viruslasterhöhung in der Peripherie kommt, obwohl die Tumorzellen EBV-Genome enthalten (39). Mit Hilfe eines Viruslastmonitoring kann die Diagnose einer PTLD unterstützt werden, eine echte Vorhersage ist hingegen wegen der oft fulminanten Verläufe schwer möglich (43). Ebenso wenig ist ein Ansprechen auf eine Therapie über die Viruslast möglich, wenn Therapieformen appliziert werden, die keinen direkten Bezug zur EBV-Infektion haben wie z.B. bei Rituximab oder Chemotherapie (siehe unten) (44). Ein wichtiger neuer Ansatz für ein EBV Viruslastmonitoring ist die Steuerung der Immunsuppression. Aktuell haben wir keine Laborparameter, um die Immunsuppression quantitativ zu erfassen. Die EBV-Viruslast könnte in gewissen Grenzen ein Surrogatparameter für die Immunsuppression darstellen. Bei diesem Konzept geht man davon aus, dass die EBV-Viruslast oberhalb eines bestimmten Grenzwertes eine zu stark reduzierte T-zelluläre Antwort darstellt und dadurch ein Marker für eine zu hohe Immunsuppression ist. In der Folge kann man bei diesen Patienten die Immunsuppression gefahrlos reduzieren, ohne dass es einer Zunahme an Abstoßungen kommt (45, 46). Das bedeutet, dass die EBV-Viruslast als Marker für die sog. Nettoimmunsuppression herangezogen werden kann. Bei PTLD gibt es im Prinzip verschiedene Therapieverfahren: Am wichtigsten ist die Therapie mit Rituximab, die alleine schon in ca. 50% zum Erfolg führt. Eine Kombination aus der initialen Gabe von Rituximab und – bei fehlendem kompletten Ansprechen - der Kombination aus CHOP (Cyclophosphamid, Doxorubicin, Vincristin, Prednisolon) mit Rituximab, kann heute as state of the art gelten, mit Ansprechraten von um die 90% (42). Die Therapie mit Donorlymphozyten, sei es vom Stammzellspender oder von Dritten, zeigte ebenfalls gute Ansprechraten im Bereich von ca. 50% (47). Es hat sich dabei gezeigt, dass das Abstoßungsrisiko bei der Gabe von EBV spezifischen Donorlymphozyten gegenüber nicht spezifischen Donorlymphozyten massiv reduziert ist (48). 2.2 HIV-Lymphome Bei HIV-Positiven finden sich zwei EBV-assoziierte Erkrankungen. Erstens die orale Haarleukoplakie, eine harmlose Erkrankung, bei der EBV lytisch in der Zungen- oder Wangenschleimhaut repliziert, und die gut auf Aciclovir anspricht, und zweitens EBV-assoziierte Lymphome. Neben dem Kaposi-Sarkom sind EBV-positive Lymphome die zweithäufigste Tumorerkrankung bei HIV. Differentialdiagnostisch ist die Messung der EBV-Viruslast in vielen Fällen nicht hilfreich. So konnte im Zusammenhang mit EBVpositiven ZNS-Lymphomen gezeigt werden, dass sich EBV-DNA im Liquor sehr häufig bei den unterschiedlichsten Erkrankungen nachweisen ließ und ein EBV-positives Lymphom eher die Ausnahme als die Regel war (49). Therapeutisch kann auf ähnliche Konzepte wie bei den Transplantierten zurückgegriffen werden (Rituximab plus CHOP) (50). 2.3 X-linked lymphoproliferatives Syndrom (XLP-Syndrom) Das sog. X-linked-lymphoproliferatives Syndrom (XLP) ist eine seltene genetische Erkrankung, bei der die EBV-Primärinfektion oft fulminant verläuft oder bei der nach der Primärinfektion häufig EBV-assoziierte Tumore entstehen. Der genetische Defekt konnte in letzter Zeit gut charakterisiert werden (51). Bei Patienten mit diesem Syndrom gehen EBV-infizierte proliferierende Zellen nicht mehr in die Apoptose, wobei das Hauptproblem bei den antigenpräsentierenden Zellen zu liegen zu scheint und weniger bei EBV selbst (52). Aktuell ist eine Stammzelltransplantation der einzig kurative Ansatz für diese Erkrankung (53). Barbara C. Gärtner Institut für Mikrobiologie und Hygiene Universitätsklinikum Homburg/Saar 66421 Homburg/Saar Tel: 06841/1623900 Fax: 06841/1623985 E-Mail: [email protected] Tab. 1: Bei EBV Infektionen werden verschiedene Begrifflichkeiten oft nicht korrekt benutzt. Aus diesem Grunde sind sie hier dargestellt. Prof. Barbara C. Gärtner und Prof. Mathias Herrmann, Institut für Mikrobiologie und Hygiene, Universitätsklinikum Homburg/Saar Literatur: (1) Gärtner BC. Epstein-Barr Virus. In: Versalovic J, Carroll KC, Funke G, Jorgensen JH, Landry ML, Warnock DW, editors. Manual of Clinical Microbiology. 10th ed: ASM Press; 2011. p. 1575-84. (2) Vidrih JA, Walensky RP, Sax PE, Freedberg KA. Positive Epstein-Barr virus heterophile antibody tests in patients with primary human immunodeficiency virus infection. Am J Med. 2001;111(3):192-4. (3) Walensky RP, Rosenberg ES, Ferraro MJ, Losina E, Walker BD, Freedberg KA. Investigation of primary human immunodeficiency virus infection in patients who test positive for heterophile antibody. Clin Infect Dis. 2001;33(4):570-2. (4) Balfour HH, Jr., Hokanson KM, Schacherer RM, Fietzer CM, Schmeling DO, Holman CJ, et al. A virologic pilot study of valacyclovir in infectious mononucleosis. J Clin Virol. 2007;39(1):16-21. (5) Roy M, Bailey B, Amre DK, Girodias JB, Bussieres JF, Gaudreault P. Dexamethasone for the treatment of sore throat in children with suspected infectious mononucleosis: a randomized, double-blind, placebo-controlled, clinical trial. Arch Pediatr Adolesc Med. 2004;158(3):250-4. (6) Torre D, Tambini R. Acyclovir for treatment of infectious mononucleosis: a meta-analysis. Scand J Infect Dis. 1999;31(6):543-7. (7) Tynell E, Aurelius E, Brandell A, Julander I, Wood M, Yao QY, et al. Acyclovir and prednisolone treatment of acute infectious mononucleosis: a multicenter, double-blind, placebo-controlled study. J Infect Dis. 1996;174(2):324-31. (8) Petersen I, Thomas JM, Hamilton WT, White PD. Risk and predictors of fatigue after infectious mononucleosis in a large primary-care cohort. QJM. 2006;99(1):49-55. (9) Kogelnik AM, Loomis K, Hoegh-Petersen M, Rosso F, Hischier C, Montoya JG. Use of valganciclovir in patients with elevated antibody titers against Human Herpesvirus-6 (HHV-6) and Epstein-Barr Virus (EBV) who were experiencing central nervous system dysfunction including long-standing fatigue. J Clin Virol. 2006;37 Suppl 1:S33-8. (10) Lerner AM, Beqaj SH, Deeter RG, Fitzgerald JT. Valacyclovir treatment in Epstein-Barr virus subset chronic fatigue syndrome: thirty-six months follow-up. In Vivo. 2007;21(5):707-13. (11) Elliott SL, Suhrbier A, Miles JJ, Lawrence G, Pye SJ, Le TT, et al. Phase I trial of a CD8+ T-cell peptide epitope-based vaccine for infectious mononucleosis. J Virol. 2008;82(3):1448-57. (12) Moutschen M, Leonard P, Sokal EM, Smets F, Haumont M, Mazzu P, et al. Phase I/II studies to evaluate safety and immunogenicity of a recombinant gp350 Epstein-Barr virus vaccine in healthy adults. Vaccine. 2007;25(24):4697-705. (13) Rees L, Tizard EJ, Morgan AJ, Cubitt WD, Finerty S, Oyewole-Eletu TA, et al. A phase I trial of epstein-barr virus gp350 vaccine for children with chronic kidney disease awaiting transplantation. Transplantation. 2009;88(8):1025-9. (14) Sokal EM, Hoppenbrouwers K, Vandermeulen C, Moutschen M, Leonard P, Moreels A, et al. Recombinant gp350 vaccine for infectious mononucleosis: a phase 2, randomized, double-blind, placebo-controlled trial to evaluate the safety, immunogenicity, and efficacy of an Epstein-Barr virus vaccine in healthy young adults. J Infect Dis. 2007;196(12):1749-53. (15) Niller HH, Wolf H, Ay E, Minarovits J. Epigenetic dysregulation of epstein-barr virus latency and development of autoimmune disease. Adv Exp Med Biol. 2011;711:82-102. (16) Dreyfus DH. Autoimmune disease: A role for new anti-viral therapies? Autoimmunity reviews. 2011;11(2):88-97. (17) Thacker EL, Mirzaei F, Ascherio A. Infectious mononucleosis and risk for multiple sclerosis: a meta-analysis. Ann Neurol. 2006;59(3):499-503. (18) Handel AE, Williamson AJ, Disanto G, Handunnetthi L, Giovannoni G, Ramagopalan SV. An updated meta-analysis of risk of multiple sclerosis following infectious mononucleosis. PloS one. 2010;5(9). (19) Ascherio A, Munger KL, Lennette ET, Spiegelman D, Hernan MA, Olek MJ, et al. Epstein-Barr virus antibodies and risk of multiple sclerosis: a prospective study. JAMA. 2001;286(24):3083-8. (20) Santiago O, Gutierrez J, Sorlozano A, de Dios Luna J, Villegas E, Fernandez O. Relation between Epstein-Barr virus and multiple sclerosis: analytic study of scientific production. Eur J Clin Microbiol Infect Dis. 2010;29(7):857-66. (21) Balandraud N, Meynard JB, Auger I, Sovran H, Mugnier B, Reviron D, et al. Epstein-Barr virus load in the peripheral blood of patients with rheumatoid arthritis: accurate quantification using real-time polymerase chain reaction. Arthritis Rheum. 2003;48(5):1223-8. (22) Callan MF. The immune response to Epstein-Barr virus. Microbes and infection / Institut Pasteur. 2004;6(10):937-45. (23) Larsen M, Sauce D, Deback C, Arnaud L, Mathian A, Miyara M, et al. Exhausted cytotoxic control of Epstein-Barr virus in human lupus. PLoS pathogens. 2011;7(10):e1002328. (24) Ulff-Moller CJ, Nielsen NM, Rostgaard K, Hjalgrim H, Frisch M. Epstein-Barr virus-associated infectious mononucleosis and risk of systemic lupus erythematosus. Rheumatology (Oxford). 2010;49(9):1706-12. (25) James JA, Robertson JM. Lupus and Epstein-Barr. Curr Opin Rheumatol. 2012. (26) Taylor GS, Blackbourn DJ. Infectious agents in human cancers: lessons in immunity and immunomodulation from gammaherpesviruses EBV and KSHV. Cancer Lett. 2011;305(2):263-78. (27) Shah KM, Young LS. Epstein-Barr virus and carcinogenesis: beyond Burkitt's lymphoma. Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases. 2009;15(11):982-8. (28) Akiba S, Koriyama C, Herrera-Goepfert R, Eizuru Y. Epstein-Barr virus associated gastric carcinoma: epidemiological and clinicopathological features. Cancer science. 2008;99(2):195-201. (29) Hippocrate A, Oussaief L, Joab I. Possible role of EBV in breast cancer and other unusually EBV-associated cancers. Cancer Lett. 2011;305(2):144-9. (30) Bonnet M, Guinebretiere JM, Kremmer E, Grunewald V, Benhamou E, Contesso G, et al. Detection of Epstein-Barr virus in invasive breast cancers. J Natl Cancer Inst. 1999;91(16):1376-81.. (31) Huang J, Chen H, Hutt-Fletcher L, Ambinder RF, Hayward SD. Lytic viral replication as a contributor to the detection of Epstein-Barr virus in breast cancer. J Virol. 2003;77(24):13267-74. (32) Smith C, Tsang J, Beagley L, Chua D, Lee V, Li V, et al. Effective treatment of metastatic forms of Epstein-Barr virus-associated nasopharyngeal carcinoma with a novel adenovirus-based adoptive immunotherapy. Cancer Res. 2012;72(5):1116-25. (33) Louis CU, Straathof K, Bollard CM, Ennamuri S, Gerken C, Lopez TT, et al. Adoptive transfer of EBV-specific T cells results in sustained clinical responses in patients with locoregional nasopharyngeal carcinoma. J Immunother. 2010;33(9):983-90. (34) Rooney CM, Roskrow MA, Suzuki N, Ng CY, Brenner MK, Heslop H. Treatment of relapsed Hodgkin's disease using EBV-specific cytotoxic T cells. Ann Oncol. 1998;9(Suppl 5):S129-32. (35) Roskrow MA, Dilloo D, Suzuki N, Zhong W, Rooney CM, Brenner MK. Autoimmune disease induced by dendritic cell immunization against leukemia. Leuk Res. 1999;23(6):549-57. (36) Kimura H. Pathogenesis of chronic active Epstein-Barr virus infection: is this an infectious disease, lymphoproliferative disorder, or immunodeficiency? Rev Med Virol. 2006;16(4):251-61. (37) Cohen JI, Jaffe ES, Dale JK, Pittaluga S, Heslop HE, Rooney CM, et al. Characterization and treatment of chronic active Epstein-Barr virus disease: a 28year experience in the United States. Blood. 2011;117(22):5835-49. (38) Kawa K, Sawada A, Sato M, Okamura T, Sakata N, Kondo O, et al. Excellent outcome of allogeneic hematopoietic SCT with reduced-intensity conditioning for the treatment of chronic active EBV infection. Bone Marrow Transplant. 2011;46(1):77-83. (39) Gärtner B, Preiksaitis JK. EBV viral load detection in clinical virology. J Clin Virol. 2010;48(2):82-90. (40) Biological-Standard-and-Control N-I-f. 1st WHO international standard for Epstein-Barr virus for nucleic acid amplification techniques NIBSC code: 09/260. 2012 [cited 2012 01.06.2012]; Available from: http://www.nibsc.ac.uk/documents/ifu/09-260.pdf. (41) Zimmermann H, Oschlies I, Fink S, Pott C, Neumayer HH, Lehmkuhl H, et al. Plasmablastic posttransplant lymphoma: cytogenetic aberrations and lack of Epstein-Barr virus association linked with poor outcome in the prospective German Posttransplant Lymphoproliferative Disorder Registry. Transplantation. 2012;93(5):543-50. (42) Trappe R, Oertel S, Leblond V, Mollee P, Sender M, Reinke P, et al. Sequential treatment with rituximab followed by CHOP chemotherapy in adult B-cell post-transplant lymphoproliferative disorder (PTLD): the prospective international multicentre phase 2 PTLD-1 trial. Lancet Oncol. 2012;13(2):196-206. (43) Gärtner BC, Schafer H, Marggraff K, Eisele G, Schafer M, Dilloo D, et al. Evaluation of use of Epstein-Barr viral load in patients after allogeneic stem cell transplantation to diagnose and monitor posttransplant lymphoproliferative disease. J Clin Microbiol. 2002;40(2):351-8. (44) Oertel S, Trappe RU, Zeidler K, Babel N, Reinke P, Hummel M, et al. Epstein-Barr viral load in whole blood of adults with posttransplant lymphoproliferative disorder after solid organ transplantation does not correlate with clinical course. Ann Hematol. 2006;85(7):478-84. (45) Bakker NA, Verschuuren EA, Erasmus ME, Hepkema BG, Veeger NJ, Kallenberg CG, et al. Epstein-Barr virus-DNA load monitoring late after lung transplantation: a surrogate marker of the degree of immunosuppression and a safe guide to reduce immunosuppression. Transplantation. 2007;83(4):433-8. (46) Lee TC, Savoldo B, Rooney CM, Heslop HE, Gee AP, Caldwell Y, et al. Quantitative EBV viral loads and immunosuppression alterations can decrease PTLD incidence in pediatric liver transplant recipients. Am J Transplant. 2005;5(9):2222-8. (47) Haque T, Wilkie GM, Jones MM, Higgins CD, Urquhart G, Wingate P, et al. Allogeneic cytotoxic T-cell therapy for EBV-positive posttransplantation lymphoproliferative disease: results of a phase 2 multicenter clinical trial. Blood. 2007;110(4):1123-31. (48) Heslop HE. Equal-opportunity treatment of EBV-PTLD. Blood. 2012;119(11):2436-8. (49) Corcoran C, Rebe K, van der Plas H, Myer L, Hardie DR. The predictive value of cerebrospinal fluid Epstein-Barr viral load as a marker of primary central nervous system lymphoma in HIV-infected persons. J Clin Virol. 2008;42(4):433-6. (50) Castillo JJ, Echenique IA. Rituximab in combination with chemotherapy versus chemotherapy alone in HIV-associated non-Hodgkin lymphoma: a pooled analysis of 15 prospective studies. Am J Hematol. 2012;87(3):330-3. (51) Nagy N, Klein E. Deficiency of the proapoptotic SAP function in X-linked lymphoproliferative disease aggravates Epstein-Barr virus (EBV) induced mononucleosis and promotes lymphoma development. Immunol Lett. 2010;130(1-2):13-8. (52) Palendira U, Low C, Chan A, Hislop AD, Ho E, Phan TG, et al. Molecular pathogenesis of EBV susceptibility in XLP as revealed by analysis of female carriers with heterozygous expression of SAP. PLoS biology. 2011;9(11):e1001187. (53) Booth C, Gilmour KC, Veys P, Gennery AR, Slatter MA, Chapel H, et al. X-linked lymphoproliferative disease due to SAP/SH2D1A deficiency: a multicenter study on the manifestations, management and outcome of the disease. Blood. 2011;117(1):53-62.