Management of Neuromuscular Diseases 11
Werbung

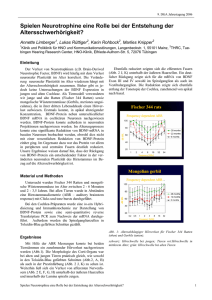
Management of Neuromuscular Diseases 11 Therapeutische Möglichkeiten von Wachstumsfaktoren bei neuromuskulären Erkrankungen Günter Ochs Abstract Results of basic research suggest that neurotrophic factors have considerable therapeutic potential for neuromuscular diseases. Clinical application is most advanced in the field of motoneuron diseases. Multiple clinical trials have been conducted for amyotrophic lateral sclerosis using subcutaneous injections of either ciliary neurotrophic factor (CNTF), brain-derived neurotrophic factor (BDNF) or insulin-like growth factor (IGF-1). Among the most important reasons for the rather disappointing results of these trials are probably the complex pharmacokinetic profile of the proteins, their side effect spectrum and the stability of the compounds. These issues have been addressed by using alternative ways of application in the most recent trials. Neurotrophic factors have been under investigation for polyneuropathies or traumatic nerve lesions as well. Preclinical studies were promising, but results from clinical trials in patients with such conditions are still conflicting. In neurodegenerative diseases of the central nervous system such as Parkinson’s, preclinical data from animal models suggest significant effects on survival and function of dopaminergic cells in the substantia nigra. Clinical studies using glia-derived neurotrophic factor (GDNF) by an intracerebro-ventricular route of application are in process, results are not published yet. Einleitung Nervenwachstumsfaktoren oder neurotrophe Faktoren sind in der embryonalen Entwicklung für die Spezifizierung und Aufrechterhaltung der Funktion von Neuronen notwendig. Im adulten Organismus können Sie nach Schädigungen des peripheren oder zentralen Nervensystems in die Regeneration eingreifen (Abbildung 1). Daher vermuten Grundlagenwissenschaftler und Kliniker ein therapeutisches Potential für neurodegenerative Erkrankungen. Neurotrophe Faktoren, die auf Motoneurone wirken, könnten sich zur Therapie neuromuskulärer Erkrankungen eignen. Tierexperimentelle Untersuchungen belegen einen deutlichen Effekt verschiedener neurotropher Faktoren auf Motoneurone in vitro und in vivo. Bei geigneter Applikation gelingt es zum Beispiel im Läsionsmodell des n. facialis 60–80% der Motoneurone nach Durchtrennung des Nerven zu erhalten [15]. Auch bei der sog. pmn-Maus, bei der es aufgrund eines bisher unbekannten genetischen Defektes zu einem der spinalen Muskelatrophie oder ALS vergleichbaren Untergang von MN mit entsprechender atropher Parese innerhalb der ersten Monate nach der Geburt kommt, kann die systemische Verabreichung von CNTF den Verlauf der Erkrankung wesentlich verlangsamen [28]. Die Kombination mehrerer neurotropher Faktoren bessert das Gesamtresultat. Diese Ergebnisse haben die Hoffnung bestärkt, daß neurotrophe Faktoren bei bisher unbehandelbaren neuromuskulären Erkankungen eine wichtige therapeutische Lücke schließen könnten. Abbildung 1 Potentieller Wirkmechanismus von Wachstumsfaktoren [34] Grb2 growth factor binding protein-2 MAP mitogen-activated protein 1 von 12 Management of Neuromuscular Diseases 11 GEF guanine nucleotide exchanger factor MAP mitogen-activated protein MAPKK MAP-Kinase-Kinase Einer von vier derzeit bekannten Signaltransduktionswegen neurotropher Faktoren. Die Aktivierung der Receptor Tyrosin Kinasen durch Wachstumsfaktoren bewirkt zunächst eine Phosphorylierung über mehrere Thr Residuen. Über eine Kaskade weiterer Reaktionen wird schließlich eine MAP-Kinase aktiviert, die die Aktivierung der Gentranskription im Kern einleitet. Details und Übersicht in [34]. Klinische Studien mit neurotrophen Faktoren (NTF) Amyotrophe Lateralsklerose (ALS) Wegen der infausten Prognose der Erkrankung und in Ermangelung einer geeigneten, kausalen Therapie wurden klinische Studien mit neurotrophen Faktoren zunächst und vor allem bei der ALS erwogen (Tabelle 1). Diese seit 1992 durchgeführten Studien konnten zwar bisher noch nicht zu einem Durchbruch in der Behandlung der ALS führen, es sind jedoch Trends erkennbar. Die Studien zur ALS waren wegbereitend auch für andere Indikationen in der Neurologie und angrenzenden Gebieten. Ciliary neurotrophic factor (CNTF) CNTF wurde in mehreren plazebo-kontrollierten, doppelblinden Studien in den USA in einem Dosisbereich zwischen 2 und 100 µg/ kgKG/die subkutan erprobt. Die Ergebnisse wurden zwischenzeitlich publiziert [3/4/22]. Nebenwirkungen, vor allem trockener Husten, Asthenie, Übelkeit, Anorexie, Stomatitis, Fieber und Hautreaktionen an der Injektionsstelle, waren dosisabhängig. Höhere Dosierung als 100 µg/kgKG/die waren unverträglich. Einige Patienten bildeten Antikörper gegen das rekombinante Protein. Verlaufsparameter wie isometrische Myometrie und funktionelle Tests (ALS-functional rating scale) zeigten keine signifikante Verlangsamung der Progredienz über einen 2 von 12 Management of Neuromuscular Diseases 11 Zeitraum von 6 oder 9 Monaten. Tabelle 1 Studien mit subkutaner Applikation von neurotrophen Faktoren BDNF Ergebnisse als Kongreßbeitrag ALS publiziert CNTF ALS mehrere Publikationen IGF-1 ALS Post-polio-Syndrom Vincristin-Neuropathie Paclitaxel/Cisplatin-Neuropathie publiziert Ergebnisse nicht publiziert Ergebnisse nicht publiziert Ergebnisse nicht publiziert NGF Diabetische Neuropathie AIDS-Neuropathie M. Alzheimer Ergebnisse nicht publiziert Ergebnisse nicht publiziert Ergebnisse nicht publiziert NT-3 ‘large-fibre’- Neuropathie Ergebnisse nicht publiziert GDNF Studie noch nicht abgeschlossen Studie noch nicht abgeschlossen M. Parkinson ALS Einige dieser Studien sind zur Zeit noch nicht abgeschlossen oder die Ergebnisse noch nicht veröffentlicht (siehe [16] zum Design der Studien). Die publizierten Resultate sind im Text mit Literatur zitiert. Der Grund für das Scheitern von CNTF in den ALS Studien liegt unter anderem in der komplexen Pharmakokinetik des Proteins. Es wird innerhalb von Minuten in verschiedenen Organen, vor allem der Leber, gebunden und verstoffwechselt [10]. Nur wenig erreicht – wahrscheinlich über axonalen Transport – das Nervensystem, so daß die in den Tiermodellen wirksamen Konzentrationen im ZNS bei den StudienPatienten durch die subkutane Gabe nicht erreicht werden konnten. Durch die Cytokin-artigen Wirkungen von CNTF entsteht das Nebenwirkungsprofil einer sog. ‘Akute-Phase-Reaktion’, was die Verträglichkeit von CNTF bei systemischer Anwendung stark einschränkt und den therapeutischen Nutzen weiter limitiert. Ein möglicher Ausweg aus dem Dilemma wurde schon früh in der intrathekalen Verabreichung von CNTF gesehen [32]. Der wesentliche Vorteil besteht dabei darin, daß die Blut-Hirn-Schranke umgangen wird und das relativ große Molekül (MG ca. 25 kDalton) direkt mit dem ZNS in Kontakt kommt. Außerdem werden der Abbau in der Leber verhindert, systemische Nebenwirkungen vermieden und ein gleichmäßig hoher Spiegel der Substanz gewährleistet. Die chronische intrathekale Infusion eines Medikamentes kann durch implantierbare Pumpensysteme realisiert werden (Abbildung 2). Erfahrungen hiermit gibt es für Morphin bei schweren Schmerzzuständen [18] oder Baclofen für die Behandlung von Spastizität [25]. Tierexperimentelle Verträglichkeitsuntersuchungen mit dieser Technologie unter Verwendung von CNTF zeigten bei täglicher Injektion von 100 µg in den lumbalen Spinalkanal lokal entzündliche Reaktionen, die durch die Cytokinartigen Wirkungen von CNTF in hohen Dosen ausgelöst wurden. Bei ersten Pilotversuchen bei ALS Patienten mit dieser Technik zeigten sich intolerable Nebenwirkungen in Form radikulitischer oder meningitischer Symptome [26]. Während des relativ kurzen Behandlungszeitraums von sechs Monaten wurde kein signifikanter Effekt auf den Krankheitsverlauf festgestellt. 3 von 12 Management of Neuromuscular Diseases 11 Abbildung 2 Implantierbare Pumpe zur intrathekalen Infusion. Implantierbare Infusionspumpe zur intrathekalen Verabreichung von Medikamenten (SynchroMed, Medtronic). In der Mitte befindet sich das Füllseptum, über welches das Reservoir mit 18 ml Lösung gefüllt werden kann. Dieses Modell ist im implantierten Zustand elektronisch steuerbar. Über einen ‘side-port’ kann direkt in den Katheter injiziert oder Liquorproben entnommen werden. Eine andere Möglichkeit neurotrophe Faktoren intrathekal zu verabreichen besteht in der Verwendung gentechnisch manipulierter Zellen, die in halbdurchlässigen Polymer-Kapseln verpackt (Abbildung 3) in den spinalen Subarachnoidalraum eingebracht werden [2]. 106 BHK-Zellen produzieren etwa 0,5 µg/die CNTF in vitro. In einer Pilotstudie bei ALS Patienten fanden sich mit dieser Appliktionsweise inter- und intra-individuell stark schwankende Liquorspiegel von CNTF zwischen 170 und 6282 pg/ml bei guter Verträglichkeit [1]. Die applizierte Dosis reicht wahrscheinlich bei freier Diffusion im Liquorraum aus, den hochaffinen CNTF-Rezeptor zu sättigen. Die Beobachtungszeit betrug auch in dieser Studie nur sechs Monate, so daß ein Effekt auf den Krankheitsverlauf in dem offenen Studiendesign nicht gesichert werden konnte. Abbildung 3 Schematische Darstellung der Funktionsweise halbdurchlässiger PolymerKapseln [30] Schematische Darstellung selektiv permeabler Polymer-Kapseln [30]. Die Wand der 2–3 cm langen Kapsel (ø 2–3 mm) besteht aus einem Polymer-Gewebe mit definierter Porengröße, durch die Nährstoffe, Wasser, Sauerstoff und kleine bioaktive Moleküle 4 von 12 Management of Neuromuscular Diseases 11 eindringen können. Immunkompetente Körperzellen können nicht ins Innere der Kapseln gelangen, so daß die implantierten Zellen dem Zugriff des Immunsystems entzogen sind. Das gewünschte Substrat, der neurotrophe Faktor, wird über einige Monate gebildet und durch die Poren in die umgebende Körperflüßigkeit abgegeben. Eine Kapsel enthält ca. l06 Zellen, jede mit etwa 30 Kopien des entsprechenden Gens. Sie können subkutan in den spinalen Liquor oder ins Hirngewebe selbst (bisher nur tierexperimentell) eingebracht und nach einigen Wochen getauscht werden [1]. Isoformen von CNTF Es wird daran gearbeitet, CNTF-Isoformen herzustellen, die eine geringere Affinität zum niedrig-affinen CNTF-Rezeptor besitzen, jedoch die Fähigkeit, die Signaltransduktion über den hoch-affinen Rezeptor nach Bindung an gp130 und LIFR-ß behalten. Solche Proteine wurden kürzlich beschrieben [27], stehen jedoch erst für präklinische pharmakokinetische Untersuchungen zur Verfügung. Dadurch ließe sich die Verträglichkeit bei gleichzeitig besserer trophischer Wirkung unter Umständen erhöhen. Brain-derived neurotrophic factor (BDNF) BDNF wurde in einer Phase-I/II-Studie doppelblind, plazebo-kontrolliert bei 284 ALS Patienten geprüft [8]. Über sechs Monate wurden in 5 Dosisgruppen 10 bis 300 µg/kgKG/die täglich subkutan appliziert, umgerechnet entspricht das etwa 5% der bei der wobbler-Maus beschriebenen Dosis. Die Substanz wurde gut vertragen. Es fand sich im mittleren Dosisbereich ein Effekt auf die Lebenserwartung, die forcierte Vitalkapazität (13,5% Abnahme im Vergleich zu 20% in der Plazebo-Gruppe ) und ein Trend zur Verbesserung der Ganggeschwindigkeit [7/8]. Die aufgrund dieser Ergebnisse eingeleitete Phase-III-Studie zeigte leider keine Signifikanz hinsichtlich der primären Zielvariablen ‘Lebenserwartung’ und auch keinen Effekt auf die klinischen Verlaufsparameter der Erkankung. Einschränkend muß festgestellt werden, daß die Zahl der Todesfälle am Ende der Nachbeobachtungsphase von 9 Monaten zu gering war, um eine statistisch zuverlässige Unterscheidung zwischen den Gruppen überhaupt zu erlauben. Eine Nacherhebung fand nicht statt. Bisher nicht veröffentlichte, retrospektive Subgruppenanalysen scheinen allerdings Anhaltspunkte für Effekte von BDNF zu liefern. Wenngleich solche Untersuchungen methodisch angreifbar sind, wurden neue Studien mit BDNF mittels subkutaner Applikation in den Vereinigten Staaten und Japan in diesem Jahr begonnen. Auch bei BDNF scheint der eher geringe Effekt auf den Verlauf der Erkrankung mit der Pharmakokinetik des Proteins zusammenzuhängen. Daher wurde auch für BDNF die intrathekale Applikation untersucht, zunächst tierexperimentell, später im Rahmen einer Verträglichkeits- und Dosisfindungsstudie. BDNF wurde bis zu Tagesdosen von 400 µg intrathekal gut toleriert [24]. Es traten einige psychotrope Effekte auf, die eine biologische Wirkung belegen und auch eine Verteilung nach supraspinal vermuten lassen. 5 von 12 Management of Neuromuscular Diseases 11 Abbildung 4 Anfärbung des Motoneurons nach BDNF-Gabe beim Schaf Die immunhistochemische Darstellung von BDNF im Myelon zeigte bereits bei Versuchstieren, daß das Protein über die Nervenwurzeln aufgenommen und retrograd transportiert wird, wo es sich in Motoneuronen nachweisen läßt [9] (Abbildung 4). Aufgrund der kleinen Fallzahl der noch laufenden Studien und des offenen Designs ist noch keine Aussage über den Effekt auf die Erkrankung möglich. Hierzu ist eine Phase-III-Studie zur Prüfung der Wirksamkeit bei intrathekaler Applikation notwendig. Insulin-like Growth-Factor-1 (IGF-1) IGF-1 wurde in den USA bei 449 und in Immunhistochemische Darstellung von BDNF Europa bei 266 ALS-Patienten in einer zweiarmigen, doppelblinden, plazeboim spinalen Motoneuron nach kontinuierlicher intrathekaler Verabreichung kontrollierten Studie in einer Dosis von 0,05 und 0,1 mg/kg KG/die (2x täglich) subkutan von 3500 µg/die BDNF beim Schaf. über 9 Monate geprüft. Es fand sich ein Trend Querschnitt durch das Spinalmark in Höhe zu langsamerer Progression in der behandelten der Infusinonsstelle [9]. Gruppe. Die Substanz wurde auch in der BDNF findet sich in Vesikel-artigen höheren Dosis gut vertragen [19]. Der Effekt Strukturen um den Zellkern, der selbst frei war dosisabhängig. IGF-1 erhielt aufgrund von BDNF bleibt. dieser Ergebnisse jedoch nur eine Einzelfallbezogene Teilzulassung als experimentelle Therapie für die Indikation ALS. Über das weitere Schicksal der Substanz ist derzeit nichts bekannt. Glial Cell-Derived Neurotrophic Factor (GDNF) Auch GDNF ist ein potenter Überlebensfaktor für Motoneurone, so daß die klinische Anwendung bei ALS nahe liegt. Ausgehend von den Erfahrungen mit CNTF und BDNF hat man allerdings auf die subkutane Anwendung Immunhistochemische Anfärbung von BDNF von vornherein verzichtet und einen an Meningen und Nervenwurzeln nach Pilotversuch mit intraventrikulärer Anwendung intrathekaler Verabreichung von 1500 – 3500 begonnen. Da aus präklinischen µg/die BDNF beim Schaf. Gefrierschnitt. Untersuchungen bekannt war, daß GDNF eine BDNF bindet möglicherweise an den lang anhaltende Wirkung bereits nach trunkierten trk-B-Rezeptor an der Oberfläche einmaliger Applikation entfaltet, wird die der Hirnhäute. Gleichzeitig finden sich Substanz über ein Portsystem in Abständen geringe Mengen von bräunlichem von mehreren Tagen oder wenigen Wochen Färbeprodukt in den Axonen als Hinweis für intraventrikulär injiziert (siehe Morbus eine Aufnahme und axonalen Transport [9]. Parkinson).Es ist derzeit nicht bekannt, wie BDNF diffundiert offensichtlich nicht ins verträglich diese Art der Anwendung ist und ob Myelon selbst. therapeutische Erfolge erzielbar sind. Auch andere Daten aus der noch laufenden Studie sind derzeit nicht offiziell bekannt (Tabelle 2). 6 von 12 Management of Neuromuscular Diseases 11 Tabelle 2 Therapiestudien mit intrathekaler oder intraventrikulärer Applikation von CNTF, BDNF oder GDNF CNTF ciliary neurotrophic factor Verfahren Ergebnis Implantierte Pumpe mit intrathekalem Dauerkatheter [26] 4 Patienten mit ALS. Studie wegen Nebenwirkungen abgebrochen; keine Aussage über die Wirkung auf den Krankheitsverlauf möglich. Semipermeable Polymerkapsel gefüllt mit gentechnisch 10 Patienten mit ALS. manipulierten BHK Zellen,die Beobachtungszeit 6 Monate. Keine Plazebokontrolle. 32 Kopien des CNTF-gens Aussage über die Wirksamkeit nicht möglich. tragen [1]. BDNF brain-derived neurotrophic factor 25 Patienten mit ALS. Verträglichkeitsstudie mit Kontrollgruppe, Implantierbare Infusionspumpe Dosisfindungsstudie Bis 150 µg/die i.t. gut toleriert. Bei mit intrathekalem höheren Dosierungen vor allem supraspinale Effekte Dauerkatheter [24]. (Schlaflosigkeit, sensible Reizerscheinungen, etc.). Fortsetzung der Studie zurEvaluierung der Wirksamkeit geplant. GDNF Glial cell-derived neurotrophic factor Intraventrikulärer Katheter mit Injektionsport. Regelmäßige Injektionen (Quelle: Pressemitteilung: Amgen Inc, USA). Ca. 25 Patienten mit M. Parkinson und ebensoviele Patienten mit ALS. Nähere Einzelheiten, insbesondere Angaben zur Verträglichkeit liegen noch nicht vor. Andere Erkrankungen des Zentralnervensystems Morbus Parkinson BDNF begünstigt das Überleben nigraler dopaminerger Neurone der pars compacta im MPP+ Modell der Parkinsonschen Krankheit, allerdings nur bei direkter, lokaler Applikation durch Implantation von BDNF-freisetzenden transfizierten Fibroblasten [13]. BDNF diffundiert schlecht aus dem Liquor in das Hirnparenchym [23/36]. Untersuchungen an Patienten mit Parkinson-Syndrom mittels intraventrikulärer Gabe liegen nicht vor. Auch für GDNF sind in Tiermodellen neuroprotektive Effekte auf nigro-striatale Neurone nachgewiesen [33]. GDNF diffundiert gut aus dem ventrikulären Liquor in das Hirnparenchym [20]. Sowohl Untersuchungen am Mausmodell (6-OHDA, Rotationsmodell) als auch am Primatenmodell der Parkinsonkrankheit (unilaterale MPTP Läsion am Rhesusaffen) belegen eine Wirkung auf die Funktion dopaminerger Neurone in Striatum, Putamen und Substantia nigra. Die Wirkung von L-DOPA auf diese Neurone verbessert sich, eine vergleichbare therapeutische Wirkung wird bereits mit einem Sechstel der Dosis erreicht, wobei Zeichen der dopaminergen Überfunktion fehlen. Appliziert wurden in den 7 von 12 Management of Neuromuscular Diseases 11 Tiermodellen Bolusdosen von 100 µg intraventrikulär einmal monatlich. Die im Caudatum und Putamen gemessenen Werte des Dopaminmetaboliten Homovallininsäure (HVA) stiegen im Vergleich um 65% bzw. 146% des Kontrollwertes [14]. Als Konsequenz aus diesen Ergebnissen wird derzeit im Rahmen eines Pilotversuches die intraventrikuläre Applikation bei Parkinson-Patienten erprobt. Ergebnisse sind zur Zeit noch nicht bekannt. Chorea Huntington In Läsionsmodellen der Chorea Huntington hat BDNF protektive Wirkung, die Neuronengröße in der substantia nigra nimmt um 25% zu und der transneuronale Neuronenverlust kann durch die Gabe von BDNF weitgehend verhindert werden [35]. In einem anderen Läsionsmodell für die Huntingtonsche Krankheit verbessert die intraventrikuläre Applikation von 100 µg GDNF die Beweglichkeit der Tiere signifikant. Die Ergebnisse belegen einen protektiven Effekt von GDNF auch bei chronischen excitotoxischen Schädigungen wie sie bei Störungen der mitochondrialen Funktion auftreten können [6]. Ähnliche Effekte ließen sich auch mit CNTF in einem Tiermodell der Chorea (intrastriatale Quinolin-Säure Injektion) zeigen, wobei hier die Applikation über CNTF exprimierende BHK-Zellen [2] erfolgte, die in Polymer-Kapseln verpackt direkt im Striatum implantiert wurden [11]. Mit der gleichen Applikationsweise ließen sich auch motorische und kognitive Effekte nachweisen [12]. Neuropathien Bereits in der Phase-I-Prüfung von Nerve Growth Factor (NGF) zeigten sich erhebliche Nebenwirkungen in Form von lokaler Hyperalgesie und Muskelschmerzen, die in Einzelfällen die Anwendung noch mehrere Wochen überdauerten. Erklärbar sind diese Effekte wahrscheinlich durch Aussprossen dünn-bemarkter Nervenfasern. Es ist daher sehr fraglich, ob sich NGF in der subkutanen Applikationsform als Therapeutikum für Neuropathien eignet. Große Hoffnungen für die Behandlung der diabetischen Neuropathie werden auf Neurotrophin-3 (NT-3) gesetzt, welches im Rahmen einer Phase-I-Studie an freiwilligen Versuchspersonen gut vertragen wurde [5]. Eine klinische Studie bei Patienten mit diabetischer Neuropathie ist geplant. Mögliche zukünftige Indikationsbereiche bei neuromuskulären Erkrankungen – präklinische Untersuchungen Nervenläsionen und Rückenmarksschäden Tierexperimentelle Daten sprechen dafür, daß die lokale Anwendung von BDNF bei spinalen Wurzelausrissen geschädigte spinale Neurone retten und sogar deren Aussprossen induzieren kann [17]. Durch die intrathekale Anwendung von BDNF im Tiermodell unmittelbar nach einem Wurzelausriß konnten selbst schwer geschädigte Motoneurone am traumatisierten Rückenmark überleben und wieder sprossen. Effekte auf die Größe des Zellsomas und die cholinerge Enzymaktivität belegen den trophischen Effekt auf Neurone des adulten Nervensystems und bahnen den Weg für experimentelle Anwendungen bei Patienten, nachdem die Verträglichkeit der Applikationsweise und das Dosisfenster für die Indikation ALS bereits untersucht wurde [24]. Die Verwendung neurotropher Faktoren bei traumatischen Rückenmarksläsionen befindet sich noch im tierexperimentellen Stadium. Es gibt Hinweise darauf, daß auch im erwachsenen Nervensystem des Säugers eine Regeneration nach spinalen Traumen möglich ist. Diese führt zwar noch nicht zu einem funktionellen Gewinn, wohl aber zu histologisch nachweisbaren Effekten betreffend Sprossung nach Zellimplantation im Tierexperiment [30]. Die Verbesserung der axonalen Regeneration supraspinaler kortiko-spinaler Neurone durch Anwendung neurotropher Faktoren ist auch nach chronischen spinalen Läsionen inzwischen belegt. Vier Wochen nach einer zervikalen Hemisection des Rückenmarks führte die lokale Anwendung von Gel-Schaum, getränkt mit einer Kombination von BDNF, NT-3 und CNTF in der Läsionshöhle zu einem signifikanten 8 von 12 Management of Neuromuscular Diseases 11 Aussprossen von Axonen [37]. Alle Studien, bei denen eine Wirkung neurotropher Faktoren auf das Überleben oder das Aussprossen von Neuronen nachgewiesen werden konnte, zeigen, daß eine lokale Anwendung in biologisch aktiver Form notwendig ist. Es bedarf offensichtlich spezieller Applikationstechniken, oft unter Verwendung von gentechnologischen Verfahren oder mittels Applikationssystemen, um am Wirkort effektive Konzentrationen bereit zu stellen. Auch scheint der Effekt um so günstiger zu sein, je früher nach der Läsion oder im Verlauf der Krankheit die Anwendung stattfindet. Es ist evident, daß hierin eine für die therapeutische Anwendung bei Patienten ganz entscheidende praktische Hürde besteht, die nur durch moderne Methoden überwunden werden kann. Mögliche zukünftige Perspektiven für die Anwendung von neurotrophen Faktoren Die bisherigen Studienergebnisse bei ALS und anderen neuromuskulären Erkrankungen lassen erkennen, daß ein Faktor alleine nicht ausreichen wird, den Krankheitsverlauf wesentlich zu beeinflussen. Es ist lange bekannt, daß neurotrophe Faktoren spezifische Wirkungen auf bestimmte Neuronenpopulationen bezüglich des Überlebens der Neurone oder des Sproutings haben [32]. Die bei Patienten bisher systemisch angewendeten oder noch verträglichen Dosierungen liegen grob um 2 bis 3 Zehnerpotenzen unter denjenigen, die in Tiermodellen von Motoneuron-Erkrankungen als wirksam gelten. Höhere Spiegel im ZNS können derzeit nur durch die intrathekale oder intraventrikuläre Verabreichung erzielt werden. Dies bietet auch den Vorteil einer kontinuierlichen, gleichmäßigen Darbietung des Faktors, was der biologischen Rolle als neurotropher Stoff näher kommt als die intermittierende Gabe. Zukünftige Therapieversuche werden sich mit hoher Wahrscheinlichkeit bevorzugt dieser Applikationsweisen bedienen. Die seit mehr als 10 Jahren mit anderen Wirkstoffen praktizierte intrathekale Infusion mit implantierbaren Infusionspumpen könnte durch gentechnologische Verfahren ergänzt werden. Das Problem der Kombination verschiedener Faktoren oder der Stabilität über längere Zeit in Reservoirs bei Körpertemperatur könnte dazu zwingen, neurotrophe Faktoren durch transfizierte Zellen, die das Protein im Überschuß exprimieren, zu applizieren. Die hierzu erforderliche Technologie ist allerdings noch nicht ausgereift und bedarf weiterer Entwicklungsarbeit [2]. Die Risiken der Applikationsform sind noch nicht ausreichend evaluiert. Interessante Anwendungen für NTF außerhalb des Nervensystems könnten bei degenerativen Erkrankungen der Retina [21] oder in der Förderung der Regeneration von Schäden am vestibulären System [29] bestehen (Übersicht in [16]). Zusammenfassung Die bisher vorliegenden Erfahrungen mit der klinischen Anwendung von neurotrophen Faktoren sind noch ernüchternd. Die ursprünglichen tierexperimentellen Erfolge ließen sich in klinischen Studien bei neuromuskulären Erkrankungen leider nicht reproduzieren. Hauptproblem dabei ist die Pharmakokinetik, die Anwendungsform und möglicherweise auch die Pathogenese der Erkrankungen selbst. Für viele neuromuskuläre Erkrankungen existieren keine geeigneten Tiermodelle, so daß die Übertragbarkeit tierexperimenteller Studien problematisch ist. Die nahe Zukunft wird zeigen, ob und für welche Erkrankungen des Nervensystems neurotrophe Faktoren als Therapeutikum in Frage kommen. Es handelt sich unfraglich um äußerst potente Wirkstoffe, die mit großer Wahrscheinlichkeit ein therapeutisches Potential besitzen. Literatur 1. Aebischer P, Schluep M, Deglon N, Joseph JM, Hirt L, Heyd B, Goddard M, Hammang JP, Zurn AD, Kato AC, Regli F, Baetge EE: Intrathecal delivery of CNTF using encapsulated genetically modified xenogeneic cells in amyotrophic lateral sclerosis patients. Nat Med 1996a; 2:696 – 699. 9 von 12 Management of Neuromuscular Diseases 11 2. Aebischer P, Tan SA, Deglon N, Heyd B, Zurn A, Baetge E, Sagot Y, Kato A: Encapsulation of neurotrophic factor-releasing cells for the treatment of neurodegenerative diseases. Restor Neurol Neurosci 1995; 8:65 – 66. 3. ALS CNTF Treatment Study (ACTS): A phase I study of recombinant human ciliary neurotrophic factor (rHCNTF) in patients with amyotrophic lateral sclerosis. Clin Neuropharmacol 1995; 18:515 – 532. 4. ALS CNTF Treatment Study (ACTS): A double-blind placebo-controlled clinical trial of subcutaneous recombinant human ciliary neurotrophic factor (rHCNTF) in amyotrophic lateral sclerosis. Neurol 1996; 46:1244 – 1249. 5. Apfel SC, Kessler JA: Neurotrophic factors in the therapy of peripheral neuropathy. Bailliere'S Clin Neurol 1995; 4:593 – 606. 6. Araujo DM, Hilt DJ: Glial cell-derived neurotrophic factor attentuates the excitotoxin- induced behavioral and neurochemical deficits in a rodent model of Huntington’s disease. Neuroscience 1997; 81:1099 – 1110. 7. Bradley WG, The BDNF Study Group: Subcutaneous administration of recombinant brain- derived neurotrophic factor in patients with ALS. 6th International Symposium on ALS/MND 1995; Dublin: 30.10.–1.11.95(Abstract) 8. Bradley WG, the BDNF Trial Group: A phase I/II study of recombinant human brain- derived neurotrophic factor in patients with amyotrophic lateral sclerosis. Ann Neurol 1995; 38:971 9. Dittrich F, Ochs G, Grosse-Wilde A, Berweiler U, Yan Q, Miller J, Toyka KV, Sendtner M: Pharmacokinetics of intrathecally applied BDNF and effects on spinal Motoneurons. Exp Neurol 1996; 141:225 – 239. 10. Dittrich F, Thoenen H, Sendtner M: Ciliaryneurotrophic factor: Pharmacokinetics and acute-phase response in rat. Ann Neurol 1994; 35:151 – 163. 11. Emerich DF, Bruhn S, Chu Y, Kordower JH: Cellular delivery of CNTF but not NT-4/5 prevents degeneration of striatal neurons in a rodent model of Huntington disease. Cell Transplant 1998; 7:213 – 225 12. Emerich DF, Winn SR, Hantraye PM, Peschanski M, Chen EY, Chu Y, McDermott P, Baetge EE, Kordower JH: Protective effect of encapsulated cells producing neurotrophic factor CNTF in a monkey model of Huntington's disease. Nature 1997; 386:395 – 399. 13. Galpern WR, Frim DM, Tatter SB, Altar CA, Beal MF, Isacson O: Cell-mediated delivery of brainderived neurotrophic factor enhances dopamine levels in an MPP+ rat model of substantia nigra degeneration. Cell Transplant 1996; 5:225 – 232. 14. Gash DM, Zhang Z, Ovadia A, Cass WA, Yi A, Simmerman L, Russell D, Martin D, Lapchak PA, Collins F, Hoffer BJ, Gerhardt GA: Functional recovery in parkinsonian monkeys treated with GDNF. Nature 1996; 380:252 – 255. 15. Gravel C, Gotz R, Lorrain A, Sendtner M: Adenoviral gene transfer of ciliary neurotrophic factor and brain- derived neurotrophic factor leads to long-term survival of axotomized motor neurons. Nat Med 1997; 3:765 – 770. 10 von 12 Management of Neuromuscular Diseases 11 16. Kessler JA: Growth Factors as Drugs for Neurological Sensory Disorders, John Wiley & Sons, 1996. 17. Kishino A, Ishige Y, Tatsuno T, Nakayama C, Noguchi H: BDNF prevents and reverses adult rat motor neuron degeneration and induces axonal outgrowth. Exp Neurol 1997; 144:273 – 286. 18. Krames E S: Intrathecal Infusional Therapies for Intractable Pain: Patient Management Guidelines. J Pain Symptom Manage. 1993; 8:36 – 46. 19. Lai EC, Felice KJ, Festoff BW, Gawel MJ, Glinas DF, Kratz R, Murphy MF, Natter HM et al.: Effect of recombinant human insulin-like growth factor-I on progression of ALS: A placebocontrolled study. Neurol 1997; 49:1621 – 1630. 20. Lapchak PA: A Preclinical Development Strategy Designed to Optimize the Use of Glial Cell Line-Derived Neurotrophic Factor in the Treatment of Parkinson's Disease. Movement Disoders 1998; 13:49 – 54. 21. LaVail MM, Unoki K, Yasumura D, Matthes MT, Yancopoulos GD, Steinberg RH: Multiple growth factors, cytokines, and neurotrophins rescue photoreceptors from the damaging effects of constant light. Proc Natl Acad Sci USA 1992; 89: 11249 – 11253. 22. Miller RG, Petajan JH, Bryan WW, Armon C, Barohn RJ, Goodpasture JC, Hoagland RJ, Parry GJ, Ross MA, Stromatt SC: A placebo-controlled trial of recombinant human ciliary neurotrophic (rhCNTF) factor in amyotrophic lateral sclerosis. Ann Neurol 1996; 39: 256 – 260. 23. Mufson EJ, Kroin JS, Liu YT, Sobreviela T, Penn RD, Miller JA, Kordower JH: Intrastriatal and intraventricular infusion of brain-derived neurotrophic factor in the cynomologous monkey: Distribution, retrograde transport and co-localization with substantia nigra dopamine-containing neurons. Neuroscience 1996; 71:179 – 191. 24. Ochs G, Penn RD, Giess RSB, Sendtner M, Toyka KV: A Trial of Recombinant Methionyl Human Brain-Derived Neurotrophic Factor (BDNF) Given by Intrathecal Infusion to Patients with Amyotrophic Lateral Sclerosis (ALS). Neurol 1998; 50:A246 25. Ochs G, Struppler A, Meyerson BA, Linderoth B, Gybels J, Gardner BP, Teddy P, Jamous A, Weinmann P: Intrathecal baclofen for long-term treatment of spasticity: a multi-centre study. J Neurol Neurosurg Psychiatry 1989; 52:933 – 939. 26. Penn RD, Kroin JS, York MM, Cedarbaum JM, Bakay RAE, Weiner LP, Luns ford LD: Intrathecal ciliary neurotrophic factor delivery for treatment of amyotrophic lateral sclerosis (phase I trial). Neurosurg 1997; 40:94 – 100. 27. Saggio I, Gloaguen I, Poiana G, Laufer R: CNTF variants with increased biological potency and receptor selectivity define a functional site of receptor interaction. Embo J 1995; 14:3045 – 3054. 28. Sendtner M, Schmalbruch H, Stockli KA, Carroll P, Kreutzberg GW, Thoenen H: Ciliary neurotrophic factor prevents degeneration of motor neurons in mouse mutant progressive motor neuronopathy. Nature 1992; 358:502 – 504. 29. Staecker H, Liu W, Hartnick C, Lefebvre P, Malgrange B, Moonen G, Van de Water TR: NT-3 combined with CNTF promotes survival of neurons in modiolus- spiral ganglion explants. Neuroreport 1995; 6:1533 – 1537. 30. Tan SA, Aebischer P: The problems of delivering neuroactive molecules to the CNS, in: Growth Factors as Drugs for Neurological and Sensory Disorders. Chichester, John Wiley & Sons, 1996, pp 11 von 12 Management of Neuromuscular Diseases 11 211 – 240. 31. Tatagiba M, Brosamle C, Schwab M, Piepmeier JM, Tator CH: Regeneration of injured axons in the adult mammalian central nervous system. Neurosurg 1997; 40:541 – 547. 32. Thoenen H, Hughes RA, Sendtner M: Trophic support of motoneurons: Physiological, pathophysiological, and therapeutic implications. Exp Neurol 1993; 124:47 – 55. 33. Tomac A, Widenfalk J, Lin LF, Kohno T, Ebendal T, Hoffer BJ, Olson L: Retrograde axonal transport of glial cell line-derived neurotrophic factor in the adult nigrostriatal system suggests a trophic role in the adult. Proc Natl Acad Sci USA 1995; 92:8274 – 8278. 34. Traverse S, Seedorf K, Paterson H, Marshall CJ, Cohen P, Ullrich A. EGF triggers neuronal differentiation of PC12 cells that overexpress the EGF receptor. Current Biology 1994; 4:694 – 701. 35. Volpe G, Wildmann J, Altar CA: Brain-derived neurotrophic factor prevents the loss of nigral neurons induced by excitotoxic striatal-pallidal lesions. Neuroscience 1998; 83: 741 – 748. 36. Yan Q, Matheson C, Sun J, Radeke MJ, Feinstein SC, Miller JA: Distribution of intracerebral ventricularly administered neurotrophins in rat brain and its correlation with trk receptor expression. Exp Neurol 1994; 127:23 – 36. 37. Ye JH, Houle JD: Treatment of the chronically injured spinal cord with neurotrophic factors can promote axonal regeneration from supraspinal neurons. Exp Neurol 1997; 143:70 – 81. 12 von 12