ppt - Ruhr-Universität Bochum
Werbung

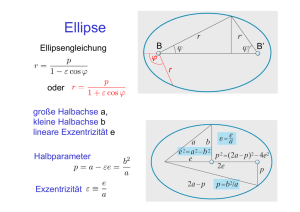
Die Rutherford‘schen Streuexperimente Seminarvortrag von Christopher Kükenbrink Ruhr-Universität Bochum 2014 Inhalt - Steckbrief Rutherford‘s - Wichtige Entdeckungen vor/um 1900 - Der Aufbau der Atome - Rutherford‘s Streuversuche und –Formel - Video + Demoversuch Steckbrief: Leben - Geboren 1871 in Spring Grove, Nelson/Neuseeland - Ab 1889 Stipendium und Studium an der University of New Zealand in Wellington, Mathematik und Physik - 1894 erneutes Stipendium, das ihm eine Arbeitsstelle am Cavendish-Laboratorium an der Trinity College in Cambridge/England einbrachte - 1898 Berufung als Professor für Physik an die McGill University in Montreal/Kanada. -1907 Rückkehr nach England, Professorenstelle für Physik an der Universität in Manchester - 1908 Verleihung des Nobelpreises für Chemie - Ab 1919 leitete er das Cavendish-Laboratorium in Cambridge - 1914 Ernennung zum Ritter, 1931 zum Baron - Gestorben 1937 überraschend an einem Nabelbruch in Cambrigde Steckbrief: Forschung - 1894: „Magnetization of Iron by High-Frequency Discharges“ - 1895: „Magnetic Viscosity“ (führte zur Entwicklung des Radiowellenempfängers) - Ab 1898: neues Forschungsfeld: natürliche Radioaktivität (Becquerel): - Entdeckung zweier unterschiedlicher Komponenten in der Strahlung von Pechblende: αund β-Strahlung - Aufstellung Zerfallsgesetz (1900) - Identifikation der α-Strahlen: so reaktionsträge wie Helium-Atome, jedoch positiv geladen (Vermutung 1903, Nachweis 1908) - Ab 1907: Streuversuche der Strahlung von gasförmigem Radon an Targets - 1911: "The Scattering of Alpha- and Beta-Particles by Matter and the Structure of the Atom“ -> Begriff des Nukleus - 1919: Erste künstliche Kernumwandlung durch Beschuss von Stickstoff mit Alpha-Teilchen Wichtige Entdeckungen vor/um 1900 Kanal- und Kathodenstrahlung -1869: Hittorf beobachtet in Gasentladungsröhren Strahlen, die sich von der Kathode aus (=Kathodenstrahlung) geradlinig ausbreiten (z.B. Schattenkreuzröhre) - Thompson: Ablenkung durch Magneten möglich -> negative Ladung der Strahlung - 1886: Goldstein entdeckt ähnliche Strahlung von der Anode: Kanalstrahlung - Ablenkung im Magnetfeld in die andere Richtung: positiv geladen - Durch Messungen von Thompson: Verhältnis q/m der Kanal- zu Kathodenstrahlen etwa 104, und unabhängig vom Füllgas - Wiechert fand, dass die Strahlung aus Teilchen (Elektronen) besteht. Kathodenstrahlung Zeeman-Effekt -1896: Zeeman fand eine Aufspaltung der emittierten Spektrallinien von Atomen, wenn diese einem Magnetfeld ausgesetzt werden - Dies war für Lorentz direkt der Beweis seiner 1892 aufgestellten Theorie: normaler Zeeman-Effekt - Problem: Die gemessenen Aufspaltungen sind 1000-fach größer als von Lorentz abgeschätzt. -> Nicht das Atom ist Quelle der Linien, sondern das Elektron als Bestandteil des Atoms! Kanalstrahlung I - Kanalstrahlen sind positiv geladen - Wien (später Thompson) brachten die Strahlen senkrecht in ein elektrisches und magnetisches Feld, beide in y-Richtung: - Ablenkung in y: - Ablenkung in z: -> , Parabeln auf einem Schirm Kanalstrahlung II -Wien konnte, trotz ungenügendem Versuchsaufbau, bestätigen, dass die Strahlen aus positiven Teilchen bestehen - Er bestimmte die spezifische Ladung als etwa 1/1000 der von Elektronen, also in Übereinstimmung mit der von Ionen aus elektrochemischen Versuchen - 1906 erzeugte Thompson diskrete Parabeln und bewies so, dass Atome diskrete Massen besitzen. Messungen von q/m wiesen außerdem darauf hin, dass die Kanalstrahlen Ionen des Gases zwischen den Platten sind Kanalstrahlung III - Für manche Elemente wurden früh mehrere gleichzeitige Parabeln gefunden, mit winzigen Bahnabständen -> Es müssen Atome desselben chemischen Elements mit leicht verschiedenen Massen existieren: Isotope Das Zerfallsgesetz -In Montreal untersuchten Rutherford und Owens die Strahlung von Thorium. Obwohl er die Alpha-Teilchen mit dünnem Papier abschirmte, ließ es eine gasförmige, radioaktive Substanz durch: die Emanation - Während sie das Gas sammelten und untersuchten, stellten sie fest, dass sich die Aktivität pro Minute halbiert -Das Resultat weiterer zwei Forschungsjahre war das Paper "Cause and Nature of Radioactivity“ -> Nobelpreis für Chemie 1908 - Rutherford schloss aus seinen Messungen: Radioaktive Elemente zerfallen, unter Abgabe von α- und βStrahlung, in andere Elemente! Zusammenfassung Bis 1908: - Atome sind nicht strukturlos, sondern aus elementareren Teilchen aufgebaut -Elektronen sind Bestandteile aller Atome und erklären den (normalen) Zeeman-Effekt sowie elektrochemische Beobachtungen - Einzelne Atome haben Massen in der Größenordnung von 1000 Massen des Elektrons -Damit sie insgesamt elektrisch neutral sind, müssen sie positive Ladungen enthalten - Es existieren verschiedene Isotope von Atomen desselben Elements mit ähnlichen Massen - Manche Elemente sind radioaktiv und zerfallen exponentiell in andere Elemente unter Abgabe von α- und β-Strahlung Der Aufbau der Atome Wie viele Elektronen pro Atom? -Larmor und Lorentz hielten es für sinnvoll, dass die positive Ladung in Atomen durch ein Teilchen identisch zu dem Elektron, bis auf das Vorzeichen der Ladung, realisiert werden -> Allein Wasserstoff müsste 1000 Teilchen jeder Sorte beinhalten -Thompson führte in einem Paper einige Argumente auf, die besagen, dass die Zahl an Elektronen in Atomen klein, ~ A ist -> Die positiven Ladungen müssen fast die gesamte Masse des Atoms beinhalten ? oder ? oder ? oder ? ….oder ?? Natur der positiven Ladung I Lodge, 1906: Natur der positiven Ladung II „… (5) A fifth view of the atom would regard it as a central ‚sun‘ of extremly concentrated positive electricity at the centre, with a multitude of electrons revolving in astronomical orbits, like asteroids, within ist range of attraction. But this would give a law of inverse square for the force, and consequently periodic times dependent on distance, which appears not to correspond with anything satisfactorily observed.“ Offensichtlich war die Unsicherheit groß, da keinerlei Messdaten vorlagen. Das Rutherford‘sche Atommodell war aber schon eine theoretische Möglichkeit Das Thompsonsche Modell I - „plum-pudding“ oder „Rosinenkuchen“ -Bis 1911: Verbreitetes Modell zur Beschreibung der inneren Struktur des Atoms, 1904 von Thompson postuliert - Punktförmige Elektronen sind in einer positiv geladenen Masse, die den Radius des Atoms definiert, eingebettet - Es wird eine Kraft benötigt, die das Fluid zusammenhält (vergleiche starke WW!); - wurde durch Kohäsion wie in Flüssigkeiten erklärt - Thompson entwickelte Unmengen an Theorie zur Verteilung der Elektronen in Abhängigkeit ihrer Anzahl - Störungen in den (statischen) Anordnungen der Elektronen erzeugen Oszillationen; mögliche Erklärungen der Spektrallinien. -> Jedoch: Vorhersagen stimmen in keinster Weise mit den Beobachtungen überein Das Thompsonsche Modell II Die Streuexperimente Gold als Target -Ab 1908: Rutherford und Geiger bombardieren verschiedene Targets mit αTeilchen, um ihre Eigenschaften weiter zu verstehen - Bei dünnen Goldfolien als Targets treten vereinzelte Streuungen mit großen Ablenkwinkel, sogar >90° Video! Ablenkung á la Thompson -Wie können homogen gefüllte Atome die α-Teilchen teilweise sogar zurückstreuen? - Modell sagt gaußförmige statistische Verteilung der Ablenkung bei Mehrfachstreuung voraus. Selbst durch (höchst unwahrscheinliche) Streuung in immer die gleiche Richtung wird eine maximale Ablenkung in der Größenordnung von mehreren 10° (bei 10.000 Atomschichten) erreicht. -> Thompsonsches Atommodell kann Beobachtungen nicht erklären Ablenkung á la Rutherford - Rutherford et al. schlossen aus den seltenen Rückstreuungen, dass nur sehr große Feldstärken im Atom dafür sorgen können. Diese können nur durch eine äußerst kompakte Anordnung der positiven Ladungen im Atom entstehen, die zudem fast die gesamte Masse des Atoms beinhaltet. Rutherford nannte diesen Bereich Atomkern Experiment! Die Streuformel I Annahmen: - α-Teilchen und Atomkern punktförmig - mKern >> mα , d.h. der Kern - Ziel: Ausdruck für Streuintensität dN/N in Abhängigkeit vom Streuwinkel θ Die Streuformel II Wirkende Kraft: Aufteilung der Kräfte im Punkt B: Drehimpulserhaltung: Bewegungsgleichung senkrecht zur ursprünglichen Flugrichtung: Integration + Drehimpulserhaltung: Die Streuformel III Integration + Drehimpulserhaltung: Substitution: => trigon. Zusammenhänge: Ableiten: Die Streuformel IV Aktive Fläche: Aktive Fläche der gesamten Folie (Dicke D, Fläche A und Dichte n): Wahrscheinlichkeit, dass ein α-Teilchen die aktive Fläche der gesamten Folie trifft: Zahl der Teilchen, die in das intervall [θ-dθ, θ] gestreut werden: Zahl der Teilchen in das Segment dΩ: Die Streuformel V Fläche dS des Kreisrings: -> ALLES einsetzen: Theorie - Experiment -> Offensichtliche Bestätigung durch experimentelle Daten! -> bei Winkeln > 140° erkennt man bereits die Abweichungen Eine Revolution I - 1911 veröffentlichte Rutherford den Artikel "The Scattering of Alpha- and Beta-Particels by Matter and the Structure of the Atom“ - Das Bemerkenswerte: Er sprach in diesem Artikel bereits über eine hypotetische starke WW im Kern: "Dieser Raum wurde als der Raum definiert, in dem die anziehend wirkende starke Wechselwirkung der Protonen das Coulombsche Abstoßungspotential überwiegt (...) Das Bemerkenswerte ist also nicht die Massen'konzentration', sondern die merkwürdige neue starke Kraft, die in diesem Kernraum wirksam ist." Eine Revolution II - Durch Messungen an vielen verschiedenen Elementen als Targets konnte Rutherford deren Kernladungen bestimmen. Sie unterschieden sich um ganzzahlige Werte. - Er nannte die gequantelten positiven Ladungen Protonen - Die Unzulänglichkeiten des Rutherfordschen Atommodells sollten erst 20 Jahre später durch Niels Bohr gelöst werden Quellen Bücher - Demtröder: Experimentalphysik 3. Atome, Moleküle und Festkörper, 3. Auflage - F.L.Friedman, L.Sartori: The Classical Atom. - G.Gamow: The Atom and ist Nucleus. - H.Haken, H.C.Wolf: Atom- und Quantenphysik, 8.Auflage. - H.Friedrich: Theoretical Atomic Physics, 2. Auflage Websites - http://www.biography.com/people/ernest-rutherford-39099#death-and-legacy - http://www.seilnacht.com/chemiker/cherut.html - https://the-history-of-the-atom.wikispaces.com/Ernst+Rutherford - http://www.numericana.com/arms/rutherford.htm - http://en.wikipedia.org/wiki/Ernest_Rutherford#Nuclear_physics